功能化海藻酸钠水凝胶促骨髓间充质干细胞增殖、成软骨向分化的研究
张琦 滕彬宏
软骨组织因其缺乏血管和细胞含量低的特点,无法完成自我修复和重建。基于间充质干细胞治疗的方法可以为软骨组织的修复和再生提供一种新策略[1-3]。但间充质干细胞治疗策略仍然面临植入后细胞本身存活率低,或是受周围血液和组织液的影响导致细胞流失等问题。基于组织工程化的水凝胶支架可以解决上述问题,其不仅可提供间充质干细胞生存的三维载体环境,而且可以模拟天然细胞外基质的部分特性,并具备临床工作所需的可注射特性[4-5]。然而,传统的组织工程水凝胶仍然无法有效调控细胞行为活性的表达,例如细胞扩增、凝聚、分化以及伴随着基质沉淀,而这些是间充质干细胞向软骨细胞转变过程中必不可少的细胞行为事件[6]。越来越多的研究开始关注细胞在支架中的行为,结合生物活性信号可以促进水凝胶支架中细胞表达活性和功能[7-8]。这其中,有通过修饰活性基团改变水凝胶的功能[9],或是将活性因子直接引入水凝胶体系中[10],也有从空间结构入手,改变水凝胶的内部构造[11]。这些方式都可以在某些方面调控间充质干细胞的功能和活性。本研究以天然高分子材料海藻酸钠(sodium alginate,SA)为支架主体,将生物活性多肽RGD 接枝于酰化SA(methacryloyl sodium alginate,MeSA)中,研究功能化的SA 水凝胶基质调控骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的行为活性以及成软骨向分化的效果,现报道如下。
1 材料和方法
1.1 主要试剂和仪器 MeSA(中国阿拉丁生化科技有限公司);三乙醇胺(triethanolamine,TEOA)缓冲液(中国麦克林生化科技有限公司);RGD 多肽(序列GCGYRGDSPG,杭州丹港生物科技公司);光引发剂Irgacure 2959(美国Sigma 公司);CCK-8 试剂盒(日本Dojindo 公司);鬼笔环肽染色液-FITC(美国Sigma 公司);酶标仪(美国Bio-RAD 公司);真空冷冻干燥机(北京博医康实验仪器公司);S-4800 扫描电子显微镜(日本Hitachi 公司);激光共聚焦扫描显微镜(日本Nikon 公司);小鼠单克隆抗体、兔多克隆抗体(美国Abcam 公司);人源BMSCs、人源BMSCs 成软骨向分化诱导培养基(苏州赛业生物科技有限公司);BCA 试剂盒、逆转录试剂盒(北京索莱宝科技有限公司)。
1.2 MeSA 水凝胶及接枝RGD 多肽的MeSA[MeSA(RGD)]水凝胶制备 MeSA(10 g/L)与光引发剂(1 g/L)溶解于去离子水中,充分混合后,在紫外光(365 nm,1 W)照射下交联1 min后成胶,即MeSA水凝胶。采用迈克尔加成反应,将冻干MeSA 和RGD 多肽(112 mol/g)溶解在0.2 mol/L TEOA 缓冲液(pH 8.0)中,在37 ℃下过夜反应,然后透析3 d,冷冻干燥后,-20 ℃保存,即MeSA(RGD)水凝胶。
1.3 细胞培养和传代 BMSCs 在含10% FBS 和1%青霉素/链霉素的高糖DMEM 中培养,每隔1 d 更换1 次培养液。
1.4 细胞-水凝胶二维和三维培养体系构建
1.4.1 细胞-水凝胶二维培养体系构建 将水凝胶成胶于24 孔板底部,每个孔包含300 μL 的水凝胶溶液,在紫外光照射下交联成胶。将1 mL 细胞悬液(密度为1.0×105个细胞/mL)接种于孔板底部的水凝胶基质表面。
1.4.2 细胞-水凝胶三维培养体系构建 将300 μL 的细胞-水凝胶悬液(密度为2×106个细胞/mL)滴加到24孔板底部,在紫外光照射下交联成胶(形成细胞-水凝胶复合体)后,每孔添加2 mL培养液进行培养或者诱导。
1.5 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 形态的影响评估 用扫描电镜观察水凝胶表面的细胞形态。细胞在水凝胶表面培养至3 d 时,经过PBS 洗涤和多聚甲醛固定,冷冻干燥获得样品。样品经过喷金20 s 后,在扫描电镜下观察细胞形态。细胞培养至7 d时,细胞-水凝胶复合体经过多聚甲醛固定30 min,在细胞穿孔液(0.1% Triton X-100/PBS)中打孔10 min,经PBS 洗涤后在鬼笔环肽染色液-FITC 中孵育30 min。后经PBS 充分洗涤3 次,在室温下用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色10 min,染色后的样品在激光共聚焦显微镜下观察。
1.6 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 增殖活性的影响评估 BMSCs 在水凝胶二维和三维培养体系中连续培养7 d,分别在培养1、3、7 d 时,采用CCK-8 试剂盒检测细胞增殖活性。
1.7 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 成软骨向分化的影响评估
1.7.1 软骨形成标志物胶原蛋白Ⅱ(collagen Ⅱ,CollⅡ)和软骨聚蛋白多糖(aggrecan,ACAN)蛋白表达定性检测 采用免疫荧光染色法。细胞-水凝胶复合体在成软骨分化诱导液中连续培养14 d 后,在多聚甲醛(40 g/L)中固定30 min。PBS 洗涤3 次后,在细胞穿孔液(0.1% Triton X-100/PBS)中打孔15 min。PBS 洗涤3次后,在3%(w/v)牛血清白蛋白溶液中室温孵育2 h。经PBS 洗涤后加入一抗混合液,4 ℃冰箱孵育12 h。分别添加山羊抗兔IgG H&L(荧光强度:Alexa Fluor 488)、山羊抗小鼠IgG H&L(荧光强度:Alexa Fluor 647)的二抗(稀释比为1∶500),在室温黑暗中孵育2 h。最后在室温下用DAPI 染色10 min,染色后的样品在激光共聚焦显微镜下观察。
1.7.2 Coll Ⅱ和ACAN mRNA 表达水平检测 采用RT-PCR 法。细胞-水凝胶复合体在成软骨分化诱导液中连续培养14 d,PBS 洗涤3 次,放置于Trizol 溶液中充分研磨提取RNA。采用逆转录试剂盒将提取的RNA 逆向转录为cDNA,通过PCR 分析仪解析软骨形成标志物基因表达水平。实验涉及的引物序列如下,28sr RNA:5'-CCCAGTGCTCTGAATGTCAA-3',5'-AGTGGGAATCTCGTTCATCC-3';Coll Ⅱ:5'-TGGACGATCAGGCGAAACC-3',5'-GCTGCGGATGCTCTCAATCT-3';ACAN:5'- TGCATTCCACGAAGCTAACCTT- 3',5'-GACGCCTCGCCTTCTTGAA-3')。将28sr RNA作为内参指标,采用2-ΔΔCt法分析目标基因表达水平。
1.7.3 Coll Ⅱ和ACAN 蛋白表达定量检测 采用Western blot 法。细胞-水凝胶复合体在成软骨分化诱导液中连续培养14 d,PBS 洗涤3 次,后放置于细胞裂解液中充分研磨。研磨后的溶液经离心(12 000 r/min,15 min)后获得上清液。首先使用BCA 试剂盒测定上清液的总蛋白浓度。其次采用聚丙烯酰胺凝胶电泳分离细胞蛋白,将电泳结束后的蛋白凝胶转入至PVDF 膜上。最后PVDF 膜依次经过一抗和二抗孵育后,放置于发光成像仪内曝光显影,Image lab 软件分析蛋白表达水平。
1.8 统计学处理 采用SPSS 22.0 统计软件。计量资料以表示,组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 形态影响的比较 细胞在水凝胶表面培养3 d 后,BMSCs在MeSA(RGD)水凝胶表面可以很好地铺展和黏附,而在MeSA 水凝胶表面成独立的球形结构,见图1。BMSCs 在水凝胶三维培养体系中培养7 d 后,在MeSA水凝胶中的细胞呈球形并且相对独立,而在MeSA(RGD)水凝胶内可以向基质中伸展和迁移,并出现相互聚集的现象,细胞增殖明显,细胞和基质间的相互作用更显著,见图2(插页)。

图1 细胞在水凝胶二维培养体系培养3 d 时的形态电镜下所见[A:在MeSA 水凝胶表面的细胞形态;B:在MeSA(RGD)水凝胶表面的细胞形态]
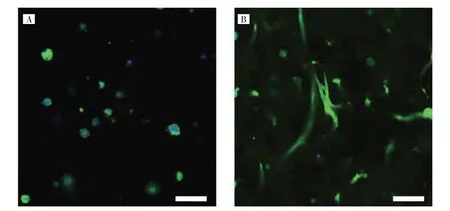
图2 细胞在水凝胶三维培养体系培养7 d 时的形态电镜下所见[A:在MeSA 水凝胶内的细胞形态;B:在MeSA(RGD)水凝胶内的细胞形态]
2.2 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 增殖活性的比较 随着培养时间的延长,细胞增殖活性呈现上升趋势。无论在MeSA(RGD)水凝胶二维或是三维培养体系,BMSCs 增殖活性明显高于在MeSA 水凝胶中(均P<0.05),见图3。这表明,MeSA(RGD)水凝胶可以更好地促进BMSCs 的增殖活性。

图3 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 增殖活性的比较(A:二维培养体系;B:三维培养体系)
2.3 MeSA(RGD)水凝胶与MeSA 水凝胶对BMSCs 成软骨向分化的诱导效果比较 免疫荧光染色定性分析显示,在MeSA(RGD)水凝胶中,BMSCs Coll Ⅱ和ACAN 的表达强度高于在MeSA 水凝胶中,同时可以观察到在MeSA(RGD)水凝胶中BMSCs 聚集明显,出现细胞凝聚现象,见图4(插页)。定量分析显示,在Me-SA(RGD)水凝胶中,BMSCs Coll Ⅱ和ACAN 基因及蛋白表达水平高于在MeSA 水凝胶中(均P<0.05),见图5。这表明,MeSA(RGD)水凝胶可以更好地促进BMSCs 的成软骨向分化。
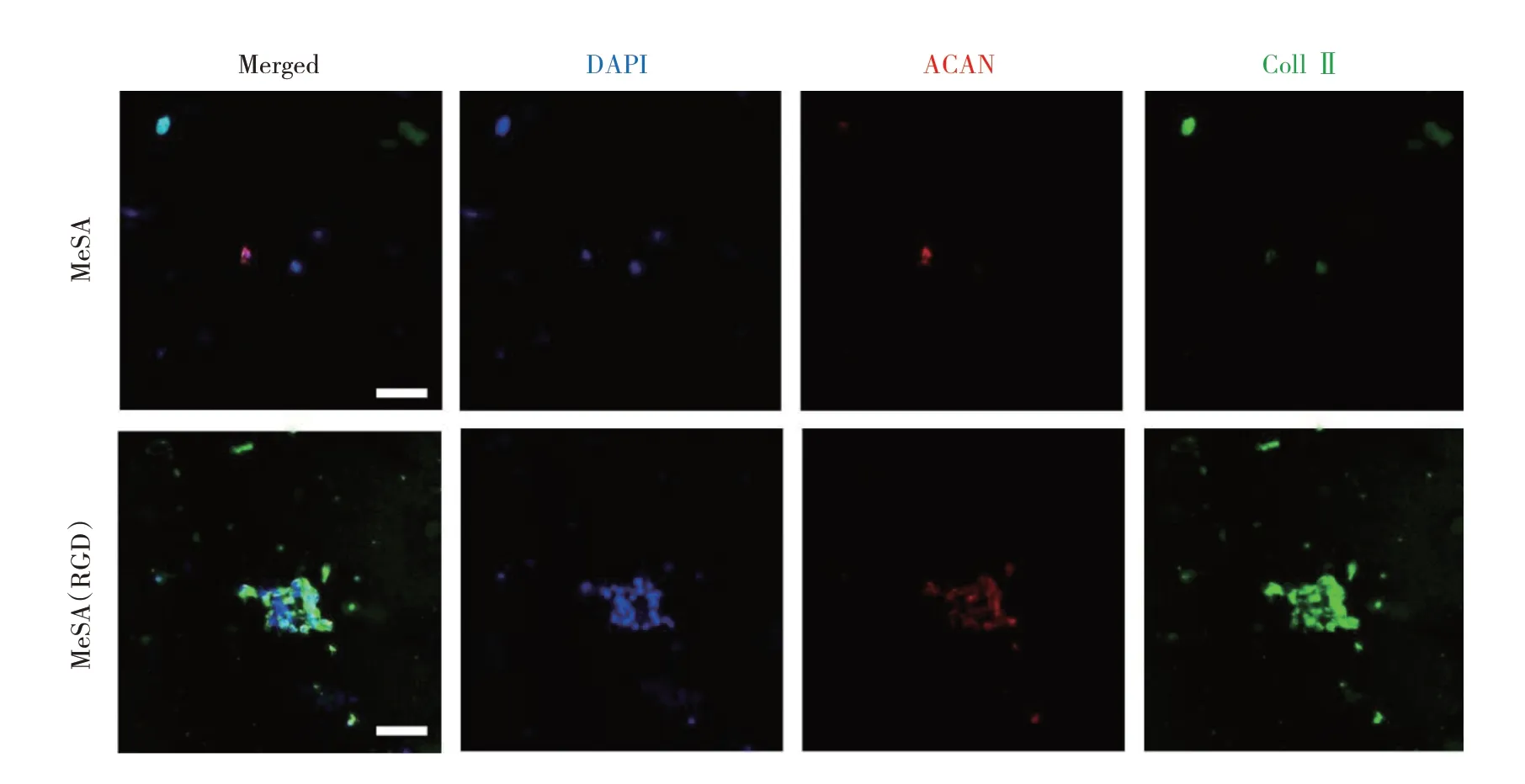
图4 体外培养14 d 后的细胞-水凝胶复合体激光共聚焦显微镜下所见

图5 体外培养14 d 后的细胞-水凝胶复合体的软骨相关基因mRNA 和蛋白的表达水平比较(A:ACAN mRNA 表达水平比较;B:Coll ⅡmRNA 表达水平比较;C:ACAN 和Coll Ⅱ在水凝胶基质内的蛋白表达电泳图)
3 讨论
水凝胶支架作为一种新型细胞培养体系和可注射修复材料,在近些年的组织再生领域得到广泛的关注和研究[12-13]。以海藻酸钠为代表的天然高分子材料,可以通过物理和化学改性,制备适用于组织工程技术的支架体系[14-16]。海藻酸钠来源于褐色海藻,具有优良的亲水性和生物相容性,其较慢的降解速度可以保证支架较长时间充填和修复目标缺损[17-18]。以往的研究表明,通过共价交联形成的MeSA 水凝胶,可以提供一种稳定非降解的胶态结构,并且有利于细胞的生存和生长[19]。然而,天然的细胞外基质是复杂和动态的,这种稳定且高度交联的网络基质结构往往会限制种子细胞的迁移和增殖。同时,由于MeSA 本身缺乏与细胞接触的位点,这也会导致种子细胞在此凝胶基质中的信号传递和细胞-基质相互作用受到限制[20-21]。基于此,本研究着眼于BMSCs 向软骨分化转变中的关键细胞行为,构建功能化MeSA 基质,改善基质的生物活性,用以调节关键细胞行为并高效促软骨形成。
本研究首先通过迈克尔加成反应,将仿生多肽接枝于MeSA 中的双键上。仿生多肽由于其结构稳定、生物相容性好以及生物学效果显著等优点,可以赋予水凝胶额外的生物性能。以往的研究表明,RGD 多肽可以通过整合素,提供细胞作用于基质的结合位点并调控种子细胞存活和增殖,显著改善凝胶基质微环境。Luo 等[22]研究RGD 调控BMSCs 增殖和成骨分化的实验中,证明了离子交联的MeSA 水凝胶通过接枝RGD 序列,可以改善细胞增殖活性。同时指出增殖活性的提高可以更好地促进成骨分化效果。Huebsch等[8]在研究三维水凝胶基质对BMSCs 分化的调控中,为了更好地模拟天然细胞外基质环境,也是首先将RGD 多肽修饰于MeSA 基质中,增强细胞与基质间的连接。同时也指出,细胞与基质间的作用力加强,是调控细胞分化的重要指标。因此,在水凝胶的设计中,增强基质与细胞间的黏附对于细胞活性的表达和细胞分化的调控至关重要。就目前的研究动态来讲,仿生RGD 多肽功能化SA 在调节BMSC 成软骨向分化中的细胞行为还鲜有报道。本实验中,无论在二维培养体系还是三维培养体系,细胞可以与功能化基质产生更好的相互作用,细胞表现出显著的迁移趋势和骨架延展。在RGD 对细胞活性调控的基础上,将细胞-水凝胶三维复合体在体外诱导培养14 d 后,功能化的水凝胶基质可以更好地调控BMSCs 的成软骨向分化。同时,在功能化的三维培养体系内,细胞出现明显的聚集成团现象,而BMSCs 在发育和分化过程中的聚集和凝聚现象,是软骨形成过程中的关键行为特征[23]。
本研究通过将RGD 多肽接枝于MeSA 上,改善共价交联水凝胶的基质特性,促进了BMSCs 增殖和聚集活性的表达。BMSCs 在凝胶基质中诱导培养14 d 后,软骨形成相关的蛋白和基因表达显著。因此,该功能化的水凝胶可以提供BMSCs 良好的生存空间和微环境,促进BMSCs 在凝胶基质中的成软骨向分化。

