MTHFD2与头颈部鳞状细胞癌的肿瘤微环境相关性
史振祥,吴 洒,蔡伟松,明小平,陈 雄
1. 武汉大学中南医院耳鼻咽喉头颈外科(武汉 430071)
2. 华中科技大学同济医学院附属湖北妇幼保健院妇科Ⅱ(武汉 430070)
头颈部癌症在全球癌症相关死亡率中排名第六,每年约有60 万新发病例和近50%死亡率[1-2]。头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)作为最主要的组织学类型,占所有头颈部癌症的90%以上[3]。HNSCC 来源于口腔、咽和喉的黏膜上皮细胞。吸烟、酗酒是导致口腔癌和喉癌发展的两个主要危险因素,而感染人乳头状瘤病毒(human papilloma virus,HPV)则与咽癌高度相关[2]。目前,HNSCC 的诊断是通过对原发肿瘤和(或)颈部肿块的活检来确定的,手术、放疗、化疗和免疫治疗仍是HNSCC 的主要治疗方式。HNSCC 的TNM分期系统是临床上判断预后最常用的指标,这对治疗策略的选择至关重要[4]。虽然有文献报道是否感染HPV 也能帮助评估一部分患者治疗反应与预后[2],但仍有相当一部分处于相同TNM 分期的HNSCC 患者在应用免疫治疗时可能会产生不同的临床结果[5]。相同TNM 分期的HNSCC 患者,只有少部分对免疫检查点抑制剂显示出治疗效果[6]。因此,发现新的和敏感的HNSCC 生物标志物仍然是至关重要的。
亚甲基四氢叶酸脱氢酶2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)是叶酸介导的一碳代谢的关键酶之一,在细胞核苷酸补充氨基酸(甘氨酸和丝氨酸)稳态和s-腺苷蛋氨酸(SAM)产生中发挥重要作用[7]。为满足对核苷酸供应的需求,MTHFD2表达上调,这是胚胎发生过程中细胞增殖的关键,但其在大多数成人组织中很少表达[8]。值得注意的是,由于细胞增殖的高生物合成需求,MTHFD2在多种肿瘤中显著上调。除了在肿瘤中的代谢功能外,MTHFD2在非代谢功能方面也起着至关重要的作用,如调节免疫攻击能力的免疫细胞信号通路[9]。虽然HNSCC 是一种较为常见的癌症类型,但MTHFD2在HNSCC 中的作用尚不清楚。本研究采用生物信息学方法,系统全面地获取MTHFD2在HNSCC 中的表达情况,分析与肿瘤分级分期及预后的关系,并从基因功能与信号通路、肿瘤突变负荷、肿瘤免疫浸润等角度诠释MTHFD2与HNSCC 之间的关系,以期为临床上HNSCC 的诊断和治疗提供依据。
1 材料与方法
1.1 数据来源
在癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA) 数据库(https://portal.gdc.cancer.gov/)中,选择HNSCC 项目编号TCGA-HNSC,下载免疫系统浸润、基因表达(工作流类型:HTSeq FPKM)和相关临床信息(数据类型:临床补充)的数据[10]。本研究排除了任何关于年龄、TNM 分期、总生存期(overall survival,OS)、远处和淋巴结转移以及局部浸润等数据缺失或不足的样本。在全部528 例HNSCC 数据与44 例对照数据中,519 例HNSCC 样本、44 例对照样本符合纳入标准,保留了RNA-Seq 和临床数据,并用于进一步的研究。本研究符合TCGA 提供的出版指南。
1.2 基因集合富集分析
使用从TCGA 数据库中获得的归一化RNASeq 数据进行基因集合富集分析(gene sets enrichment analysis,GSEA)[11]。排列的数量被设置为1 000 个。利用GSEA 分析GO 和KEGG 通路,以研究MTHFD2可能的生物学功能。富集结果满足错误发现率(false discovery rate,FDR)和P值均小于0.05 时表示具有统计学意义。
1.3 肿瘤突变负荷分析
体细胞突变数据,包括体细胞、编码、碱基替换和插入-缺失突变,由R 软件和maftools 软件包进行处理,该软件包分析并创建突变注释格式文件(https://github.com/PoisonAlien/maftools)的可视化,其中,能进行数据处理的样本有508 例。肿瘤突变负荷(tumor mutation burden,TMB)计算为每百万碱基的体细胞突变数。中位TMB 值定义为将HNSCC 患者分为高TMB 组和低TMB 组的临界值。
1.4 免疫浸润分析
使用CIBERSORT 和TIMER 2.0(http://timer.comp-genomics.org/)相关模块评估MTHFD2表达与肿瘤浸润性免疫细胞(tumor-infiltrating immune cells,TIICs)之间的潜在关系。数据处理采用Spearman 相关性分析,P<0.05 表示具有统计学意义。TIMER 2.0 是一个用于系统分析不同癌症类型的免疫浸润的综合资源站。
1.5 统计学分析
使用R 4.2.3 软件进行统计学分析。应用Cox比例风险回归模型进行单变量和多变量模型生存分析,分别计算风险比(hazard ratio,HR)和95%置信区间(confidence interval,CI),并评估MTHFD2的表达以及其他病理和临床因素对OS 的影响。组间比较采用χ2检验及Fisher 精确检验分析。
2 结果
2.1 生存分析
TCGA 数据库用于识别正常组织和肿瘤组织中MTHFD2mRNA 水平的差异。对纳入的519个肿瘤文件和44 个正常文件进行数据转换,将计数数据转换为与微阵列数据更相似的值。正常组织和HNSCC 组织中MTHFD2的表达结果见图 1-A,MTHFD2在HNSCC 组织中高表达,在正常组织中低表达;差异表达与HNSCC 组织与配对相邻正常组织比较结果一致(图1-B)。使用Cox 回归分析探索MTHFD2以及其他病理和临床因素与HNSCC 患者OS 之间的联系,单因素分析显示,远处转移[HR=4.745,95%CI(1.748,12.883),P=0.02]、淋巴血管浸润[HR=1.699,95%CI(1.211,2.384),P=0.02]、MTHFD2表达 水 平[HR=1.477,95%CI(1.185,1.842),P<0.001]与OS 显著相关;多因素分析结果如图1-C 显示,MTHFD2表达是预后的独立危险因素。如图1-D 所示,使用最佳阈值方法确定cut-off 值,并划分为高、低表达组,每组各130例患者。相较于MTHFD2低表达的HNSCC 患者,MTHFD2高表达人群OS 更低(HR=1.5,P=0.04)。MTHFD2表达的分布、HNSCC 患者的生存状态、MTHFD2的表达谱如图1-E 所示。MTHFD2对HNSCC 预后有一定预测价值,ROC曲线显示MTHFD2表达水平预测HNSCC 患者5年生存率的AUC 为0.612(图1-F)。
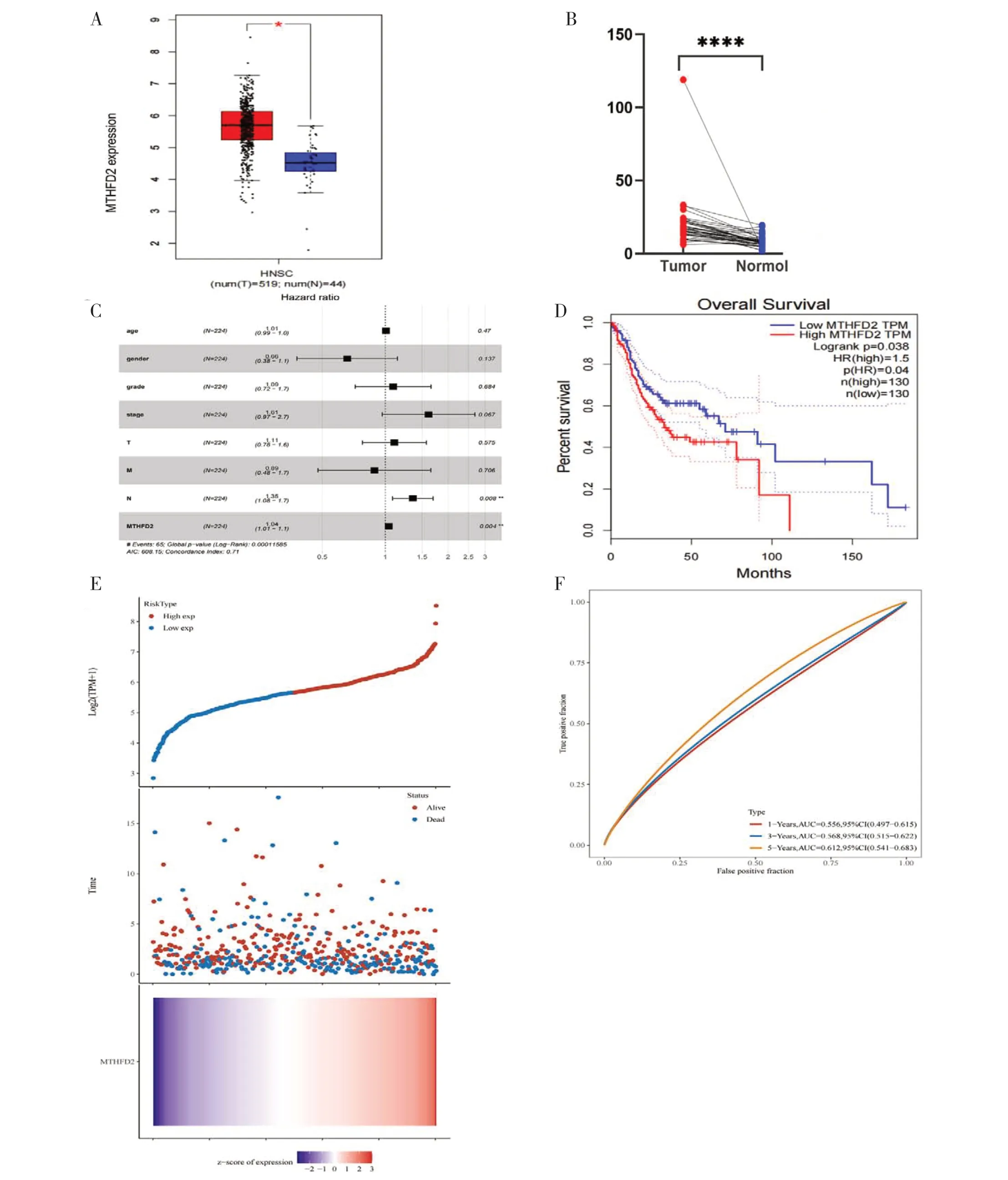
图1 MTHFD2表达及其与头颈部鳞状细胞癌患者生存预后的关系Figure 1.The expression of MTHFD2 and its relationship with survival status of patients with HNSCC
2.2 MTHFD2表达与临床病理的关系
MTHFD2表达水平增加与T 分期(图2-A)、N 分期(图2-B)、临床分期(图2-D)、组织学分级(图2-E)、淋巴血管浸润程度(图2-F)显著相关,P值均<0.05,而M 分期与MTHFD2过表达之间无统计学意义(图2-C)。结果表明,与MTHFD2低表达水平HNSCC 患者相比,MTHFD2高表达水平者具有更高的组织学分级和临床分期。
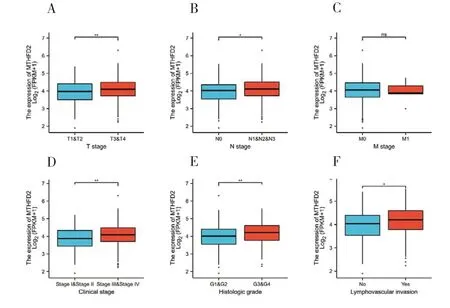
图2 MTHFD2表达与临床病理的关系Figure 2. Relationship between MTHFD2 expression and clinicopathology
2.3 MTHFD2的GSEA研究
采用GO 和KEGG 通路分析,探讨MTHFD2潜在的生物学功能。G S E A 结果显示,在MTHFD2高水平样本中,GO 项和KEGG 通路富集存在显著差异(FDR <0.050,P<0.050)。根据其归一化富集评分(normalized enrichment score,NES)选择最高度富集的信号通路。KEGG通路分析显示,与MTHFD2表达呈强正相关的通路包括细胞周期、药物代谢细胞色素p450、细胞色素p450的异生物代谢、视黄醇代谢和类固醇激素生物合成;强负相关通路包括心肌收缩、扩张性心肌病、细胞外基质受体相互作用、肥厚性心肌病和阿尔茨海默病(图3-A、图3-B)。GO 通路分析显示5 类与高水平MTHFD2正相关的生物进程,分别为ncRNA 代谢过程、模式形成过程、细胞器分裂、ATP 酶活性和纤毛组织;负相关进程为神经递质受体调节活动、血管紧张素激活信号通路、原纤维胶原三聚体、角质形成细胞发育和细胞外基质组织的负调控,如图3-C 和3-D 所示。与MTHFD2密切相关的生物过程和分子功能分别是小分子分解代谢过程、羧酸生物合成过程和羧酸结合过程。结果表明,在HNSCC患者中调控细胞周期控制和ncRNA 代谢过程的通路与MTHFD2的表达密切相关。
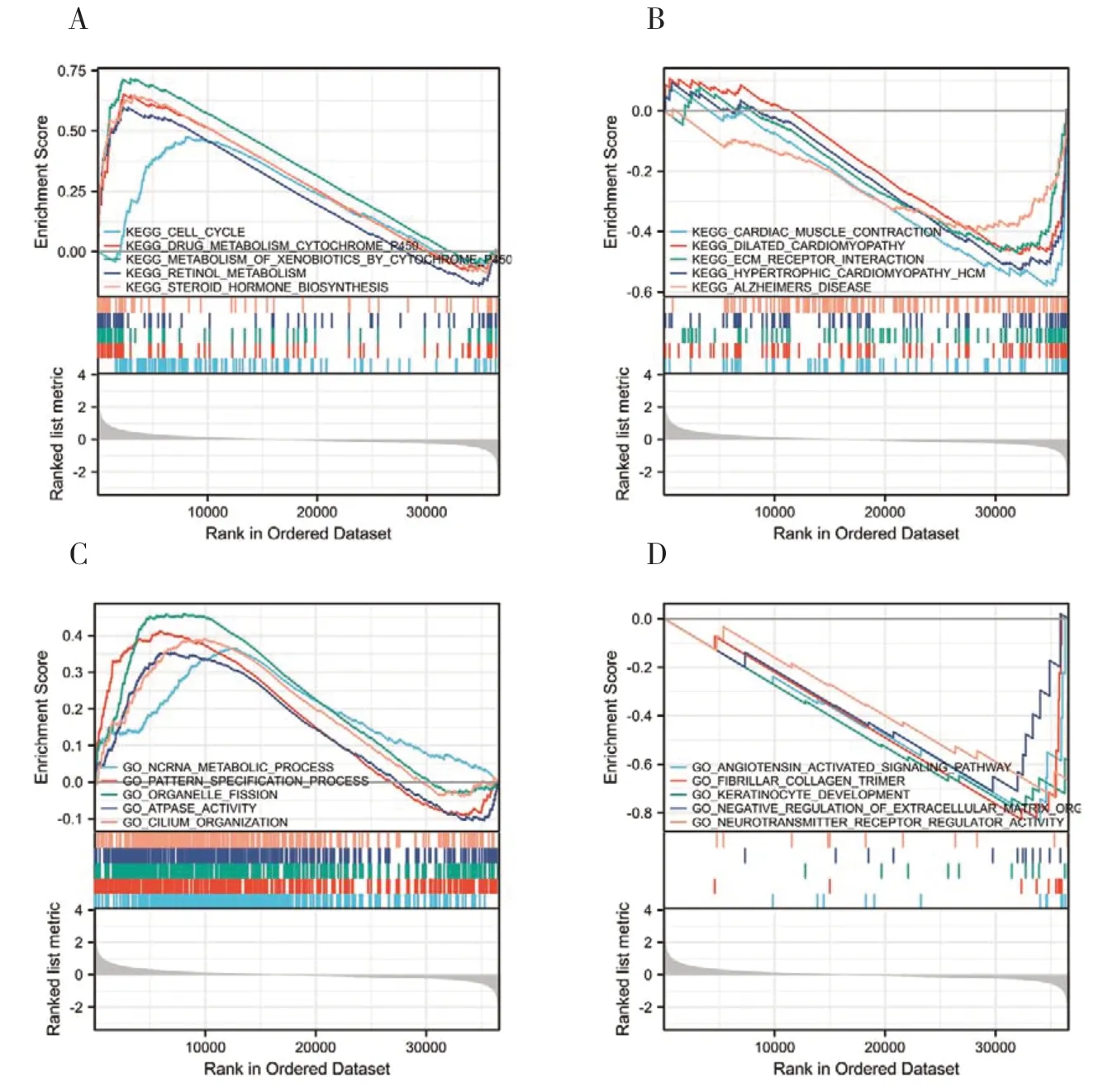
图3 MTHFD2 的GO功能富集分析与KEGG信号通路分析Figure 3. GO term and KEGG pathway analyses of MTHFD2
2.4 MTHFD2表达与肿瘤突变负荷的关系
TMB 被认为是一种新的免疫疗效的预测生物标志物。本研究共分析了508 个样本,其中451 个样本发生了改变,MTHFD2体细胞突变率为0.59%(图4-A)。图4-B 显示MTHFD2和TP53、TTN、FAT1等前10 个突变基因的错义突变几乎占了所有的突变类型。变异型中单核苷酸多态性(single nucleotide polymorphism,SNP)的频率明显高于插入和缺失,C >T 是最常见的突变型。特定样本中的TMB 和排名前10位的突变基因见图4-C。进行相关性分析以确定MTHFD2表达与TMB 评分之间的关系,结果发现MTHFD2表达与TMB 评分呈正相关(r=0.18,P<0.001),这些结果可能为MTHFD2干预治疗HNSCC 提供潜在线索和证据。
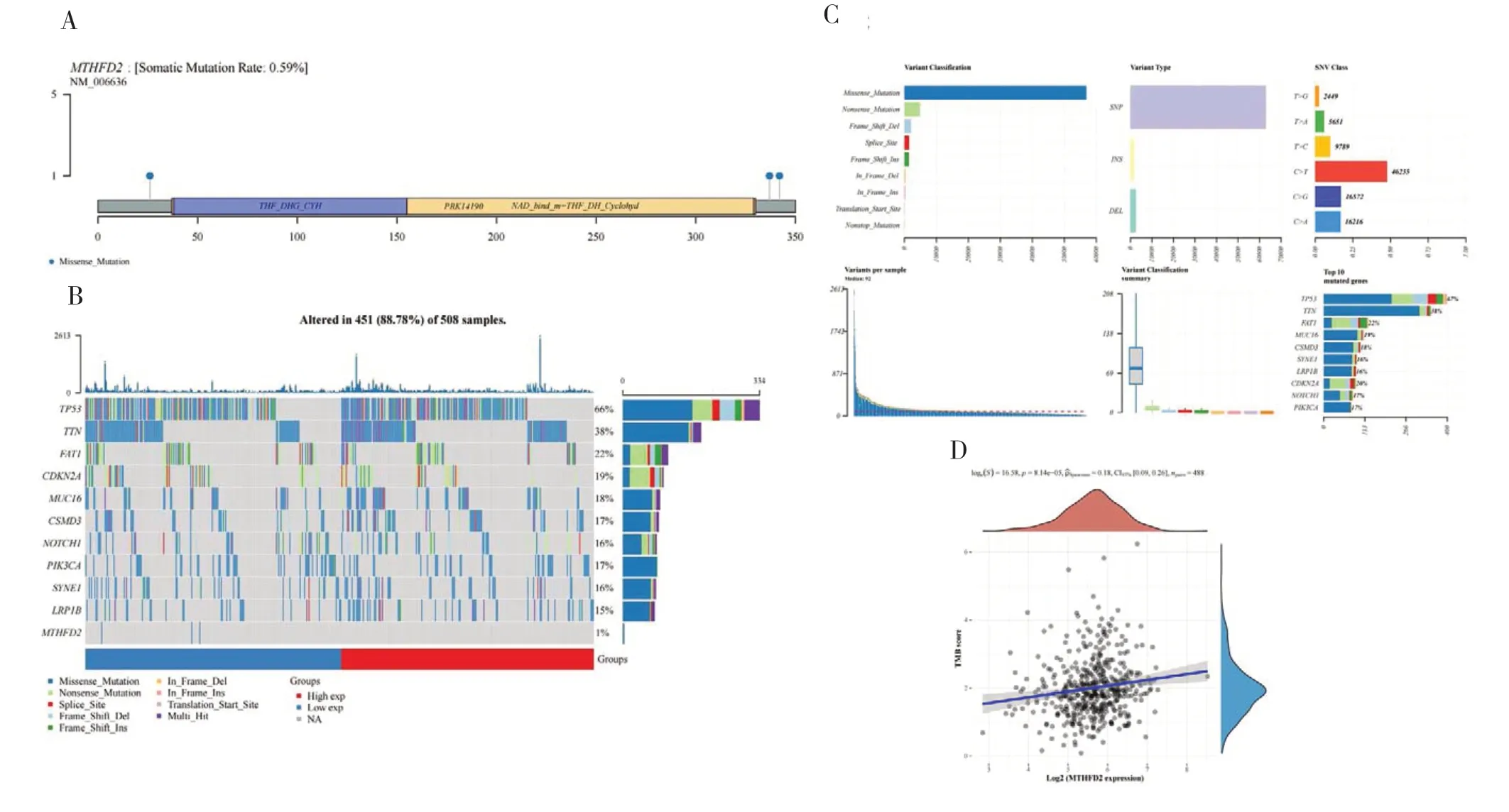
图4 MTHFD2存在体细胞突变且其表达与肿瘤突变负荷呈正相关Figure 4.The somatic mutation of MTHFD2 and the positive correlation between its expression and TMB score
2.5 MTHFD2表达与肿瘤浸润性免疫细胞的关系
为探究不同MTHFD2水平的HNSCC 患者肿瘤免疫微环境是否不同,根据MTHFD2的表达情况将肿瘤样本分为2 组,其中高表达组250 例,低表达组250 例。使用CIBERSORT 算法评估MTHFD2高、低表达组在24 种免疫细胞上表达水平的差异,结果显示指状树突细胞(interdigitating dendritic cell,iDC)、肥大细胞、NK CD56 bright 细胞、NK CD56 dim 细胞、T 辅助细胞、TFH、Th17 细胞、Th2 细胞和Treg 细胞的浸润程度均受到MTHFD2表达的影响;与低表达组相比,高表达组NK CD56 bright 细胞、T 辅助细胞和Th2 细胞升高,而iDC、TFH、Th17 细胞、Treg 细胞、NK CD56 dim 细胞和肥大细胞降低(图5-A)。本研究还评估了24 种免疫细胞之间可能存在的相关性,热图结果显示,不同的肿瘤浸润性免疫细胞亚群的比例是从弱相关到中度相关的(图5-B)。考虑到独立的肿瘤浸润淋巴细胞在预测总生存率和前哨淋巴结状态中起着关键作用,使用TIMER 2.0 来分析HNSCC 中MTHFD2的表达与免疫浸润水平之间可能存在的相关性。如图5-C 所示,MTHFD2的表达与Th2细胞(r=0.245,P<0.001)、T 辅助细胞(r=0.225,P<0.001)的浸润水平呈正相关,和肥大细胞(r=-0.172,P<0.001)、Th17 细胞(r=-0.128,P=0.004)、中性粒细胞(r=-0.104,P=0.020)以及Treg 细胞(r=-0.094,P=0.036)的浸润水平呈负相关。这些结果表明,MTHFD2与HNSCC的免疫浸润水平有着十分密切的联系。
3 讨论
HNSCC 发病率逐年上升,预计其2030 年发病率相较于2018 年升高30%[2]。既往研究显示尽管癌症患者总体生存率显著提高,但晚期HNSCC患者治疗后失败的可能性仍相对较高[12]。目前临床采用包括手术、放化疗和免疫治疗在内的多种治疗策略[13],为各个阶段的HNSCC 患者提供个体化和有效治疗,免疫治疗是其中发展最为迅速的一种治疗方法[4,14]。生物标志物有助于预测免疫表型,这是由免疫反应状态定义的。大量研究证据提供了关于HNSCC 生物标志物的信息。PD-L1 负向调节免疫功能,是HNSCC 中著名但有争议的生物标志物[15]。与PD-L1-肿瘤相比,PD-L1+肿瘤对应用抗PD-1/PD-L1 治疗的反应率提升[16]。然而,来自III 期随机对照试验的数据未能发现PD-L1 表达与肿瘤反应或生存之间的显著相关性,通过长期的随访,使用纳武利尤单抗对PD-L1 表达与PD-L1 非表达患者均有疗效,死亡风险分别降低了45%和27%,且两组患者总体生存率在18、24、30 个月时均无显著性差异[17-18]。TMB 近年来在前瞻性临床试验和许多肿瘤类型中被评估为免疫检查点封锁的潜在生物标志物[19-21]。据报道,MTHFD2参与了一系列关键的细胞生物学过程,如核苷酸补充、氨基酸(甘氨酸和丝氨酸)稳态和s-腺苷甲硫氨酸(SAM)产生[7]。最初,MTHFD2被认为是叶酸介导的一碳代谢的关键酶之一,通过上调一碳代谢策略参与肿瘤的发生和癌症的发展[22-23]。基于此原理,针对一碳代谢的选择性化疗药物不断被研发并被应用于肿瘤治疗,如经典药物甲氨蝶呤等。近年来MTHFD2的非代谢功能越来越受到关注,研究认为IFN-γ 诱导的MTHFD2通过非代谢方式上调PD-L1 来诱导癌症免疫逃避[9]。
本研究使用从TCGA 获得的HNSCC 患者的数据来评估MTHFD2对生存结局的预测价值,结果发现MTHFD2高表达可作为不良OS 的独立预测因素。有报道称MTHFD2在急性髓系白血病(AML)中过表达,下调MTHFD2可降低AML细胞的生长和集落形成,并诱导分化[24]。在乳腺癌细胞中抑制MTHFD2可显著影响许多重要的代谢途径,表明MTHFD2在癌细胞可能起着中央代谢酶的作用[25]。高表达MTHFD2的HNSCC 患者较低表达者更有可能表现为晚的TNM 分期[26],反映高MTHFD2表达水平可能影响肿瘤发生和肿瘤免疫机制的进展[27]。
GO 项和KEGG 通路分析显示,MTHFD2表达上调主要与细胞周期控制和小分子分解代谢过程有关。在HNSCC 患者中MTHFD2表达升高可能会改变细胞周期控制和代谢过程。除代谢功能外,MTHFD2体细胞突变率接近1%,其表达与TMB 评分呈正相关。自从TMB 首次被认为是黑色素瘤免疫检查点抑制剂(ICIs)的潜在生物标志物以来[20],许多研究已经报道了更高的TMB和ICIs 疗效之间的联系,表明TMB 可能是一个很好的疗效预测生物标志物[28-30]。
本研究使用TIMER 2.0 数据库揭示了HNSCC中MTHFD2的表达和免疫浸润水平之间的联系。MTHFD2表达与肥大细胞、T 辅助细胞和Th2细胞的相关性最强。此外,CIBERSORT 分析显示,MTHFD2表达水平与免疫细胞浸润水平,特别是NK 细胞、巨噬细胞和T 辅助细胞之间呈中度至强正相关。MTHFD2高表达组中NK CD56 bright、Th2 等细胞增加,而iDC、NK CD56 dim和肥大细胞等减少。NK 细胞根据CD56 的密度分为NK CD56 dim 细胞和NK CD56 bright 细胞2种类型,前者有强大的细胞毒性,后者可以分泌丰富的细胞因子[29]。有研究报道CD4+细胞中不同细胞亚群一碳代谢和嘌呤合成的激活有明显差异[31-32],与本团队分析一致,MTHFD2表达的差异可能与不同T 细胞亚型的浸润有关,提示了MTHFD2调控HNSCC 中NK 细胞和T 细胞功能的可能机制。
综上所述,本研究结果显示MTHFD2可作为HNSCC 新的生物标志物。研究有助于在HNSCC中阐明MTHFD2与HNSCC 患者预后的关系及其与肿瘤免疫细胞浸润的作用,以及调节这些过程的蛋白质。随着对其功能范围的进一步研究,MTHFD2可作为一种对HNSCC 诊断和免疫生物标志物的有效工具,并可能有助于使生物标志物治疗成为未来治疗HNSCC 的一个有前途的选择。

