脂噬抑制细胞泡沫化在动脉粥样硬化中作用的研究进展*
靳 雅, 张立双, 黄湘龙, 马耀磊, 刘金杰, 张 晗, 李 霄△
(1天津中医药大学组分中药国家重点实验室,方剂学教育部重点实验室,中医药研究院,天津 301617;2天津市滨海新区中医医院暨天津中医药大学第四附属医院,天津 300451)
动脉粥样硬化(atherosclerosis, AS)是多数心脑血管疾病致死的重要原因之一。全球疾病研究表明,AS 性心脏病在全球流行,发病数已由1990 年的约1 亿例增长为2019 年的1.8 亿例[1];在2020 年流行病调查中发现30 岁以上颈动脉内膜增厚的比率为27.6%[2]。同时,国家心血管病中心发布的《中国心血管健康与疾病报告2021》中指出我国心血管病人数达3.3 亿,每5 例死亡中就有2 例死于心血管病。AS 是一种以动脉血管壁脂质异常蓄积为主要特征的慢性血管炎症性病变,形成富含脂质的泡沫细胞(foam cells)是AS 病变的起始与早期重要病理特征之一(图1)。调控细胞内脂质代谢过程、抑制细胞泡沫化历来是逆转AS 病变进程的关键切入点之一。在AS病变过程中,脂滴(lipid droplets)作为细胞内储存中性脂质的主要细胞器,其异常蓄积是AS 泡沫细胞的标志。脂噬(lipophagy)是通过溶酶体介导选择性降解细胞内脂滴的过程。脂滴降解为游离胆固醇(free cholesterol, FC)后,启动胆固醇外流与逆向转运(reverse cholesterol transport, RCT)机制,清除血液和外周组织过多的胆固醇,从而抑制细胞泡沫化。因此,探究脂滴的合成、分解、代谢、外排等机制以抑制泡沫细胞形成对于延缓AS 疾病进展尤为重要,同时深入探讨脂噬过程与AS 泡沫细胞脂质稳态的调控关系,可为抗AS开发新靶点与新策略。

Figure 1. The formation of foam cell in the vasculature.图1 血管中泡沫细胞的形成
1 脂噬概述
1.1 脂噬是一种选择性自噬 自噬(autophagy)是一个“自食”过程,即溶酶体通过吞噬自身胞质蛋白或细胞器后形成自噬溶酶体并降解其内容物的过程,可通过降解胞内蛋白质、线粒体、过氧化物酶和脂滴[3-4],从而维持细胞稳态和新陈代谢。经典观点认为自噬是一种非选择性的降解过程,近10 年的研究证实,自噬还可选择性地识别特定类型的降解底物并定向运送至溶酶体中进行降解,即选择性自噬,如线粒体自噬、铁自噬、内质网自噬、核糖体自噬、糖噬和脂噬等[5]。脂噬作为一种选择性自噬过程,主要通过自噬溶酶体途径介导细胞内脂滴降解,促进胆固醇外流,以减少多余脂质蓄积,对于维持细胞内脂质代谢稳态、抑制AS 泡沫细胞形成起到重要作用。2009年Singh等发现了肝脏中的脂噬过程,并通过一系列研究明确了脂噬在肝脏脂质循环中可发挥与经典脂肪酶驱动的脂质降解同样重要的作用[6]。随后的研究相继表明,脂噬还可在多种细胞中发挥调控脂滴代谢的作用,包括巨噬细胞、脂肪细胞、下丘脑和纹状神经元、肾小管细胞、T 细胞、肠细胞、成纤维细胞等,已成为调节细胞脂质代谢平衡与能量代谢的关键环节之一[7]。
1.2 脂噬底物——脂滴 脂噬的底物脂滴是细胞内脂质成分的主要存在形式。作为包裹中性脂质的细胞器,脂滴对细胞内脂质代谢稳态的维持有重要作用。虽然不同组织和细胞中脂滴的形态、数量和分布各异,但结构均类似,即以甘油三酯(triglyceride,TG)和胆固醇酯(cholesterol ester, CE)构成中性脂质核心,周围包绕磷脂单分子层,表面覆盖脂滴相关蛋白。脂滴相关蛋白是具有相似序列并调节脂滴脂质代谢的一类蛋白质,包括围脂蛋白、结构蛋白、脂质转运蛋白、脂肪分化蛋白及脂质代谢酶等。脂滴代谢过程主要包括了生成、融合和降解。在生理条件下,细胞内游离脂肪酸在内质网中被转化为中性脂质储存于脂滴内,以防止胞内脂质蓄积产生膜损伤和脂毒性。当能量缺乏时,成熟的脂滴进入胞质后,一方面细胞内启动以脂肪酶级联反应介导的水解作用(即脂解作用),脂滴以TG 的形式被水解为脂肪酸;另一方面,自噬反应被诱导,脂滴通过自噬体、溶酶体等脂质自噬方式(即脂噬作用)被降解,释放游离脂肪酸,最终通过线粒体和过氧化物酶体产生能量,以维持胞内能量代谢稳态[8]。因此,脂滴这种可与多种细胞器相互作用的独特、动态的细胞器,已成为细胞内脂质吸收、分布、储存和利用的主要调节器之一。干预脂滴的自噬过程可抑制脂质蓄积、脂毒性、活性氧增多、线粒体解偶联及细胞凋亡,对延缓脂质代谢紊乱相关疾病的病理进展有重要意义[9]。
2 AS脂噬途径
根据自噬降解产物与溶酶体结合途径的不同,自噬过程可分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperonemediated autophagy, CMA)[10]。脂噬可以调控细胞内脂质代谢,当机体脂质存储异常时可以触发脂噬调节脂质稳态。目前,已明确AS 脂噬过程主要涉及巨自噬和CMA两种降解方式。
2.1 巨自噬 巨自噬主要特征是通过双层膜包绕待降解体(脂滴),形成自噬体,再与溶酶体融合并降解[11]。巨自噬的过程一般分为以下几个阶段:诱导、成核、伸长、自噬体与溶酶体融合、自噬溶酶体的底物降解。自噬体由一个稳定的以UNC-51 样激酶1/2(UNC-51-like kinase 1/2, ULK1/2)、自噬相关蛋白13(autophagy-related protein 13, Atg13)和FIP200 (focal adhesion kinase family interacting protein of 200 kD)组成的ULK1/Atg1 复合物诱导形成[12]。当降解底物脂滴过大时,自噬体只封存部分脂滴[13]。随后III 类磷酸肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)复合物被招募于自噬体形成部位,并被ULK1复合物磷酸化激活[14]产生磷脂酰肌醇3-磷酸。两个泛醌蛋白(ubiquilin)的共轭系统Atg12-Atg5-Atg16 复合体、Atg8/微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3, LC3)复合体和跨膜蛋白ATG9影响自噬体的伸长[15]。不断伸长的自噬体最终成熟形成一个完整的自吞体,自吞体接触溶酶体并融合成自噬溶酶体[16],随后脂滴被溶酶体酸性脂肪酶(ly‐sosomal acid lipase, LAL)降解,形成FC排出细胞。
大量研究表明,巨自噬参与AS 的进程。研究显示,嘌呤能P2Y12 受体通过抑制血管平滑肌细胞(vascular smooth muscle cells, VSMCs)中的巨自噬造成细胞内的胆固醇沉积促进泡沫化[17]。P2RY12 受体抑制剂可以通过PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)促进载脂蛋白E 基因敲除(apolipoprotein E gene knockout,ApoE−/−)小鼠斑块中VSMCs 的自噬,减少斑块的产生;同时在VSMCs 中P2RY12 受体激活可抑制LC3成熟、p62 降解和自噬体形成,减弱了胆固醇外流;P2RY12 受体促进的胆固醇外流与自噬相关蛋白Atg5密切相关,Atg5敲除可以减弱P2RY12受体诱导的胆固醇外流。巨脂噬同样发生在巨噬细胞中,维生素D3(vitamin D3, VitD3)和过氧化物氧还蛋白1(peroxiredoxin 1, PRDX1)可通过自噬途径降解脂滴,抑制巨噬细胞泡沫化[18]。巨噬细胞中,VitD3 通过调节非受体型蛋白酪氨酸磷酸酶6(protein tyro‐sine phosphatase non-receptor type 6, PTPN6)促进STAT3 磷酸化,恢复自噬相关蛋白LC3-IIB 和p62 的水平,消除氧化型低密度脂蛋白(oxidized low-density lipoprotein, ox-LDL)引发的自噬受损,抑制脂滴积累,从而抑制细胞泡沫化;同时VitD3-VDR (vitamin D receptor)-PTPN6 轴可以激活MAPK1 和CEBPB(CCAAT/enhancer-binding protein beta),启动增强自噬相关蛋白BECN1 和ATG5 表达,从而促进自噬。PRDX1缺乏导致ApoE−/−小鼠斑块中p62 积累引发脂噬障碍,加速AS斑块的产生;巨噬细胞中,PRDX1缺乏可以加速ox-LDL 诱导的氧化应激,导致p62 积累,自噬通量受损,同时促进ATP 结合盒转运体A1(ATP-binding cassette transporter A1, ABCA1)的下调,抑制胆固醇外流[19]。
2.2 CMA CMA 是一种具有高度选择性的自噬。CMA 降解底物的氨基酸序列带有KFERQ 基序,伴侣蛋白HSPA8 (heat shock protein family A member 8)及其供体如CHIP (C terminus of Hsc70-interacting protein)、HSP40 和应激诱导磷蛋白1(stress-induced phosphoprotein 1, STIP1)特异性识别此基序[20]。随后,溶酶体相关膜蛋白2A(lysosomal-associated mem‐brane protein 2A, LAMP2A)识别结合蛋白暴露的KFERQ-HSPA8 基团,LAMP2A 被聚化形成功能性易位复合物,帮助“引导”目的蛋白进入溶酶体腔降解[21];易位复合物解体再次生成LAMP2A,识别下一个KFERQ-HSPA8基团。
最近的研究表明,CMA 可以通过调节脂质代谢预防AS。LAMP2A−/−小鼠中,CMA的抑制导致斑块中坏死核心增加,平滑肌细胞收缩表型变多,巨噬细胞促炎表型增加,进而加快斑块的产生,同时CMA 的抑制可以通过扰乱体内的新陈代谢和凝血功能,加速AS发生进程;恢复CMA后,斑块显著减小,代谢得到改善,AS 程度减弱[22-23]。在巨噬细胞中,LAMP2A的缺乏会导致LAL 减少,影响脂滴分解,引起脂质积累,进而加速AS进程[24]。
3 AS脂噬的调控机制
脂噬过程受细胞内多种蛋白和分子机制的调控,主要涉及脂滴相关蛋白和自噬相关蛋白(图2)。脂滴表面包含数百万个影响脂滴代谢和信号传导的蛋白,这些蛋白具有调节脂噬的特异性功能。同时脂噬作为特异性自噬也受自噬调节相关基因的调控。因此,可以通过调节脂滴蛋白和脂滴包被蛋白(perilipin, PLIN)、抑制mTOR、激活自噬相关蛋白等途径激活脂噬,抑制细胞泡沫化进程。
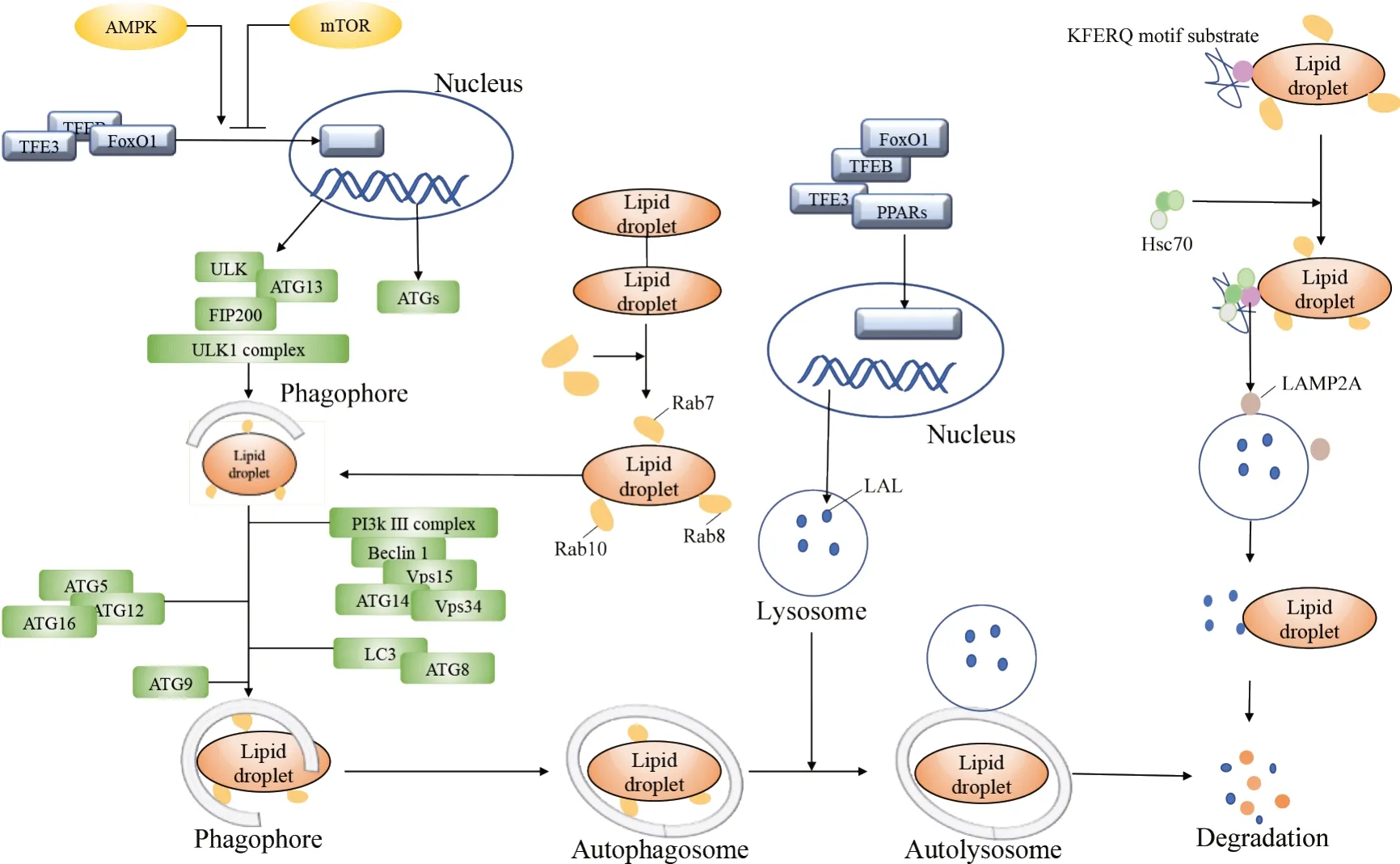
Figure 2. The process and regulation mechanism of liphagy in foam cells.图2 泡沫细胞中脂噬的发生过程与调节机制
3.1 Rab GTPase 激活蛋白 Rab (Ras-like proteins in brain)是存在于真核细胞质膜和细胞器膜的一类调节型小分子GTPase。研究表明多种Rab 蛋白均参与脂滴在胞内的运转过程。Rab7是Rab家族中的一种小G 蛋白,主要位于晚期自噬体中,促进脂滴向溶酶体转运与融合[25]。此外,Rab7 在介导肝细胞的脂噬中发挥作用,在饥饿的肝细胞中激活脂滴上的Rab7,可促进脂滴与溶酶体的融合[26]。Rab10 也被证实可介导脂滴的脂噬。实验表明,在饥饿的肝细胞中自噬膜上Rab10 被激活,并与效应蛋白EHBP1(EH domain binding protein 1)和EHD2(EH domain containing 2)形成三聚体复合物,连接自噬膜至脂滴表面,从而导致脂滴被自噬体吞噬[27]。Rab18是一种仅存在于脂滴的特异性Rab GTPase[28-29]。研究发现,抑制Rab18 时可观察到细胞中脂滴大量积累和脂质分解受损[30]。在巨噬细胞和VSMCs 中Rab GTPase的研究暂无报道,但是Rab GTPase 普遍存在于脂滴上,通过调节脂滴上的Rab GTPase 调节胞内的脂噬毋庸置疑,Rab GTPase 在巨噬细胞和VSMCs 中调节脂噬的作用尚需实验进行验证。
3.2 PLIN 蛋白家族 脂滴表面的PLIN 在脂噬中发挥重要作用,是脂噬开始的第一步[31]。PLIN 是脂滴是表面含量最多的蛋白,PLIN 通过与脂肪酶的相互作用调控脂滴内脂质储存和脂噬。PLIN参与了巨自噬和CMA 过程。研究表明,脂肪细胞中PLIN1敲除可促进脂滴与溶酶体的融合,加快巨自噬过程[32]。CMA 可选择性识别并降解脂滴表面的PLIN2 和PLIN3,介导脂滴进入溶酶体中降解[33]。此外,免疫组化显示AS 患者颈动脉斑块中的PLIN2 表达水平比正常人高;在体外培养的巨噬细胞中PLIN2 随着脂滴的积累表达上调[34]。如前所述,PLIN 是抑制脂滴被脂肪酶水解的一道屏障,下调脂滴表面的PLIN有助于促进脂噬,抑制细胞泡沫化。PLIN在AS中的具体作用与调控机制还需深入探究。
3.3 mTOR 与自噬相同,脂噬起源于mTOR 的抑制。mTOR 有两种复合体mTORC1 和mTORC2,与脂噬密切相关的是mTORC1。研究表明,mTORC1激活可促进ULK1/2 和ATG13 磷酸化,阻止ULK1 复合物形成[35-36]。此外,mTORC1 通过转录因子EB(tran‐scription factor EB, TFEB)和ATG14 抑制脂噬[37-38],而通过激活AMP 活化蛋白激酶(AMP-activated pro‐tein kinase, AMPK)抑制mTOR。研究表明,青蒿素可以促进ApoE−/−小鼠中AMPK 的激活,抑制mTOR 和ULK1磷酸化,增加微管相关蛋白1轻链3-II(microtu‐bule-associated protein 1 light chain 3-II, LC3-II)积累和p62 的降解,进而增加巨噬细胞脂噬,抑制细胞泡沫化[39]。在ox-LDL 处理的THP-1 细胞中,姜黄素衍生物可通过PI3K-AKT-mTOR 信号通路的抑制促进脂噬通量,增加胆固醇外流,减少细胞中脂质积累[40]。同样在平滑肌细胞中也观察到相似现象,P2RY12 受体抑制剂通过PI3K-AKT-mTOR 途径影响自噬通量,促进脂噬,抑制泡沫细胞形成[17]。
3.4 自噬受体蛋白 选择性自噬受体蛋白p62 可以调控脂滴的脂噬。p62 可作为泛素化目标和自噬体之间的联系物,标记泛素化蛋白降解物,通过LC3-II 识别输送至溶酶体中。褐藻糖胶可增强p62 依赖的选择性自噬,减少暴露于ox-LDL 的THP-1 细胞的脂质积累,减轻AS;沉默p62可增强mTOR 活性,抑制自噬下游蛋白,从而抑制巨噬细胞中的胆固醇外流[41]。缺乏p62的小鼠主动脉中巨噬细胞的脂质积累更严重,斑块中坏死核心增大,加重AS 病程。如前所述,p62 在选择性自噬中的标记作用可识别脂滴,加速脂滴降解,从而缓解AS。
3.5 LAL 脂滴内储存的CE 并不能穿透细胞膜,CE需要水解成FC流出细胞参与RCT。因此,脂噬的发生需要脂肪酶的参与,尤其是LAL。LAL 最早被发现于1968 年[42],它存在于溶酶体中,是水解胆固醇和TG 的关键酶[43]。LAL 在细胞中普遍表达,在肝细胞和巨噬细胞中表达水平最高。CE 在溶酶体中被LAL 水解为FC,之后依赖C1 型尼曼-匹克病(nie‐mann-pick disease type C1, NPC1)蛋白从溶酶体释放并通过多种机制抑制重新合成[44]。LAL 受转录因子过氧化物酶体增殖物激活受体(peroxisome prolifera‐tor-activated receptors, PPARs)、插头盒蛋白O1(fork‐head box protein O1, FoxO1)、TFEB 和转录因子E3(transcription factor E3, TFE3)的调控[45]。缺乏LAL的小鼠中脂质代谢紊乱[46],同时在缺乏LAL的巨噬细胞中观察到CE 在溶酶体中滞留积累,细胞泡沫化发生[47]。此外,外源性注射LAL 可以降低AopE−/−小鼠血浆脂质水平,减轻AS 症状[48]。上述研究表明,LAL在促进脂噬调节中可能起到重要作用。
3.6 转录因子 TFEB[49]、TFE3[50]、FoxO1[51]、PPARα等转录因子可以调节脂噬。TFEB 是溶酶体生物发生的主要转录因子,最近研究表明,海藻糖和三氧化二砷可影响TFEB 的激活和核移位,从而调控巨噬细胞的自噬[52-53]。血管生成素1 可与其受体Tie2 结合,抑制TFE3 的核转移,导致肝X 受体α(liver X recep‐tor α, LXRα)、ABCA1和ABCG1的下调,影响胆固醇外流。FoxO1 可以上调ATG14 和LAL,促进自噬。还有研究表明,天麻素可通过AMPK/FoxO1/TFEB 信号轴诱导溶酶体生物发生,抑制细胞泡沫化[54]。PPARα 激动剂可以调节转运蛋白ABCA1,通过促进ApoA-1介导的胆固醇流出抑制细胞泡沫化。
4 通过脂噬途径抑制细胞泡沫化防治AS
以富含脂滴为主要特征的泡沫细胞是斑块中重要的特征性病理细胞。AS 泡沫细胞形成主要涉及3个过程:细胞对胆固醇的摄取、胆固醇胞内储存和胆固醇外流。当血液中低密度脂蛋白(low-density lipo‐protein, LDL)和ox-LDL[55]大量沉积在血管内皮时,此类脂质成分会以胞饮或清道夫受体等方式进入巨噬细胞、平滑肌细胞及内皮细胞。LDL/ox-LDL 经摄取吸收后,其携带的胆固醇被水解为FC,过多的FC通过脂酰辅酶A:胆固醇酰基转移酶(acyl-coenzyme A:cholesterol acyltransferase, ACAT)生成惰性的CE,暂时存贮于脂滴中[56]。随着LDL/ox-LDL 的摄取增多与胞内FC 不断积累,为防止“胆固醇毒性”[57],部分FC 以扩散、B 类1 型清道夫受体介导的被动传输和ABCG1/ABCA1 介导的主动运输流出细胞[58-59]。当细胞内脂质摄取持续大于流出,则多余的脂质在细胞内积累,脂滴不断增加,细胞内胆固醇运转失衡,逐渐形成富含脂滴的泡沫细胞[60]。长期以来,巨噬细胞被认为是AS 泡沫细胞的主要来源,但最近的系谱追踪研究表明,晚期AS 斑块中50%的泡沫细胞可能来源于VSMCs[61]。巨噬细胞[62]和平滑肌细胞样泡沫细胞的脂噬在AS 进程中发挥重要作用,且脂噬驱动的胆固醇外流机制与细胞类型有关。
4.1 脂噬与巨噬细胞泡沫化 巨噬细胞泡沫化是AS 形成的早期标志之一,随着病程加重越来越多的泡沫细胞堆积在一起形成脂质条纹和脂质斑块,进一步促进AS 的发生。有研究显示,程序性细胞死亡因子4(programmde cell death 4, PDCD4)通过自噬溶酶体途径可以抑制巨噬细胞的脂质分解[63]。在小鼠腹腔巨噬细胞的脂质蓄积模型中,通过自噬体与脂滴的荧光共定位发现,缺乏PDCD4后自噬体数量增加,脂滴数量减少,表明缺乏PDCD4的巨噬细胞可通过增强自噬减少胆固醇的蓄积,抑制细胞泡沫化。同时,在缺乏PDCD4的细胞中,胆固醇转运体AB‐CA1 和ABCG1 及其相关转录因子LXRα 表达上调,通过促进胆固醇转运蛋白的表达减少脂质蓄积,抑制细胞泡沫化。沉默信息调节因子6(silent informa‐tion regulator 6, SIRT6)是巨噬细胞脂质代谢中的关键调节剂,可以通过影响自噬通量促进ABCA1 和ABCG1 的上调,抑制细胞泡沫化[64]。沉默自噬关键基因ATG5可以逆转SIRT6 抑制细胞泡沫化的作用,表明SIRT6 通过自噬途径介导胆固醇外流而抑制细胞泡沫化。脂噬介导的胆固醇外流与自噬通路有关。mTOR 信号通路的激活可抑制LXRα 和ABCA1表达,减少胆固醇外流。CTRP9 (C1q/tumor necrosis factor‐related protein 9)可通过AMPK/mTOR 信号通路影响巨噬细胞的脂质蓄积,自噬抑制剂3-甲基腺嘌呤可以消除CTRP9促进胆固醇外流的作用和抑制细胞泡沫化的作用[65]。巨噬细胞的胆固醇积累与自噬途径的联系密切,可以通过增强自噬,诱导脂滴的脂解,促进胆固醇排出,从而抑制细胞泡沫化。
4.2 脂噬与VSMCs 泡沫化 VSMCs 的自噬依赖性胆固醇外流与巨噬细胞稍有不同。在一项究中,精氨酸可以促进VSMCs 的胆固醇外流,抑制细胞内的脂质积累,减少坏死核心[66]。但是因精氨酸通过抑制乙酰转移酶EP300 诱导自噬,巨噬细胞中EP300表达量较高,精氨酸不能彻底抑制巨噬细胞中EP300 的表达,达不到抑制细胞泡沫化生成的作用。P2RY12 受体激活对VSMCs 胆固醇自噬也起到抑制作用。在ApoE−/−小鼠中,P2RY12 受体的抑制可促进主动脉VSMCs 自噬和胆固醇外流,ABCA1 和ABCG1的表达没有受到影响,同时自噬相关蛋白ATG5的敲除可明显逆转P2RY12 受体抑制的作用,表明P2RY12 受体的抑制通过自噬途径介导自噬依赖性胆固醇外流[17]。在另一项实验中,VSMCs 中雷公藤红素可通过LXRα/ABCA1 通路显著减少ox-LDL 诱导的脂质积累,也可以诱导自噬通量,显著提高LC3-II/LC3-I 比值,降低p62 的表达抑制,促进脂滴自噬,抑制胞内胆固醇积累[67]。因此,脂噬依赖性胆固醇外流对VSMCs 中的脂质积累至关重要,可以通过此途径抑制VSMCs的泡沫化。
5 总结与展望
近20 年的临床历程表明,促进胆固醇外流、提高RCT 可有效缓解细胞泡沫化。他汀类药物调控RCT 已成为防治AS 的基石。贝特类药物刺激脂蛋白脂酶激活脂肪分解降低TG。近年来发现,PCSK9(proprotein convertase subtilisin/kexin type 9)抑制剂通过抑制PCSK9 释放肝细胞表面的LDL 受体(LDL recptor, LDLR)而增强RCT。但是他汀类药物治疗的个体差异性、不良反应和“他汀疗效6%效应”制约着治疗效果;贝特类药物具有损害肝肾功能和横纹肌溶解症的不良反应;PCSK9 抑制剂产生的极低水平LDL-C的长期安全性仍在进一步探索中。
现在越来越多证据表明,AS 病变中泡沫细胞的脂滴主要由CE 积累形成。脂噬对防治AS 具有重要意义,不仅可以促进细胞中的脂滴降解,加速胆固醇流出,抑制泡沫细胞的形成[68],还参与AS 的多个病理环节:通过抑制细胞泡沫化,减轻AS 中炎性细胞的炎症反应,减轻内皮细胞损伤,抑制平滑肌细胞的增殖和迁移等。由此可以提出猜想:促进脂滴的分解代谢可以有效预防和治疗AS。脂滴的分解代谢作为胆固醇外流的限制性步骤,在上临床还未有特异性药物。综上所述,脂噬可以作为一个潜在靶点防治AS。
种种迹象表明,促进脂噬有利于阻止细胞泡沫化,从而预防AS。但是目前还存在一些问题:(1)脂噬只是自噬其中一种,促进自噬也可能引发其他细胞器和蛋白的自噬,如线粒体自噬、蛋白质自噬等。是否可以特异性促进脂噬?(2)脂噬生成的FC 需要转运体运出细胞,参与RCT。促进脂噬生成的FC 增多可能会引发“胆固醇-转运体”的过饱和,造成FC在细胞质中的蓄积,形成“胆固醇毒性”,加速细胞的损伤与凋亡。是否可以保持脂噬与RCT的流通与平衡?(3)脂噬激活剂激活胞内自噬,抑制泡沫细胞形成,排出胞内的胆固醇是否可以及时通过肝脏代谢排出体外,大量FC 堆积在肝脏是否会进一步引起“脂肪肝”?(4)脂噬激活剂与其他降脂药物的联用是否也会引起较大的肝肾负担?总而言之,调节脂噬抑制细胞泡沫化可以作为预防AS 的一个新靶点,但是上述问题有待研究者进一步探讨。

