Mdivi-1通过抑制少突胶质细胞凋亡信号通路发挥髓鞘保护作用*
李艳花, 张晓娟▲, 张思羽, 侯惜缘, 刘子乙, 于晓静, 张年萍△
(1山西大同大学医学院,老年慢性病智慧医康养大同市重点实验室,山西 大同 037009;2西安交通大学医学院,陕西 西安 710004)
多发性硬化(multiple sclerosis)是一种难治易复发的自身免疫性中枢神经系统白质脱髓鞘疾病,已经成为导致青壮年残疾的第二大类疾病,在我国多发性硬化发病率逐年提高,目前缺乏特效药[1]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)是目前最为常用的多发性硬化动物模型,与多发性硬化临床表现接近,普遍认为多发性硬化和EAE 的病理过程相似[2]。已有研究显示,线粒体分裂抑制剂1(mitochondrial fission inhibi‐tor-1, Mdivi-1)能明显改善小鼠EAE 发病期临床症状,但关于具体作用机制仍不明确。髓鞘是包裹在神经元轴突外面的管状外膜,在中枢神经系统中由少突胶质细胞形成。髓鞘持续损伤,可累及轴索、神经元和异常激活神经胶质细胞,进而严重损害中枢神经系统,导致病情加重,因此,阻断髓鞘损伤和促进髓鞘再生是改善临床结局过程的关键事件[3]。
材料和方法
1 实验动物及主要试剂、仪器
8 周 龄雌性SPF 级C57BL/6 小鼠30 只,体质 量18~21 g,从北京维通利华动物有限公司购买,许可证号:SCXK(京)2019-0008。实验动物的使用、饲养和处理均符合山西大同大学的动物伦理道德原则。Mdivi-1、二甲基亚砜(dimethyl sulfoxide, DMSO)、弗氏完全佐剂、DAPI、细胞增殖试剂盒和乳酸脱氢酶(lactate dehydrogenase, LDH)细胞毒性检测试剂盒(Sigma);JC-1 线粒体膜电位检测试剂盒(Invitro‐gen);髓磷脂少突胶质细胞糖蛋白第35~55 位肽段(myelin oligodendrocyte glycoprotein peptide fragment 35-55, MOG35-55)购自Genscript;星形孢菌素(stauro‐sporine)购 自Enzo Life Sciences;抗MOG、CC1、cleaved caspase-3、caspase-9、cytochrome C (CytC)和Bax 和Bcl-2 抗体(Abcam);TUNEL 凋亡试剂盒(Pro‐mega)。流式细胞仪(Bio-Rad);激光共聚焦显微镜(Olympus)。
2 方法
2.1 实验动物分组及处理 所有小鼠后颈部皮下注射0.2 mL MOG35-55乳剂(含MOG35-55300 µg、灭活的结核分枝杆菌400 µg、生理盐水100 µL 和弗氏完全佐剂100 µL)[4]。小鼠随机分为2 组(每组15 只),免疫后第3 天起持续进行如下处理:(1)DMSO 模型组,腹腔给予0.1% DMSO 水溶液;(2)Mdivi-1 干预组,腹腔给予Mdivi-1(25 mg·kg−1·d−1,用0.1% DMSO水溶液溶解)。至免疫后第28 天,腹腔注射氯胺酮-甲苯噻嗪(80 mg/kg+5 mg/kg),麻醉断颈处死,用生理盐水快速经心脏灌注冲洗血管,灌注4%多聚甲醛进行体内固定,分离完整的脊髓组织;4 ℃冰箱中,2%多聚甲醛体外固定4 h,蔗糖溶液中梯度脱水各4 h,OCT 充分浸润包埋,并制成10 µm 切片,过夜晾干后,−80 ℃冰箱保存备用。
2.2 髓鞘病理染色 上述冰冻切片使用本实验室改良的Luxol fast blue (LFB)染色流程进行染色[5],具体如下:切片先经乙醇二甲苯梯度脱水脱脂,再复水至95%乙醇溶液,除去二甲苯,放入LFB 溶液中染色过夜(56 ℃温箱中),经乙醇梯度复水,滴加0.05%碳酸锂分化液,分化两次至脊髓灰质变白,终止分化,乙醇二甲苯梯度脱水透明,中性树胶封片,显微镜下观察脊髓白质髓鞘染色情况,使用Image-Pro Plus 6.0 软件measure-Count-area 工具测量脊髓白质区域中没有染蓝的区域(该区域为髓鞘脱失区域),计算脱髓鞘区域占整个白质区域的百分比。
2.3 免疫荧光染色 上述冰冻切片用PBS 洗3 次,1% BSA/0.3% Triton X-100/PBS 封闭通透2 h,加抗MOG、CC1、cleaved caspase-3、caspase-9、cytochrome C、Bax 和Bcl-2 抗体,4 ℃冰箱中孵育过夜,次日PBS洗3 次,加入相应的Ⅱ抗,室温孵育1.5 h,DAPI 染色5 min,PBS 洗3 次,50%甘油封片,缺失Ⅰ抗处理的切片作为阴性对照,用激光共聚焦采集图像,使用Image-Pro Plus 6.0 软件measure-Count-area 工具测量阳性区域,使用图片上的标尺折合成面积。
2.4 TUNEL 染色使用0.3% Triton X-100/PBS 将切片通透10 min,PBS 洗3 次,在TUNEL 荧光素染色液中浸染10 min,PBS 洗3 次,50%甘油封片,用激光共聚焦采集图像。Image-Pro Plus 6.0 软件“面积”参数测量阳性表达荧光信号。
2.5 Western blot实验 称量脊髓组织,置于离心管中,以1 g∶7 mL 的比例加入RIPA 裂解液,加入两颗磁珠,在bead shaker 上震荡1 min,4 ℃孵育30 min。BCA 试剂盒测定蛋白浓度,制备浓度相同的蛋白样本。用15% SDS-PAGE 分离脊髓蛋白,250 mA,75 min 转膜,50%脱脂奶粉溶液封闭1 h,加入Ⅰ抗(cleaved caspase-3、caspase-9、cytochrome C、Bax、Bcl-2和GAPDH 抗体,均1∶1 000),4 ℃孵育过夜,次日早上孵育HRP 偶联抗兔或抗小鼠Ⅱ抗,室温孵育2 h。洗膜后,加ECL 显色液显色,Bio-Rad 成像仪凝胶成像,Image Lab 6.1软件分析检测条带灰度比值。
2.6 MO3.13少突胶质细胞处理和JC-1染色 用含10%胎牛血清的DMEM 培养液培养MO3.13 少突胶质细胞系于6 孔板中,分为正常对照组、Mdivi-1 组、staurosporine 组和staurosporine+Mdivi-1,每组设置3个复孔。细胞贴壁后,加入5 µmol/L staurosporine 和10 nmol/L Mdivi-1 处理2 h,更换只含有DMSO 或Mdivi-1 的培养液继续培养过夜,次日收集上清液,1×109/L 细胞加入10 mg/L 的JC-1 染色10 min,PBS 洗涤,流式细胞仪检测荧光信号,实验重复3次。
2.7 LDH 检测MO3.13 少突胶质细胞死亡 取上述细胞培养液50 µL于96孔板中,再加入50 µL反应混合液,室温孵育30 min,加入终止液,振荡10 s,于492 nm波长检测吸光度(A),实验重复3次。
2.8 MTT检测MO3.13少突胶质细胞活力 细胞培养于96 孔板中,培养和处理方法同2.6,药物处理结束前,加入MTT,继续培养4 h 后,吸去培养液,加入含0.04 mol/L HCl 的0.2 mL 异丙醇,充分混匀,于570 nm波长测定A值,实验重复3次。
3 统计学处理
上述数据输入GraphPad Prism 6 软件,以均数±标准差(mean±SD)表示,两组间均数比较使用韦尔奇校正的非配对t检验,多组间均数比较采用方差分析。以P<0.05 为差异有统计学意义。山西大同大学统计学专家对文章中的统计学方法进行审核。
结 果
1 Mdivi-1减少EAE小鼠脊髓组织白质区髓鞘丢失
LFB 染色结果显示,给予DMSO 的EAE 模型小鼠髓鞘丢失较多,而给予Mdivi-1 的EAE 模型小鼠髓鞘丢失较少(P<0.01),见图1A;使用抗MOG 抗体对脊髓组织进行免疫荧光染色,发现给予DMSO 的EAE 模型小鼠脊髓组织中较多部位的MOG 表达量减少,MOG 蛋白分布杂乱,而给予Mdivi-1 的EAE 模型小鼠脊髓组织中MOG 蛋白分布均匀且表达量较DMSO 组显著增加(P<0.01),见图1B;对DAPI 标记的细胞核周围MOG 蛋白的分枝状表达进行统计,发现Mdivi-1 干预显著增加了细胞核周围MOG 的分布量(P<0.05),见图1C。
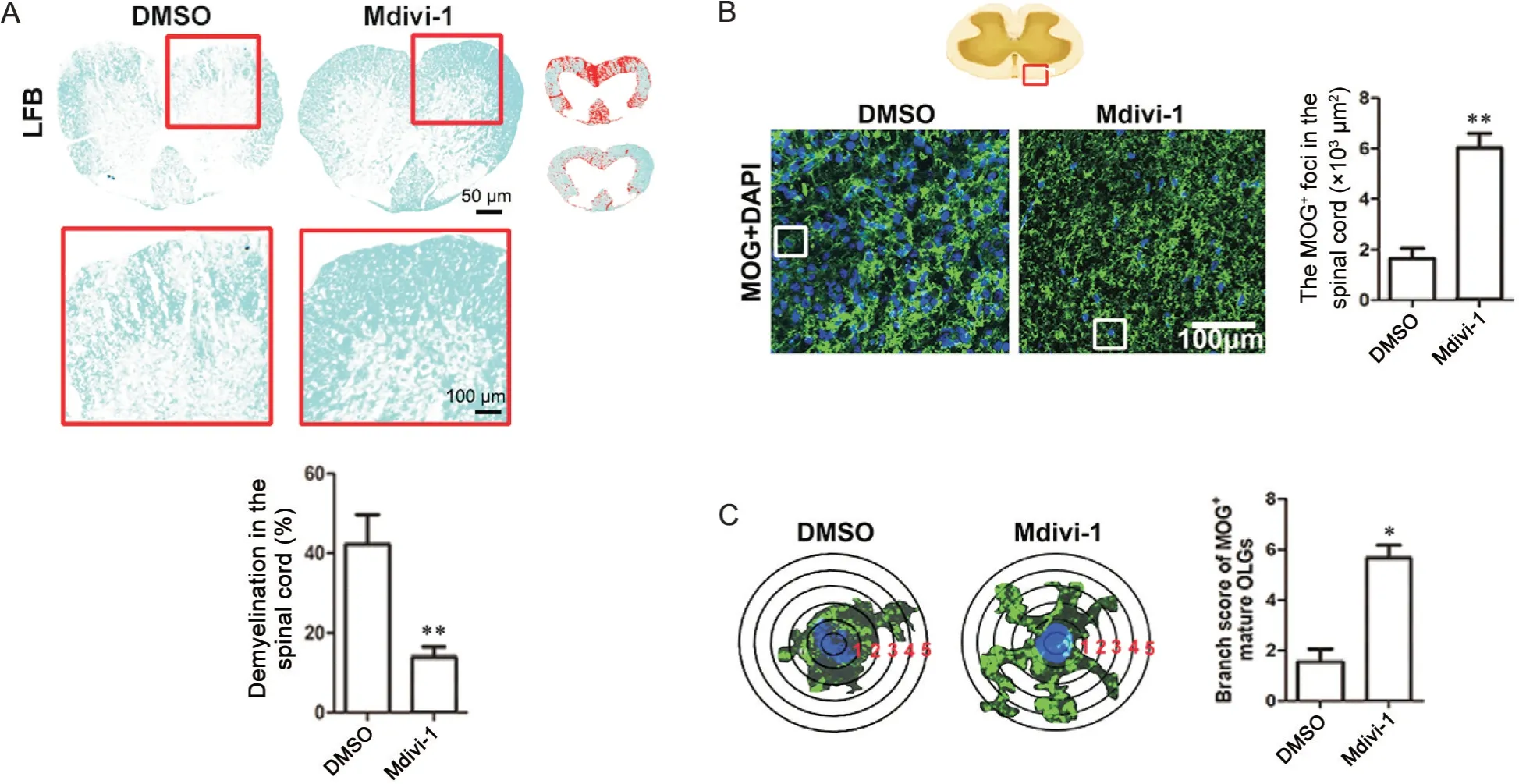
Figure 1. Mdivi-1 decreased demyelination in the spinal cord of EAE mice. A: LFB staining and quantitative analysis of demyelin‐ation in the white matter of spinal cord; B: immunofluorescence of MOG-positive myelin in the white matter of spinal cord and quantitative analysis of MOG+ myelin density; C: demonstration of the method to quantify branching of oligodendrocyte process extension. Concentric circles separated by 15 µm were drawn around the DAPI+ nucleus, and the number of inter‐sections that MOG+ myelin with the concentric circles was defined as the branching score using the Sholl analysis plugin for ImageJ software. Quantitative analysis was performed for MOG+ branch score. Mean±SD. n=6. *P<0.05, **P<0.01 vs DMSO group.图1 Mdivi-1减少EAE小鼠脊髓组织髓鞘丢失
2 Mdivi-1 减少EAE 小鼠脊髓组织中少突胶质细胞凋亡
使用CC1 抗体和TUNEL 稀释液对小鼠脊髓组织进行染色,结果显示在DMSO 处理的EAE 模型小鼠脊髓组织中有很少的CC1 表达,TUNEL 和cleaved caspase-3 阳性细胞较多,而Mdivi-1 处理组的CC1 表达量高,TUNEL 和cleaved caspase-3 阳性细胞少,两组进行比较,Mdivi-1 显著减少了CC1 和TUNEL 双阳性细胞数量,也显著减少了cleaved caspase-3 阳性细胞数量(P<0.01),见图2。

Figure 2. Mdivi-1 decreased the apoptosis of CC1+ oligodendrocytes in the spinal cord of EAE mice. A: double immunofluorescence staining of CC1 and TUNEL was shown and quantitative analysis was performed; B: immunofluorescence staining of cleaved caspase-3 was shown and quantitative analysis was performed. Mean±SD. n=6. **P<0.01 vs DMSO group.图2 Mdivi-1减少EAE小鼠脊髓组织中少突胶质细胞凋亡
3 Mdivi-1 减少凋亡蛋白caspase-9 和cytochrome C的表达
使用抗caspase-9 抗体和抗cytochrome C 抗体对小鼠脊髓组织进行免疫荧光染色,结果显示在DMSO处理的EAE 模型小鼠脊髓组织中有很多caspase-9和cytochrome C 表达,而Mdivi-1 处理组caspase-9 和cytochrome C表达显著减少(P<0.01),见图3。

Figure 3. Mdivi-1 decreased the expression of caspase-9 and cytochrome C in the spinal cord of EAE mice. Immunofluorescence staining of caspase-9( A) and cytochrome C( B) was shown, and quantitative analysis was performed. Mean±SD. n=6. **P<0.01 vs DMSO group.图3 Mdivi-1减少EAE小鼠脊髓组织白质区caspase-9和cytochrome C的表达
4 Mdivi-1 减少细胞凋亡蛋白Bax 的表达,而不影响抗凋亡蛋白Bcl-2的表达
使用Bax抗体和Bcl-2抗体对小鼠脊髓组织进行染色,结果显示,与DMSO 处理的EAE 模型组相比,Mdivi-1 处理组小鼠脊髓组织中Bax 表达量较低(P<0.01),而Bcl-2 的表达量两组之间没有显著差异,见图4。

Figure 4. Effect of Mdivi-1 on Bax and Bcl-2 expression levels in the spinal cord of EAE mice. Immunofluorescence staining of Bax(A) and Bcl-2( B) was shown, and quantitative analysis was performed. Mean±SD. n=6. **P<0.01 vs DMSO group.图4 Mdivi-1对EAE小鼠脊髓组织Bax和Bcl-2表达的影响
5 Mdivi-1 对cleaved caspase-3、caspase-9、CytC、Bax和Bcl-2表达的影响
Western blot 实验结果进一步显示,与DMSO 组相比,Mdivi-1 组小鼠脊髓组织凋亡蛋白cleaved cas‐pase-3、caspase-9、CytC 和Bax 的表达水平显著降低(P<0.05),而Bcl-2 表达没有显著差异,与免疫荧光染色结果相同,见图5。
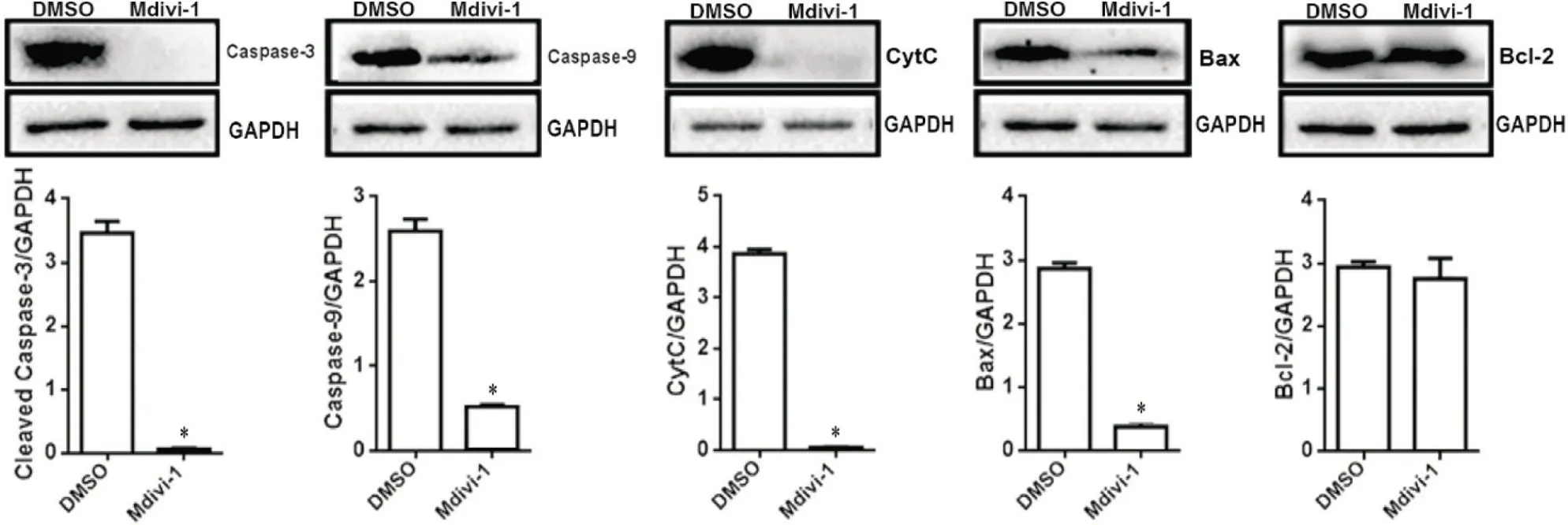
Figure 5. Effect of Mdivi-1 on apoptotic protein expression levels in the spinal cord of EAE mice. The protein levels of cleaved cas‐pase-3, caspase-9, cytochrome C( CytC), Bax and Bcl-2 in the spinal cord were detected by Western blot. Mean±SD. n=5. *P<0.05 vs DMSO group.图5 Mdivi-1对EAE小鼠脊髓组织凋亡蛋白表达的影响
6 Mdivi-1减少MO3.13少突胶质细胞的损伤
体外培养MO3.13 少突胶质细胞系6 h,待细胞贴壁后,先加入staurosporine 和Mdivi-1 处理2 h,更换只含有DMSO 或Mdivi-1 的细胞培养液,继续培养24 h,取细胞,使用JC-1 染料标记线粒体膜电位极化状态,结果显示staurosporine 处理导致正常细胞(live cells)与线粒体膜去极化的细胞(apoptotic cells)比值显著降低(P<0.01),Mdivi-1 处理增加了正常细胞与线粒体膜去极化的细胞的比值(P<0.05),说明Mdi‐vi-1 能阻止staurosporine 诱导的线粒体膜电位去极化,减少线粒体相关细胞凋亡,见图6A。收集细胞上清液,使用LDH 试剂盒检测细胞死亡情况,发现staurosporine 诱导更多的细胞死亡(P<0.01),Mdivi-1处理显著减少了staurosporine 诱导的细胞死亡(P<0.01),见图6B;使用MTT 实验检测细胞活力,发现staurosporine 处理导致细胞活力显著下降(P<0.01),Mdivi-1 显著阻止staurosporine 诱导的细胞活力下降(P<0.01),见图6C。
讨 论
少突胶质细胞的丢失与多发性硬化疾病的进展密切相关,凋亡信号通路和补体系统异常激活是少突胶质细胞丢失的主要机制之一,抑制少突胶质细胞凋亡能起到髓鞘保护的作用。已有研究显示EAE模型小鼠的脊髓组织中发动蛋白相关蛋白1(dyna‐min-related protein 1, Drp1)第616 位丝氨酸(Ser616)磷酸化水平明显升高[6],Drp1(Ser616)过度磷酸化导致线粒体过度分裂、生物能量缺陷、活性氧和促凋亡因子的释放,导致线粒体相关细胞凋亡[7-8]。Mdivi-1是Drp1 的抑制剂,能有效抑制Drp1 的磷酸化。因此,本课题组使用TUNEL 试剂盒检测了Mdivi-1 对EAE 小鼠脊髓组织细胞凋亡的影响,结果发现DMSO 处理的EAE 小鼠脊髓组织中有大量的TUNEL阳性细胞,表明有大量细胞发生凋亡,使用CC1 标记少突胶质细胞,结果显示在DMSO 模型组中,大量的凋亡信号定位于少突胶质细胞。因此,我们认为MOG 免疫诱导的脱髓鞘依赖于少突胶质细胞凋亡,是EAE 模型中少突胶质细胞丢失的原因,但是Mdi‐vi-1 干预使得EAE 小鼠脊髓组织中CC1+TUNEL+细胞数量明显减少。体外培养MO3.13少突胶质细胞,使用staurosporine 处理2 h,明显诱导MO3.13少突胶质细胞线粒体膜电位发生去极化,增加细胞膜通透性,使更多的LDH 渗出到胞外,MTT 实验也显示staurosporine 使细胞活力明显下降,但给予Mdivi-1干预,可以明显阻止staurosporine 诱导的细胞损伤。以上体内和体外实验均证明Mdivi-1 干预可以抑制少突胶质细胞凋亡。
大量cytochrome C 进入细胞质是线粒体相关凋亡途径中最关键的环节[9]。因此,本研究对线粒体相关凋亡蛋白表达进行了分析,结果显示EAE 小鼠脊髓组织白质区caspase-9、cytochrome C 和cleaved caspase-3 被激活。有研究显示线粒体内外膜通透性转变孔过度开放,膜通透性增加,促进了cytochrome C 释放进入细胞质[10],与凋亡蛋白酶活化因子1 和procaspase-9结合形成凋亡小体,启动caspase 家族凋亡级联反应,激活下游靶点caspase-3,最终导致细胞凋亡[11]。Mdivi-1 治疗减少了caspase-9、cytochrome C和cleaved caspase-3的表达,这为Mdivi-1抑制细胞凋亡提供了直接证据。Yi 等[12]2022 年发现,Mdivi-1 能阻止镉诱导的线粒体过度分裂、阻止cytochrome C 从线粒体释放到胞质并减弱生殖细胞凋亡,这与我们的研究结论相似。另外,在线粒体相关凋亡途径中,Bax 是一个重要的介导者,当Bax 被激活后,破坏线粒体外膜完整性,Bax 易位到线粒体,促进cyto‐chrome C 释放[13]。正常情况下,促凋亡和抗凋亡蛋白平衡协调,但当这种平衡被打破后,就会导致细胞凋亡[14]。在实验中EAE 小鼠脊髓白质中Bax 的表达量明显增加,Mdivi-1 干预明显降低了Bax 的表达,但是没有影响抗凋亡蛋白Bcl-2的表达,暗示在EAE 模型小鼠中Mdivi-1 具有明显抑制凋亡的能力而不能提升细胞的抗凋亡能力。Nguyen 等[15]2021 年 对Mdivi-1在中风后缺血再灌注损伤的临床前应用评估中发现,十项研究均显示Mdivi-1 能降低线粒体介导的促凋亡因子(凋亡诱导因子、Bax、cytochrome C、caspase-9 和caspase-3)的表达,并增强抗凋亡因子Bcl-2 的表达,这与我们的研究结果相似但不完全一致。
综上所述,我们推测在EAE 模型中,MOG 免疫诱导的脱髓鞘与少突胶质细胞丢失有关,凋亡是少突胶质细胞丢失的原因;Mdivi-1 干预可以通过抑制线粒体相关凋亡途径来抑制细胞凋亡,起到对少突胶质细胞和髓鞘的保护作用。但是细胞凋亡是个复杂的过程,Mdivi-1 能否通过抑制其他的凋亡途径来减少EAE小鼠脊髓组织中少突胶质细胞的丢失还有待我们进一步探讨。

