茯苓多糖通过SQLE/NLRP3/GSDMD信号通路调控肝癌细胞焦亡*
杨 莹, 曹 媛, 赵 佼, 李 政, 王 群, 高 浩,孙小扉, 袁明殿, 宋 囡△
(1辽宁中医药大学,辽宁 沈阳 110847;2辽宁省肿瘤医院,辽宁 沈阳 110801;3辽宁省中医院,辽宁 沈阳 110033)
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤之一,全世界约55%的肝癌病例来自中国,致死率在恶性肿瘤中排名第二,其发病率呈逐年上升趋势,严重危害患者生命健康[1-4]。《局方发挥》:云“自积成痰。”《外科正宗·瘿瘤论》指出,瘤的病因“全是痰气凝结而成”。现代病机研究从宏观视角和微观角度明确了“痰”是肝癌产生的物质基础,是肿瘤微环境的重要组成部分,痰浊和血脂的代谢异常之间亦含有一定关系。《证治汇补》有云,“脾虚不运清浊,停留津液而痰生”,说明肥甘不节饮食会导致脾运化失常,摄入的水谷不能正常吸收,转输,布散化为精微,痰浊内生,故脾失运化为血脂异常的根本原因。故治疗上,从肝、脾入手,以条达肝之疏泄,健运脾之水谷精微,化痰祛瘀等法为主。
茯苓是我国传统中药材,具有健脾益中,化痰燥湿之功效[5]。余静芳等[6]应用茯苓四逆汤联合索拉菲尼治疗晚期原发性肝癌的结果显示,茯苓益气健脾,配伍方剂中其他中药治疗可改善患者的免疫功能从而提高患者自身的抗肿瘤作用。温晓丽等[7]认为黄芪四君子汤中茯苓化痰燥湿,健脾和胃,提升正气效果进一步增强,可改善HCC 肝切除术后肝功能和免疫功能,提高治疗效果。茯苓多糖是茯苓的主要成分,占茯苓干重的80%,具有保肝、抗肿瘤、抗炎、抗病毒、免疫调节等药理作用[8-9],但目前有关茯苓及其有效成分治疗肝癌的具体机制鲜有报道。同时脂代谢异常与细胞焦亡存在联系。文献表明,过量胆固醇在胞质内形成结晶可直接活化核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligo‐merization domain-like receptor protein 3, NLRP3),调控细胞焦亡[10];胆固醇代谢通路中的SCAP-SREBP2与NLRP3 炎症小体活化间亦存在相互调控关系[11]。故本研究欲以脂代谢为切入点,探讨茯苓多糖调控肝癌细胞焦亡的作用机制。
材料和方法
1 主要仪器和试剂
NanoQuant Infinite M200 Pro 酶标仪(TECAN);ND5000 超微量紫外分光光度计(BioTeke);T100™PCR 仪(Bio-Rad);QuantStudio 3 PCR 扩增仪(Ther‐mo Fisher);Tanon 5200化学发光成像系统(上海天能科技有限公司)。
茯苓多糖(C25F7Y10033)购自上海源叶生物科技有限公司;引物由北京赛百盛基因技术有限公司合成;HiFi-Script gDNA Removal cDNA Synthesis Kit(CW2582)和UltraSYBR Mixture(CW2601)购自康为世纪生物科技有限公司;BCA 蛋白浓度测定试剂盒(20220829)购自杭州弗德生物科技有限公司;角鲨烯环氧酶(squalene epoxidase, SQLE)抗体(22915-1-AP)和caspase-1 抗体(12544-1-AP)购自武汉三鹰生物技术有限公司;消皮素D N 端片段(gasdermin D Nterminal fragment, GSDMD-N)抗体(DF12275)购自Affinity;NLRP3 抗体(bs-23723R)购自博奥森生物技术有限公司;TriQuick Reagent 总RNA 提取试剂(20211007)、CCK-8 试剂盒(508E011)、乳酸脱氢酶(lactate dehydrogenase, LDH)活性检测试剂盒(BC0685)、人白细胞介素1β(interleukin-1β, IL-1β)ELISA 试剂盒(SKEH-0002)和人IL-18 ELISA 试剂盒(SKEH-0028)购自北京索莱宝生命科技有限公司。
2 实验标本
收集2020 年6 月~2021 年4 月期间在辽宁省肿瘤医院肝胆普外科确诊并接受外科手术治疗的HCC患者9 例,得到HCC 组织和对应癌旁组织(距肿瘤2 cm)新鲜样本9对,置于液氮保存。其中男性5例,女性4 例,年龄42~71 岁,中位年龄56 岁,按照Edmond‐son-Steiner标准,Ⅰ+Ⅱ和Ⅲ+Ⅳ级分别有4和5例,所有患者术前均未接受放、化疗等抗肿瘤治疗。本研究通过辽宁省肿瘤医院伦理委员会批准,采集样本的受试者均已签署书面知情同意书。人HCC细胞系HepG2购于中国科学院上海生命科学院细胞库。
3 主要方法
3.1 数据来源 从GEO 数据库中下载基因芯片GSE84402 数据集,并用其分析工具GEO2R analysis对数据进行初步分析并筛选肝癌差异表达基因(dif‐ferentially expressed genes, DEGs;筛选标准为Padj<0.05,|log2FC|>2)。
3.2 脂代谢DEGs 筛选 (1)利用DAVID 数据库对HCC 的DEGs 进行GO 和KEGG 富集分析。KEGG 确定其通路功能,GO 分析生物学过程。(2)同时利用GSEA 数据库逐条筛选脂代谢相关基因,并与GEO筛选出的肝癌DEGs进行交集。
3.3 蛋白质相互作用(protein-protein interaction,PPI)网络构建 将筛选出的脂代谢DEGs 放入韦恩图中取交集,再输入STRING 数据库中,以combined score>0.4 为PPI 显著,构建出PPI 网络图,再用Cyto‐scape软件进行可视化分析。
3.4 GEPIA 数据库验证DEGs 使用GEPIA 数据库验证上述胆固醇代谢通路上DEGs 的表达情况。该数据库包含TCGA 和GETx 数据库常见恶性肿瘤的RNA测序数据。将DEGs放入其中,在“Boxplot”模块中设置∣log2FC∣=1,Pvalue=0.01。
3.5 DEGs 预后生存分析 应用GEPIA 和KM-plot‐ter数据库分别对上述筛选出的基因表达水平与肝癌患者总体生存率之间进行分析。进入GEPIA 数据库后,在survival analysis 界面设置Gene 为筛选出的DEGs,Datasets 为LIHC,输出即可。进入KM-plotter数据库后,在liver cancer RNA-seq 界面设置Gene symbol 为筛选出的DEGs,其他检索条件设置为默认状态即可。
3.6 RT-qPCR 检测mRNA 表达水平 HepG2 细胞、HCC 组织及癌旁组织加入TriQuick 试剂裂解,提取总RNA 并检测浓度和纯度。按照反转录试剂盒说明书操作合成cDNA,反应条件为:50 ℃ 15 min,70 ℃ 5 min。使用2× SYBR Green qPCR Master Mix进行qPCR 扩增,反应条件为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40 个循环;95 ℃ 15 sec,60 ℃ 1 min,95 ℃ 15 s。以GAPDH 为内参照,通过2−ΔΔCt法分析mRNA相对表达水平。引物序列见表1。
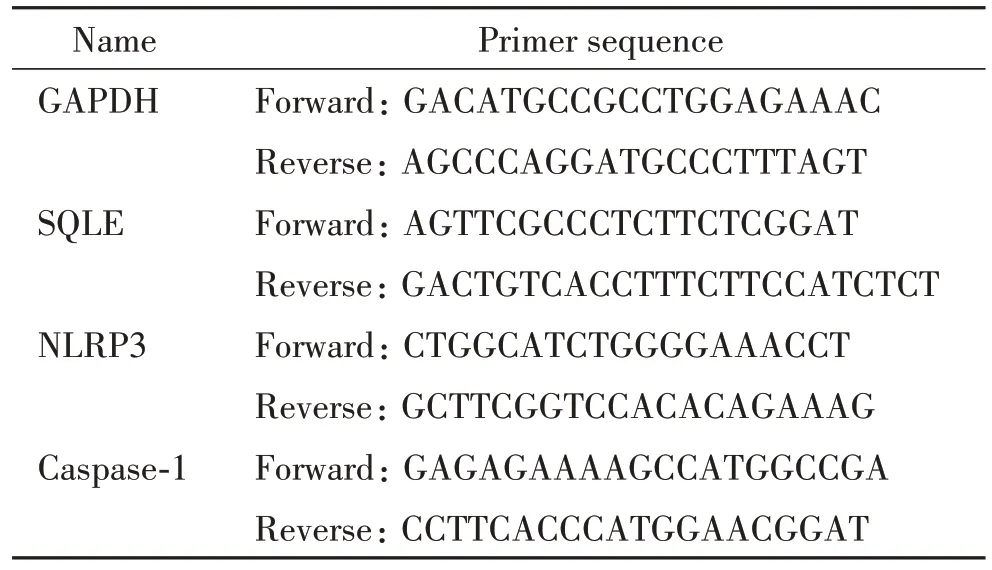
表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
3.7 药物配制 称取茯苓多糖0.16 g 融于100 µL DMSO,加入10 mL 培养液配制成浓度为16 g/L 的母液并过细胞滤器,−20 ℃保存备用。
3.8 细胞培养 HepG2 细胞在含10%胎牛血清的DMEM 培养液中,于37 ℃、5% CO2培养箱中培养。生长至90%后取出,弃去培养液,4 mL PBS 清洗3次,1 mL 胰酶消化,2 mL 培养液终止消化,250×g离心3 min,弃上清,传代。
3.9 CCK-8 法检测细胞活力 每孔1×105个细胞接种于96 孔板,待细胞贴壁后,加入茯苓多糖浓度为0、25、50、100、200、400、800 和1 600 mg/L 的培养液,每组设置5个平行孔,分别在24、48和72 h向各孔加入10 µL 的CCK-8 检测液,37 ℃孵育显色,酶标仪检测OD值,计算抑制活力。
3.10 划痕实验测各组细胞迁移能力 将HepG2细胞接种于6 孔板中,细胞贴壁后,用移液枪头尖端在孔板底部划出一条细痕,PBS 清洗后不同条件继续培养,显微镜下观察并测量划痕宽度。运用ImageJ软件计算细胞迁移率。细胞迁移率(%)=(0 h 划痕面积−培养后划痕面积)/0 h划痕面积×100%。
3.11 细胞转染 6 孔板中每孔接种1×105个细胞,培养24 h后弃掉培养液,根据MOI=50来计算所需病毒体积,将其溶于1 mL 完全培养液中,加入6 孔板中,继续培养并注意观察细胞形态;在细胞感染后48~72 h,细胞密度达到60%~80%,更换培养液为含嘌呤霉素的培养液,使终浓度为0.5 mg/L,12 h 后半量换液,24 h 后全量换液,期间观察细胞筛选情况,可适当调整筛选时间;荧光显微镜下观察感染效率,达到80%以上可用于后续实验。
3.12 Western blot检测蛋白表达水平 样本加入蛋白裂解液提取蛋白,根据BCA 蛋白定量试剂盒测定蛋白浓度。上样,电泳,转膜,5%脱脂奶粉封闭1h,洗膜。裁剪目的条带,Ⅰ抗4 ℃孵育过夜。TBST洗3次,Ⅱ抗室温孵育1 h,TBST 洗3 次,曝光,保存条带并用ImageJ软件对灰度值进行分析。
3.13 比色法检测LDH活性 先收集细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个)∶提取液体积(mL)为(500~1 000)∶1的比例,超声波破碎细胞,在4 ℃、8 000×g离心10 min,取上清。对照管、测定管和标准管按照试剂说明书加入待测样本、标准液、试剂一、试剂二、试剂三、试剂四及蒸馏水,37 ℃水浴15 min。450 nm下测定吸光度并计算。
3.14 ELISA 法检测细胞上清中IL-1β 和IL-18 释放情况 将细胞培养基移至无菌离心管,4 ℃、1 000×g离心10 min,然后将上清等量分装于小EP 管内,按照相应试剂说明书分别设定标准孔、调零孔和样本孔,加入样本或标准品后,孵育、洗涤、加生物素化检测抗体、孵育、洗涤、加酶结合物、孵育、洗涤、加底物显色及终止液。450 nm下测定吸光度并计算。
3.15 流式细胞术 将各组细胞500×g离心5 min后收集,小心吸除上清,用PBS 洗涤细胞2 次,500×g离心5 min收集细胞,小心吸除上清,残留约50 µL左右的PBS,每管细胞样品中加入500 µL 染色缓冲液轻轻重悬细胞;加入5 µL annexinV-FITC 混匀后,加入5 µL PI,混匀;室温避光孵育15 min;随即进行流式检测。
4 统计学分析
各组实验均取重复3 次的平均值。采用Graph‐Pad Prism 8.0 软件进行数据处理与分析。数据以均数±标准差(mean±SD)表示。两组间比较采用t检验分析,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
结 果
1 生信分析筛选DEGs
1.1 DEGs 的筛选 使用GEO 数据库获取HCC 基因数据集GSE84402,其中包括上调基因(红色)238个,下调基因(蓝色)380 个,黑色为其中表达不显著的基因(图1A);图1B为前40个DEGs的表达热图。
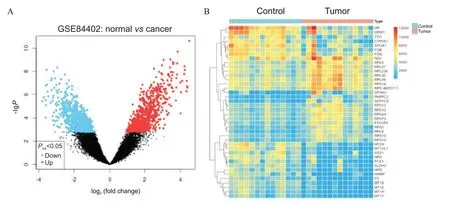
Figure 1. Volcano plot and heatmap of differentially expressed genes in liver cancer. A: volcano plot showed differentially expressed genes; B: heatmap showed top 40 differentially expressed genes.图1 差异表达基因的火山图和热图
1.2 DEGs 的GO 和KEGG 富集分析 使用DAVID软件对DEGs 进行GO 和KEGG 富集分析。GO 富集分析显示,这些DEGs主要参与脂质、胆固醇、类固醇等代谢过程。KEGG通路分析显示,这些差异基因主要参与代谢、细胞周期等信号通路。根据GO 分析中的生物学过程结果找出脂代谢相关通路(图2A),整理得到脂代谢相关基因37 个,同时KEGG 结果显示其主要富集在细胞周期和代谢途径等信号通路(图2B)。GSEA 逐条筛出肝癌脂代谢相关DEGs 有50个。
1.3 PPI网络构建及关键基因的筛选 为了进一步筛选核心的DEGs,使用STRING 在线数据库分别对DAVID 和GSEA 数据库筛出的基因构建PPI 网络进行分析,使用韦恩图做出2 个数据库脂代谢相关肝癌差异基因的交集,得到22 个DEGs(图3A)。通过Cytoscape 软件做出PPI网络图(图3B)。其中与胆固醇代谢相关核心DEGs 有6 个:EPHX2、ApoC2、ApoA5、PON1、SQLE和SOAT2(表2),其中上调表达的基因为SQLE和SOAT2,下调表达的基因为ApoA5、EPHX2、ApoC2和PON1。

Figure 3. Screening of differentially expressed genes( DEGs). A: Venn diagram identified 22 DEGs. B: Cytoscape mapped protein interaction networks.图3 差异表达基因的筛选

表2 胆固醇代谢相关的6个肝癌差异表达基因Table 2. Six differentially expressed genes related to cholesterol metabolism in hepatocellular carcinoma
1.4 GEPIA 数据库验证DEGs 通过GEPIA 数据库验证DEGs 在HCC 样本(369 例)和正常样本(160 例)中mRNA 表达差异数据。如图4 和表3 所示,6 个DEGs 中,ApoA5和EPHX2在HCC 组织中的表达水平显著低于正常肝脏组织(P<0.05),SQLE和ApoC2表达水平在HCC 组织中显著升高(P<0.05),而PON1和SOAT2表达无显著差异(P>0.05)。与前期筛选结果比较,得到ApoA5和SQLE两个基因。
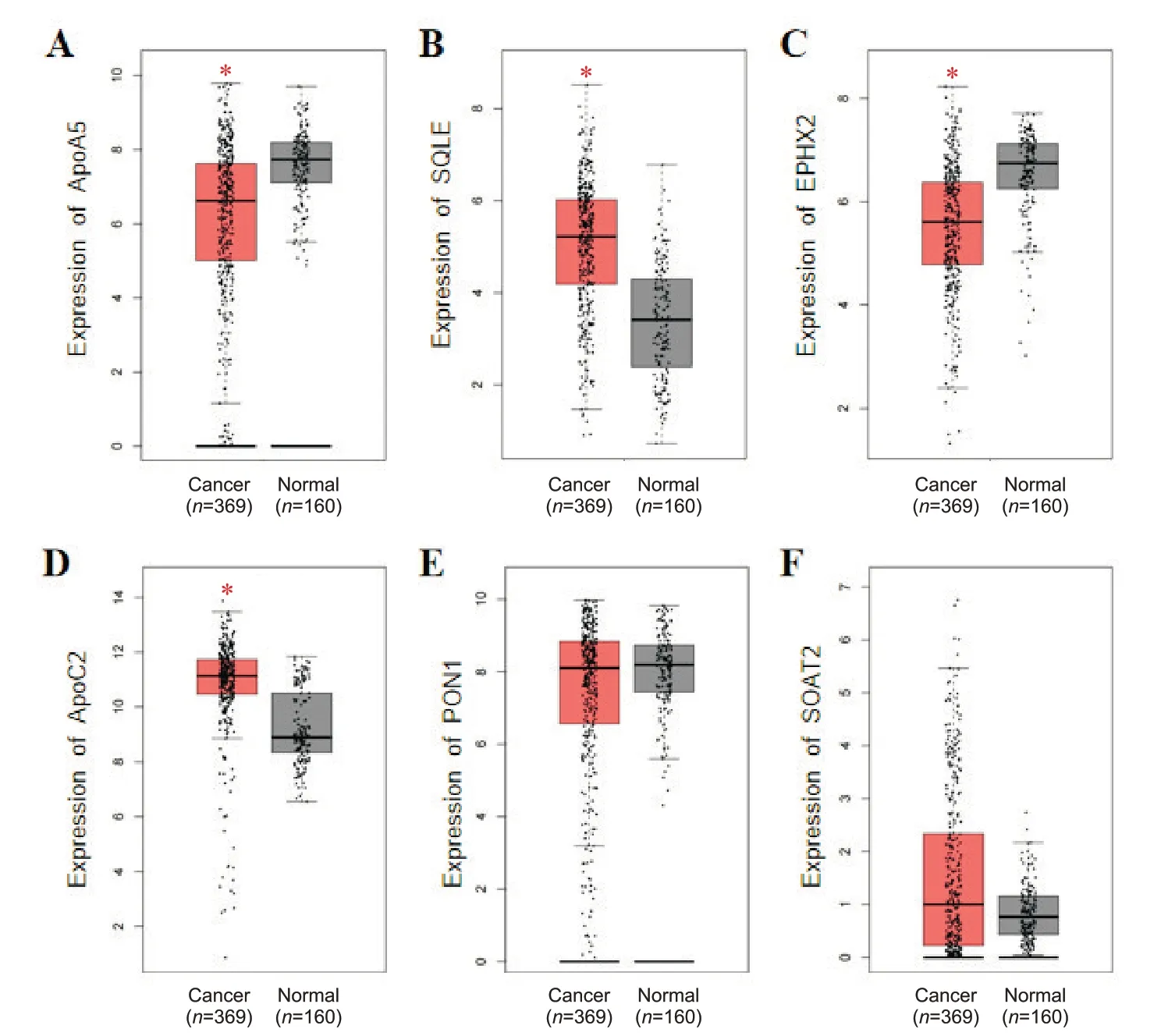
Figure 4. Box plots of the 6 differentially expressed genes in GEPIA database. A: ApoA5; B: SQLE; C: EPHX2; D: ApoC2; E:PON1; F: SOAT2. *P<0.05 vs normal group.图4 GEPIA数据库中差异表达基因的箱图

表3 差异表达基因在肝癌组织和正常肝组织的表达Table 3. The expression of differentially expressed genes between HCC and normal liver tissues
1.5 预后生存分析 GEPIA 数据库显示,SQLE mRNA 高表达肝癌患者总体生存率显著降低,低表达肝癌患者预后较好(P<0.05),见图5A。KM-plot‐ter 数据库的生存分析数据与GEPIA 数据库表达趋势相同,见图5B。
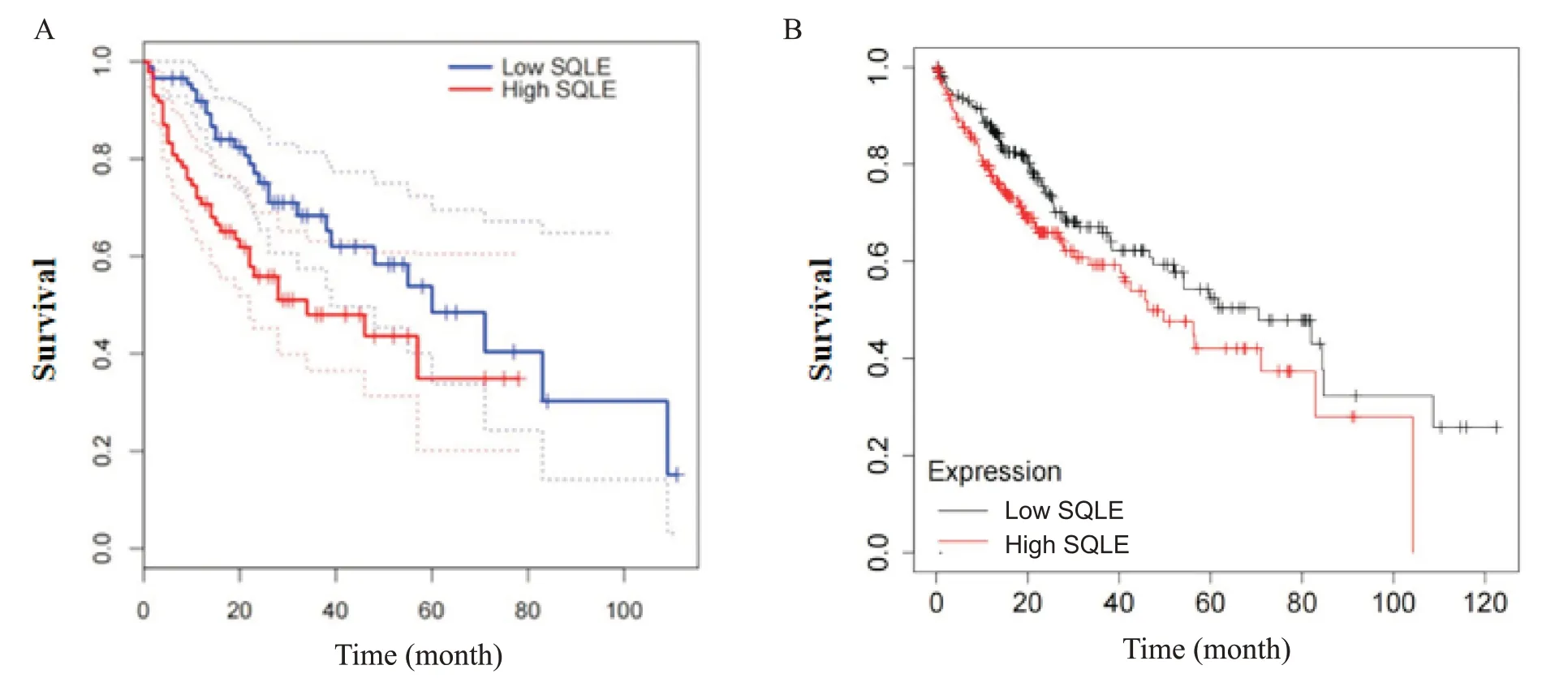
Figure 5. Survival analysis of the HCC patients with low and high expression of SQLE in GEPIA database and KM-plotter database.A: GEPIA database( n=91 in low SQLE group; n=90 in high SQLE group); B: KM-plotter database( n=168 in low SQLE group; n=196 in high SQLE group).图5 预后生存分析
1.6 肝癌组织中SQLE 的mRNA 表达水平 如图6所示,与癌旁组相比,SQLE 的mRNA 表达水平在肝癌组织中显著升高(P<0.01)。
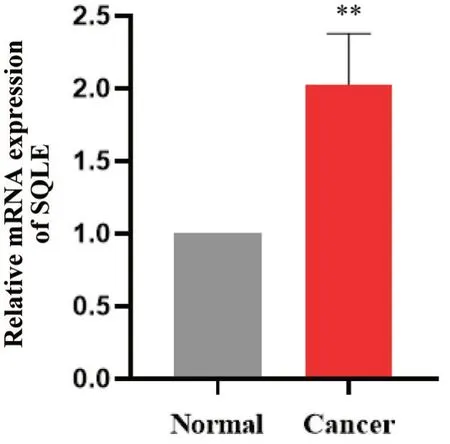
Figure 6. RT-qPCR analysis of SQLE in liver cancer patients.The SQLE mRNA level in tumor tissues was higher than that in adjacent normal tissues. Mean±SD. n=9.**P<0.01 vs normal group.图6 人肝癌组织中SQLE的mRNA表达水平
2 茯苓多糖通过SQLE/细胞焦亡途径对HepG2 细胞的影响
2.1 不同浓度茯苓多糖对HepG2 细胞活力的影响 经过不同浓度的茯苓多糖干预24、48 和72 h,HepG2 细胞活力被显著抑制,其中800 mg/L 茯苓多糖干预48 h对细胞活力的抑制效果最好,见图7。
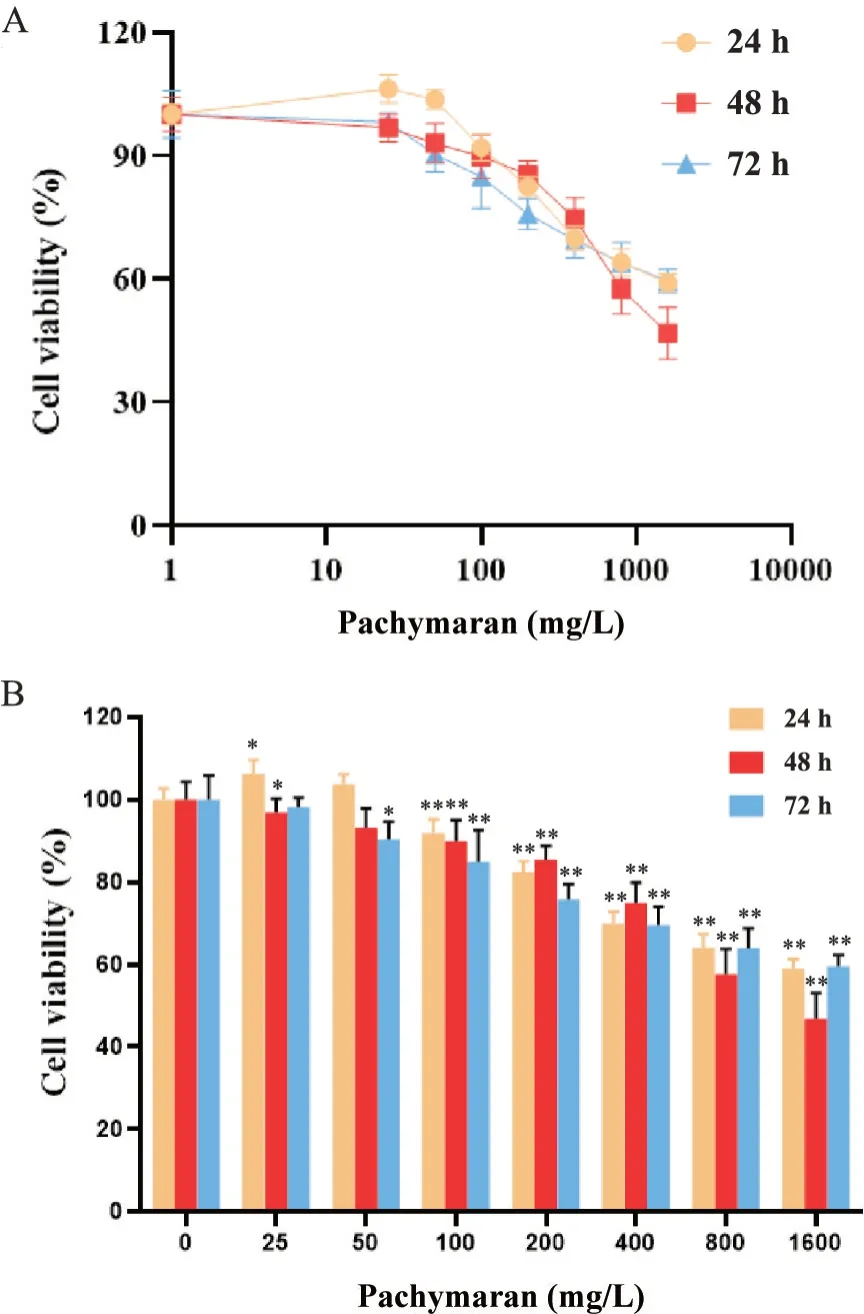
Figure 7. Effect of pachymaran on the viability of HepG2 cells.The HepG2 cells were treated with different concentra‐tions of pachymaran for 24, 48 and 72 h, and the cell viability was assessed by CCK-8 assay. A: the line chart; B: the bar chart. Mean±SD. n=6. *P<0.05,**P<0.01 vs control( 0 mg/L) group.图7 茯苓多糖对HepG2细胞活力的影响
2.2 茯苓多糖对HepG2 生长形态的影响 如图8所示,与对照组相比,800 mg/L 茯苓多糖干预48 h后,HepG2 细胞梭形逐渐消失,开始出现类圆形,且细胞出现脱落、聚集生长现象。

Figure 8. Effect of pachymaran on the morphological changes of HepG2 cells( scale bar=100 µm). A: control group;B: pachymaran group (the spindle shape of the cells gradually disappeared, and the circular shape began to appear, with cell shedding and aggregating for growth).图8 茯苓多糖干预后肝癌细胞的形态变化
2.3 茯苓多糖对HepG2 细胞迁移能力的影响 划痕实验结果表明,与对照组相比,茯苓多糖对HepG2细胞的迁移能力有显著抑制作用,见图9。
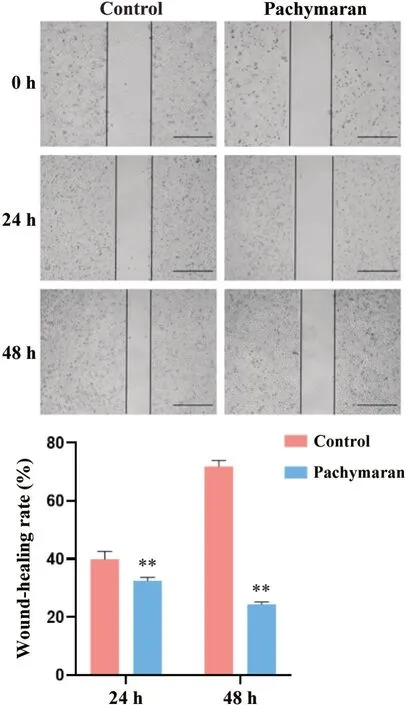
Figure 9. Effect of pachymaran on the migration of HepG2 cells was detected by wound-healing assay (scale bar=100µm). Mean±SD. n=3. **P<0.01 vs control group.图9 划痕实验检测茯苓多糖对HepG2细胞迁移能力的影响
2.4 荧光显微镜观察携带SQLE病毒感染情况 如图10 所示,荧光显微镜下可清晰看到有带绿色标签的过表达质粒,感染效率在80%。

Figure 10. Observation of infection of virus carrying SQLE gene under fluorescence microscope(scale bar=100 µm).A: phase-contrast; B: fluorescence; C: merged.The infection rate was about 80%.图10 荧光显微镜下观察携带SQLE基因病毒的感染情况
2.4 茯苓多糖对HepG2细胞中SQLE mRNA 表达水平的影响 如图11 所示,与对照组相比,茯苓多糖干预后HepG2 细胞中SQLE mRNA 表达水平显著下降(P<0.01)。
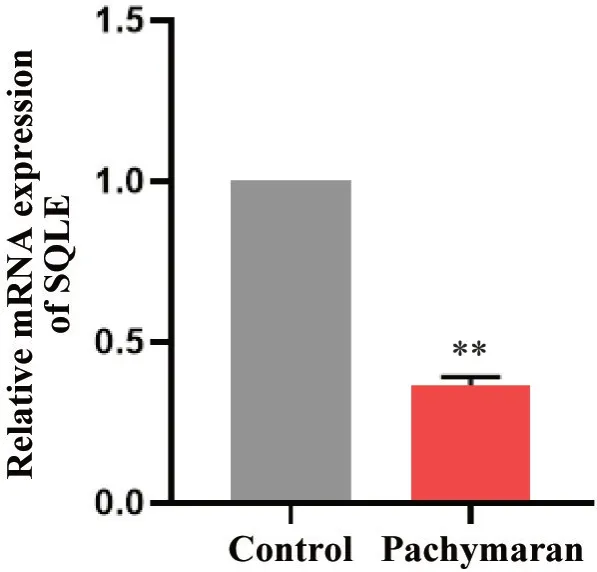
Figure 11. The mRNA expression level of SQLE in HepG2 cells was detected by RT-qPCR. The HepG2 cells were treated with pachymaran (800 mg/L) for 48 h. The SQLE mRNA level in pachymaran group was lower than that in control group. Mean±SD. n=3. **P<0.01 vs control group.图11 HepG2细胞中SQLE的mRNA表达水平
2.5 茯苓多糖对HepG2 细胞中焦亡相关因子mRNA 表达水平的影响 如图12 所示,与对照组相比,OE-NC 组SQLE、NLRP3 和caspase-1 的表达均无显著差异(P>0.05);与OE-NC 组相比,OE-SQLE 组SQLE 的mRNA 表达水平显著升高(P<0.01),NLRP3和caspase-1 的mRNA 表达水平显著降低(P<0.01),OE-NC+茯苓多糖组SQLE 的mRNA 表达水平显著降低(P<0.01),NLRP3 和caspase-1 的mRNA 表达水平显著升高(P<0.01);与OE-SQLE 组相比,OE-SQLE+茯苓多糖组SQLE 的mRNA 表达水平显著降低(P<0.01),NLRP3和caspase-1的mRNA 表达水平显著升高(P<0.01);与OE-NC+茯苓多糖组相比,SQLE 的mRNA 表达水平显著升高(P<0.01),NLRP3 和cas‐pase-1的mRNA表达水平显著降低(P<0.01)。
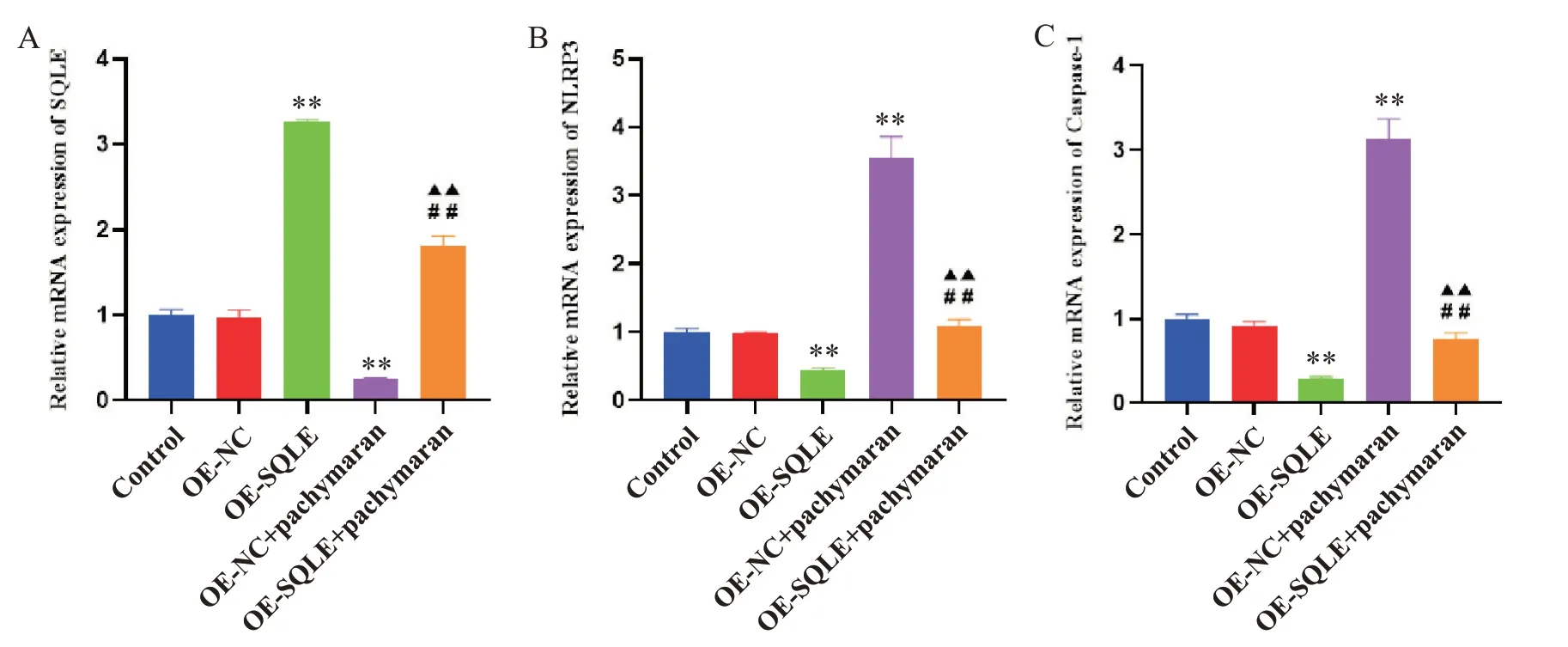
Figure 12. The mRNA expression levels of SQLE( A), NLRP3( B) and caspase-1( C) in HepG2 cells were detected by RT-qPCR.Mean±SD. n=3. **P<0.01 vs OE-NC group; ▲▲P<0.01 vs OE-SQLE group; ##P<0.01 vsOE-NC+pachymaran group.图12 RT-qPCR检测HepG2细胞中SQLE、NLRP3和caspase-1的mRNA表达水平
2.6 茯苓多糖对HepG2 细胞中焦亡相关蛋白表达水平的影响 Western blot结果显示,与对照组相比,OE-NC 组SQLE、NLRP3、caspase-1 和GSDMD-N 蛋白表达水平均无显著差异(P>0.05);与OE-NC 组相比,OE-SQLE 组SQLE 蛋白表达水平显著升高(P<0.01),NLRP3、caspase-1 和GSDMD-N 蛋白表达水平显著降低(P<0.01),OE-NC+茯苓多糖组SQLE 蛋白表达水平显著降低(P<0.01),NLRP3、caspase-1 和GSDMD-N 蛋白表达水平显著升高(P<0.01);与OESQLE 组相比,OE-SQLE+茯苓多糖组SQLE 蛋白表达水平显著降低(P<0.01),NLRP3、caspase-1和GSDMDN 蛋白表达水平显著升高(P<0.01);与OE-NC+茯苓多糖组相比,SQLE 蛋白表达水平显著升高(P<0.01),NLRP3、caspase-1 和GSDMD-N 蛋白表达水平显著降低(P<0.01),见图13。
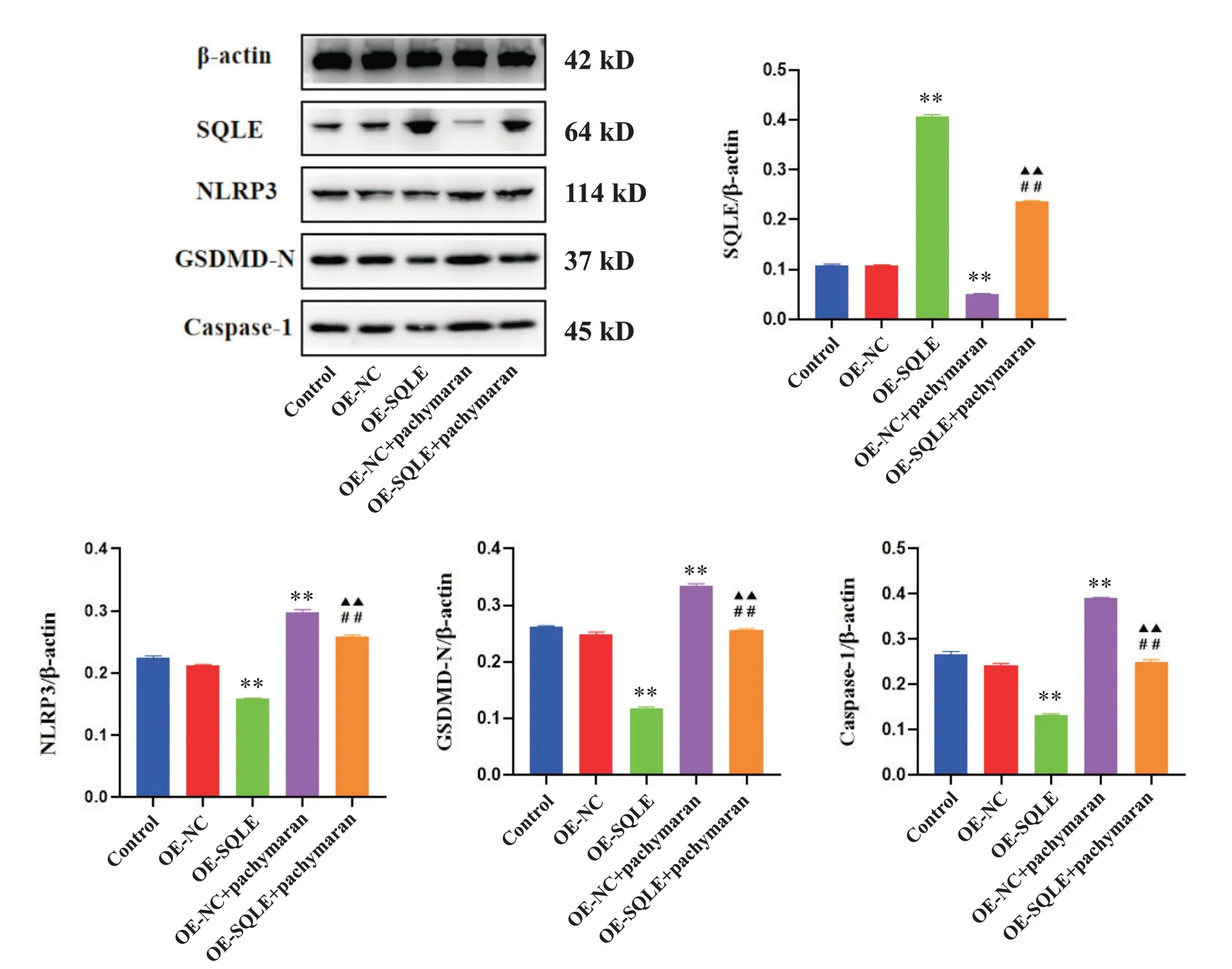
Figure 13. The protein expression levels of SQLE, NLRP3, GSDMD-N and caspase-1 in HepG2 cells were detected by Western blot.Mean±SD. n=3. **P<0.01vs OE-NC group; ▲▲P<0.01 vs OE-SQLE group; ##P<0.01 vs OE-NC+pachymaran group.图13 Western blot检测SQLE、NLRP3、GSDMD-N和caspase-1蛋白表达水平
2.7 茯苓多糖对HepG2 细胞坏死水平的影响 如图14 所示,与OE-NC 组相比,OE-SQLE 组细胞坏死水平降低,OE-NC+茯苓多糖组细胞坏死水平升高;与OE-SQLE组相比,OE-SQLE+茯苓多糖组细胞坏死水平升高;与OE-NC+茯苓多糖组相比,OE-SQLE+茯苓多糖组细胞坏死水平升高。
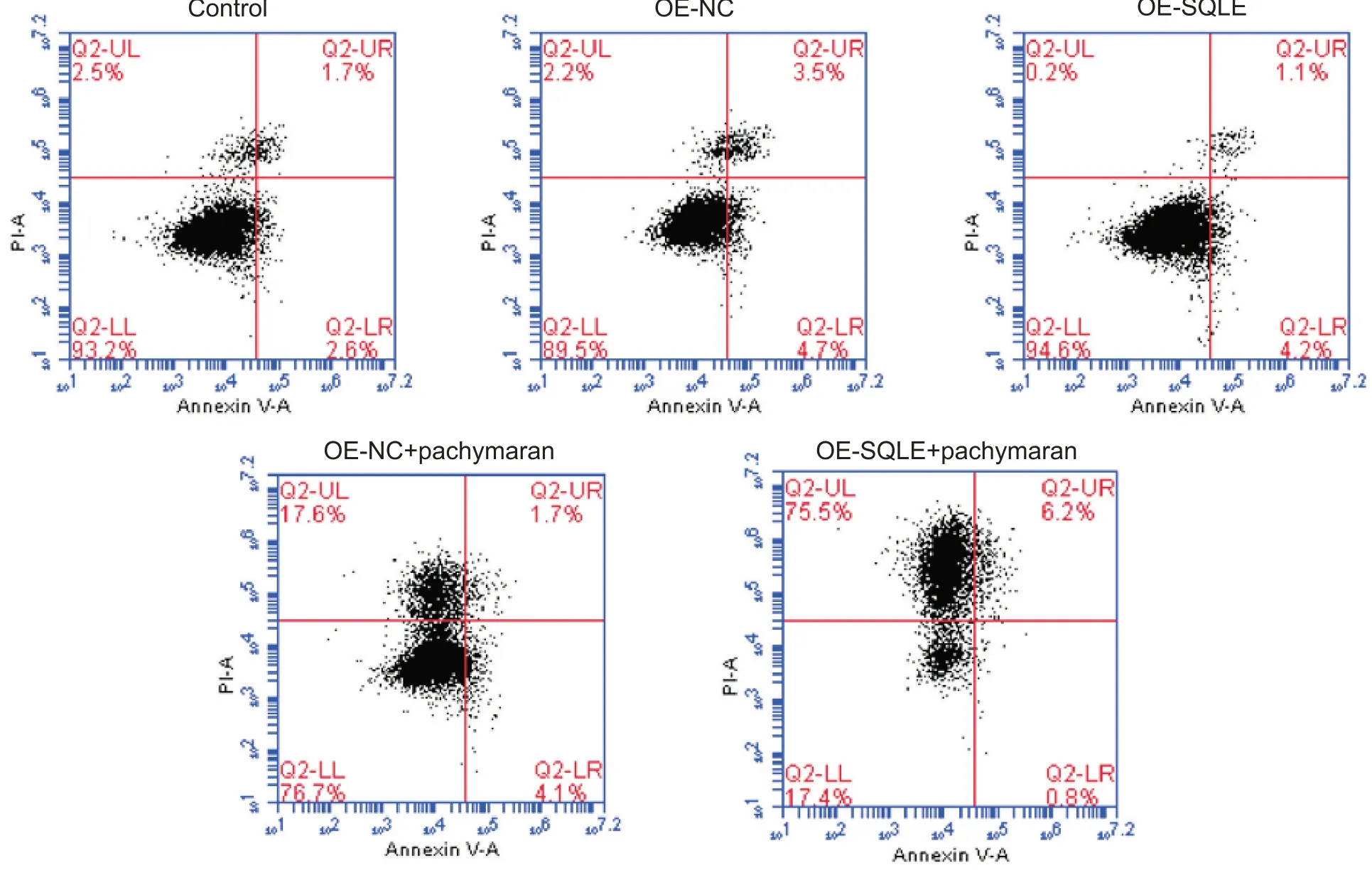
Figure 14. The necrosis of HepG2 cells was determined by flow cytometry.图14 流式细胞术检测HepG2细胞坏死水平
2.8 茯苓多糖对HepG2 细胞LDH 释放水平的影响 经过不同处理后,细胞释放LDH 的检测结果如图15 所示。与对照组相比,OE-NC 组LDH 释放量无显著差异(P>0.05);与OE-NC 组比较,OE-SQLE 组LDH释放量显著减少(P<0.01),OE-NC+茯苓多糖组LDH 释放量显著增多(P<0.01);与OE-SQLE 组相比,OE-SQLE+茯苓多糖组LDH 释放量增多(P<0.01);与OE-NC+茯苓多糖组相比,OE-SQLE+茯苓多糖组LDH释放量减少(P<0.01)。

Figure 15. The activity of LDH was measured by colorimetry.Mean±SD. n=3. **P<0.01 vs OE-NC group; ▲▲P<0.01 vs OE-SQLE group; ##P<0.01 vs OE-NC+pachymaran group.图15 比色法检测LDH活性
2.9 茯苓多糖对HepG2 细胞IL-18 和IL-1β 释放水平的影响 如图16 所示,与对照组相比,OE-NC 组IL-18 和IL-1β 释放量无显著差异(P>0.05);与OENC 组比较,OE-SQLE 组IL-18 和IL-1β 释放量显著减少(P<0.01),OE-NC+茯苓多糖组IL-18和IL-1β释放量显著增多(P<0.01);与OE-SQLE 组相比,OESQLE+茯苓多糖组IL-18 和IL-1β 释放量增多(P<0.01);与OE-NC+茯苓多糖组相比,OE-SQLE+茯苓多糖组IL-18和IL-1β释放量减少(P<0.01)。

Figure 16. Release levels of IL-18( A) and IL-1β( B) were measured by ELISA. Mean±SD. n=3. **P<0.01 vs OE-NC group; ▲▲P<0.01 vs OE-SQLE group; ##P<0.01 vs OE-NC+pachymaran group.图16 ELISA法测定IL-18和IL-1β的释放水平
讨 论
本研究根据生物信息学数据,在临床组织验证SQLE 差异表达,并在细胞实验中探究SQLE 在肝癌中的分子机制。相关研究表明,SQLE 可以通过P53调控PTEN/AKT/GSK3β 信号通路而影响膀胱癌进展[12],同时也与肺癌[13]、胰腺癌[14]和鼻咽癌[15]相关。本研究也提出SQLE 在肝癌中表达的确异常升高,这与既往其他肿瘤研究结果一致。同时,SQLE 通过调控脂代谢影响相关疾病也有相关报道。SQLE 可以诱导脂质新生,活化促炎通路(NF-κB),影响非酒精性脂肪性肝炎[16];也可以影响胆固醇酯的积累,激活PI3K/AKT 通路,抑制细胞凋亡,影响肿瘤细胞增殖[17]。而本研究在生信分析中也建立SQLE 与肝癌之间的联系,并在细胞实验中探讨相关机制。结果显示,在肝癌组织中,SQLE的确显著上调,过表达SQLE可以显著降低肝癌细胞凋亡率,细胞迁移能力也明显增强。
早期肝癌患者无明显临床症状,大多数患者就诊时已处于中晚期,术后愈后效果不佳。中医从整体观念出发,采用辨证论治的方法对原发性肝癌的治疗在减毒增效上具有很大优势。茯苓始载于《神农本草经》,被列为上品。自20世纪70~80年代报道茯苓多糖抗肿瘤作用以来,茯苓多糖的功效报道集中于免疫活性调节、抗炎、抗肿瘤等作用[18]。本课题组前期研究显示,茯苓多糖可以促进NLRP3、cas‐pase-1、GSDMD 等的mRNA 和蛋白表达,激活细胞焦亡途径,影响肝癌细胞形态,抑制HepG2细胞迁移能力,起到抗肝癌作用[19]。相关研究表明,茯苓多糖可诱导铁死亡以抗卵巢癌[20];还可通过线粒体途径诱导HepG2 细胞凋亡发生,也可通过死亡受体途径诱导细胞凋亡的发生[21]。因此,本研究探讨茯苓多糖通过SQLE 调控肝癌细胞焦亡的分子机制。结果显示,过表达SQLE能减少NLRP3、caspase-1、GSDMD等细胞焦亡相关因子的表达,抑制LDH、IL-18、IL-1β等细胞损伤和炎症因子的释放,抑制细胞焦亡途径及坏死水平,而茯苓多糖干预会部分逆转此趋势,促进肝癌细胞发生焦亡。这揭示SQLE 在肝癌进展中具有重要作用,为肝癌的治疗提供了参考资料。
综上所述,本研究应用生物信息学分析结合细胞实验,结果显示茯苓多糖可以通过抑制SQLE 促进NLRP3/GSDMD细胞焦亡途径,从而延缓肝癌进展。

