姜黄素通过下调HO-1/NQO1保护肝癌模型小鼠*
牟海军, 陈幸幸, 刘安安, 张 丽, 朱加兴, 金 海
(遵义医科大学附属医院消化病医院,遵义医科大学附属医院消化内科,贵州 遵义 563000)
肝细胞癌(hepatocellular carcinoma, HCC)是世界上第六大常见癌症[1]。其发病率和死亡率占我国恶性肿瘤前5 位[2]。HCC 的发生发展是一个慢性多阶段的病理过程,并且伴随各种基因的改变。抗肿瘤药物的作用机制也是多种多样,中药因其药效多样,副作用少,增强免疫力且不易产生耐药等优点,在肿瘤治疗方面一直是人们关注的热点。姜黄素是中药材姜黄中含有的一种天然抗氧化物质,可调节细胞周期、增殖、清除氧自由基、抑制肿瘤生长,还具有较强的抗病毒和肝功能保护作用[3-4]。近期研究显示,姜黄素可能同时作用于多条信号通路发挥抗癌作用。对前列腺癌[5]、结直肠癌[6]、肺癌[7]等疾病均有较好的作用,在肿瘤的防治具有良好的应用前景。本研究采用N-亚硝基二乙胺(N-nitrosodiethylamine,DEN)联合四氯化碳(carbon tetrachloride, CCl4)诱导C57BL/6J 小鼠肝癌模型,以观察姜黄素对小鼠肝癌模型发生发展的影响,并探究其机制。
材料和方法
1 材料
1.1 动物 SPF 级C57BL/6J 小鼠30 只(雌性20 只,雄性10只),5周龄,体重19~22 g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2016-0002。动物均饲养于遵义医科大学附属医院实验动物中心,环境温度(22±2) ℃、湿度50%±10%、明暗周期 12 h/12 h,自由摄食和饮水。动物实验经遵义医科大学附属医院实验动物伦理委员会批准。
1.2 药品及主要试剂 姜黄素(纯度≥75.0%; CAS:458-37-7; CB0346)购自上海生工生物工程股份有限公司;DEN(N0756)购自Sigma;CCl4(C11605036)购自上海麦克林生化科技有限公司;逆转录试剂盒(AQ601)、荧光PCR 扩增酶(AE311)和β-actin 抗体(HC201)购自北京全式金生物技术有限公司;血红素加氧酶1(heme oxygenase-1, HO-1)、NAD(P)H-醌氧化还原酶1[NAD(P)H-quinone oxidoreductase 1,NQO1]和β-actin引物由南京金斯瑞生物科技有限公司设计及合成;HO-1 抗体(ab13248)购自Abcam;NQO1 抗体(BM4978)和Ki67 抗体(A00254)购自武汉博士德生物工程有限公司。
1.3 主要仪器 5849R 型高速冷冻离心机(Eppen‐dorff);Icycler IQ 实时荧光定量PCR 仪、GelDoc 型电泳凝胶成像分析仪和DDY-10 型电泳仪(Bio-Rad);IX53+DP73 倒置显微镜(Olympus);AU680 全自动生化仪(Beckman)。
2 方法
2.1 药物制备 称取233、466 和932 mg 姜黄素,分别加入17.5 mL 纯净水搅拌混匀,并陶瓷研钵搅拌研磨混匀为混悬液,4 ℃冰箱保存,每周制备1次。
2.2 动物分组与模型建立 按雌雄比例为2∶1分笼饲养繁殖,取繁殖雄性幼鼠40只,出生后第14天一次性腹腔注射DEN(25 mg/kg),第4 周将小鼠断乳饲养并随机分为模型组和药物组(低、中、高剂量分别为100、200和400 mg/kg),每组10只。另取同龄雄性小鼠10只作为正常对照。从第8周开始,模型组和药物组灌胃给予CCl4(0.5 mL/kg),每周2 次;药物组以灌胃方式给予不同剂量姜黄素,每天1次(10 mL/kg)。
2.3 标本采集 第22 周末次给药后小鼠禁食不禁水,24 h 后称重,2%戊巴比妥钠腹腔注射麻醉小鼠后眼球取血,1 000×g离心15 min,分离血清−80 ℃保存,切取肝左叶部分组织用10%福尔马林固定,其余肝脏组织−80 ℃保存备用。
2.4 肝脏组织巨检 小鼠肝脏取出后生理盐水洗净拍照,观察小鼠肝脏表面,比较各组癌结节数量。
2.5 肝脏组织病理学观察 福尔马林固定48 h 后,常规石蜡包埋切片和HE 染色,光镜下观察并拍照,观察小鼠肝脏组织病变。
2.6 血清天冬氨酸转氨酶(aspartate aminotransferase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)活性的检测 采用全自动生化仪测定血清中AST和ALT活性,按试剂盒说明书操作。
2.7 RT-qPCR 检测HO-1 和NQO1 mRNA 表达 取相同部位肝脏组织约50 mg,加入1 mL Trizol UP 组织匀浆裂解,按照试剂盒说明书提取纯化RNA,逆转录为cDNA 后进行PCR 扩增,扩增条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40 个循环。以β-actin 为内参照,采用2−ΔΔCt法计算HO-1 和NQO1 的mRNA 相对表达水平。NQO1 的上游引物序列为5´-GCA GAT CCT GGA AGG ATG GA-3´,下游引物序列为5´-GGT TGT CAGC TGG AAT GGA C-3´;HO-1 的上游引物序列为5´-TGT CTG AGG CCT TGA AGG AG-3´,下游引物序列为5´-CAG GGC CGT GTA GAT ATG GT-3´;β-actin的上游引物序列为5´-GTG ACG TTG ACA TCC GTA AAG A-3´,下游引物序列为5´-GCC GGA CTC ATC GTA CTC C-3´。
2.8 Western blot 检测HO-1 和NQO1 蛋白表达取相同部位肝脏组织约100 mg,将肝组织置于冰冷的裂解液收集裂解物总蛋白,采用BCA 法测定蛋白含量,并定量为5 g/L,配置10% SDS-PAGE 凝胶,每个样本点样10 µL,分离组织总蛋白并转印至PVDF膜;5%脱脂奶粉室温封闭2 h 后,分别与HO-1、NQO1 和β-actin 抗体(1∶1 000)孵育过夜,次日用TBST 洗膜(每次15 min,洗3 次)后,再与辣根过氧化物酶偶联的Ⅱ抗(1∶2 000)反应,洗涤Ⅱ抗(每次15 min,洗3次),经凝胶成像系统曝光成像,ImageJ软件测定条带灰度值,计算目的蛋白与β-actin 条带灰度值之比,即为目的蛋白的相对表达量。
2.9 免疫组化检测Ki67 蛋白表达 取包埋组织切片,按照二步法免疫组织化学试剂盒说明进行操作。为定量分析Ki67 阳性细胞,每张染色切片在显微镜下随机取5 个视野拍照并计数阳性细胞,观察到呈现棕褐色的为Ki67 阳性细胞,采用阳性细胞数所占百分比来表示表达量。
3 统计学处理
用GraphPad Prism 7.03 软件进行统计。计量资料均以均数±标准差(mean±SD)表示。采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 小鼠一般情况比较
至实验结束,模型及药物干预组小鼠肝脏100%成瘤且均无中途死亡。实验中后期模型及药物干预组小鼠开始精神萎靡,进食减少,体重增加缓慢且小于正常对照组。与正常对照组比较,模型组小鼠体重及增重显著降低(P<0.01),与模型组比较,低、中、高剂量姜黄素组小鼠体重及增重均显著升高(P<0.01);与正常对照组比较,模型组小鼠肝重及肝脏指数显著升高(P<0.01),与模型组比较,低、中、高剂量姜黄素组小鼠肝重及肝脏指数均无显著变化(P>0.05),见表1。
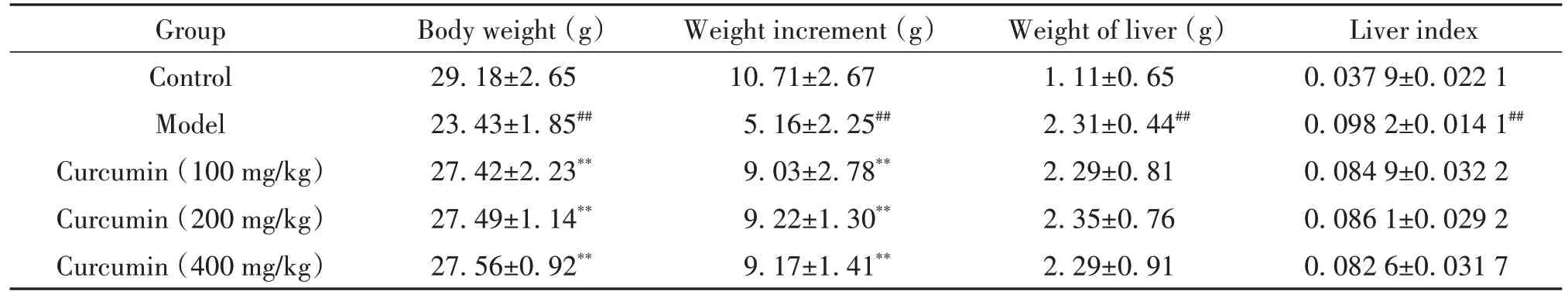
表1 小鼠体重、增重、肝重及肝脏指数的比较Table 1. Comparison of body weight, weight gain, liver weight and liver index of the mice (Mean±SD. n=10)
2 肝脏形态学变化
由图1 可见,正常组小鼠肝脏表明光滑、色泽红润、质地细腻,没有出现增生结节;模型组小鼠肝脏色泽暗淡,边缘不整齐,可见表面出现大小不一质地较硬的白色圆形癌结节,结节切面有坏死及出血;给予姜黄素后,小鼠肝脏也可见白色癌结节,但与模型组相比,癌结节数量及大小明显减小。
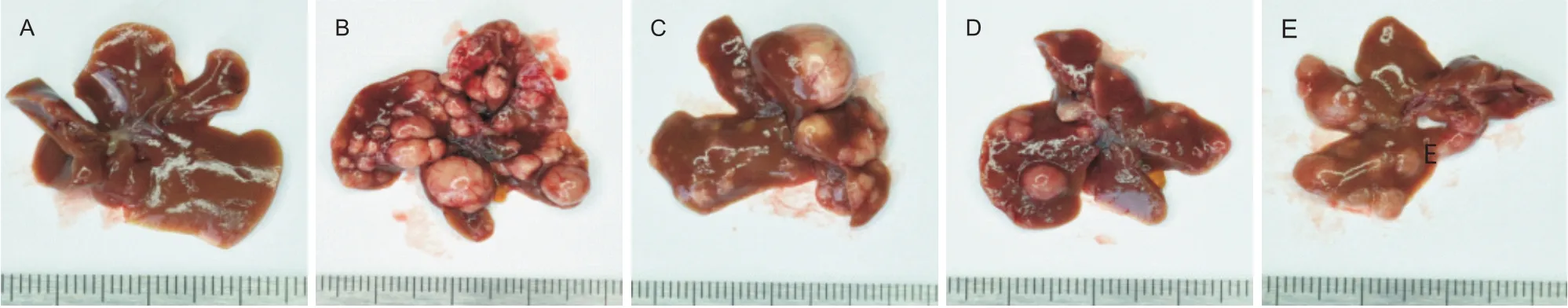
Figure 1. Macroscopic examination of mouse livers. A: control group; B: model group; C: curcumin( 100 mg/kg) group; D: cur‐cumin( 200 mg/kg) group; E: curcumin( 400 mg/kg) group.图1 小鼠肝脏外观
3 肝脏癌结节数量
通过图片观察肝脏,以直径2 mm 和5 mm 为界,计数肝脏正反表面癌结节数量。由表2 可见,与模型组比较,给予姜黄素后小鼠肝脏癌结节总数及小于2 mm 癌结节数量均显著减少(P<0.05 或P<0.01),大于2 mm癌结节数量均无显著差异。

表2 小鼠肝脏癌结节数Table 2. The numbers of tumor nodules in mouse livers (Mean±SD. n=10)
4 血清ALT和AST活性
与正常对照组比较,模型组小鼠血清ALT 和AST 活性显著升高(P<0.01);与模型组比较,低、中、高剂量姜黄素组小鼠血清ALT 活性无显著变化,而AST活性均显著降低(P<0.01),见表3。
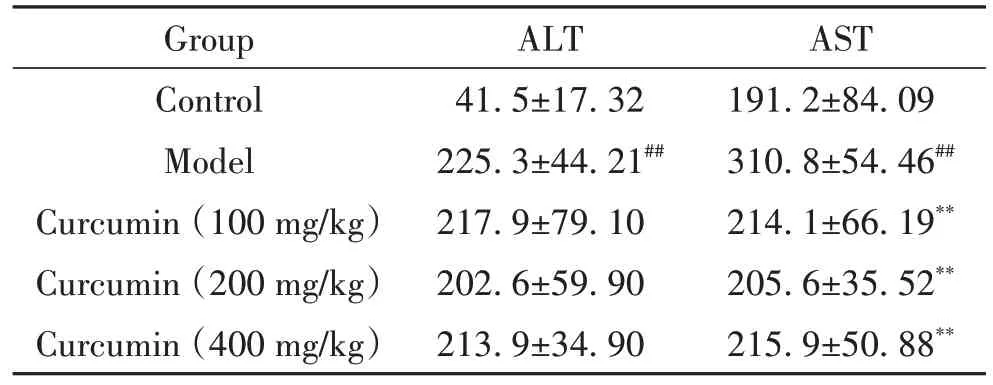
表3 小鼠血清ALT和AST水平Table 3. The serum levels of ALT and AST in mice (U/L. Mean±SD. n=10)
5 肝组织病理学
HE 染色结果显示,正常对照组小鼠肝脏结构正常,肝细胞结构完整、清晰,肝索排列整齐;模型组肝小叶结构模糊,有多处坏死并伴有炎症细胞浸润,出现大量大小、形状不一不规则排列的细胞核;与模型组相比,各姜黄素组肝小叶结构紊乱和肝细胞变性程度明显减轻,肝癌细胞排列相对有序,见图2。
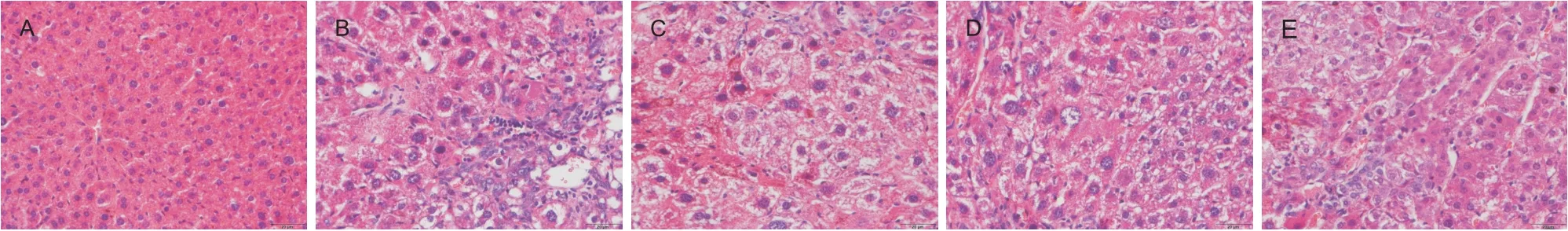
Figure 2. HE staining results of paraffin sections of the mouse liver( scale bar=20 µm). A: control group; B: model group; C: cur‐cumin( 100 mg/kg) group; D: curcumin( 200 mg/kg) group; E: curcumin( 400 mg/kg) group.图2 小鼠肝脏石蜡切片HE染色结果
6 肝组织中HO-1和NQO1的mRNA表达水平
RT-PCR 检测结果显示,与正常对照组比较,模型组小鼠肝组织中HO-1和NQO1的mRNA表达水平均显著升高(P<0.05);与模型组相比,中剂量姜黄素组小鼠肝组织中HO-1 的mRNA 表达水平显著降低(P<0.05),高剂量姜黄素组小鼠肝组织中NQO1 的mRNA表达水平显著降低(P<0.05),见图3。
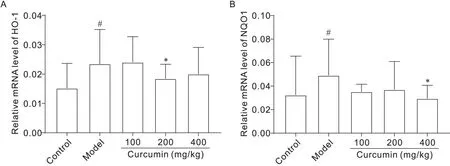
Figure 3. The mRNA expression levels of HO-1( A) and NQO1( B) in mouse livers. Mean±SD. n=10. #P<0.05 vs control group; *P<0.05 vs model group.图3 小鼠肝脏HO-1和NQO1的mRNA表达水平
7 肝组织中HO-1和NQO1蛋白表达水平
Western blot实验结果显示,与正常对照组比较,模型组HO-1 和NQO1 蛋白表达水平均显著升高(P<0.01);与模型组相比,中剂量姜黄素组小鼠肝组织中HO-1 和NQO1 蛋白表达水平均显著降低(P<0.05),高剂量姜黄素组小鼠肝组织中NQO1 蛋白表达水平显著降低(P<0.05),见图4。

Figure 4. The protein expression levels of HO-1 and NQO1 in mouse livers. Mean±SD. n=10. ##P<0.01 vs control group; *P<0.05 vs model group.图4 小鼠肝脏HO-1和NQO1蛋白表达水平
8 肝组织Ki67蛋白的免疫组化染色
免疫组化染色结果(图5)显示,正常对照组、模型组、低剂量姜黄素组、中剂量姜黄素组和高剂量姜黄素组小鼠肝组织中Ki67阳性表达率分别为(1.55±0.05)%、(63.24±5.42)%、(38.32±2.98)%、(40.68±3.52)%和(35.46±3.79)%。低、中、高剂量组小鼠肝脏组织中Ki67 阳性表达率均低于模型组,差异有统计学意义(P<0.05),给药组之间比较差异无统计学意义(P>0.05)。

Figure 5. Immunohistochemical staining of Ki67 in mouse livers( scale bar=50 µm). A: control group; B: model group; C: curcumin(100 mg/kg) group; D: curcumin( 200 mg/kg) group; E: curcumin( 400 mg/kg) group.图5 小鼠肝脏Ki67免疫组化染色
讨 论
本研究使用DEN 联合CCl4诱发的肝癌模型,100%的小鼠在5 个月大时出现肝脏肿瘤,且对肝脏致癌有较好的专一性。肝脏是药物代谢的主要器官,DEN 具有较强的肝毒性,可诱导急性肝毒性和肝细胞DNA 损伤[8],可诱导肝内炎症发生,损伤肝细胞,造成肝组织纤维化,继而发生肝细胞结节性增生及肝硬化,最后诱发肝癌。将DEN 与CCl4联合使用诱导肝癌,可缩短造模时间,降低小鼠死亡率,其病变过程与人类肝癌病程相似,因而被广泛用于肝癌的临床及基础研究中。
Ki67是恶性肿瘤细胞增殖的标志物,表达越高,说明肿瘤细胞处于快速分裂期,增殖快,恶性程度较高。血清ALT 和AST 水平是评价肝功能损害的重要指标。当肝功能损害发生时血清ALT 和AST 活性也会大幅升高。本研究结果提示DEN 联合CCl4可明显诱导小鼠肝癌的发生,给与姜黄素干预后,小鼠肝脏Ki67表达显著降低,同时血清AST 活性也显著降低,提示姜黄素对DEN 联合CCl4诱导的肝癌模型小鼠有保护作用。
大多数HCC在慢性肝脏炎症的背景下发展。氧化应激被认为在HCC 发展的发病机制中起主要作用[9-10]。Nrf2-Keap1信号通路被认为是细胞内最重要的抗氧化应激机制之一。当细胞受毒物刺激时,Nrf2从Keap1中解偶联进入细胞核内,通过调控下游抗氧化分子如HO-1、NQO1 等的表达,从而抵抗氧化应激损伤[11-13]。本研究显示DEN 联合CCl4诱导小鼠肝癌形成,小鼠机体快速启动氧化应激形成自我保护,导致模型组小鼠肝脏HO-1 和NQO1 蛋白表达大幅度增加,但HO-1 和NQO1 过度表达将产生过多的Fe2+和CO,过多的Fe2+和CO 会一定程度地加大细胞氧化应激压力,损伤线粒体[14],破坏细胞完整性[15],因此过度表达的HO-1 和NQO1 反而有细胞毒性作用。而给予姜黄素后,小鼠肝脏HO-1 和NQO1 蛋白表达较模型组显著降低,将细胞内HO-1 和NQO1 蛋白表达控制在一定范围内,保障了Nrf2-Keap1 信号通路更好地发挥抗氧化应激的作用,因此姜黄素对于肝癌小鼠Nrf2-Keap1 信号通路平衡的调节值得进一步研究。

