特瑞普利单抗治疗转移性恶性黑色素瘤1例
徐兰 叶刚
暨南大学附属第一医院消化内科,广州 510630
恶性黑色素瘤(malignant melanoma,MM)是由人体组织内的黑色素细胞发生恶变所致。原发灶多见于皮肤,也可发于肢端、黏膜、眼脉络膜,近年来发现越来越多罕见原发灶报道,如胆道、胸腺、脊柱、头颅等部位[1-4]。MM 在早期易发生淋巴、血运转移。现有研究文献报道,远处转移中胃肠道转移较多见,然而症状多不典型,以消化道穿孔、出血、肠梗阻等急腹症为常见就诊原因[5]。早期MM 外科手术切除为常用治疗手段,晚期MM 手术治愈率低,以往化疗效果不佳。免疫治疗是当前肿瘤治疗的新浪潮,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的研究最为热门,免疫系统有多个检查点抑制途径,例如程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)与其相应配体(programmed cell death ligand 1 and 2,PD-L1、PD-L2)[6-7]。ICIs 作用机理是引导免疫细胞攻击肿瘤细胞,同时保护正常宿主细胞,帕博利珠单抗、纳武单抗和特瑞普利单抗均是当前晚期MM 的主要PD-1 抑制药物,特瑞普利是国内首个用于晚期MM的国产PD-1单抗。
病例资料
患者,79 岁,女性,因“呕血、便血3 d,再发便血3 h”于2022年8月11日入院。现病史:3 d前患者无明显诱因出现呕血、便血,呕血2 次,总量100 ml。便血3 次,先解暗红色血便,后转为鲜血便,量50 ml/次。伴晕厥3 次,表现为呼之不应、面色苍白、大汗淋漓,数秒钟后自行缓解,遂至外院就诊,予护胃、止血、扩容等处理后患者自觉症状改善。3 h 前患者无明显诱因再次解暗红色血便1次,量50 ml,遂就诊于暨南大学附属第一医院。既往史:患者“鼻腔MM”病史2年余,已分别于2021 年3 月18 日和2021 年11 月12 日行鼻腔MM 根治术,2 次术后病理示:镜下观见肿瘤细胞呈片状、乳头状浸润性生长,肿瘤细胞呈圆形,胞质偏少,细胞核呈圆形、椭圆形或空泡状,可见核仁、核分裂象,周围间质纤维组织、血管增生,局部出血,有黑色素沉积。免疫组化:SOX-10(+),S-100(弱+),HMB-45(+),MelanA(+),Ki67 40%(+)。见图1。余既往史无特殊。回顾患者既往2 次行手术治疗病历,手术切除后予以告知患者及家属病情及可能预后,患者强烈要求出院,因此并未行术后辅助治疗。本研究符合《世界医学会赫尔辛基宣言》相关要求。

图1 1例鼻腔恶性黑色素瘤术后转移至十二指肠患者病理图。1A为苏木素-伊红染色,×40;1B为免疫组化染色,×200
诊疗经过
入院后行急诊胃镜示:上消化道出血;十二指肠球降交界凹陷性病变:MM 待排?见图2。胸部+全腹部CT 平扫+增强均未见异常。正电子发射断层显像(positron emission tomography-CT,PET-CT)示:(1)鼻窦黑色素瘤综合治疗后,右侧筛窦部分骨质缺如,局部斑片状软组织密度影,糖代谢未见增高,考虑治疗后改变;(2)十二指肠降升段见2 个糖代谢异常增高灶。见图3。依据《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南》(2022 年)[8],考虑取活检易导致出血、转移,该患者处于出血急性期,故未取活检送病理。结合患者病史、PET-CT、内镜等结果,并排除其他肿瘤的存在,最终诊断为十二指肠转移性MM 伴出血(Ⅳ期T4bN1bM1c),予输血、补液、抑酸止血等对症支持治疗,并行第一疗程“特瑞普利单抗注射液(拓益)150 mg”治疗后患者无呕血、便血,病情平稳后出院。
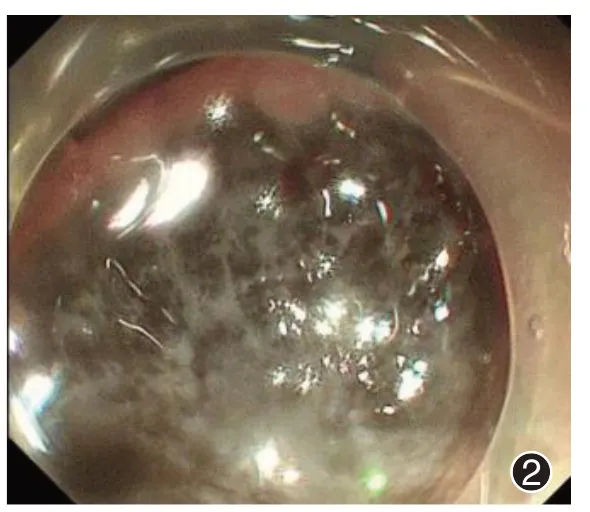
图2 1例鼻腔恶性黑色素瘤术后转移至十二指肠患者免疫治疗前胃镜
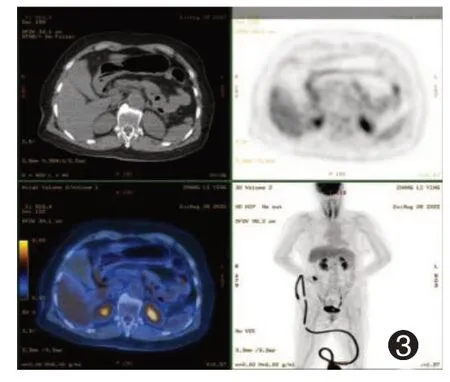
图3 1例鼻腔恶性黑色素瘤术后转移至十二指肠患者免疫治疗前正电子发射断层显像(PET-CT)
免疫治疗过程:患者出院后,每2 周返院行免疫治疗,治疗方案均为:特瑞普利单抗注射液(拓益)150 mg,(2022 年8 月11 日、2022 年8 月25 日、2022 年9 月8 日、2022 年9 月22 日、2022 年10 月6 日、2022 年10 月23 日)完成6 个疗程免疫治疗后,复查胃肠镜示十二指肠球降部病灶缩小。见图4。在(2022 年11 月9 日、2022 年11 月23 日、2022年12月8日、2023年1月11日)完成第10次治疗后,常规复查PET-CT示十二指肠糖代谢灶较前减低。
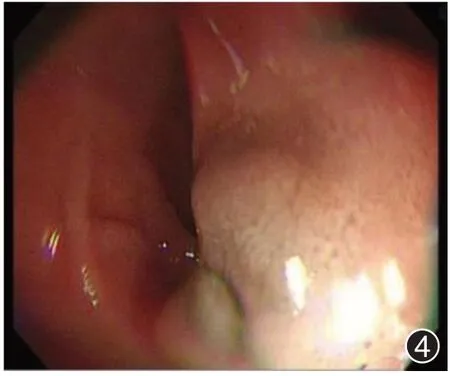
图4 1 例鼻腔恶性黑色素瘤术后转移至十二指肠患者免疫治疗后胃镜
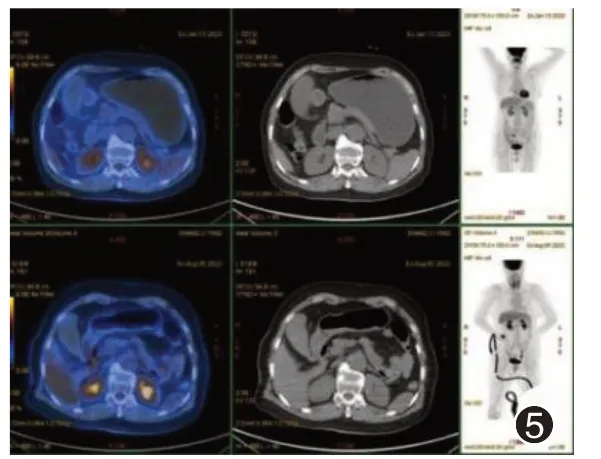
图5 1 例鼻腔恶性黑色素瘤术后转移至十二指肠患者免疫治疗后正电子发射断层显像(PET-CT)
讨论
MM起自皮肤、黏膜、肢端等组织部位,在我国肢端型和黏膜型较为常见,其中黏膜型包含鼻腔/鼻窦/鼻咽、口腔、直肠、肛管及生殖泌尿道等。与皮肤、肢端型相比较,黏膜型MM 侵袭性更强、复发及转移率更高,这与黏膜富含淋巴管和血管供应有关[9-10],考虑到这一特点,结合本病例中该患者处于出血急性期,未取病理活检。临床上明确黑色素瘤是原发还是继发对后续治疗起关键作用,经仔细询问病史可有助于鉴别,联系本例患者既往病史特点,并完善相关检验、检查,排除了其他肿瘤,最终考虑是转移性MM。
目前,黏膜型MM 治疗总的原则为:(1)以手术切除为主,0~Ⅲ期及部分寡-单转移Ⅳ期可手术,Ⅱ期可开始行术后辅助治疗,Ⅲ期应常规予以术后辅助治疗;(2)复发或转移到器官组织的Ⅳ期不可手术,应给予姑息治疗,方案首选PD-1 单抗单药或联合伊匹木单抗双免治疗,行基因检测出BRAF 突变阳性者可选择双靶治疗。另外根据最新版本的美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)的黑色素瘤指南[11]提到:由于一线免疫治疗进展患者再次使用原药物仍可获得良好的疗效,指南推荐继续原药治疗。本病例患者处于消化道出血急性期,存在后续出血风险,并未联用抗血管药物,结合患者经济情况,未进一步完善基因检测,最终方案是使用特瑞普利单抗150 mg单药治疗。
无论是原发或继发消化道MM多数就诊时,已属于中晚期,病死率高[12]。黄文鹏等[13]发现消化道MM整体中位生存时间仅有13.5个月。临床与分子生物学实验证明,黑色素瘤与其浸润组织中的T细胞关系密切,属于免疫原性肿瘤[14-15]。与传统药物直接杀灭肿瘤细胞效应不同,免疫治疗是通过激活本身的免疫功能攻击肿瘤细胞,因这一特殊的作用机制,免疫治疗起效较慢。张同梅[16]提到ICIs 可以为某些患者带来更为长期的生存,因为其独特的拖尾效果。查阅文献,在一项纳入655例接受PD-1抑制剂治疗的晚期MM患者,其中1/6实现了完全缓解并停药;随访3、4年后维持完全缓解患者占比87.6%[17]。抑制致癌途径、增益抗肿瘤活性的免疫治疗已逐渐成为肿瘤治疗新标准、新路径。
在消化道MM 姑息性治疗过程中,需多次行相关影像学及内镜等检查,因其可作为MM 疗效监测及预后评估的最有力证据。针对残留、隐匿的微小转移病灶,PET-CT 更具备强大优势,追究其因,或许是消化道MM 的18F-氟代脱氧葡萄糖(18F-fluorodexyglucose,18F-FDG)摄取率偏高[18-19]。本病例患者完成6 次特瑞普利单抗治疗后,复查胃镜示十二指肠球降部转移病变较前缩小,第10 次免疫治疗后复查PET-CT 示十二指肠糖代谢较前减低,说明免疫治疗对MM转移灶有免疫应答,治疗有效,临床效果确切。随访患者现一般情况可,带瘤生存中,规律返院治疗。
既往文献报道,由于消化道MM 的罕见及其临床症状的不典范性,易漏诊和误诊[20-21]。扩展对MM 的认知,有助于消化科医生在对消化道出血、消化道占位性病变病因探查中提供思考方向,对误诊、漏诊的减少有一定帮助。对恶黑诊治的系统了解,有益于临床医生开展医学多学科协疗,并且联合相应临床场景制定正确且个体化的治疗方案。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明徐兰:文献检索、论文撰写、病例随访;叶刚:论文修改

