肾移植非糖尿病患者血浆置换或透析的危险因素
王乐 陈颖力 张凯璐 张银福 杜瑞妮 高巍
西安交通大学第一附属医院麻醉手术部,西安 710061
肾移植是终末期肾衰竭的有效治疗方法,可提高需要肾脏替代治疗患者的预期寿命和生活质量。由于术前配型、缺血再灌注损伤、输血等,患者术后可能发生急性肺水肿、心力衰竭、排斥反应等,若处理不当,将导致移植肾丢失,严重时可危及患者生命,而血浆置换或透析是临床应用的主要治疗方案[1-4]。与移植前合并糖尿病(发生率22%~23.9%)和移植后糖尿病(post-transplantation diabetes mellitus,PTDM)患者(发生率10%~20%)相比,非糖尿病患者人数较多,占比70.9%[5-7]。既往有文献分析肾移植前合并糖尿病或PTDM 患者生存的危险因素,也有分析术前不同程度空腹血糖(fasting plasma glucose,FPG)对肾移植死亡的影响,但有关术前术后非糖尿病患者血浆置换或透析相关文献鲜有报道[4,8-9]。因此,本研究拟探讨肾移植非糖尿病患者血浆置换或透析的危险因素。
资料与方法
1.研究对象
收集2019 年1 月至2020 年12 月在西安交通大学第一附属医院接受异体肾移植的507 例患者临床资料进行回顾性研究,并随访1 年。按照移植后1 年内有无血浆置换或透析治疗,分为两组:有治疗组(49 例)和无治疗组(458 例)。⑴纳入标准:全麻下首次行异体肾移植;年龄15~65 岁;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ~Ⅳ级。⑵排除标准:既往有糖尿病史;多器官联合移植;确诊PTDM;异体肾移植术后1年内失访;数据缺失。
本研究经西安交通大学第一附属医院医学伦理委员会审批通过(XJTUIAF2019LSL-008),并获得患者或家属同意。
2.观察指标
收集变量包括年龄、性别、体质量指数、吸烟史、代谢综合征史、糖尿病家族史、透析时长、肾衰竭原因、肾移植位置、冷热缺血时间、ASA 分级、总出入量、手术麻醉时间,术后第8 天胰岛素、降糖药、高脂血症、FPG、移植肾功能延迟恢复(delayed graft function,DGF)、胱抑素C(Cystatin C,CysC)、肌酐、肾小球滤过率[10]。
3.血浆置换或透析
血浆置换:指将全血引出体外分离成血浆和细胞成分,后将新鲜血浆、白蛋白、平衡液等血浆代用品代替分离出的血浆回输进体内的过程。透析:通过弥散、超滤、吸附和对流原理进行物质交换,清除体内的代谢废物,维持电解质和酸碱平衡,同时清除体内过多的水分。
4.统计学方法
采用SPSS 20.0 进行数据分析。计量资料不符合正态分布,以中位数(四分位数间距)描述,组间比较采用非参数检验;计数资料以例(%)表示,采用χ2检验或连续校正χ2检验、Fisher 确切概率法;P<0.1 变量纳入多因素logistic 回归分析以确定独立危险因素。P<0.05为差异有统计学意义。
结果
1.血浆置换或透析患者占比
2019年1月至2020年12月共611例患者在西安交通大学第一附属医院接受异体肾移植,104 例患者排除(包括非首次肾移植患者2 例、ASA V 级患者1 例、既往有糖尿病史患者21 例、多器官联合移植患者1 例、确诊PTDM 患者40 例、失访患者20 例、数据缺失患者19 例),最终507 例纳入分析,其中有治疗组49 例,无治疗组458 例,血浆置换或透析患者占比9.7%。
2.两组患者人口学特征和一般资料比较
与无治疗组相比,有治疗组患者术中总出量较少(P=0.032),其中尿量较少(P=0.028),见表1。
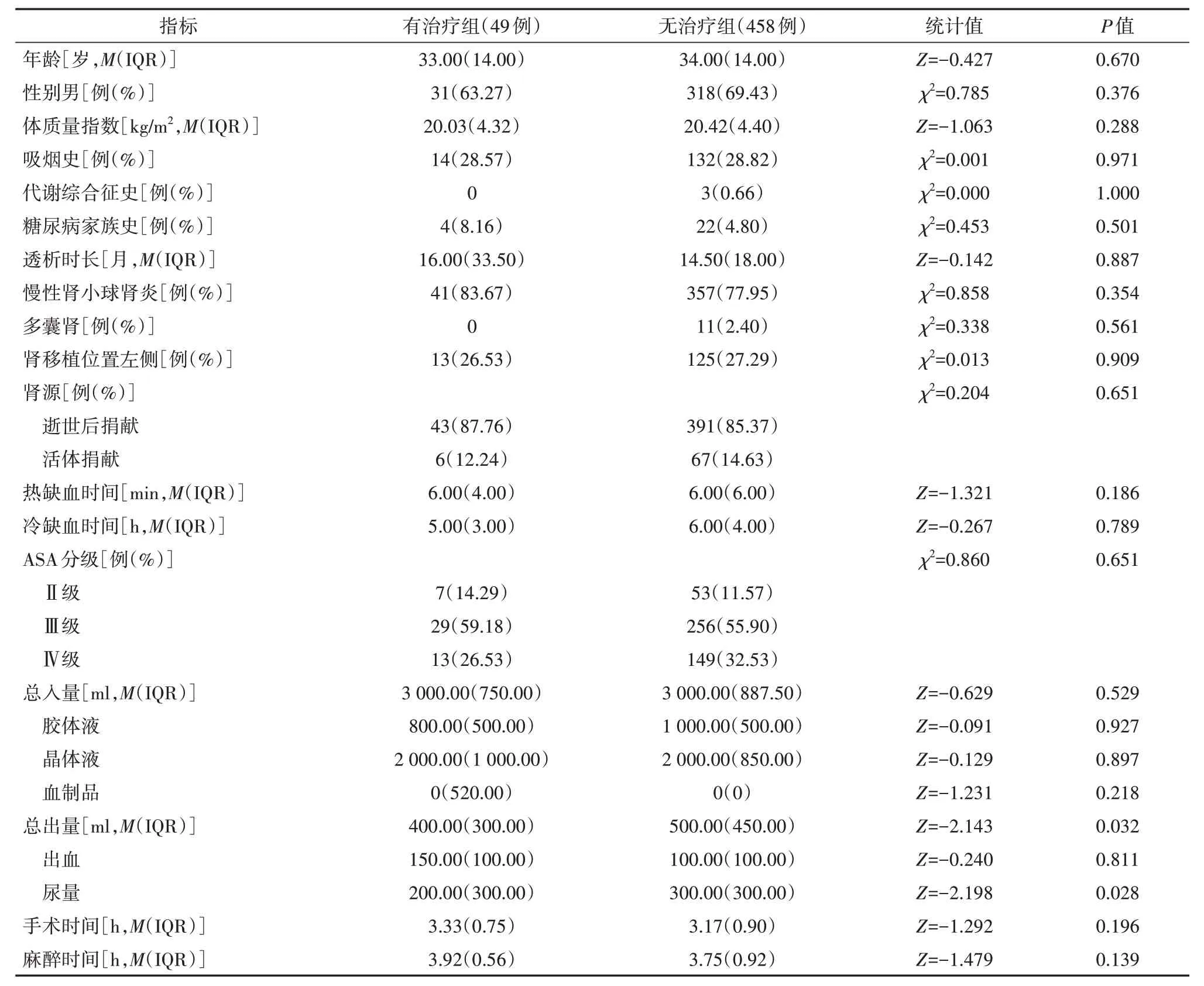
表1 两组肾移植患者人口学特征和一般资料比较
3.两组患者术后资料比较
与无治疗组相比,有治疗组术后第8天FPG ≥7.8 mmol/L的患者与DGF 患者比例较高,术后第8 天CysC 和肌酐水平较高,肾小球滤过率较低(均P<0.05),见表2。
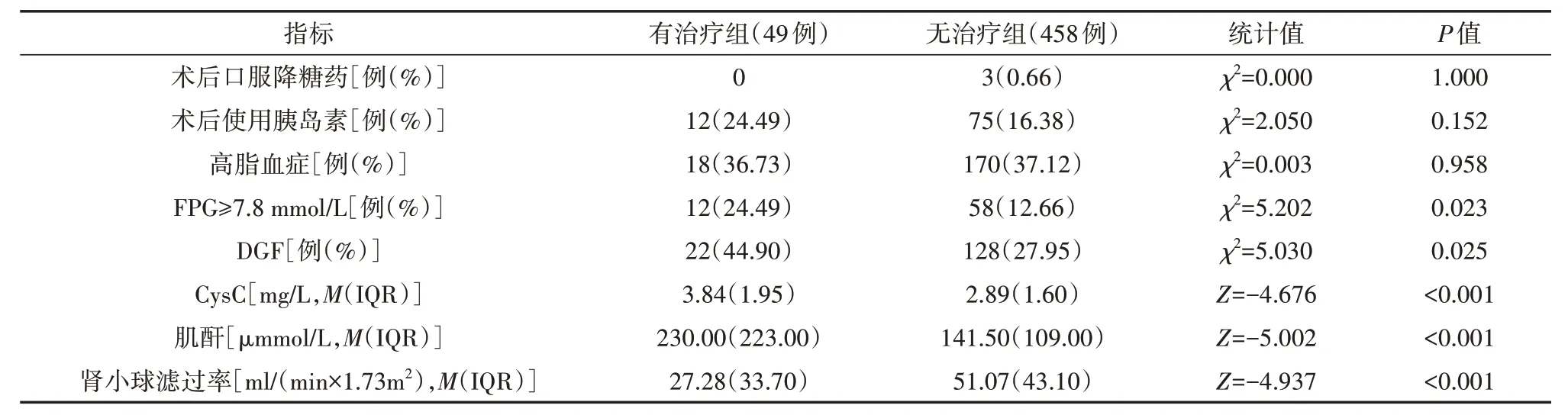
表2 两组肾移植患者术后第8天资料比较
4.血浆置换或透析多因素logistic分析
经多因素logistic回归分析,术后第8天FPG≥7.8 mmol/L(OR=1.216,P=0.046)和CysC(OR=1.610,P<0.001)是血浆置换或透析的独立危险因素,可增加血浆置换或透析的风险,见表3。
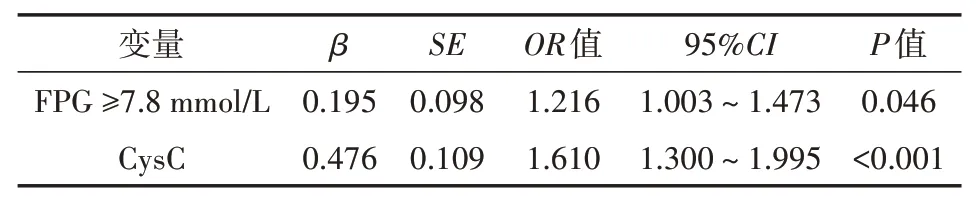
表3 507例肾移植非糖尿病患者血浆置换或透析危险因素的多因素logistic分析
讨论
肾移植是终末期肾病的理想治疗方法,潜在捐献者数量的减少和对实体器官需求患者的不断增长均能导致扩展标准供体或心脏死亡捐献供体器官的使用增加[11]。这些器官出现不良结果的风险较高,因为它们更容易受到缺血再灌注损伤。肾移植中的缺血再灌注损伤可能与移植后并发症发生率的增加有关,在肾移植后10 年内出现移植肾功能失败的患者占26%~42%,移植后1周内接受透析的肾移植受者占25%~30%[12-13]。有研究发现,每年接受治疗性血浆置换的肾移植受者达6.3%~20.1%,非糖尿病受者占肾移植受者的70.9%[7,14]。肾移植非糖尿病患者与移植前有糖尿病或PTDM 相比,在移植物失败率或患者生存率的结果相似[15-16]。因此,分析肾移植非糖尿病患者血浆置换或透析的风险因素有重要意义。
Palermo等[17]研究发现,术后第1天,循环中胰岛素生理反应的短暂降低最为明显,并可能持续数天或数周,术后5 d内胰岛素敏感度平均下降50%,术后9~21 d恢复正常。肾移植受者较一般人群有更多的胰岛素抵抗,20%~50%术前无糖尿病史的肾移植受者出现明显的移植后葡萄糖不耐受,66%术前糖代谢正常的患者术后需要胰岛素治疗,早期发现有移植后高血糖风险的患者对预防长期并发症具有重要的临床意义,应激性血糖范围在6.1~7.8 mmol/L 的患者预后优于7.8~10.0 mmol/L 的患者[18-21]。基于上述研究,本研究选取术后第8天化验结果,并以血糖7.8 mmol/L 作为分界点进行分层分析,发现血浆置换或透析组中术后第8 天FPG≥7.8 mmol/L 的非糖尿病患者占比高,与文献结果一致,进一步验证了其是肾移植非糖尿病患者术后血浆置换或透析的独立危险因素[18-21]。因此,对于术后第8 天FPG≥7.8 mmol/L的非糖尿病患者常规监测血糖,宣教调控血糖相关知识,使其早认识并做好相关应对措施,同时优化术后管理,进而提高移植肾存活率,减少再入院次数。
CysC 是有核细胞在恒定条件下产生,参与机体蛋白酶的分泌,是肾功能常规项目之一,正常会被肾小管上皮细胞重吸收,一旦肾小管受损则明显增加,不受性别、炎症、肿瘤、免疫性和内分泌疾病等因素的影响[22]。CysC 是肾小球滤过和早期肾功能不全的可靠生物标志物,也是透析充分性的评价指标,与心脑血管疾病、代谢综合征、DGF、肺脏疾病及死亡等相关[23-27]。一项关于CysC在肾移植围手术期应用的研究发现,术后第1 天CysC 可预测肾损伤,界值为4.77 mg/L,灵敏度为81.8%,特异度为88.9%,术后7 d 可预测肾移植受者的短期预后[28]。血清中CysC 的含量在肾移植术后1 d迅速下降,术后4~5 d内达到稳定。为便于临床实施,选取术后第8 天CysC 进行比较,其处于稳定期,并受免疫冲击治疗影响小。本研究发现有治疗组第8天CysC高于无治疗组,且是独立风险因素。
高脂血症是肾移植后心血管疾病的主要危险因素,可导致移植肾慢性肾病的发生,影响移植物的存活,但本研究两组患者高脂血症差异无统计学意义。多项研究运用尿量评估肾移植术后肾功能,本研究中治疗组术中尿量低于无治疗组,但并非独立因素[29-30]。DGF 是移植后常见的并发症,在移植肾功能恢复前,选择适当的血液净化方案非常重要,免疫抑制剂的合理调整也是关键[31]。本研究中治疗组合并DGF的患者占比为44.9%,但DGF并非独立危险因素。
本研究的意义在于通过术后第8天FPG和CysC两个临床常用指标来评估是否增加肾移植非糖尿病患者血浆置换或透析的风险,可早期评估、早期防治。局限性在于仅针对单中心数据进行回顾性研究,论证力度有限,需多中心数据或开展随机对照研究进一步证实本研究结论。
综上所述,术后第8 天FPG≥7.8mmol/L 和CysC 是肾移植非糖尿病患者血浆置换或透析的独立风险因素,或将增加血浆置换或透析的风险。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明王乐:研究设计与实施、数据采集与分析、文章撰写、统计分析;陈颖力、张凯璐、张银福、杜瑞妮:采集数据;高巍:对文章的知识性内容作批评性审阅、获取研究经费、指导

