非小细胞肺癌组织中CLCA4的表达情况及与病理和预后的关系
吴媛媛 刘科 齐艳丽 童小华
1商洛市中心医院病理科,商洛 726000;2商洛市中心医院呼吸与危重症医学科,商洛 726000
非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌类型,占85%以上[1-3]。尽管近年来针对NSCLC的诊疗技术不断进步,但该疾病的发病率和病死率仍居高不下。因此,寻找新的治疗靶点和标志物对于NSCLC 的诊疗及预后评估至关重要。钙激活的氯离子通道A 4(calcium-activated chloride channel regulator 4,CLCA4)是一种离子通道调节蛋白,在人体中广泛分布,并参与多种生理过程[4]。CLCA4 可通过调节磷脂酰肌醇3-激酶/蛋白激酶B 信号通路(PI3K/AKT)、Janus 激酶2/信号转导与转录激活子3(JAK2/STAT3)等肿瘤细胞增殖的信号途径,介导结直肠癌的病理改变[5-6]。而PI3K/AKT、JAK2/STAT3 等肿瘤信号作为NSCLC 病理进展的关键信号途径,部分学者认为CLCA4的表达与NSCLC 的病理进展及预后存在关联[4]。然而,目前对于CLCA4 在NSCLC 中的作用和机制研究资料有限,能否成为NSCLC 新的治疗靶点尚待验证[5]。基于此,本文旨在探讨CLCA4 在NSCLC 组织中的表达情况,并研究其与病理及预后的关系,为NSCLC 的诊疗及预后评估提供新的思路和策略。
资料与方法
1.一般资料
前瞻性选取商洛市中心医院2019年4月至2022年4月收治的106 例NSCLC 患者进行研究。(1)纳入标准:①符合肺癌的临床诊断[7],术前经病理穿刺活检确诊;②符合手术指征,均行NSCLC根治性切除术,术后留存病理组织送常规病理。美国麻醉师医学会分级I~Ⅱ级;③TNM 分期Ⅱ~ⅢA 期;④卡氏健康评分>65 分;⑤年龄>18 岁;⑥患者家属均签署知情同意书。(2)排除标准:①转移癌;②NSCLC 复发;③肝、肾功能衰竭;④合并其他呼吸道急性感染;⑤心脑血管急症治疗期;⑥妊娠期、哺乳期女性;⑦病历资料缺失或不接受随访。
本研究通过商洛市中心医院医学伦理委员会批准(伦理编号:2019-001)。
2.研究方法
术后收集患者的临床资料,采用实时荧光定量逆转录聚合酶链反应(qRT-PCR)检测癌组织及癌旁正常组织中CLCA4的表达情况。
2.1.资料收集 人口学资料包括性别、年龄、体质量指数(BMI)、吸烟、肺癌家族史;病理资料包括组织类型、分化程度、肿瘤大小、TNM分期、淋巴结转移。
2.2.CLCA4 阳性表达检测 采用免疫组化法检测病理组织中CLCA4 阳性表达情况。采用半定量评分法判定结果:染色强度分为无染色、弱染色、中等强度染色、强染色,对应评分依次记为0分、1分、2分、3分;染色数量分为阳性细胞占比<5%、5%~25%、>25%~75%、>75%~100%,对应评分依次记为0分、1分、2分、3分。染色强度和染色数量得分之和≥2分判定为阳性(阳性细胞占比<5%直接记为阴性。)
2.3.CLCA4 表达检测方法 病理标本置于RNAlater 保护液中,-80 ℃冷冻保存,检测前离心去除保护剂。将组织标本置于液氮中研磨成粉,依次提取总RNA、逆转录成cDNA,-20 ℃冷冻保存,预备PCR扩增。PCR反应体系20 μl,反应条件:95 ℃预变性10 min、变性15 s、60 ℃退火1 min、延伸温度68 ℃,40个循环。取3个样本复孔的均值,以CT值为基础,采用2-△△CT法计算CLCA4 mRNA的相对表达量。
2.4.随访及分组 所有患者术后采用门诊复查、电话随访等方法跟踪随访12 个月,观察无病生存期(disease-free survival,DFS)情况。
3.统计学方法
数据处理采用SPSS 24统计学软件,计数资料以构成比或率(%)表示,采用χ2检验;符合正态分布的计量资料以均数±标准差()表示,采用t检验。P<0.05 表示差异有统计学意义。影响因素的分析采用多因素logistic逐步回归模型,生存曲线Kaplan-Meier 分析与对数秩检验,绘制受试者操作特征曲线(receiver operating characteristic curve,ROC)评估预测效能。
结果
1.CLCA4表达(表1)
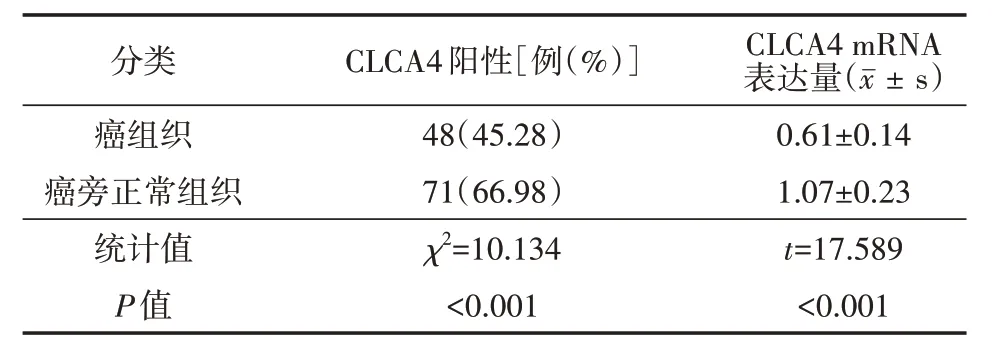
表1 106例非小细胞肺癌患者癌组织、癌旁正常组织中CLCA4表达分析
癌组织中CLCA4 阳性率及CLCA4 mRNA 的相对表达量均低于癌旁正常组织(均P<0.05)。
2.不同病理分期患者的CLCA4表达
42 例Ⅱ期患者的CLCA4 mRNA 表达量为(0.69±0.15),64 例ⅢA 期患者的CLCA4 mRNA 表达量为(0.61±0.13),差异有统计学意义(t=2.914,P=0.004)。
3.不同预后组患者的临床资料比较(表2)
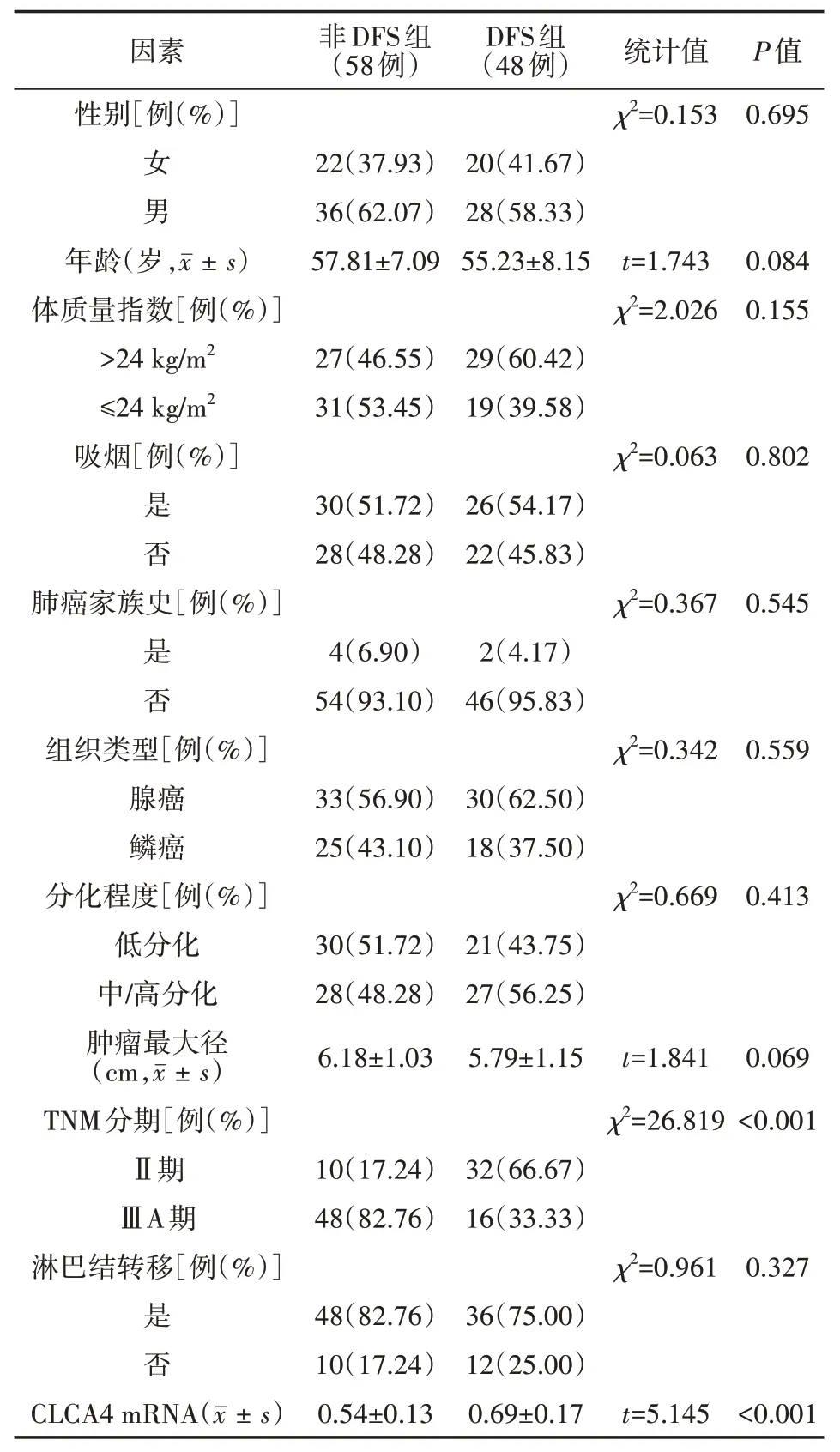
表2 不同预后非小细胞肺癌患者的临床资料比较
106例患者均正常随访12个月,其中非DFS组58例,DFS组48例。两组患者的性别、年龄、BMI、吸烟、肺癌家族史、组织类型、分化程度、肿瘤大小、淋巴结转移比较,差异均无统计学意义(均P>0.05);非DFS组中ⅢA期患者例数高于DFS组(P<0.05),CLCA4 mRNA表达量低于DFS组(P<0.05)。
4.预后影响因素分析(表3)

表3 106例非小细胞肺癌患者预后的影响因素分析
以NSCLC 患者死亡为因变量(是=1,否=0),logistic 回归分析得出,TNM 分期(OR=4.031,95%CI1.429~11.364,P=0.003)、CLCA4 mRNA 表达量(OR=0.310,95%CI0.109~0.873,P=0.003)均是NSCLC患者DFS的影响因素。
5.预测效能分析(图1)
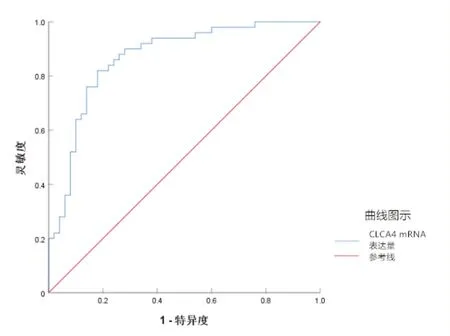
图1 CLCA4 mRNA预测106例非小细胞肺癌患者DFS的ROC
ROC 分析得出,CLCA4 mRNA 预测NSCLC 患者DFS 的最佳截断值为0.60,灵敏度为0.802(95%CI0.715~0.893)、特异度为0.809(95%CI0.721~0.904)、曲线下面积(area under the curve,AUC)为0.857(95%CI0.782~0.935)。
6.生存预后分析(图2)
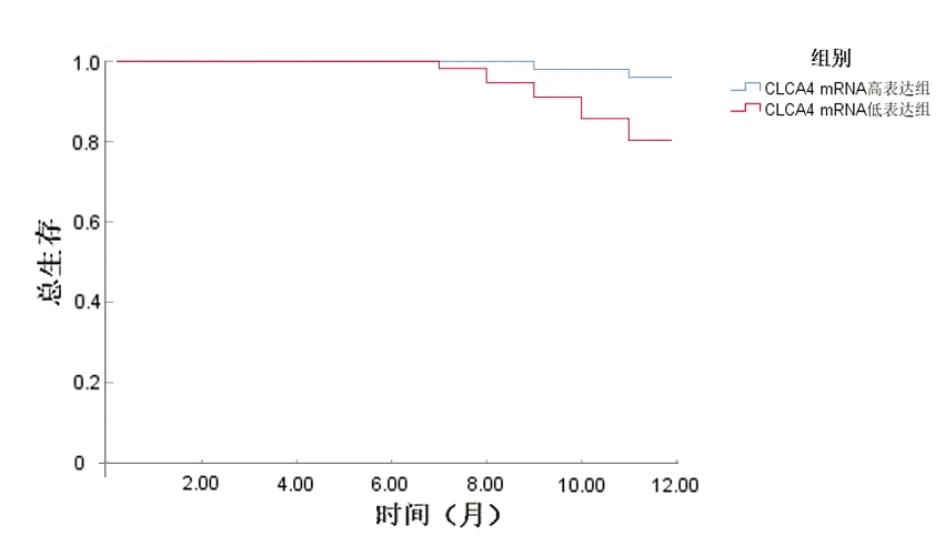
图2 不同CLCA4 mRNA 表达水平的非小细胞肺癌患者的DFS曲线比较
基于5.中CLCA4 mRNA 预测NSCLC 患者DFS 的最佳截断值,将患者分为CLCA4 mRNA高表达组和低表达组,其中CLCA4 mRNA 高表达组50 例,死亡2 例;低表达组56 例,死亡11 例。两组患者的生存曲线比较,差异有统计学意义(Log-rankχ2=6.006,P=0.014)。
讨论
NSCLC 作为全球生存率最低的实体瘤,基因蛋白的异常表达与肿瘤细胞增殖、浸润及转移密切相关[8-11]。根据全球癌症2020 年数据报道[12],肺癌是导致癌症相关死亡的主要原因,我国约30%的癌因死亡与肺癌有关,且发病率及病死率一直呈现升高趋势。近几年随着靶向[表皮生长因子受体-酪氨酸激酶抑制剂、间变性淋巴瘤激酶(ALK)融合基因、C-ros原癌基因1酪氨酸激酶(ROS1)融合基因等]、免疫[程序性死亡受体1(PD-1)、程序性死亡受体配体1(PD-L1)、细胞毒性T 淋巴细胞相关抗原4(CTLA-4)抑制剂等)]等生物疗法不断取得突破,肺癌患者的生存效果显著改善,但5 年总生存率仅保持在20%,且晚期NSCLC 患者的预后更差[13-15]。因此,针对NSCLC 新型诊疗靶点的探索一直是临床医学者研究的重点。
本研究尝试探究CLCA4 在NSCLC 组织中的表达情况以及与病理和预后的关系,结果表明,与癌旁正常组织比较,癌组织中CLCA4 mRNA 的相对表达量更低,且随着NSCLC 患者的病理进展,CLCA4 表达量呈降低趋势。与Li和Huang[6]、陈慧莉等[16]报道的CLCA4 在结直肠癌、乳腺癌中的表达均被抑制一致。Horaira等[17]研究提出,在癌组织中CLCA4基因甲基化改变可导致其表达水平下降。因此,本研究分析NSCLC 组织中DNA 甲基化改变是导致CLCA4 表达降低的原因之一,CLCA4 mRNA 表达量与NSCLC 患者的DFS预后相关,且在NSCLC 患者DFS预测中效能表现良好。同时,CLCA4 mRNA 高表达组与低表达组生存曲线存在差异,进一步证实CLCA4 表达的变化与NSCLC 的病理进展及预后密切相关。JAK2/STAT3 信号通路被广泛认为是与肿瘤细胞增殖密切相关的一条信号通路,JAK2/STAT3 信号通路的活化可诱导靶向基因的转录及翻译,促进肿瘤细胞的增殖、生长和转移[18-21]。早期研究表明,JAK2/STAT3 信号通路可通过介导干扰素-γ、白细胞介素-10 等细胞因子激活JAK2酪氨酸激酶,从而使其磷酸化并激活STAT3转录因子[22-23]。激活的STAT3可通过转录调控启动子区域的结合,诱导靶基因(如cyclin D1、c-myc、Bcl-2等)的转录和翻译,从而促进细胞周期的进程[24-26]。在肝癌、乳腺癌、肺癌等[27-28]多种恶性肿瘤中都存在JAK2/STAT3 的异常激活。Xiong 等[29]发现CircRPPH1 通过PI3K/AKT 和JAK2/STAT3 信号通路促进NSCLC 细胞的增殖、迁移和侵袭。在NSCLC 的治疗中可通过阻断JAK2/STAT3信号通路和抑制msi2 细胞活性抑制肿瘤细胞的增殖和转移[30]。而蒋可心等[31]研究发现,CLCA4对JAK2/STAT3信号通路具有抑制作用,且该信号途径可抑制肿瘤细胞的增殖、迁移及侵袭。因此,CLCA4 与JAK2/STAT3信号通路的相互作用,同样是影响NSCLC病理进展及预后的关键。后续临床实践可通过检测NSCLC癌组织中CLCA4 的变化,辅助诊断或评估NSCLC 患者的病理状态,且可能成为后续治疗NSCLC的新型靶点。
综上,NSCLC 患者癌组织中CLCA4 表达被抑制,且与病理进展及DFS 预后有关。但鉴于本研究纳入样本量有限,后续仍需完善多中心、大样本随机对照研究,证实本研究结论。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明吴媛媛:酝酿和设计试验,实施研究,采集数据,分析/解释数据,文章撰写,统计分析,获取研究经费,行政、技术或材料支持,指导,支持性贡献;刘科、齐艳丽:采集数据,对文章的知识性内容作批评性审阅,统计分析,支持性贡献;童小华:酝酿和设计试验,分析/解释数据,对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导

