响应面优化硒化白及多糖的制备工艺及其体外抗氧化活性研究
涂玲飞,李 焱,*,张 振
(1.贵州大学药学院,贵州贵阳 550025;2.贵州省分析测试研究院,贵州贵阳 550014)
白及(Bletilla striata(Thunb.) Reichb.f.)是兰科(Orchidaceae)白及属(Bletilla)多年生草本植物,植株高18~60 cm,披针形叶片,假鳞茎呈白色,具有很强的环境适性,主要分布在贵州、广西、四川和云南等地[1]。白及多糖是白及块茎中最主要的活性成分,随着科学技术和研究方法的发展,许多研究者通过相关实验表明白及多糖具有抗氧化、抗炎、抗肿瘤、免疫调节、止血及胃肠黏膜保护等作用[2]。现已广泛应用于医药[3]、食品[4]及日化领域[5]。
硒是人和动物体所必需的一种微量元素,它在维持机体正常功能和健康方面起着重要作用,具有抗菌、抗氧化及调节免疫力等功能[6]。但硒不能由机体自主合成只能从体外吸收,因此对于人和动物而言,为避免缺硒导致各种疾病的产生,补充一定量的硒元素尤为重要。其中,硒多糖是一种将无机硒与多糖结合形成的新型功能性多糖,目前研究的硒多糖主要有天然硒多糖和人工合成硒多糖[7]。许多研究表明,与无机硒和多糖相比,硒多糖具有更好的生物活性[8]。如通过硒化修饰可以显著增强五味子多糖的抗氧化活性,硒化五味子多糖可以显著保护肝细胞免受H2O2的侵害[9];罗敏等[10]通过使用酸作为催化剂制备的硒化米胚多糖,具有较好体内抗氧化活性以及较好的DPPH、羟自由基、以及超氧阴离子清除作用。此外,与传统的硒补充剂相比,含硒成分的硒多糖具有毒性更低、生物利用度更高、控释增加等特点[11]。因此,硒多糖成为近年来人们关注的研究课题。
白及多糖作为白及的主要活性成分之一,对其进行化学修饰也成为了研究热点,但利用无机硒对其进行硒化修饰的文章未见报道。因此,本文通过单因素实验,以白及多糖和亚硒酸钠为原料,硒化多糖的硒含量为指标,考察亚硒酸钠、冰乙酸的用量以及反应时间、反应温度对硒含量的影响,并利用响应面优化法优化硒化多糖的制备工艺。再以最优工艺制备硒化白及多糖,对比硒化前后白及多糖体外抗氧化活性的差异性,为进一步研究白及多糖及硒多糖在医药、食品及日化领域的应用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
紫花白及鳞茎 产自贵州省遵义市湄潭县白及基地;亚硒酸钠 上海泰坦科技股份有限公司;冰乙酸、无水乙醇 天津市富宇精细化工有限公司;硝酸、盐酸 成都市科隆化学品有限公司;硫酸亚铁上海皓鸿生物医药科技有限公司;水杨酸钠 国药集团化学试剂有限公司;邻苯二胺 上海麦克林生化科技有限公司;乙二胺四乙酸二钠 天津市科密欧化学试剂有限公司;ABTS 北京索莱宝科技有限公司;DPPH 合肥巴斯夫生物科技有限公司;氨水 重庆江川化工集团有限公司;甲苯 成都金山化学试剂有限公司;以上所用试剂均为分析纯;透析袋(MD44-5M,截留分子量:3500 Da) 北京兰杰柯科技有限公司。
HH-4 恒温水浴锅 常州澳华仪器有限公司;FD-1A-50 冷冻干燥机 北京博医康实验仪器有限公司;101-OAB 电热鼓风干燥箱、DK-98-Ⅱ电子万用炉天津市泰斯特仪器有限公司;UH5300 紫外可见分光光度计 天津冠泽科技有限公司;ReadMax 1500 光吸收全波长酶标仪 上海闪普生物科技有限公司;Nicolet iS5 傅里叶变换红外光谱 美国赛默飞;TLE 204E/02 电子天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 硒化白及多糖的制备 按照课题组前期通过响应面优化提取工艺所得的最佳提取条件提取白及多糖,命名为BSP[12],利用苯酚-硫酸法测得BSP 的总糖含量为59.78%±1.20%。参考李晓娇等[13]的方法,稍作修改,准确称取一定量的BSP 粉末于锥形瓶中溶解,再按比例加入一定量的冰乙酸和亚硒酸钠,充分搅拌,置于恒温水浴锅中反应一段时间,将反应液转移至3500 Da 透析袋中,使用蒸馏水透析,每隔2 h 更换一次蒸馏水,每次更换蒸馏水前取少量透析液加入抗坏血酸等待5 min,直到透析液不再变为红色,达到去除盐类等小分子杂质以及未与多糖结合的游离硒的目的,透析即可结束。将反应液转移至烧杯并加入6 倍无水乙醇于4 ℃下醇析过夜,抽滤,干燥,即得硒化白及多糖,命名为BSP-Se。
1.2.2 硒含量的测定 采用邻苯二胺法测定硒含量[14],参考李丽彩等[15]、李世杰[16]的方法,稍作修改。配制硒含量为200 μg/mL 的标准溶液精密吸取0、0.2、0.4、0.6、0.8、1.0、1.2 mL 标准溶液置于20 mL 棕色容量瓶中,先加水补至10 mL 左右,再加入2 mL 质量浓度5%的EDTA-2Na 溶液和2 mL质量浓度2%的邻苯二胺溶液,调pH 至2 左右,定容,保持pH 在2 左右。将其置于暗处反应1 h,加入5 mL 甲苯振荡萃取,收集上层有机溶液,测定各标准反应溶液在334 nm 处的吸光度值[17]。以硒质量浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,所得方程为y=0.099x+0.0615,R2=0.9908。
精密称取20 mg 多糖,加入2 mL 浓硝酸加热消解,冷却,加入6 mol/L 的盐酸5 mL,继续加热蒸发使液体减少至1 mL 左右,停止加热,冷却反应液,将反应液倒入20 mL 棕色容量瓶中,再用水冲洗并转移至容量瓶,后续步骤同标准曲线绘制方法,空白样品以同样方法操作。根据吸光值在硒标准曲线得相应浓度,按下式计算样品中硒含量(mg/g)。同时结合制备过程中亚硒酸钠的加入量和制得样品中硒含量可得硒回收率。
式中:C 为所测得硒质量浓度,μg/mL;V 为待测样溶液体积,mL;M 为待测多糖质量,g;m1为所得BSP-Se 含硒量,g;m0为BSP 含硒量,g;m 为加入的亚硒酸钠含硒量,g。
1.2.3 单因素实验条件的确定 以硒含量和硒回收率为指标,按照1.2.1 硒化白及多糖的制备方法,分别考察亚硒酸钠、冰乙酸与BSP 的用量比以及反应时间、反应温度对制备的BSP-Se 硒含量和硒回收率的影响。固定BSP 质量为0.2 g、反应温度80 ℃、反应时间为8 h、冰乙酸:BSP=3,分别考察Na2SeO3与BSP 的用量比为0.5、1.0、1.5、2.0、2.5、3.0 时对BSP-Se 硒含量和硒回收率的影响;固定BSP 质量为0.2 g、反应温度80 ℃、反应时间为8 h、Na2SeO3与BSP 的质量比为1.5,分别考察冰乙酸与BSP 的用量比为1、2、3、4、5、6 时对BSP-Se 硒含量和硒回收率的影响;固定BSP 质量为0.2 g、反应温度80 ℃、Na2SeO3与BSP 的质量比为1.5、冰乙酸:BSP=3,分别考察反应时间2、4、6、8、10、12 h 对BSP-Se 硒含量和硒回收率的影响;固定BSP 质量为0.2 g、反应时间6 h、Na2SeO3与BSP 的质量比为1.5,冰乙酸:BSP=3,分别考察反应温度50、60、70、80、90 ℃对硒化多糖硒含量和硒回收率的影响。
1.2.4 响应面优化设计 本实验利用Design-Expert 8.0.6 软件根据Box-Behnken 响应曲面设计原理[18],在单因素实验的基础上固定反应时间为6 h,以BSP-Se 的硒含量为响应值,Na2SeO3与BSP 的质量比、冰乙酸与BSP 的用量比、反应温度为响应因子,对白及多糖的硒化工艺进行三因素三水平的响应优化设计。响应面试验设计因素与水平见表1。

表1 响应面试验设计因素和水平Table 1 Factors and levels in the response surface experimental design
1.2.5 红外光谱分析 将BSP 和BSP-Se 进行干燥处理,利用KBr 压片法对其进行压片制样,样品在红外光谱上在500~4000 cm-1范围扫描。
1.2.6 清除DPPH 自由基能力的测定 参考王自凡等[19]、高洁等[20]的方法,稍作修改。以80%的乙醇为溶剂配制吸光度约为0.7 左右的DPPH-乙醇溶液并用去离子水配制0.2、0.4、0.6、0.8、1.0 mg/mL 各样品溶液。取不同浓度的样品液各1.0 mL,加入0.5 mL 的DPPH-乙醇溶液,混合均匀,避光反应30 min 后,精确吸取200 μL 于96 孔板,使用酶标仪在517 nm 波长下测定吸光度,记为A1;用相应量的80%的乙醇溶液代替多糖样品溶液测定吸光度,记为A0;0.5 mL80%的乙醇代替DPPH-乙醇溶液的吸光度,记为A2;以相同浓度梯度的VC为阳性对照品。DPPH 自由基清除率计算公式如下:
1.2.7 清除ABTS+自由基能力的测定 参考Chen等[21]的方法配制吸光度约为0.7 的ABTS 溶液,各样品溶液浓度与上述1.2.6 一致。取不同浓度的样品溶液各1.0 mL,加入2.0 mL ABTS 溶液混合均匀后,避光反应6 min,精确吸取200 μL 于96 孔板,使用酶标仪在734 nm 波长下测定吸光值,记为A1;以1.0 mL 蒸馏水代替1.0 mL 多糖样品溶液测定空白对照吸光度,记为A0;2 mL 蒸馏水代替2 mL ABTS溶液的吸光度,记为A2;以相同浓度梯度的VC为阳性对照品。ABTS+自由基清除率计算公式如下:
1.2.8 清除羟自由基(·OH)能力的测定 参考王自凡等[19]的方法配制1.5 mmol/L 的FeSO4溶液、6 mmol/L 的H2O2溶液、20 mmol/L 的水杨酸溶液,各样品溶液浓度与上述1.2.6 一致。取不同浓度的样品溶液各1 mL,分别加入1.5 mLFeSO4溶液、0.5 mL H2O2溶液、0.5 mL 水杨酸溶液,37 ℃水浴培养1 h,精确吸取200 μL 于96 孔板,使用酶标仪在529 nm 测混合物的吸光度,记为A1;用1 mL 蒸馏水代替多糖样品溶液测定吸光度,记为A0;0.5 mL 80%的乙醇溶液代替水杨酸钠的吸光度记为A2;以相同浓度梯度的VC为阳性对照品。羟自由基清除率计算公式如下:
1.3 数据处理
使用Excel 2010 对实验数据进行录用和计算,实验数据均为3 次独立重复实验结果的平均值±标准差表示,SPSS 18.0 软件进行单因素方差分析,P<0.05 为差异显著,并用Originpro 2019b 软件作图。
2 结果与分析
2.1 单因素实验
2.1.1 Na2SeO3与BSP 的质量比对BSP-Se 硒含量和硒回收率的影响 按照单因素条件中的方法考察Na2SeO3与BSP 的质量比对BSP-Se 硒含量和硒回收率的影响,结果如图1 所示,当Na2SeO3与BSP的质量比在0.5~1.5 时,随着质量比的增加,BSPSe 的硒含量也随之增加,质量比为1.5 时,硒含量达到最高值,继续增大Na2SeO3的用量,硒含量随着质量比的增加而呈现下降趋势,这可能是因为当硒含量达到最高值时,结合位点达到饱和,随着Na2SeO3的增加,过量的硒竞争多糖中的结合位点,导致与多糖结合不足,进而降低了多糖中的硒含量[22]。硒回收率随着Na2SeO3的增大而减小,是因为加入的Na2SeO3越来越多但能与多糖结合的硒却只是小部分,其余未能结合的硒均被过滤掉,导致硒回收率显著性减小,考虑到可以充分提高硒化白及多糖中硒元素的含量,故选择Na2SeO3与BSP 的质量比为1.5 时为最佳用量比。

图1 Na2SeO3 与BSP 的质量比对BSP-Se 硒含量和硒回收率的影响Fig.1 Effect of the mass ratio of Na2SeO3 to BSP on selenium content and selenium recovery of BSP-Se
2.1.2 冰乙酸的用量对BSP-Se 硒含量和硒回收率的影响 冰乙酸的用量对BSP-Se 硒含量的影响如图2 所示,从图中可以看出,随着冰乙酸用量的增加,硒含量和硒回收率呈现先增加后减小的趋势,在冰乙酸与BSP 的用量比为3 时,硒含量和硒回收率均达到最大值,说明此时为最佳酸性条件,酸水解使多糖中相应的活性基团暴露出来并与硒结合,起到了很好的催化作用。而冰乙酸与BSP 用量比低于3 时,酸性过低起不到最佳的催化作用,硒与多糖未能充分结合。但当用量比高于3 时,硒含量、硒回收率开始降低,可能是因为反应体系的酸度过高,使BSP 降解,破坏了多糖结构,不利于硒化反应的进行[23]。所以选择硒含量和硒回收率最大值时(冰乙酸:BSP=3)为最佳硒化条件。
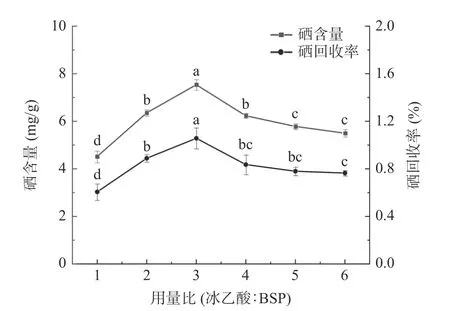
图2 冰乙酸的用量对BSP-Se 硒含量和硒回收率的影响Fig.2 Effect of amount of glacial acetic acid on selenium content and selenium recovery of BSP-Se
2.1.3 反应时间对BSP-Se 硒含量和硒回收率的影响 反应时间对BSP-Se 硒含量及硒回收率的影响如图3 所示,从图中可以看出,在开始的2~6 h 时,随着时间的延长,硒含量和硒回收率的增加较为明显,当反应时间为6 h 时,硒含量达到最大值。硒含量在2 h 时为2.38±0.24 mg/g,较6 h 时的7.89±0.27 mg/g低很多,可能是因为时间太短,反应不充分,未达到硒与多糖结合饱和点,导致硒与多糖不能充分的结合在一起。当反应时间超过6 h 之后,硒含量和硒回收率逐渐降低,可能是因为样品在80 ℃以及酸性条件下长时间反应,使多糖过度降解,导致与硒的结合位点遭到破坏,进而影响硒的结合,硒含量降低[24]。所以最佳反应时间为6 h,因6 h 与8 h 时的硒含量并没有较显著的变化(P>0.05),所以固定反应时间为6 h,不作为响应面优化参数。
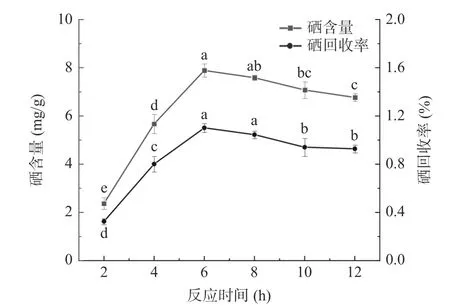
图3 反应时间对BSP-Se 硒含量和硒回收率的影响Fig.3 Effect of response time on selenium content andselenium recovery of BSP-Se
2.1.4 反应温度对BSP-Se 硒含量和硒回收率的影响 反应温度对BSP-Se 硒含量的影响如图4 所示,从图中可以看出当反应温度为50~80 ℃时随着反应温度的增大,BSP-Se 的硒含量和硒回收率也随之增大,可能是因为在高温的酸性条件下激活了反应的结合位点,使硒与多糖很好的结合,使硒含量和硒回收率增加。但继续增大反应温度,两者均开始出现减小的趋势,可能是因为过高的温度导致一部分多糖链开始断裂以及有机硒稳定性结构被破坏[17],使多糖与硒的结合减少,进而硒含量出现减小的趋势,所以选择80℃为最佳反应温度。

图4 反应温度对BSP-Se 硒含量和硒回收率的影响Fig.4 Effect of reaction temperature on selenium content and selenium recovery of BSP-Se
2.2 响应面试验结果与分析
2.2.1 回归模型建立及分析 根据响应面试验设计原理,按照表1 的设计进行三因素三水平的响应面试验,实验结果见表2。利用Design-Expert 8.0.6 软件,将表2 实验数据进行回归拟合,由回归分析结果可得,三因素对硒化白及多糖硒含量的影响拟合回归方程为:Y=7.86+0.05A-0.014B-0.027C+0.051AB-0.012AC+0.036BC-0.38A2-0.22B2-0.17C2。并对此设计的模型进行方差分析,结果见表3。试验所建立的模型复相关系数R2=0.9899,模型P<0.0001 为极显著,说明此模型有意义;失拟项P=0.4993>0.05,失拟项检验不显著,模型的拟合度良好;信噪比23.604>4,说明该模型可预测试验结果,而修正判定系数R2adj=0.9768,表示可以用此模型来预测97.68%的响应值,可信度高[17]。R2pred=0.9236 与R2adj=0.9768的值相差小于0.2,说明该响应面设计合理。模型中二次项A2、B2、C2和A 为极显著(P<0.01),AB 为显著(P<0.05),根据F值可知,各因素对硒化白及多糖的硒含量影响程度为:A(Na2SeO3:BSP)>C(反应温度)>B(冰乙酸:BSP)。综上所述,所建立的响应面模型用来优化BSP-Se 的最佳制备工艺条件是可行的。
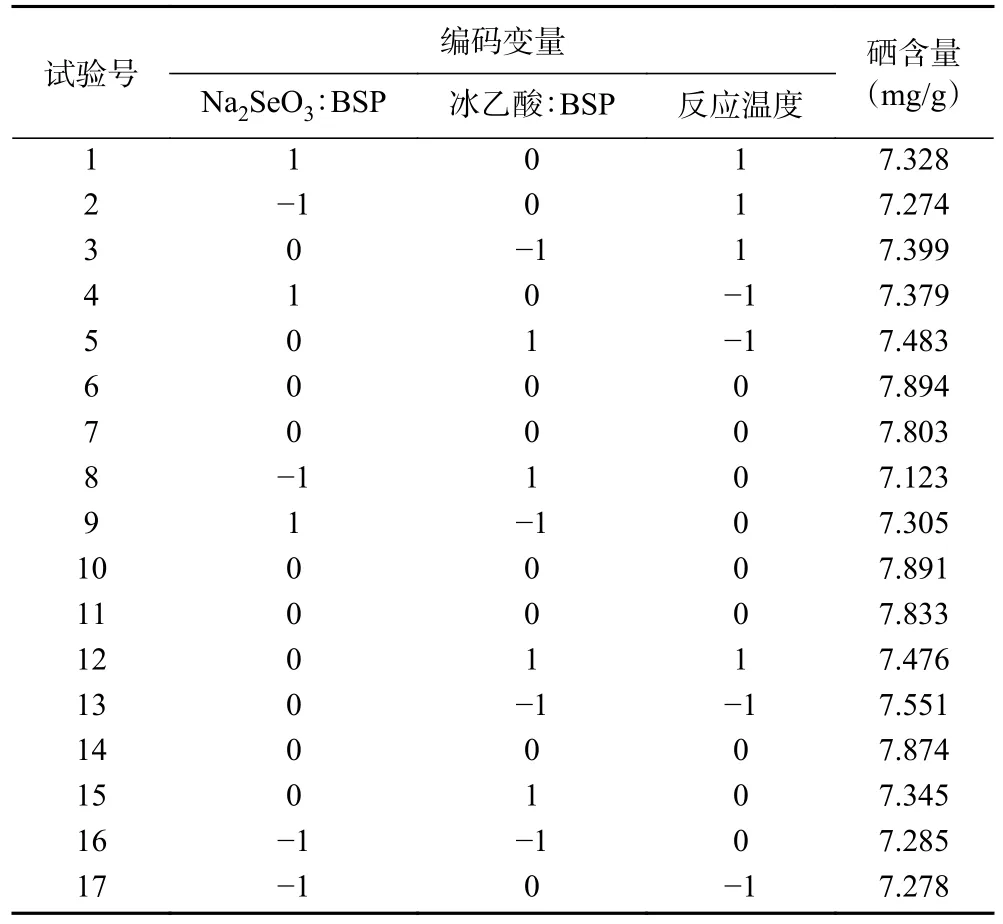
表2 BSP-Se 制备工艺响应面分析方案及结果Table 2 Response surface experimental design and results of BSP-Se

表3 方差分析Table 3 Variance analysis
2.2.2 响应面数学模型分析 用Design Expert 8.0软件对试验数据进行分析并绘制响应面图,得到图5~图7。各个因素之间的交互作用都对BSPSe 的硒含量存在相互影响,其影响程度可以通过响应面中的陡峭角度和等高线呈现的形状以及等高线的疏密、颜色变化反映出来[25]。
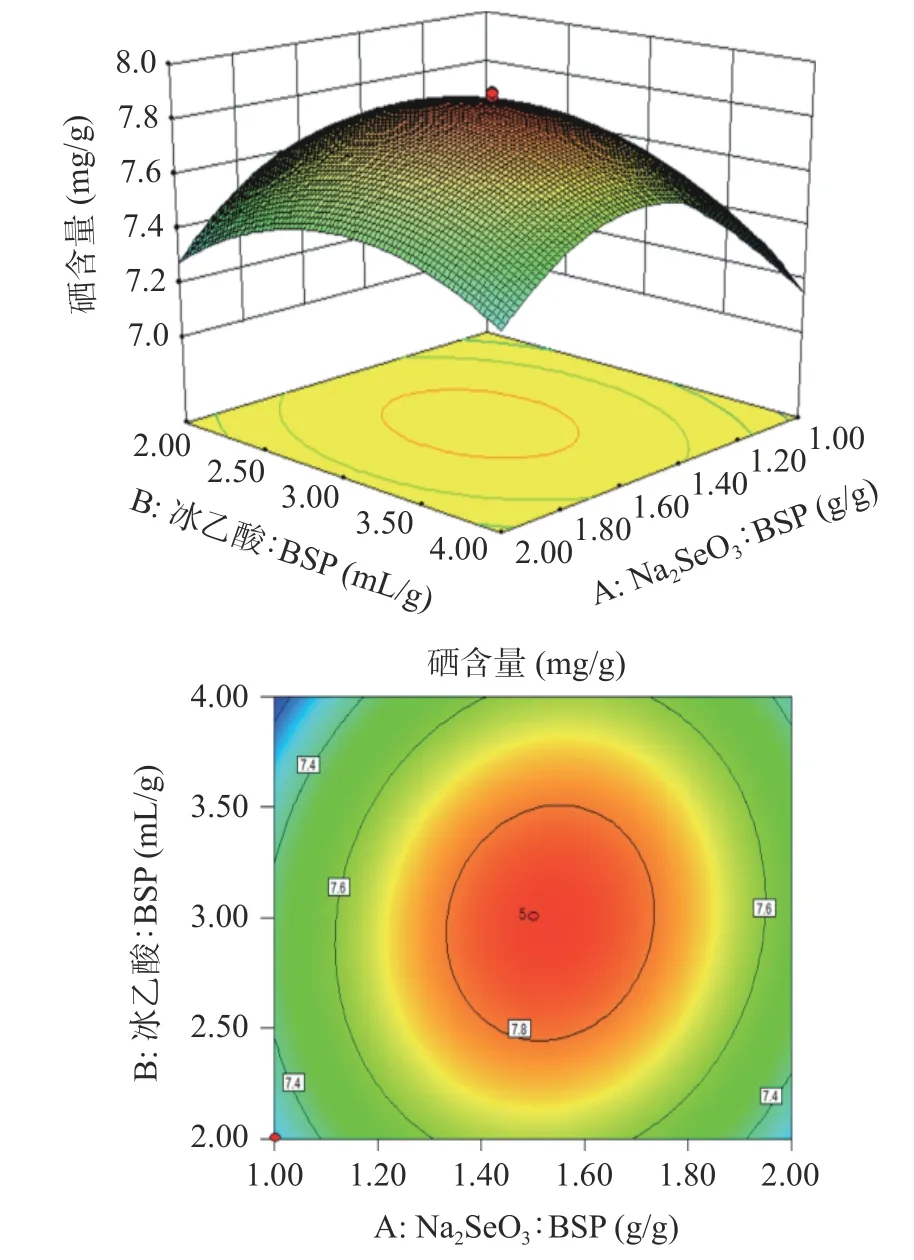
图5 Na2SeO3:BSP 和冰乙酸:BSP 对硒含量影响的响应面图Fig.5 Response surface of the effects of Na2SeO3:BSP and glacial acetic acid:BSP on selenium content
图5 中Na2SeO3:BSP 的陡峭度大于冰乙酸:BSP 的陡峭度,可以说明Na2SeO3:BSP 对硒含量的影响大于冰乙酸:BSP 对硒含量的影响,整体三维图倾斜面大,对应的等高线呈椭圆形,说明Na2SeO3:BSP 与冰乙酸:BSP 两者的交互作用对硒含量影响较大;图6 中Na2SeO3:BSP 的陡峭度大于反应温度的陡峭度,可以说明Na2SeO3:BSP 对硒含量的影响大于反应温度对硒含量的影响,对应等高线形状呈圆形,说明Na2SeO3:BSP 与反应温度的交互作用对硒含量影响不显著;图7 中两者的陡峭度大致一样,反应温度的陡峭度稍大于冰乙酸:BSP 的陡峭度,对应等高线形状呈椭圆形,说明冰乙酸:BSP 和反应时间的交互作用对硒含量的影响作用显著。相对于图7,图5 中等高线上数据及颜色变化较大,可判定AB的交互作用大于BC 的交互作用。综上所述,各因素对于BSP-Se 硒含量的影响顺序依次为:A(Na2SeO3:BSP)>C(反应温度)>B(冰乙酸:BSP),各因素交互作用对于BSP-Se 的硒含量影响顺序依次为:AB>BC>AC,与F值判断结果一致。
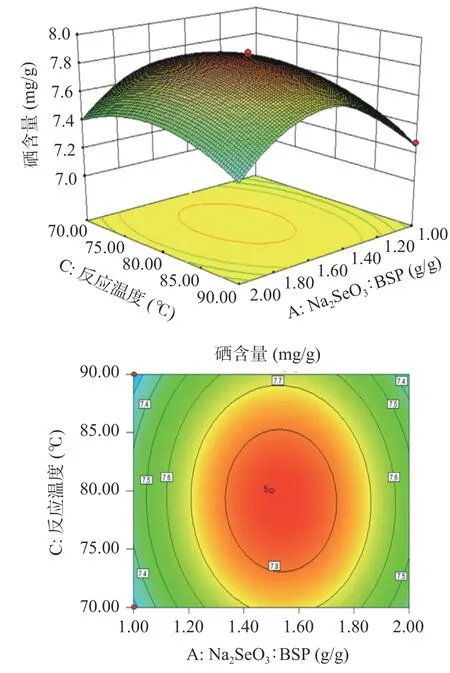
图6 Na2SeO3:BSP 和反应温度对硒含量影响的响应面图Fig.6 Response surface of the effects of Na2SeO3:BSP and reaction temperature on selenium content
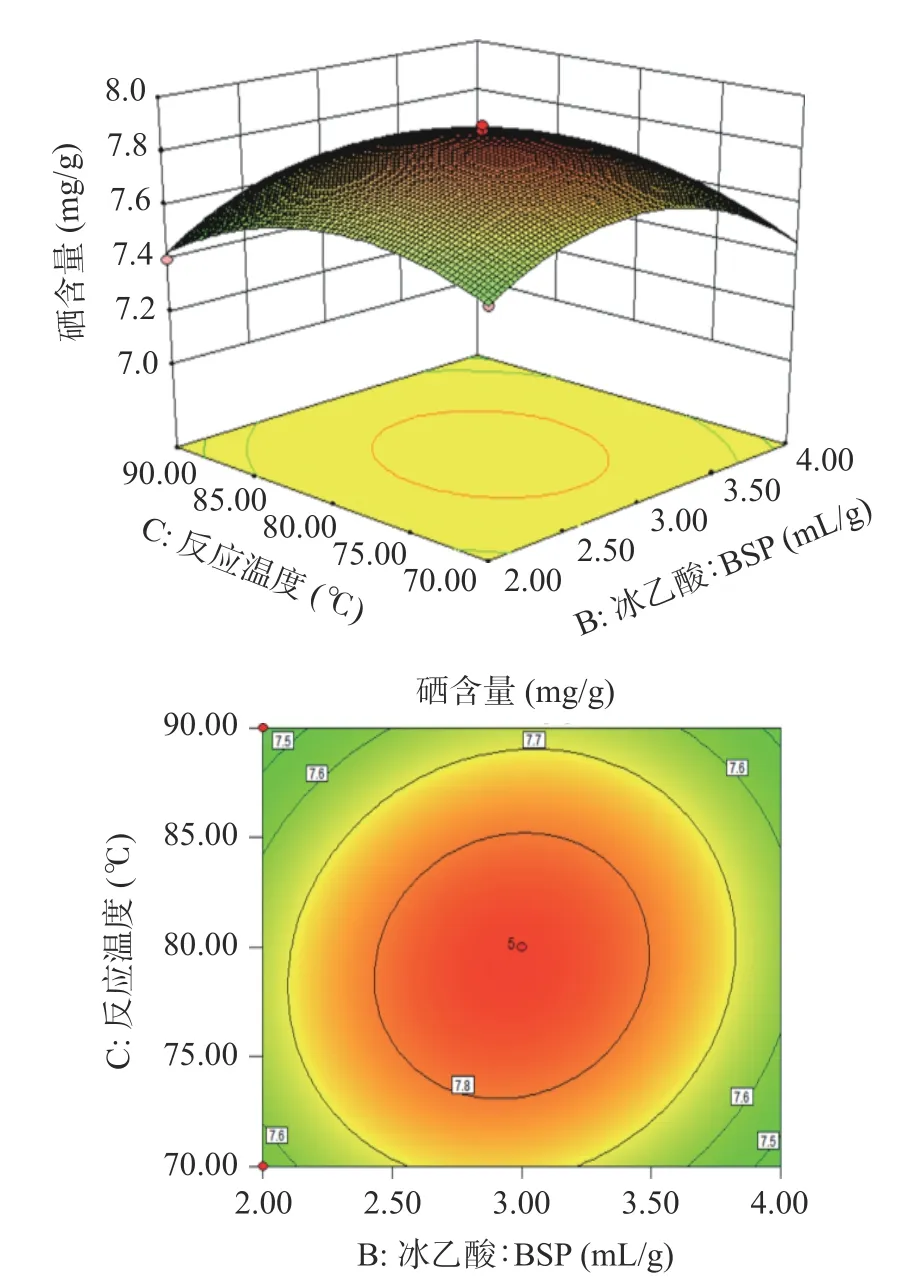
图7 冰乙酸:BSP 和反应温度对硒含量影响的响应面图Fig.7 Response surface of the effects of glacial acetic acid:BSP and reaction temperature on selenium content
2.2.3 模型验证 响应面数学模型得到硒化白及多糖的最佳制备工艺为:Na2SeO3:BSP=1.53、冰乙酸:BSP=2.97、反应温度为79.14 ℃。该条件下硒化白及多糖的硒含量为7.862 mg/g,考虑实验操作的可进行性,将工艺条件稍作调整,Na2SeO3:BSP=1.5、冰乙酸:BSP=3、反应温度为80 ℃,在此条件下进行实验,通过3 次工艺验证试验,最终得到硒化白及多糖的平均硒含量为7.831±0.11 mg/g,该结果与预测值相差0.031 mg/g,可以看出实际值和预测值相差较小,说明本次实验所做模型可以较好地反映硒化白及多糖的制备工艺,可以认为本次实验通过响应曲面法得到的各项硒化工艺的优化参数具有可靠性和准确性。
2.3 红外光谱结果与分析
傅里叶变换红外光谱可以用来判断多糖结构中糖环类型和官能团类型,因此也可用来判断硒化多糖结构的变化。BSP 和BSP-Se 的FT-IR 图谱如图8 所示,BSP 和BSP-Se 在3431、2927、1736、1375、1246、1061、875、809 cm-1等处均出现多糖典型的特征吸收峰,这些吸收峰与王自凡[26]的研究结果一致,表明硒化修饰并没有改变多糖的主体结构,而BSP-Se 分别在764 cm-1和601 cm-1处产生了新的特征吸收峰,相关研究表明在765 cm-1附近出现的峰为OSe-O 伸缩振动引起的特征峰[27],且Wang 等[28]研究发现硒化多糖与原多糖相比在609 cm-1处出现Se-O-C 键的新吸收峰,而这些特征吸收峰的出现表明多糖在硒化反应中成功修饰。综上所述,BSP-Se 红外光谱中601 cm-1处特征峰归因于Se-O-C 的不对称伸缩振动,764 cm-1处归因于O-Se-O 的不对称伸缩振动,表明BSP 在硒化反应中已成功修饰为BSP-Se。
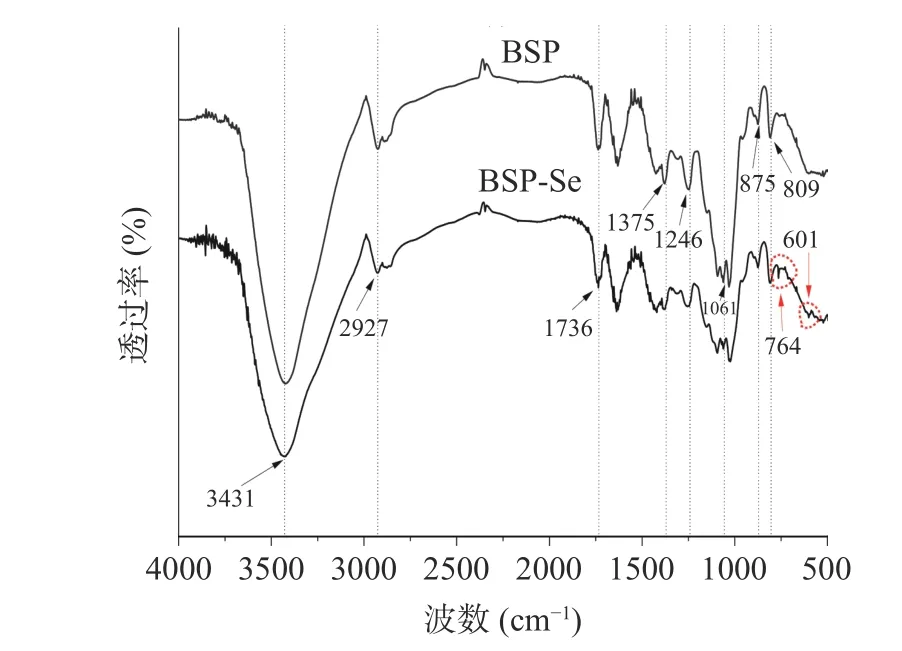
图8 BSP 和BSP-Se 的FT-IR 图Fig.8 FT-IR spectrogram of BSP and BSP-Se
2.4 体外抗氧化结果与分析
2.4.1 DPPH 自由基清除能力测定 Na2SeO3、BSP和BSP-Se 对DPPH 自由基清除能力如图9 所示。由结果可知,Na2SeO3、BSP 和BSP-Se 三者均对DPPH 自由基有一定的清除能力,且三者对自由基的清除能力均与其浓度大小呈正相关。随着浓度的增加,Na2SeO3的清除能力变化较小,而BSP 和BSPSe 随着浓度的增大,DPPH 自由基的清除率的增大比Na2SeO3明显。与Na2SeO3和BSP 相比,BSP-Se清除DPPH 自由基的能力最强,显著高于单独使用BSP 和Na2SeO3(P<0.05)。经计算,BSP 的IC50值为5.828 mg/mL,BSP-Se 的IC50值为2.875 mg/mL,BSP-Se 的IC50值几乎是BSP 的一半,说明通过硒化修饰在一定程度上增加了白及多糖清除DPPH 自由基的能力。多糖的抗氧化效果与其自身供氢能力有关,在本研究中,BSP-Se 中硒元素的存在可以激发阳极区的氢供体,使BSP-Se 表现出更强的供氢能力,因此,BSP-Se 的抗氧化作用比BSP 更强[29]。
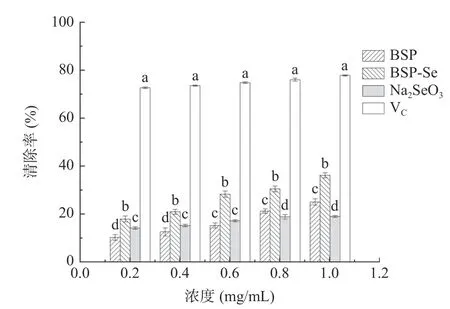
图9 硒化前、后DPPH 自由基清除能力对比Fig.9 Scavenging effect on DPPH free radicals before and after selenization
2.4.2 ABTS+自由基清除能力测定 Na2SeO3、BSP和BSP-Se 对ABTS+自由基的清除能力测定结果如图10 所示。由结果可知,Na2SeO3、BSP 和BSP-Se三者对ABTS+均具有一定的清除能力,且表现出剂量依赖关系。在小浓度范围为内(0.2~0.6 mg/mL),与Na2SeO3和BSP 相比,BSP-Se 清除ABTS+自由基的能力最强,但当浓度大于0.6 mg/mL 时,Na2SeO3对ABTS+自由基的清除能力明显增加,当浓度达到1.0 mg/mL 时,Na2SeO3对ABTS+自由基的清除能力接近于阳性对照VC,说明Na2SeO3本身就具有较强的ABTS+自由基清除能力;此浓度下,BSP 和BSP-Se 对ABTS+自由基的清除率分别为23.45%和36.41%,IC50值分别为8.475、4.431 mg/mL,由此可见,白及多糖与Na2SeO3结合后使其清除ABTS+自由基的能力明显增加。推测原因是多糖与硒元素结合产生的硒基团可以激活多糖链上的氢原子,增加多糖提供氢原子的能力,而这些氢原子能将更多的自由基转化为稳定的产物[30]。
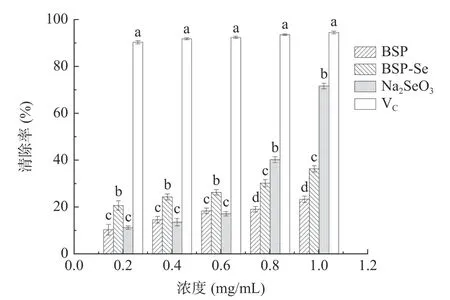
图10 硒化前、后ABTS+自由基清除能力对比Fig.10 Scavenging effect on ABTS+ free radicals before and after selenization
2.4.3 ·OH 清除能力测定 Na2SeO3、BSP 和BSPSe 对·OH 的清除能力测定如图11 所示,由图可知,Na2SeO3、BSP 和BSP-Se 三者对·OH 均具有较好的清除能力,且清除能力与其浓度大小呈正相关,即随着样品浓度的增加,清除率也随之增加。在同一浓度下,与BSP 和Na2SeO3相比,BSP-Se 对·OH 的清除能力显著增加(P<0.05)。当浓度达到1 mg/mL 时,对羟自由基的清除能力为Na2SeO3(47.55%)<BSP(52.51%)<BSP-Se(65.27%),BSP 和BSP-Se 的IC50值分别为0.833、0.314 mg/mL。可能是因为BSPSe 中的硒基团如亚硒酸酯能与自由基离子(如Fe2+)共轭,致使羟自由基的生成被抑制,同时多糖的羟基可以提供氢与羟基自由基结合,达到清除效果[31]。前者可有效抑制自由基生成,后者能清除自由基,产生协同作用,使得硒化白及多糖对·OH 的清除率增大[32]。由此可见,通过硒化修饰亦可增加白及多糖对·OH 的清除效果。
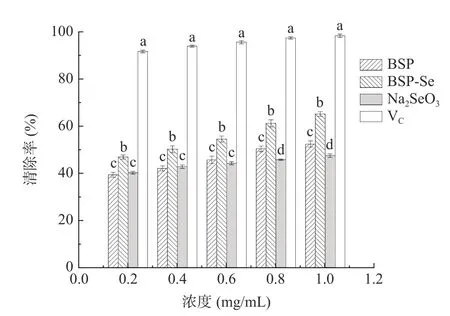
图11 硒化前、后·OH 清除能力对比Fig.11 Scavenging effect on ·OH before and after selenization
综上所述,以亚硒酸钠为原料,冰乙酸为催化剂对白及多糖进行硒化改性,硒化后的白及多糖相对于原白及多糖具有较高的清除DPPH、·OH 和ABTS+自由基的能力,且所有样品对自由基的清除能力都具有浓度依赖性,但所有样品对自由基的清除效果均显著低于VC。在相同浓度下,硒化后的白及多糖相对于原白及多糖表现出优异的抗氧化能力。相关研究表明多糖的抗氧化作用的强弱是由其供氢能力决定的,由红外光谱分析显示,硒化后的多糖中含有Se-O-C 和O-Se-O 等硒基团,而这些基团的存在可以激活异构碳中的氢原子,该基团的活化能力越高,氢原子供体能力越强,其清除自由基的能力就越强[33]。因此,硒化修饰使白及多糖与硒元素结合形成硒基团硒,进而激活多糖链上的氢原子,增加多糖提供氢原子的能力,使多糖清除自由基的能力增加。这与Yuan[34]、Huang 等[35]通过硒化修饰显著增加原多糖的抗氧化活性的研究结果一致。
3 结论
以白及多糖和亚硒酸钠为原料,利用冰乙酸为催化剂对白及多糖进行硒化修饰,通过单因素实验和响应面优化法获得了硒化白及多糖的最佳制备工艺为Na2SeO3与BSP 的用量比1.5,冰乙酸与BSP 的用量比为3.0,反应温度80 ℃,反应时间6 h,此条件下制备的MLP-Se 中硒含量高达7.831 mg/g,模型验证实验显示实际值与预测值误差仅为0.19,说明建立的响应面模型可靠。结合BSP 和BSP-Se 的红外光谱分析发现BSP-Se 在764、601 cm-1处产生新的特征峰,证明硒化产物结构中含有Se-O-C 和OSe-O 基团,说明白及多糖硒化成功。清除自由基能力试验结果表明,BSP 和BSP-Se 均具有一定的抗氧化能力,且BSP-Se 的抗氧化能力显著高于BSP,表明硒化修饰使白及多糖与硒元素结合形成硒基团,而这些基团的存在可以激活异构碳中的氢原子,增强多糖提供氢原子的能力,使多糖清除自由基的能力增加。因此,含硒多糖可作为潜在的硒膳食补充剂、抗氧化剂或营养保健品配方的成分。
本研究初步对比了硒化前后白及多糖体外抗氧化活性的差异性,显示硒化修饰显著增强了白及多糖的抗氧化能力,后续研究中可对硒化前后的白及多糖进行理化性质、结构表征等研究,探索硒化后是否改变其理化性质和结构,探究其抗氧化能力的增加是否与分子量、结构以及理化性质的改变有关。为进一步研究硒多糖作为新型抗氧化剂在食药领域、保健品领域、日化领域的应用提供一定的理论基础。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

