响应面法优化螺旋藻多糖提取及脱色工艺
吴世林,陈 冉,陈静芸,杨 宁,李 坤,章 真,*,张荣庆
(1.上海海洋大学水产与生命学院,上海 201306;2.浙江清华长三角研究院浙江省应用酶学重点实验室,浙江嘉兴 314000)
近些年来,螺旋藻被广泛应用在饲料、医药及食品等领域,因其富含丰富的蛋白质、维生素、多糖以及多种脂肪酸和矿物质等[1]。螺旋藻多糖(Spirulina platensispolysaccharides)是一种生理活性多糖,具有抗癌、抗氧化、免疫调节、抗炎、调节肠道微生物菌群等生物活性[2]。Rajasekar 等[3]研究表明,螺旋藻多糖具有强大的抗氧化活性,具有清除自由基的功效。Zhou 等[4]在探究螺旋藻多糖抑制镉诱导的小鼠损伤的机制时,发现螺旋藻多糖可以通过下调肝脏中肿瘤坏死因子-α(TNF-α)和干扰素-γ(IL-γ)来改善镉诱导的炎症相关疾病。与已知的抗癌药物阿霉素相比,螺旋藻多糖能够抑制胃癌细胞的增殖,提高巨噬细胞活性,并能抑制A549 肺癌细胞的生长[5]。Lu 等[6]发现螺旋藻多糖可以调节肺癌小鼠的肠道微生物区系,并推测螺旋藻多糖通过FcεRI 信号通路和花生四烯酸代谢抑制肺癌。
如何高效地从植物、动物及微生物中提取多糖,并最大程度保留其活性,是目前国内外研究的热点。目前,微藻多糖的提取多采用超声提取法、热水浸提法、微波辅助萃取法和酶法等[7]。超声波提取法,凭借时间快效率高,被广泛应用在多糖的提取过程中,但超声波在工作中容易使多糖结构发生变化,会影响到其提取率以及活性[8]。热水浸提法利用水的极性大的特点,对于细胞具有较强的穿透力,可以使胞内多糖溶解至水中,并且随着温度的升高,其溶解率也会相应增大[9];其缺点是耗时长,效率低,一些酸性多糖可能无法浸提完全,造成损失[10]。微波辅助萃取法利用微波中的能量将细胞壁破坏,促进细胞胞内多糖快速溶解进提取液中[11],但其使用条件受限,不适合大规模制备[12]。酶解法是利用纤维素酶作用微藻细胞壁,破坏其结构,使多糖成分溶解出[13]。酶解法提取效率高且具环境友好性,是一种高效绿色提取技术。但其成本较高,且酶保存条件苛刻[14]。
本研究采用热碱液法提取螺旋藻多糖,并对其提取条件行优化,热碱液法浸提多糖,弥补了热水浸提的缺点,可以使酸性多糖最大程度浸提出来,碱液对于细胞壁具有更强的穿透力。由于螺旋藻粗多糖含有大量色素,不利于后续纯化,因此需要对其进行脱色。近年来,使用较多的去除色素的方法是活性炭法[15]、柱色谱法[16]及过氧化氢法。过氧化氢是一种强氧化剂,能够有效地将多糖分子中的色素氧化分解,从而达到脱色的目的,过氧化氢在分解后产生水和氧气,不会对环境造成污染,具有无毒无害、操作简便、脱色高效等特点,因此本研究将对过氧化氢法脱色工艺进行响应面优化,以得到最佳脱色条件。
1 材料与方法
1.1 材料与仪器
螺旋藻干粉 陕西宝禾生物科技有限公司;浓硫酸 浙江中星化工试剂有限公司;苯酚 上海凌峰化学试剂有限公司;丙酮 北京索莱宝科技有限公司;30%过氧化氢 国药集团化学试剂有限公司;本实验其他所用试剂均为分析纯。
HH-3A 水浴锅 常州国华电器有限公司;RE 2000A 旋转蒸发仪 上海研承仪器有限公司;FD 1850 冷冻干燥机 北京博医康实验仪器有限公司;UV1800PC 分光光度计 上海菁华科技仪器有限公司;Sorvall LYNX 6000 离心机 Thermo Fisher。
1.2 实验方法
1.2.1 热碱浸提螺旋藻多糖单因素实验 技术路线[17]:取干藻粉2 g,乙醇脱脂,碱液浸提后4000 r/min离心10 min 弃去藻渣,然后使用3 倍体积无水乙醇沉淀过夜,4000 r/min 离心10 min 弃去上层溶液,沉淀经乙醚、丙酮及无水乙醇清洗数次,之后冷冻干燥,得到螺旋藻多糖,采用苯酚硫酸法测定多糖含量。
选择以下4 个因素:提取温度、时间、NaOH 质量分数和料液比。固定条件料液比1:20、提取温度80 ℃、提取时间3 h、NaOH 质量分数1.25%,通过改变单一条件分别取5 份考察料液比(1:10、1:20、1:30、1:40、1:50 g/mL)、提取温度(50、60、70、80、90 ℃)、提取时间(1、2、3、4、5 h)、NaOH 质量分数(0.5%、0.75%、1%、1.25%、1.5%)对提取螺旋藻多糖效果的影响。
1.2.2 响应面优化热碱浸提螺旋藻多糖工艺 分析比较单因素实验结果,最终确定NaOH 质量分数、提取时间和提取温度这3 个因素及其3 个水平,并通过Design Expert 13 进行3 因素3 水平的试验设计。表1 为试验的因子和等级。
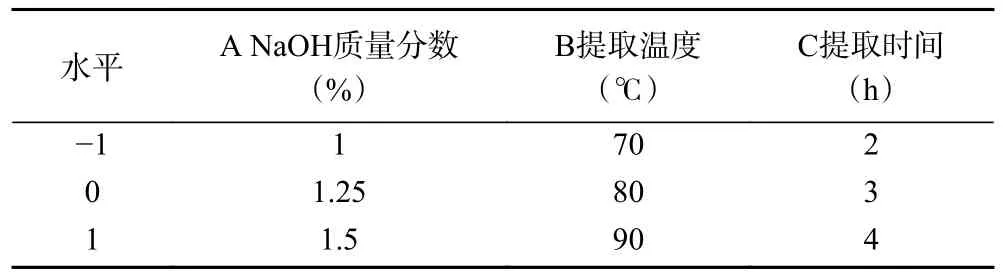
表1 试验因素及水平Table 1 Test factors and horizontal
1.2.3 过氧化氢法螺旋藻多糖脱色单因素实验 当碱性溶液的浓度较高时,会导致多糖水解,所以pH设定为8,用6 mol/L 氢氧化钠溶液进行调节。每个处理设定为10 mL,固定过氧化氢添加量15%,脱色时间60 min,脱色温度50 ℃,改变单一的实验条件:过氧化氢添加量(5%、10%、15%、20%、25%)、脱色时间(20、40、60、80、100 min)以及脱色温度(30、40、50、60、70 ℃),用脱色率来反映不同条件的脱色效果。
1.2.4 响应面试验优化过氧化氢法螺旋藻多糖脱色工艺 比较分析单因素实验结果,确定脱色时间、脱色温度和过氧化氢添加量这3 个因素,并确定各因素的3 个水平,根据常见方法Box-Behnken,设计3 因素3 水平的试验。表2 中显示了试验的因子和水平。
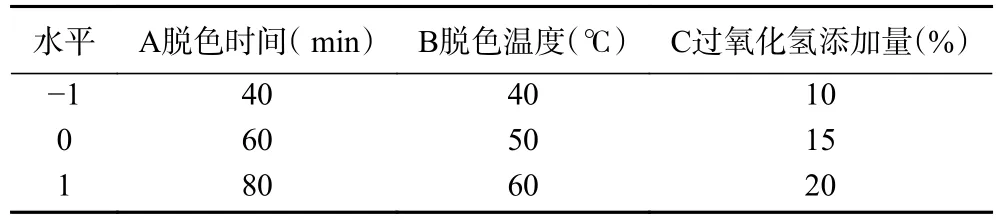
表2 试验因素及水平Table 2 Test factors and horizontal
1.2.5 多糖含量的测定 采用苯酚硫酸法,将标准葡萄糖干燥后,准确称取0.025 g,使用纯水配制成0.1 mg/mL 的标准葡萄糖溶液。在试管中分别准确吸取标准葡萄糖溶液0、0.1、0.2、0.3、0.4、0.6、0.8、0.9 mL,并用蒸馏水补齐至1.0 mL。再分别加入0.5 mL 6%苯酚溶液和2.5 mL 的浓硫酸,摇匀,室温下反应30 min。以第一管为空白对照,测定各管溶液490 nm 下的吸光度(A490),应用Origin 2022 制作葡萄糖浓度(y)-A490(x)标准曲线,并计算线性回归方程[18]。最终得到葡萄糖标准曲线方程为:y=17.166x+0.002,R2=0.996。
1.2.6 得率的测定与计算 将经过热碱法提取得到的螺旋藻多糖提取液,利用苯酚硫酸法测出其含量,利用公式(1)计算出螺旋藻多糖得率。
式中:C 为多糖浓度(mg/mL);V 为待测液定容体积(mL);N 为稀释倍数;M 为螺旋藻干粉质量(mg)。
1.2.7 多糖保留率的测定与计算 脱色前后的多糖含量使用苯酚硫酸法进行测定,然后带入公式(2)进行多糖保留率的计算。
式中:M1为脱色后多糖总量;M2为脱色前多糖总量。
1.2.8 脱色率的测定与计算 取3 mg/mL 螺旋藻粗多糖溶液,450 nm 波长条件下,分别测定并记录脱色处理前后的吸光值。多糖溶液脱色率由公式(3)计算。
1.3 数据处理
本次实验所得到的数据均为3 个重复,利用Origin 2022 和Excel 2019 软件对数据进行处理、统计计算和差异显著性分析,利用Design Expert 13 软件对响应面试验设计和结果进行分析。
2 结果与分析
2.1 热碱浸提螺旋藻多糖单因素实验结果
2.1.1 料液比对螺旋藻多糖得率的影响 合适的料液比,可以显著提高螺旋藻多糖的得率[19]。如图1所示,随着料液比中提取溶剂比例的逐渐增加,螺旋藻多糖的得率曲线呈现先快速增加,然后趋于平缓的趋势,当料液比超过1:20 g/mL 时,得率增长较慢,螺旋藻多糖得到充分提取。提高提取液的比重,对于多糖的充分溶出起促进作用,同时有利于提高后续除蛋白流程中多糖的保留率。而随着水量的增多,会相应地增加后续工艺的能耗及试验成本[20],因此选择料液比为1:20 g/mL,作为后续试验条件。
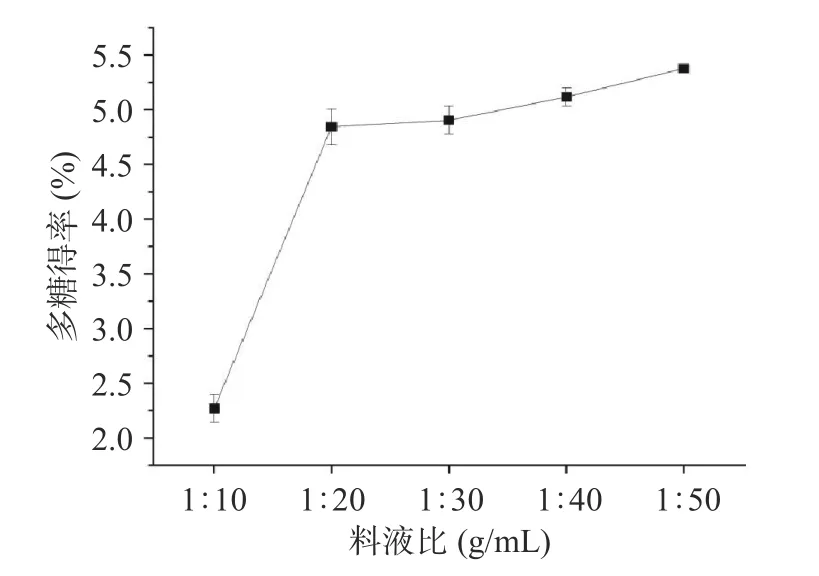
图1 料液比对螺旋藻多糖得率的影响Fig.1 Effect of material-liquid ratio on the yield of polysaccharides from Spirulina platensis
2.1.2 提取温度对螺旋藻多糖得率的影响 如图2所示,温度在50~80 ℃范围内,随着温度升高,多糖得率迅速增加;温度在80~90 ℃范围内,螺旋藻多糖的得率差异不显著,推测螺旋藻中多糖已经充分溶解在提取液里。升温促进分子运动,促进多糖分子溶出细胞,并增大溶解度[21],但是升高水温的同时,导致能耗的增加,提高了提取成本。因此,综合考虑,将温度70、80、90 ℃作为后续响应面试验3 水平。

图2 提取温度对螺旋藻多糖得率的影响Fig.2 Effect of extraction temperature on the yield of polysaccharides from Spirulina platensis
2.1.3 提取时间对螺旋藻多糖得率的影响 图3 为不同提取时间对螺旋藻多糖得率的影响曲线图。从图3 中可以发现,提取时间在1~3 h,随着时间的推移,螺旋藻多糖的得率快速提高,反应时间短,多糖溶出不充分,因此时间越长,得率会越高,当时间达到3 h 时,多糖提取接近完全,此后增加时长,得率变化并不明显。蛋白质变性和多糖水解同时在进行,延长提取时长,将导致多糖结构发生改变以及成本的增加[22]。因此,将提取时间2、3、4 h 作为后续响应面试验3 水平。

图3 提取时间对螺旋藻多糖得率的影响Fig.3 Effect of extraction time on the yield of polysaccharides from Spirulina platensis
2.1.4 NaOH 质量分数对螺旋藻多糖得率的影响图4 为不同NaOH 质量分数对螺旋藻多糖得率的影响曲线图。在碱性环境下,螺旋藻细胞壁容易被破坏,有利于加快细胞内多糖及细胞壁中多糖的溶出[23]。从图4 可以看出,螺旋藻多糖的得率,随着NaOH 质量分数升高,呈现出逐渐增加的趋势。过高的碱液质量分数会阻碍得率的进一步提高,过高的pH 会使多糖发生水解,并且会使蛋白质发生变性包裹部分多糖成为沉淀[24]。因此当碱液的质量分数达到一定值以后,增速缓慢,可能和蛋白变性,包裹多糖沉淀有关。因此,选择NaOH 质量分数1%、1.25%、1.5%作为后续响应面试验3 水平。
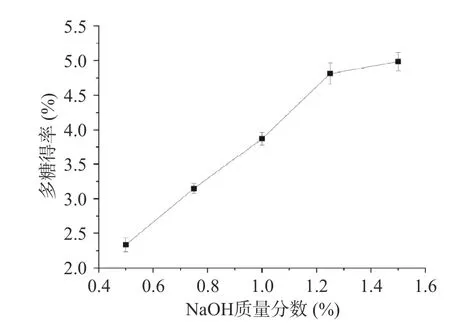
图4 NaOH 质量分数对螺旋藻多糖得率的影响Fig.4 Effect of NaOH concentration on the yield of polysaccharides from Spirulina platensis
2.2 响应面试验分析
2.2.1 响应面分析试验设计与结果 根据单因素实验结果,将NaOH 质量分数(A)、提取温度(B)、提取时间 (C) 3 个因素设为自变量,螺旋藻多糖得率设为因变量,用Box-Behnken 设计法进行3 因素3 水平的响应面优化试验,试验设计与结果见表3。

表3 响应面分析试验设计及结果Table 3 Response surface analysis test design and results
2.2.2 模型的建立及显著性分析 利用Design Expert 13 软件对表3 中的数据进行多元回归拟合、方差分析和显著性检验,得到以响应值多糖得率Y 对各条件的编码值的二次多项式回归方程为:
Y=5.8+0.13A+0.67B+0.14C-0.098AB-0.013AC-0.0025BC-0.56A2-0.52B2-0.48C2
由表4 所示,该模型的F值是149.74,P值小于0.0001,表示该模型极显著。失拟项的P值是0.2077>0.05,不显著;该回归方程的总决定系数R2=0.9948,调整决定系数R2=0.9882,说明建立的回归方程拟合的可行度高,能够很好地对螺旋藻多糖得率进行预测[25]。A、B、C、交互项BC 及三个平方项(A2、B2、C2)对螺旋藻多糖得率的影响达到了极显著的效果(P<0.01),而交互项AB 项对螺旋藻多糖得率的影响有显著效果(P<0.05),其他项不显著。
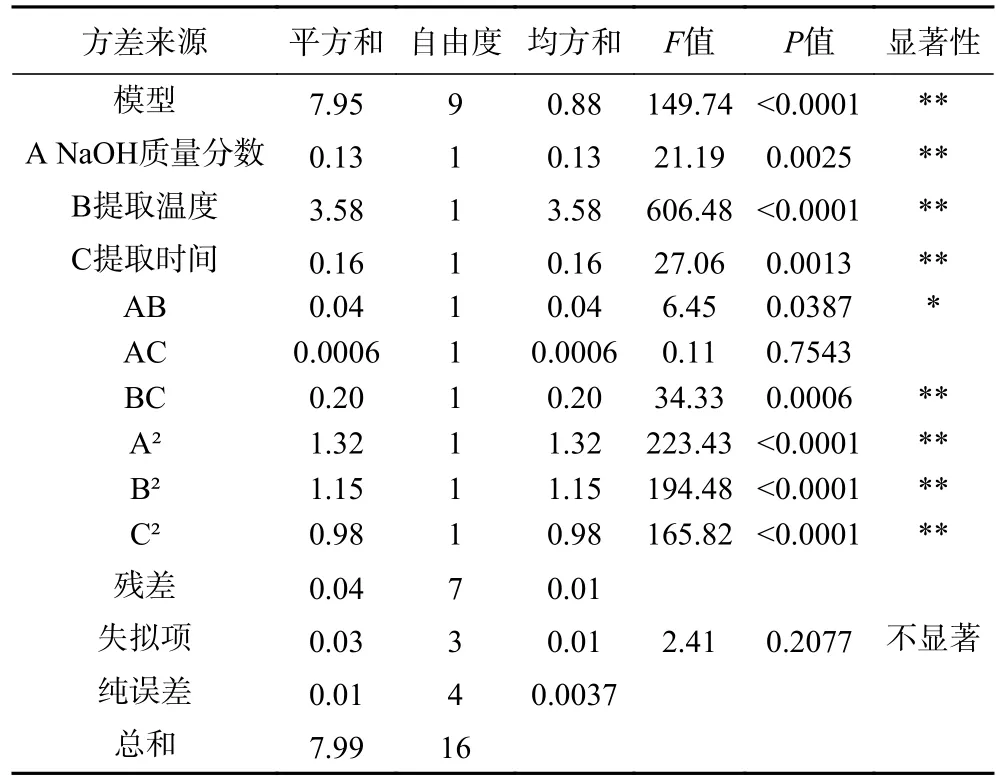
表4 响应面设计试验方差分析及回归系数显著性检验Table 4 Analysis of variance and significance test of regression coefficient in response surface design test
由方差分析结果可以比较出各因素对螺旋藻多糖得率影响力的大小关系:提取温度>提取时间>NaOH 质量分数。由图5 可知,控制提取温度不变时,随着碱液NaOH 质量分数的增加,螺旋藻多糖的得率曲线呈现先迅速增加,后逐渐趋于平缓,在高浓度NaOH 的条件下,得率出现下降的趋势。因为藻细胞在碱性环境下,细胞壁容易发生破裂,细胞内以及细胞壁中的水溶性多糖进而溶解进提取液中,同时螺旋藻酸性多糖更容易溶出,但是,多糖水解也同时在进行,高碱液溶液多糖还会出现脱酯和β-消去反应[26]。图6 显示了NaOH 质量分数和提取时间对螺旋藻多糖得率的影响,图中响应面描绘了不同NaOH质量分数和提取时间下螺旋藻多糖得率的变化趋势。图7 展示了提取温度和提取时间对螺旋藻多糖得率的影响,图中的响应面展示了不同提取温度和提取时间下螺旋藻多糖得率的变化情况,提取温度和提取时间二者交互作用达到极显著水平。通过该模型的预测,螺旋藻多糖提取工艺最佳参数:NaOH 质量分数1.46%、提取温度为90 ℃与提取时间3.79 h,多糖得率5.25%。
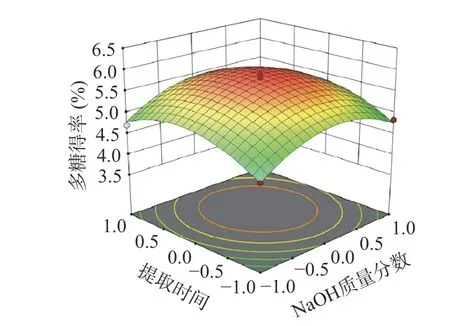
图6 NaOH 质量分数与提取时间对螺旋藻多糖得率的影响Fig.6 Effect of NaOH concentration and extraction time on the yield of polysaccharides from Spirulina platensis

图7 提取温度与提取时间对螺旋藻多糖得率的影响Fig.7 Effect of extraction temperature and time on the yield of polysaccharides from Spirulina platensis
2.2.3 验证实验 根据以上所做的单因素实验和多因素试验的响应面分析得到螺旋藻多糖热碱液提取的最优提取工艺条件,即NaOH 质量分数1.5%、提取温度为90 ℃、提取时间4 h 及料液比1:20 g/mL进行实验,平行3 组实验,得到螺旋藻多糖得率为5.18%±0.23%,与模型预测基本一致,说明该模型能够较好地预测多糖得率。
2.3 过氧化氢法螺旋藻多糖脱色单因素实验结果
2.3.1 过氧化氢添加量对脱色率的影响 根据图8分析发现,随着过氧化氢溶液添加量的增加,粗多糖溶液中色素的脱色率曲线呈现先快后慢的增加趋势;过氧化氢与色素分子发生反应,因此随着过氧化氢添加量的增加,色素分子与过氧化氢反应更充分,直至色素分子被氧化完全[27]。在过氧化氢添加量为25%时,色素分子已基本被氧化,且其脱色率相对于20%时变化不显著。鉴于多糖水解、降解、成本等问题,故选择10%、15%和20%这3 个水平进行后续响应面试验。
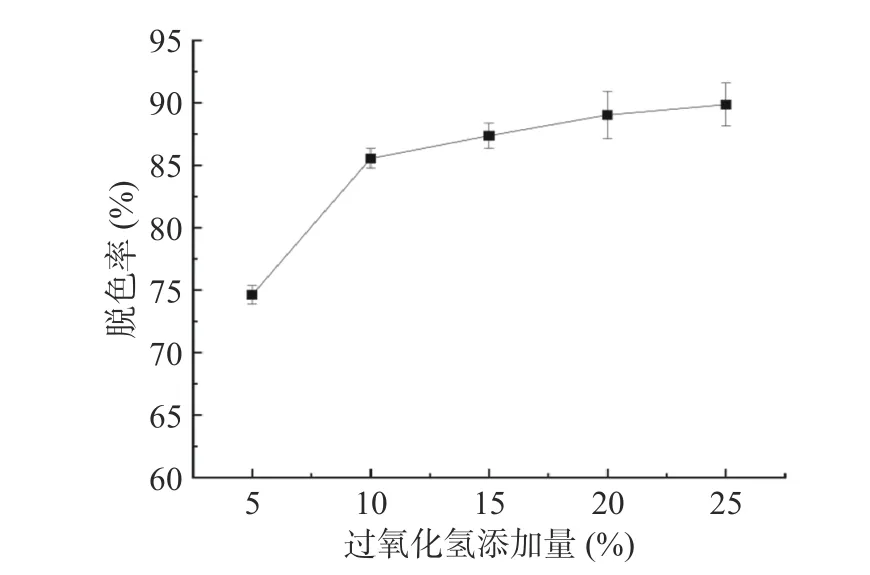
图8 过氧化氢溶液添加量对脱色率的影响Fig.8 Effect of addition amount of hydrogen peroxide solution on decolorization rate
2.3.2 脱色时间对脱色率的影响 根据图9 分析发现,当脱色时间在20~40 min 时间段内,随着时间的增加,螺旋藻多糖的脱色率增速相对于后段较快;脱色时间进行到40 min 后,螺旋藻多糖的脱色率增速较慢,且80 min 和100 min 时二者的脱色率差异并不显著。推测多糖色素分子不断地与过氧化氢发生反应,达到一定时间后,色素分子已经充分反应,进而脱色率增加也相对缓慢[28],因此,选择40、60 和80 min 这3 个水平进行响应面优化试验。
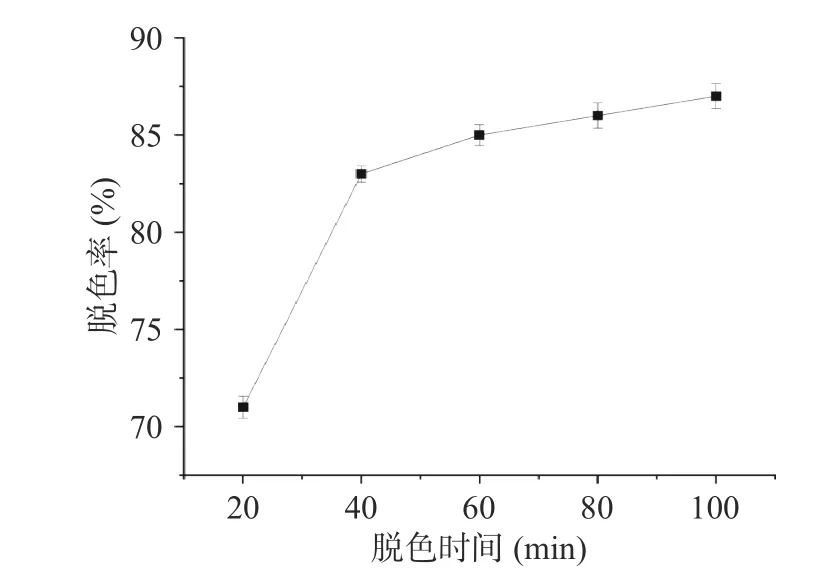
图9 脱色时间对脱色率的影响Fig.9 Effect of decolorization time on decolorization rate
2.3.3 脱色温度对脱色率的影响 根据图10 分析发现,随着脱色温度的逐渐升高,过氧化氢法脱除螺旋藻多糖溶液中色素曲线增长幅度较大,超过50 ℃后,脱色率增长幅度逐渐减小,并且过氧化氢在60 ℃与70 ℃时的多糖脱色率无显著差异。这是由于温度过高时,过氧化氢分解过快[29],失去氧化能力。因此,从能源损耗和多糖损失方面考虑,选择40、50和60 ℃这3 个水平进行响应面优化试验。

图10 脱色温度对脱色率的影响Fig.10 Effect of decolorization temperature on decolorization rate
2.4 响应面优化脱色工艺结果
按照表2 的设计因素,运用Design-Expert 设计软件,对脱色工艺展开了试验设计,进行了测试,并获得了以下的试验结果,响应面试验的结果如表5 所示,方差分析如表6 所示。
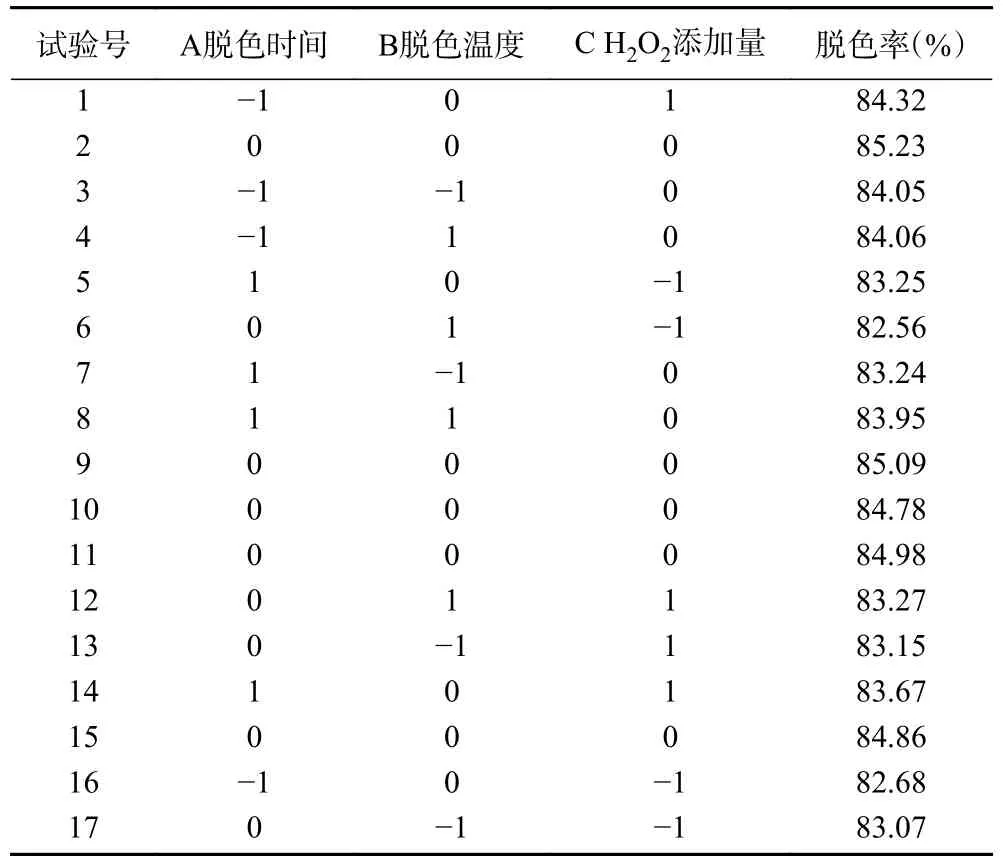
表5 响应面分析试验设计及结果Table 5 Response surface analysis test design and results
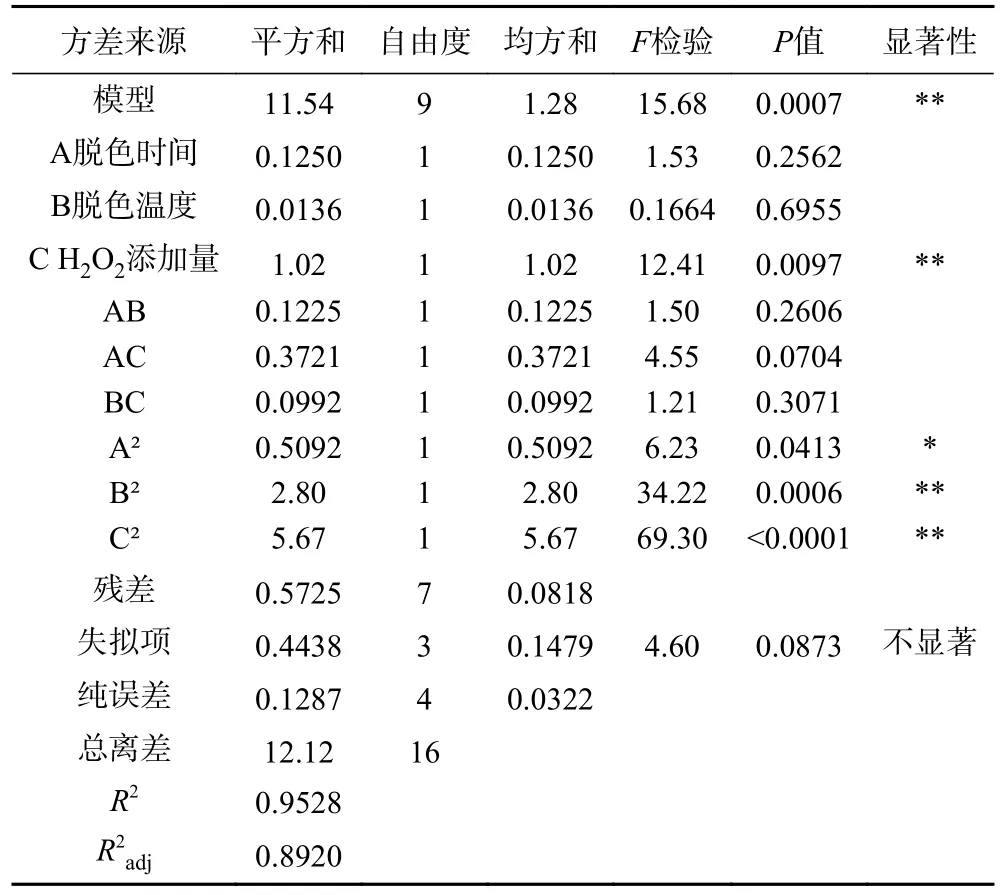
表6 响应面设计试验方差分析及回归系数显著性检验Table 6 Analysis of variance and significance test of regression coefficient in response surface design test
利用Design-Expert 软件对表5 数据进行多元回归拟合,得到螺旋藻多糖脱色率(Y)对脱色时间(A)、脱色温度(B)和过氧化氢添加量(C)的二次多项式回归模型:
Y=84.99-0.1250A+0.0413B+0.03562C+0.1750AB-0.3050AC+0.1575BC-0.3478A2-0.8153B2-1.16C2
根据表6 可知该模型的F值是15.68,P值小于0.0001,表示该模型极显著,失拟项的P值为0.0873>0.05,差异不显著,R2=0.9528,表明该模型选择合理,可以对螺旋藻多糖脱色率进行预测。其中,一次项过氧化氢添加量对响应值的影响极显著(P=0.0097<0.01),由F值可以分析得到单因素的影响大小,从高到低是:过氧化氢添加量>脱色时间>脱色温度;二次项A2对响应值的影响达到显著水平(P<0.05),B2、C2对响应值的影响达到极显著水平(P<0.01)。
2.4.1 响应曲面分析 响应面图曲面的倾斜度随着两因素之间交互作用的变化而变化[30],交互作用越强,则其倾斜度越大[31]。由图11 可知:保持脱色温度不变化的情况下,当时间增加时,螺旋藻多糖的脱色率曲线呈现逐渐增加而后逐渐下降;控制脱色时间不变时,温度逐渐增加,螺旋藻多糖的脱色率曲线呈现先增后减的趋势。由图12 可知:控制过氧化氢的添加量保持不变时,随着时间的增加,螺旋藻多糖的脱色率曲线呈现先增后减的趋势。
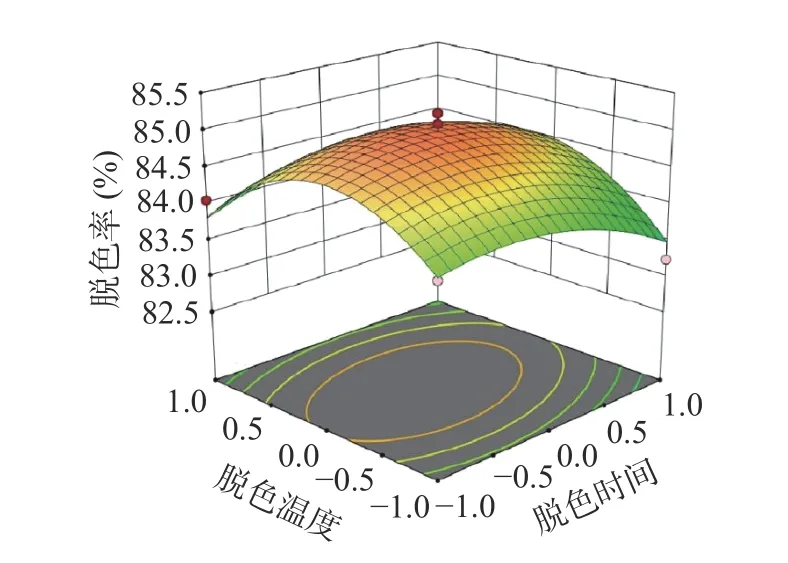
图11 脱色时间和脱色温度对螺旋藻多糖脱色率的影响Fig.11 Effect of decolorization time and decolorization temperature on decolorization rate of polysaccharides from Spirulina platensis
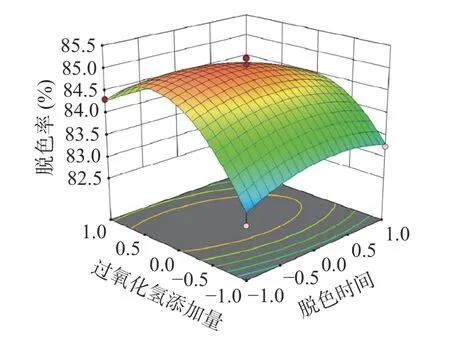
图12 脱色时间和过氧化氢添加量对螺旋藻多糖脱色率的影响Fig.12 Effect of decolorization time and hydrogen peroxide addition on decolorization rate of polysaccharides from Spirulina platensis
由图13 可知:控制过氧化氢添加量不发生变化时,螺旋藻多糖脱色率曲线随着脱色温度的升高,呈现先增后减的趋势,温度达到一定值后,脱色率开始显著下降;当脱色温度一定时,随着过氧化氢添加量的增加,螺旋藻多糖脱色率逐渐增加,过氧化氢添加量达到一定值后,脱色率开始缓慢下降。
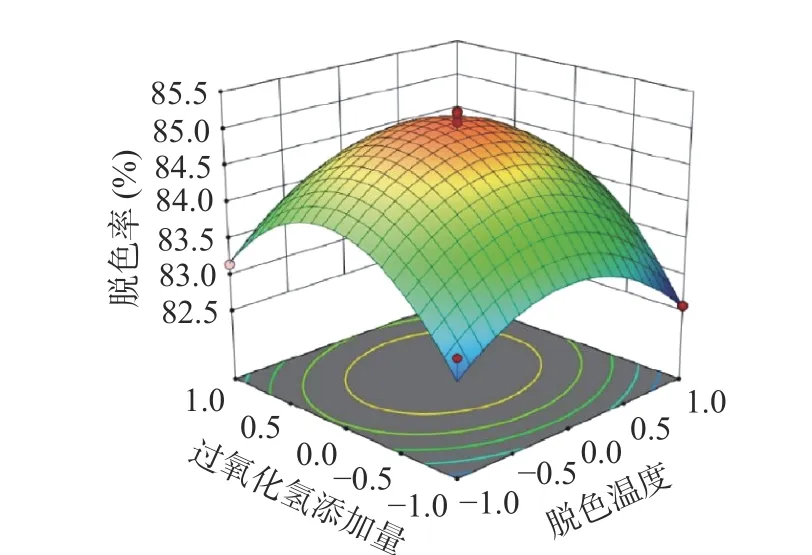
图13 脱色温度和过氧化氢添加量对螺旋藻多糖脱色率的影响Fig.13 Effect of decolorization temperature and hydrogen peroxide addition on decolorization rate of polysaccharides from Spirulina platensis
采用响应面试验优化过氧化氢法,预测得到最佳脱色工艺:过氧化氢溶液的添加量为16.88%、脱色时间为54.82 min、脱色温度为50.31 ℃,色素脱除率是83.04%。进一步验证所预测结果的准确性,将上述参数修改为:过氧化氢溶液添加量为17%,脱色时间为55 min,脱色温度为50 ℃,得到的实际脱色率为82.54%±0.03%,多糖保留率83.45%±0.13%。实验结果实际脱色率与模型预测相符,因此,基于响应面法所得的优化脱色工艺参数准确可靠。
螺旋藻由于其含多糖比例低,得率不高,严重限制了其制备及应用,因此提高其得率,除杂除色素十分必要[32]。目前,多糖的提取及脱色的方法有很多种,每一种方法都有着不同的特点。刘玉环等[33]采用内部沸腾法优化螺旋藻多糖的提取工艺,得到最佳提取条件为:40%乙醇、料液比1:14、温度80 ℃、提取时间5 min,多糖得率是8.92%。Chaiklahan等[34]通过响应面法优化热水浸提螺旋多糖的条件,最优条件是:料液比1:45、温度90 ℃、时间120 min,在此条件下,螺旋藻多糖的得率为8.3%。本研究采用的热碱液法,对酸性的螺旋藻多糖提取更充分,提取液不含有机溶剂,且用量少,大大降低了提取成本。杜玲等[35]比较了DEAE-纤维素法和活性炭法脱除螺旋藻多糖色素的效果,发现活性炭法脱除色素效果更好,确定了脱色温度40 ℃、活性炭添加量1.5%、脱色时间50 min 是最佳脱色条件,多糖脱色率为64.58%,多糖保留率为64.09%;但是,本研究采用的过氧化氢法与其结果相比,具有更高的多糖脱色率和保留率,具有更高的脱色效率。秦宇等[36]使用过氧化氢法脱除日本蛇菰多糖色素,并采用响应面法优化其脱色条件,在pH 为8 的条件下双氧水脱色最佳工艺为:双氧水用量为20%、脱色时间为46 min、脱色温度为60 ℃,在此条件下蛇菰多糖的脱色率为84.21%,其结果与本文相似,可以发现过氧化氢法在脱除色素的过程中,可以高效地去除色素,并且实验条件简单,易于操作。
3 结论
本文采用热碱液法提取螺旋藻多糖,通过单因素实验和响应面分析,分析发现影响螺旋藻多糖提取的因素,按影响大小依次为提取温度>提取时间>NaOH 质量分数,同时得到最佳提取条件是NaOH质量分数1.5%、提取温度为90 ℃、提取时间4 h 及料液比1:20 g/mL,平行3 组实验,得到螺旋藻多糖得率为5.18%±0.23%,相对于传统的提取方法,热碱液浸提法可以将酸性多糖提取充分,缩短提取时间,减少提取成本。在优化螺旋藻多糖的过氧化氢法脱色工艺中发现,所考察的3 个因素中,其影响效果从高到低为过氧化氢添加量>脱色时间>脱色温度,最优工艺参数:过氧化氢溶液添加量为17%,脱色时间为55 min,脱色温度为50 ℃,得到的实际脱色率为82.54%±0.03%,多糖保留率为83.45%±0.13%。与常用的脱色方法大孔树脂法、活性碳法及Sevage 法相比,过氧化氢法脱色具有脱色率高,时间短、效率高等特点[37],但过量的过氧化氢也会和多糖发生氧化反应,因此需要严格控制过氧化氢用量。本次研究所得结论为后续螺旋藻多糖分离纯化以及生物活性的研究,奠定一定基础。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

