LncRNA FEZF1-AS1靶向调控miR-200c-3p对人肺成纤维细胞生物学行为的影响
满君 高艳艳 宋龙飞 高福生
摘要:目的 探討FEZ家族锌指1-反义RNA1(LncRNA FEZF1-AS1)靶向调控miR-200c-3p对人肺成纤维细胞HLF生物学行为的影响。方法 采用转化生长因子β1(TGF-β1)诱导HLF向肌成纤维细胞转化,分为空白对照组(Blank组)和造模组(HLF+TGF-β1组),另根据转染质粒不同将细胞分为Blank组、TGF-β1+Si LncRNA FEZF1-AS1 NC组和TGF-β1+Si LncRNA FEZF1-AS1组。采用Western blot法检测α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(CollagenⅠ)和波形蛋白(Vimentin)蛋白的表达。采用实时荧光定量PCR(qRT-PCR)检测LncRNA FEZF1-AS1和miR-200c-3p的表达。采用CCK-8法检测细胞增殖,细胞划痕实验检测迁移能力,Transwell实验检测侵袭能力;采用双萤光素酶实验检测FEZF1-AS1与miR-200c-3p的靶向作用关系。结果 与Blank组比较,HLF+TGF-β1组α-SMA、CollagenⅠ、Vimentin蛋白表达及LncRNA FEZF1-AS1表达水平升高,miR-200c-3p表达水平降低(P<0.05);与TGF-β1+Si LncRNA FEZF1-AS1 NC组比较,TGF-β1+Si LncRNA FEZF1-AS1组细胞增殖、迁移、侵袭能力下降,LncRNA FEZF1-AS1表达及α-SMA、CollagenⅠ、Vimentin蛋白表达水平降低,miR-200c-3p表达水平升高(P<0.05);FEZF1-AS1与miR-200c-3p基因序列上存在结合位点。结论 LncRNA FEZF1-AS1通过抑制miR-200c-3p促进特发性肺间质纤维化的发生、发展。
关键词:特发性肺间质纤维化;肺成纤维细胞;肌成纤维细胞;FEZ家族锌指1-反义RNA1;微小RNA-200c-3p
中图分类号:R563.9文献标志码:ADOI:10.11958/20230719
The effect of lncRNA FEZF1-AS1 targeting regulation of miR-200c-3p on biological
behaviors of human lung fibroblasts
MAN Jun1, GAO Yanyan1, SONG Longfei2, GAO Fusheng1△
1 Department of Respiratory Medicine, 2 Department of Rehabilitation Medicine, Affiliated Hospital of Weifang Medical University, Weifang 261035, China
△Corresponding Author E-mail: gaofs888@163.com
Abstract: Objective To investigate the effect of FEZ family zinc finger 1-antisense RNA 1 (LncRNA FEZF1-AS1) targeting regulation of miR-200c-3p expression on biological behaviors of human lung fibroblasts (HLF). Methods Transforming growth factor β1 (TGF-β1) was used to induce the transformation of HLF into myofibroblasts, which were divided into the Blank group and the model group (HLF+TGF-β1 group). According to different transfection plasmid, cells were divided into the Blank group, the TGF-β1+Si LncRNA FEZF1-AS1 NC group and the TGF-β1+Si LncRNA FEZF1-AS1 group. The protein expressions of α-SMA, Collagen Ⅰ and Vimentin were detected by Western blot assay. The expressions of LncRNA FEZF1-AS1 and miR-200c-3p were detected by quantitative real-time PCR (qRT-PCR). Cell proliferation ability was detected by CCK-8 method, migration ability was detected by cell scratch experiment and invasion ability was detected by Transwell assay. The targeting relationship between FEZF1-AS1 and miR-200c-3p was detected by dual-luciferase reporter assay. Results Compared with the Blank group, protein expressions of α-SMA, Collagen Ⅰ, Vimentin and the expression of LncRNA FEZF1-AS1 were increased in the HLF+TGF-β1 group (P<0.05), and the expression of miR-200c-3p was decreased (P<0.05). Compared with the TGF-β1+Si LncRNA FEZF1-AS1 NC group, cell proliferation, migration, invasion ability, LncRNA FEZF1-AS1 expression, protein expressions of α-SMA, Collagen Ⅰ and Vimentin were decreased in the TGF-β1+Si LncRNA FEZF1-AS1 group (P<0.05), and the expression of miR-200c-3p was increased (P<0.05). There were binding sites between miR-200c-3p and FEZF1-AS1 gene sequence. Conclusion LncRNA FEZF1-AS1 promotes the formation and progression of idiopathic pulmonary interstitial fibrosis by inhibiting miR-200c-3p.
Key words: idiopathic pulmonary interstitial fibrosis;lung fibroblasts; myofibroblasts; FEZ family zinc finger 1-antisense RNA1;microRNA-200c-3p
特发性肺间质纤维化(IPF)是呼吸系统疑难疾病,肺泡上皮细胞反复损伤、异常修复和成纤维细胞激活是IPF病理过程的关键因素,其导致上皮间质转化(EMT)过程被异常启动[1]。IPF患者确诊后存活期仅为3年左右,5年生存率为30%~50%,吡非尼酮和尼达尼布可以缓解IPF的进展,但目前尚无被广泛接受的治疗IPF方法[2-4]。长链非编码RNA(long non-coding RNA,LncRNA)是一类长度超过200 nt的非编码RNA,参与生物体内各种重要的生理过程[5]。FEZ家族锌指1-反义RNA 1(LncRNA FEZF1-AS1)在肝癌、结肠癌等多种恶性肿瘤中过表达,可促进肿瘤细胞的增殖、迁移和侵袭过程,调控肿瘤细胞EMT[6]。miRNA参与多种生物学功能的调控,研究发现miR-200c-3p在肝纤维化、心肌梗死、肿瘤等疾病的发病机制中均发挥重要作用[7-8]。然而,LncRNA FEZF1-AS1在IPF中的表达情况及作用机制研究尚鲜见,且LncRNA FEZF1-AS1是否通过miR-200c-3p发挥作用尚不清楚。本研究分析了LncRNA FEZF1-AS1在IPF中的表达模式和生物学功能,探讨IPF的发病机制,为寻找有价值的治疗靶点提供依据。
1 材料与方法
1.1 细胞及培养 人肺成纤维细胞HLF购自中国科学研究院昆明细胞库(KCB 200695),HLF细胞培养于含10%胎牛血清、0.1 g/L链霉素、100 U/mL青霉素的DMEM/F12培养基中,以5%CO2、37 ℃饱和湿度环境下在恒温培养箱中培养,每1~2 d将细胞换液1次,当细胞融合度达80%时进行消化传代,取对数生长期的细胞进行后续实验。
1.2 主要试剂及仪器
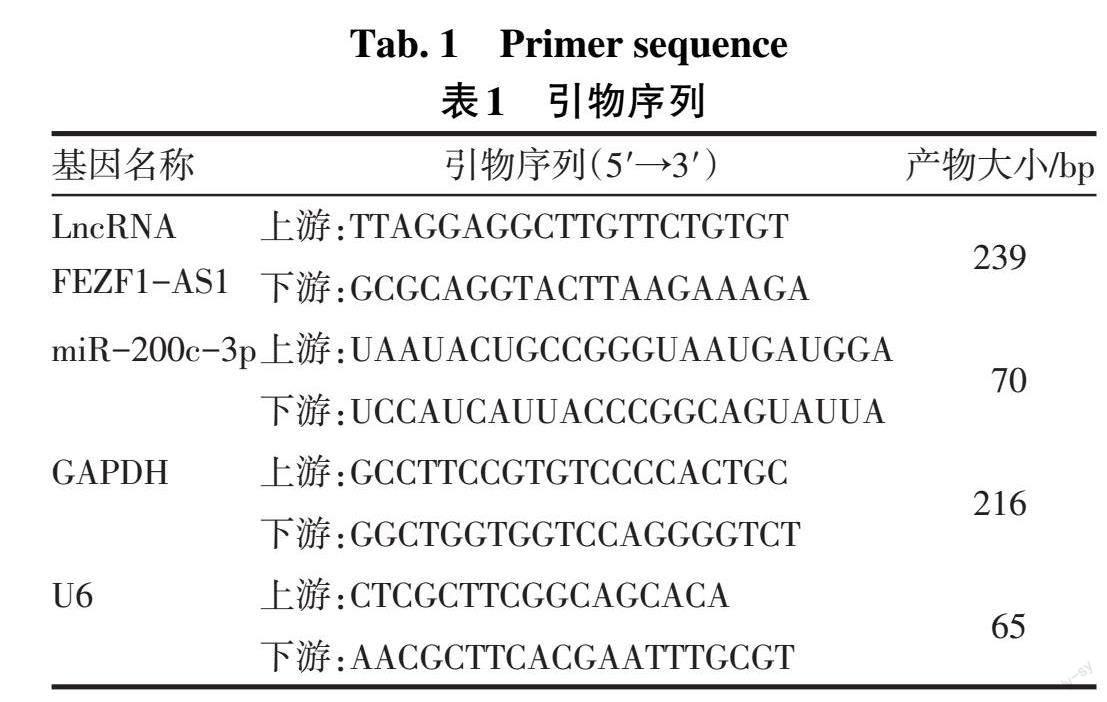
1.2.1 主要试剂 转化生长因子β1(TGF-β1)(CA59,上海近岸生物科技有限公司);胎牛血清[cat:10099141,赛默飞世尔科技(中国)有限公司];DMEM/F12液体培养基(SH30023.01,思拓);CCK-8检测试剂盒(CK04,同仁化学研究所);Transwell嵌套小室(3422,康宁公司);TRIzol(H10318)和实时荧光定量PCR(qRT-PCR)试剂盒(AQ131-01)均购自北京全式金生物技术股份有限公司;引物由上海捷瑞生物工程有限公司合成;FastKing cDNA第一链合成试剂盒和Bulge-LoopTM miRNA qRT-PCR Starter Kit试剂盒(C10211-1)购自苏州锐博生物科技有限公司;Si LncRNA FEZF1-AS1转染质粒(siB160705032412)、Si LncRNA FEZF1-AS1 NC(对照)转染质粒(siN0000001-1-1)、miR-200c-3p引物序列(MQPS0000783-1-100)均购自广州市锐博生物科技有限公司;Lipo6000TM 转染试剂(C0526-1.5ml)、α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(CollagenⅠ)、波形蛋白(Vimentin)及GAPDH抗体均购自Proteintech;辣根过氧化物酶(HRP)偶联的二抗、BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;萤光素酶检测试剂盒购自翌圣生物科技(上海)股份有限公司。
1.2.2 主要仪器 CO2培养箱(XD-101,日本SANYO);酶标仪(MULTISKAN FC,美国Thermo);离心机(centrifuge 5415R,Eppendorf);电泳仪(EPS300,Tanon);qRT-PCR仪(7500,ABI);96微孔板发光检测仪(GloMax,Promega)。
1.3 方法
1.3.1 细胞造模、转染及分组 将10 mg/L TGF-β1采用DMEM/F12液体培养基稀释500倍即形成质量浓度为20 μg/L的TGF-β1,诱导肺成纤维细胞,促使其异常活化向肌成纤维细胞转化,将细胞分为空白对照组(Blank组,HLF细胞不进行任何处理)和造模组(HLF+TGF-β1组)。
取对数生长期HLF细胞接种于6孔板内,每孔2×106个细胞,当细胞融合度达70%~90%时进行转染,参照Lipofectamine6000TM试剂盒说明书进行转染,构建Si LncRNA FEZF1-AS1转染质粒及对照质粒,采用qRT-PCR法检测LncRNA FEZF1-AS1的表达水平,从而检测细胞转染效率,用于后续实验的开展。
将转染Si LncRNA FEZF1-AS1转染质粒及对照质粒的HLF细胞加入20 μg/L TGF-β1,分为TGF-β1+Si LncRNA FEZF1-AS1组和TGF-β1+Si LncRNA FEZF1-AS1 NC组,另设空白对照组(Blank组,HLF细胞不进行任何处理),进行后续实验观察LncRNA FEZF1-AS1对细胞的影响。
1.3.2 Western blot检测α-SMA、Collagen Ⅰ、Vimentin蛋白的表达 各组细胞采用裂解液裂解,裂解完成后,在4 ℃下12 000 r/min离心15 min,提取细胞蛋白,BCA法测定蛋白浓度,加入蛋白上样缓冲液煮沸5 min,放于-80 ℃保存。SDS-PAGE分离后,采用湿转法转到PVDF膜,用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温下摇床封闭2 h,加入α-SMA、Collagen Ⅰ一抗(1∶1 000)、Vimentin一抗(1∶2 000),4 ℃孵育過夜,TBST充分洗涤PVDF膜后加入HRP标记山羊抗兔IgG二抗(1∶1 000),于37 ℃摇床孵育2 h。TBST再次洗涤后加入ECL显影,Image J软件进行灰度值分析,GAPDH作为内参蛋白,计算目的蛋白表达量。目的蛋白表达量=目的蛋白条带灰度值/GAPDH条带灰度值。
1.3.3 qRT-PCR法检测LncRNA FEZF1-AS1和miR-200c-3p表达 将细胞接种于6孔板内,每孔2×105个细胞,采用TRIzol法提取总RNA,分别应用FastKing cDNA第一链合成试剂盒及miRNA cDNA第一链合成试剂盒说明书操作将RNA反转录成cDNA。反应体系(20 μL):上、下游引物各0.4 μL,2×Supermix 10 μL,PASSIVE DYE 0.4 μL,cDNA模板2 μL,ddH2O 6.8 μL。反应条件:95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。采用2-ΔΔCt法进行相对定量分析,分别以GAPDH和U6作为内参计算LncRNA FEZF1-AS1 mRNA和miR-200c-3p的表达量,实验重复3次。引物序列见表1。
1.3.4 CCK-8法检测LncRNA FEZF1-AS1对细胞增殖的影响 HLF细胞转染24 h后,胰酶消化细胞,调整细胞密度为4×104个/mL,将100 μL的细胞悬液接种于96孔板中,加入20 μg/L TGF-β1,置于5%CO2、37 ℃培养箱中培养。分别在培养0 h、24 h、48 h时每孔加入10 μL CCK-8溶液,再次置于细胞培养箱中孵育4 h,使用酶标仪测定各个孔在450 nm波长下的光密度(OD)值。
1.3.5 细胞划痕实验检测LncRNA FEZF1-AS1对细胞迁移能力的影响 HLF细胞转染24 h后,按细胞密度2×105个/mL接种至6孔板,加入20 μg/L TGF-β1,细胞生长至铺满孔底后,用10 μL移液器吸头垂直在细胞板上划痕,充分洗去漂洗细胞,加入无血清的培养基,置于CO2培养箱中继续培养。倒置显微镜下观察各组细胞0 h、48 h的变化,拍照记录划痕面积。划痕愈合率(%)=(0 h划痕面积-48 h划痕面积)/0 h划痕面积×100%。
1.3.6 Transwell小室法检测LncRNA FEZF1-AS1对细胞侵袭能力的影响 胰酶消化细胞,制备细胞悬液,将细胞接种于小室中,调整细胞密度为2×105个/mL,每组细胞数为1×104个/孔。Transwell上室加入无血清培养基,下室加入含20 μg/L TGF-β1和10%血清的完全培养基,上室液每孔200 μL,下室液每孔800 μL。将上层小室放入下层小室,细胞计数后将细胞铺在上层小室中。在培养箱中培养48 h后,取出上室,用棉签擦去上室底部膜表面的细胞,用PBS洗涤,然后将其置于800 μL甲醇中固定,10 min后采用吉姆萨染色液染细胞,去离子水进行适度漂洗,去除浮色,最后荧光倒置显微镜计数、拍照。
1.3.7 双萤光素酶实验验证FEZF1-AS1与miR-200c-3p的靶向作用关系 将FEZF1-AS1基因插入到萤光素酶基因上游,构建FEZF1-AS1-WT(野生型)、FEZF1-AS1-Mut(突变型)的双萤光素酶报告质粒,采用NC mimic质粒及miR-200c-3p mimic质粒,与FEZF1-AS1-WT、FEZF1-AS1-Mut质粒共转染HLF细胞,最终得到FEZF1-AS1-WT+NC mimic组、FEZF1-AS1-WT+miR-200c-3p mimic组、FEZF1-AS1-Mut+NC mimic组、FEZF1-AS1-Mut+miR-200c-3p mimic组。转染后将细胞培养48 h,收集细胞,加入细胞裂解液,使用双萤光素酶报告基因检测系统检测各组细胞萤火虫和海肾荧光强度,以海肾荧光值作为内参,计算各组细胞萤光素酶活性的比值。
1.4 统计学方法 采用SPSS 23.0软件进行数据分析。计量资料以均数±标准差([x] ±s)表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
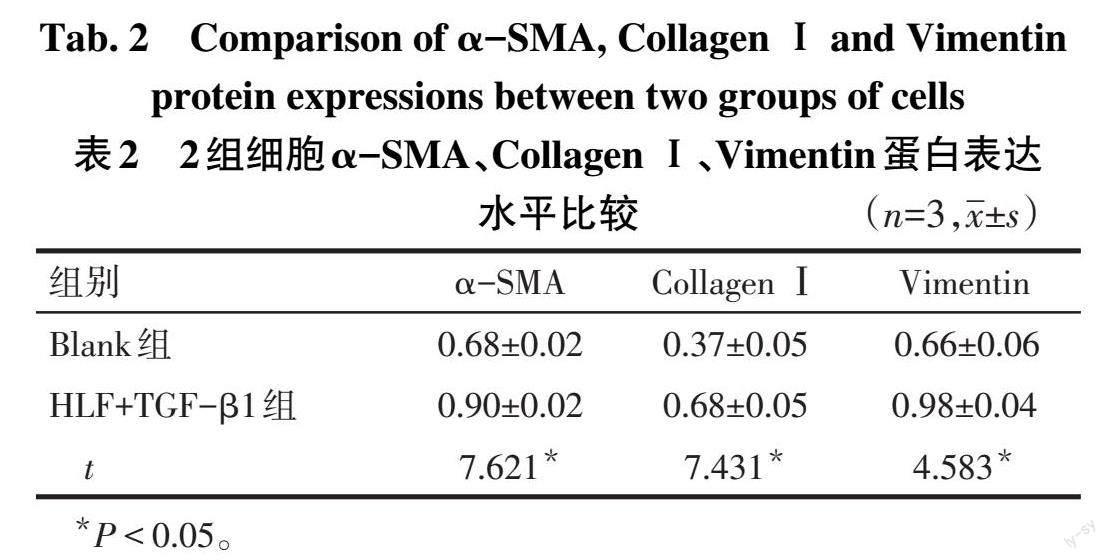
2.1 Blank组和HLF+TGF-β1组细胞α-SMA、Collagen Ⅰ、Vimentin蛋白表达水平 HLF+TGF-β1组细胞α-SMA、CollagenⅠ、Vimentin蛋白表达水平均高于Blank组(P<0.05),见表2、图1。
2.2 Blank组和HLF+TGF-β1组细胞LncRNA FEZF1-AS1、miR-200c-3p表达 与Blank组相比,HLF+TGF-β1组细胞LncRNA FEZF1-AS1表达水平升高(2.23±0.05 vs. 1.11±0.01,n=3,t=24.260,P<0.05),miR-200c-3p表达水平降低(0.20±0.01 vs. 1.10±0.03,n=3,t=33.740,P<0.05)。
2.3 Blank组、Si LncRNA FEZF1-AS1转染质粒组和对照质粒组LncRNA FEZF1-AS1的表达水平 与Blank组(1.00±0.05)和Si LncRNA FEZF1-AS1 NC组(1.01±0.10)相比,Si LncRNA FEZF1-AS1组(0.31±0.02)LncRNA FEZF1-AS1表达水平降低(n=3,F=36.360,P<0.05)。
2.4 沉默LncRNA FEZF1-AS1表达对细胞增殖的影响 CCK-8实验结果显示,与Blank组相比,TGF-β1+Si LncRNA FEZF1-AS1 NC组24、48 h细胞增殖能力升高(P<0.05);与TGF-β1+Si LncRNA FEZF1-AS1 NC组相比,TGF-β1+Si LncRNA FEZF1-AS1组24、48 h细胞增殖能力降低(P<0.05);3组细胞0、24、48 h细胞增殖能力依次升高(P<0.05),见表3。
2.5 沉默LncRNA FEZF1-AS1表达对细胞迁移的影响 细胞遷移实验结果显示,与Blank组相比,TGF-β1+Si LncRNA FEZF1-AS1 NC组细胞划痕愈合率升高(P<0.05);与TGF-β1+Si LncRNA FEZF1-AS1 NC组比较,TGF-β1+Si LncRNA FEZF1-AS1组细胞划痕愈合率降低(P<0.05),见表4、图2。
2.6 沉默LncRNA FEZF1-AS1表达对细胞侵袭的影响 Transwell实验表明,与Blank组相比,TGF-β1+Si LncRNA FEZF1-AS1 NC组细胞侵袭数升高(P<0.05);与TGF-β1+Si LncRNA FEZF1-AS1 NC组相比,TGF-β1+Si LncRNA FEZF1-AS1组细胞侵袭数降低(P<0.05),见表4、图3。
2.7 沉默LncRNA FEZF1-AS1表达对肺间质纤维化相关蛋白表达的影响 与Blank组相比,TGF-β1+Si LncRNA FEZF1-AS1 NC组Vimentin、α-SMA、CollagenⅠ蛋白表达水平升高(P<0.05);与TGF-β1+Si LncRNA FEZF1-AS1 NC组相比,TGF-β1+Si LncRNA FEZF1-AS1组Vimentin、α-SMA、CollagenⅠ蛋白表达水平降低(P<0.05),见图4、表5。
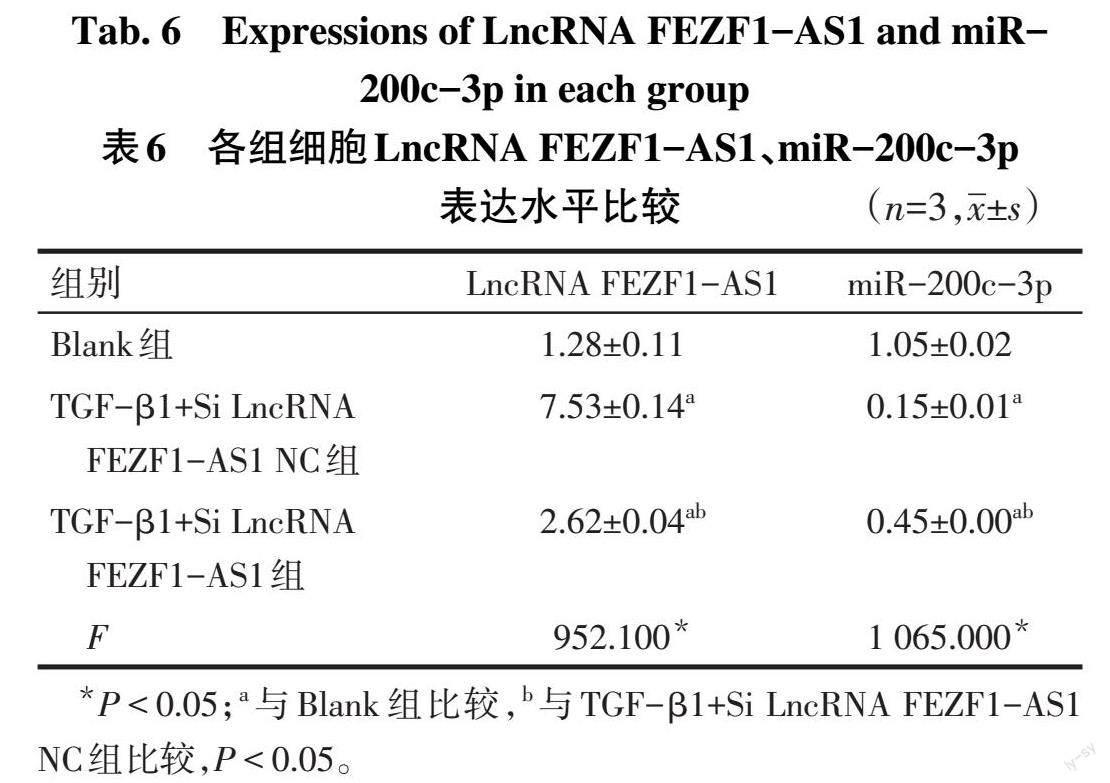
2.8 沉默LncRNA FEZF1-AS1表达对miR-200c-3p表达的影响 与TGF-β1+Si LncRNA FEZF1-AS1 NC组比较,TGF-β1+Si LncRNA FEZF1-AS1组LncRNA FEZF1-AS1表达水平降低,miR-200c-3p表达水平升高(P<0.05),见表6。
2.9 双萤光素酶实验检测LncRNA FEZF1-AS1与miR-200c-3p的关系 采用RNAhybrid软件预测LncRNA FEZF1-AS1与miR-200c-3p具有结合位点,见图5。FEZF1-AS1-WT+miR-200c-3p mimic组萤光素酶活性低于FEZF1-AS1-WT+NC mimic组(0.44±0.01 vs. 1.00±0.01,n=3,t=58.460,P<0.05);FEZF1-AS1-Mut+miR-200c-3p mimic组萤光素酶活性与FEZF1-AS1-Mut+NC mimic差异无统计学意义(0.95±0.03 vs. 1.00±0.05,n=3,t=1.415,P>0.05)。
3 讨论
IPF的病理过程与EMT激活和成纤维细胞向肌成纤维细胞转化等密切相关,成纤维细胞可分泌大量促纤维化因子以及胶原为代表的细胞外基质,这些物质可继续作用于成纤维细胞,发挥正反馈作用[9]。LncRNA参与染色体沉默、染色质修饰、转录激活与干扰等过程,这些过程与人类疾病的发生和发展密切相关[10]。目前研究发现LncRNA FEZF1-AS1在胰腺癌、结直肠癌、肺腺癌等多种恶性肿瘤中高表达,且与患者不良预后相关[6,11]。作为一种癌基因,LncRNA FEZF1-AS1可促进肿瘤细胞的增殖、迁移和侵袭[12]。LncRNA FEZF1-AS1可促进非小细胞肺癌(NSCLC)细胞增殖、迁移和侵袭能力,且其在NSCLC中通过抑制E-cadherin表达及调节Wnt/β-catenin通路增强EMT[13]。另有研究发现,LncRNA FEZF1-AS1通过调控miR-25-3p/ITGB8轴促进前列腺癌细胞EMT[14]。在肝癌中LncRNA FEZF1-AS1可通过JAK2/STAT3信号通路促进EMT,从而促进肝癌细胞的侵袭和转移[15]。然而,目前鲜见有关LncRNA FEZF1-AS1在IPF中作用的研究。本研究结果显示,LncRNA FEZF1-AS1在肺间质纤维化细胞中表达上调,提示LncRNA FEZF1-AS1可能与肺间质纤维化的发生有关;沉默肺间质纤维化细胞中LncRNA FEZF1-AS1表达后,细胞增殖、迁移和侵袭能力降低,表明LncRNA FEZF1-AS1在肺间质纤维化中发挥促纤维化基因的作用。
α-SMA是成纤维细胞表达的微丝蛋白,亦是肺成纤维细胞向肌成纤维细胞分化的标志蛋白,故肺间质纤维化中α-SMA蛋白表达水平显著升高。CollagenⅠ为细胞外基质主要成分之一,异常胶原沉积是肺间质纤维化的重要特征,故IPF中CollagenⅠ蛋白表达水平显著升高。Vimentin是间质细胞的标志蛋白,具有维持细胞形态稳定,促进细胞黏附、侵袭与转移等作用。本研究结果显示,肺间质纤维化细胞中α-SMA、CollagenⅠ和Vimentin表达明显升高,且沉默LncRNA FEZF1-AS1表达后,细胞α-SMA、CollagenⅠ、Vimentin表达水平降低,提示沉默LncRNA FEZF1-AS1表达后,肺成纤维细胞向肌成纤维细胞的转化可能受到抑制,进而抑制了肺间质纤维化细胞的增殖、迁移和侵袭。由此笔者推测,LncRNA FEZF1-AS1通过调控细胞增殖、迁移、侵袭与肺成纤维细胞向肌成纤维细胞的转化,从而促进肺间质纤维化发生、发展。
miRNA可選择性与mRNA结合,抑制mRNA翻译或促进mRNA降解,从而调控靶基因表达。有研究报道,miR-200c-3p通过逆转肺成纤维细胞的纤维原活性及抑制肺泡Ⅱ型上皮细胞向肺泡Ⅰ型上皮细胞的转化,进而抑制肺间质纤维化[16]。LncRNA通过海绵效应调控miRNA表达来参与肿瘤发生、发展。Lin等[17]研究表明,IPF中LncRNA Hoxaas3高表达可下调miR-450b-5p,上调Runx1表达,从而促进肺成纤维细胞的增殖、迁移和侵袭。本研究结果显示,miR-200c-3p在肺间质纤维化细胞中表达水平降低,且LncRNA FEZF1-AS1与miR-200c-3p存在靶向关系,沉默LncRNA FEZF1-AS1后细胞中miR-200c-3p表达水平升高,提示LncRNA FEZF1-AS1基因可靶向抑制miR-200c-3p基因表达,促进肺间质纤维化发生、发展。
综上所述,LncRNA FEZF1-AS1基因通过靶向抑制miR-200c-3p促进成纤维细胞增殖、转移、侵袭及向肌成纤维细胞转化,从而促进肺间质纤维化。本研究仅初步探讨了LncRNA FEZF1-AS1基因调控miR-200c-3p对肺成纤维细胞生物学行为的影响,该结论未在动物体内进行验证,后续研究将利用小鼠肺纤维化模型进行临床前分析。
參考文献
[1] KATZEN J,BEERS M F. Contributions of alveolar epithelial cell quality control to pulmonary fibrosis[J]. J Clin Invest,2020,130(10):5088-5099. doi:10.1172/JCI139519.
[2] MA H B,WU X Y,LI Y,et al. Research progress in the molecular mechanisms,therapeutic targets,and drug development of idiopathic pulmonary fibrosis[J]. Front Pharmacol,2022,13:963054. doi:10.3389/fphar.2022.963054.
[3] COX I A,OTAHAL P,DE GRAAFF B,et al. Incidence,prevalence and mortality of idiopathic pulmonary fibrosis in Australia[J]. Respirology,2022,27(3):209-216. doi:10.1111/resp.14194.
[4] VANCHERI C,KREUTER M,RICHELDI L,et al. Nintedanib with add-on pirfenidone in idiopathic pulmonary fibrosis. results of the INJOURNEY trial[J]. Am J Respir Crit Care Med,2018,197(3):356-363. doi:10.1164/rccm.201706-1301OC.
[5] BRIDGES M C,DAULAGALA A C,KOURTIDIS A. LNCcation:lncRNA localization and function[J]. J Cell Biol,2021,220(2):e202009045. doi:10.1083/jcb.202009045.
[6] ZHANG T,YU S,ZHAO S. LncRNA FEZF1-AS1 promotes colorectal cancer progression through regulating the miR-363-3p/PRRX1 pathway[J]. Adv Clin Exp Med,2021,30(8):839-848. doi:10.17219/acem/135693.
[7] PONTEMEZZO E,FOGLIO E,VERNUCCI E,et al. miR-200c-3p regulates epitelial-to-mesenchymal transition in epicardial mesothelial cells by targeting epicardial follistatin-related protein 1[J]. Int J Mol Sci,2021,22(9):4971. doi:10.3390/ijms22094971.
[8] WANG Y,LU K,LI W,et al. MiR-200c-3p aggravates gastric cell carcinoma via KLF6[J]. Genes Genomics,2021,43(11):1307-1316. doi:10.1007/s13258-021-01160-6.
[9] KURUNDKAR A R,KURUNDKAR D,RANGARAJAN S,et al. The matricellular protein CCN1 enhances TGF-β1/SMAD3-dependent profibrotic signaling in fibroblasts and contributes to fibrogenic responses to lung injury[J]. FASEB J,2016,30(6):2135-2150. doi:10.1096/fj.201500173.
[10] HERMAN A B,TSITSIPATIS D,GOROSPE M. Integrated lncRNA function upon genomic and epigenomic regulation[J]. Mol Cell,2022,82(12):2252-2266. doi:10.1016/j.molcel.2022.05.027.
[11] WANG H,WU Y,WANG Z,et al. The LncRNA FEZF1-AS1 promotes tumor proliferation in colon cancer by regulating the mitochondrial protein PCK2[J]. Oncol Res,2022,29(3):201-215. doi:10.32604/or.2022.03553.
[12] LIANG M,LI Y,DAI T,et al. lncRNA FEZF1-AS1 regulates biological behaviors of cervical cancer by targeting miRNA-1254[J]. Food Sci Nutr,2021,9(9):4722-4737. doi:10.1002/fsn3.2315.
[13] HE R,ZHANG F H,SHEN N. LncRNA FEZF1-AS1 enhances epithelial-mesenchymal transition (EMT) through suppressing E-cadherin and regulating WNT pathway in non-small cell lung cancer (NSCLC)[J]. Biomed Pharmacother,2017,95:331-338. doi:10.1016/j.biopha.2017.08.057.
[14] WANG Z H,WANG J H,WANG K Q,et al. LncRNA FEZF1-AS1 promoted chemoresistance,autophagy and epithelial-mesenchymal transition (EMT) through regulation of miR-25-3p/ITGB8 axis in prostate cancer[J]. Eur Rev Med Pharmacol Sci,2020,24(16):8250. doi:10.26355/eurrev_202008_22591.
[15] WANG Y D,SUN X J,YIN J J,et al. Long non-coding RNA FEZF1-AS1 promotes cell invasion and epithelial-mesenchymal transition through JAK2/STAT3 signaling pathway in human hepatocellular carcinoma[J]. Biomed Pharmacother,2018,106:134-141. doi:10.1016/j.biopha.2018.05.116.
[16] MOIMAS S,SALTON F,KOSMIDER B,et al. miR-200 family members reduce senescence and restore idiopathic pulmonary fibrosis type II alveolar epithelial cell transdifferentiation[J]. ERJ Open Res,2019,5(4):00138-2019. doi:10.1183/23120541.00138-2019.
[17] LIN S,ZHANG R,XU L,et al. LncRNA Hoxaas3 promotes lung fibroblast activation and fibrosis by targeting miR-450b-5p to regulate Runx1[J]. Cell Death Dis,2020,11(8):706. doi:10.1038/s41419-020-02889-w.
(2023-05-19收稿 2023-08-12修回)
(本文編辑 陈丽洁)

