改善肿瘤缺氧耐药的血红蛋白-紫杉醇脂质体的制备及体外评价
游训仪 朱珂慧 肖晶 吴嘉康 郑诗凡 张阿龙 钟锐 王红 曹晔 刘嘉馨
(1.中国医学科学院北京协和医学院输血研究所,四川 成都 610052;2.四川省肿瘤医院)
肿瘤是全球公共卫生问题,是导致死亡的重要原因。 缺氧是大多数实体肿瘤的典型特征,能引起肿瘤细胞基因和蛋白表达的改变,导致代谢异常,更易诱发肿瘤的增殖转移和治疗抵抗[1]。 目前已有许多研究通过改善肿瘤低氧的微环境来增强肿瘤疗效,将药物载入如脂质体、聚合物胶束和金纳米粒等的传统纳米粒子(nanoparticles,NPs)中是方法之一[2-5]。 血红蛋白(hemoglobin,Hb)是红细胞中的主要成分,由珠蛋白与4 个血红素基团构成,每个血红素均含有1 个铁原子。 Hb 可根据不同氧分压与氧气进行可逆结合,在氧分压高时携氧,氧分压低时释氧,可用于为肿瘤缺氧部位供氧[6]。 血红蛋白脂质体(liposome encapsulated hemoglobin,LEH)是磷脂双分子层包裹血红蛋白形成的纳米囊泡结构,Hb 被包封在脂质体的内水相,模仿了红细胞的结构与部分功能,最初用作常规红细胞输血的替代物,以校正缺血个体的氧分压和维持重要器官的灌注,除此之外,还被用于保护脑缺血、皮肤溃疡、细胞实验的手术伤口愈合[7]。 LEH 作为纳米颗粒可以穿过红细胞难以到达的狭窄血管,尤其是实体瘤内的血管,可以为缺氧组织供氧,已有报道LEH 可在肿瘤放疗过程中起到增敏作用[8-13]。
基于此,我们构建了1 种同时包封氧载体血红蛋白和化疗药紫杉醇(paclitaxel,PTX)的纳米脂质体——血红蛋白-紫杉醇脂质体(liposome encapsulate hemoglobin and paclitaxel,LEHP),并利用pH敏感的DOPE 磷脂,将化疗药物和氧气靶向递送至肿瘤部位,通过解决改善肿瘤部位缺氧,从而提高化疗药物的抗肿瘤效果。
1 材料与方法
1.1 细胞株来源
小鼠乳腺癌4T1-LUC 细胞1 株(购自上海富衡生物公司)。
1.2 试剂与仪器
PBS 缓冲液(货号SH30256.01, 美国Hyclone)、无水乙醇(成都市科隆化学品有限公司)、二棕榈酰磷脂酰胆碱DPPC(AVT Pharmaceutical Tech CO)、胆固醇(Aladdin)、二油酰磷脂酰乙醇胺DOPE(AVT Pharmaceutical Tech CO)、游离血红蛋白试剂盒(北京瑞尔达生物科技有限公司)、紫杉醇(Aladdin)、乙腈(Merck)、FITC 染料(Avanti)、三氯甲烷(成都科龙化工试剂厂)、DMEM 高糖培养基(货号SH30022.01,Biosharp)、胎牛血清(FBS)(货号S601S-500,德国SeraPro)、胰蛋白酶(货号0457,美国Ameresco)、DMSO(Sigma-Aldrich)、青/链霉素(Hyclone)、活性氧(ROS) 染液(货号D7008,美国Sigma)、脂质体挤出器(ATS 安诺思纳米技术苏州有限公司)、纳米粒度仪(Beckman Delsa nano C)、RV10 旋转蒸发仪(IKA)、Cytation3 全波长酶标仪(Bio-Tek)、成像流式细胞仪(Cytek)、高效液相色谱仪(Agilent)、高速冷冻离心机(Thermo Fisher)。
1.3 血红蛋白的提取
全血获取于德阳市中心血站,通过白细胞滤器滤除白细胞后离心(3 500 g,5 min),使用PBS 洗涤RBCs 2~3 次(3 500 g,5 min),弃去上清,得到洗涤红细胞,于4℃保存。 采用低渗法提取血红蛋白,在洗涤红细胞中加入双蒸水,使红细胞膨胀破裂并释放出血红蛋白,离心后上清即为血红蛋白溶液,于4℃保存[14]。
1.4 脂质体的制备
采用薄膜法制备脂质体。 选取不同磷脂配比,将相应的磷脂与3 mg PTX 装入圆底烧瓶后加入5 mL CCl3,随后使用旋转蒸发仪在48℃下旋转蒸发1 h。 用6 mL 不同Hb 浓度的PBS 在室温下水化30 min,然后通过不同孔径的聚碳酸酯膜挤出,制得紫杉醇脂质体(liposome encapsulate paclitaxel,LEP)和血红蛋白紫杉醇脂质体LEHP。
1.5 纳米粒度仪检测脂质体大小
取100 μL 脂质体加入1 mL 双蒸水中充分混匀,于室温下通过纳米粒度仪对脂质体粒径及Zeta电位进行检测。
1.6 高效液相色谱法(high performance liquidphase,HPLC)检测脂质体药物包封率
将脂质体用HPLC 级别的乙腈破膜,涡旋(1~2)min 后离心(10 000 g,2 min),提取上清液过滤(0.22 μm)后通过HPLC 检测药物包封率[15]。 柱子:C18,4.6×150 nm;流动相为超纯水∶乙腈∶甲醇=39%∶37%∶24%;流速:0.8 mL·min-1;进样量:10 μL;检测波长:227 nm;检测时间:15 min。 计算公式:包封率(EE%)=PTX 检测量·PTX 初始总量-1×100%。
1.7 血红蛋白含量检测
采用游离血红蛋白试剂盒检测血红蛋白含量。将脂质体用0.1%曲拉通破膜,加入96 孔板,然后每孔加入100 μL R1、100 μL R2 和10 μL R3(R1、R2 与R3 为试剂盒中试剂)。 混匀后于37℃中反应20 min,通过酶标仪检测吸光度(OD),波长505 nm,空白孔作为背景。
1.8 细胞毒性实验
采用噻唑蓝法(thiazole blue assay,MTT)检测低氧或常氧条件下药物的细胞毒性。 将处于对数生长期的小鼠乳腺癌细胞(4T1)按每孔5 000 接种到96 孔板中,放入低氧或常氧培养箱培养过夜。分别用不同浓度的LEP 或LEHP 进行孵育,继续低氧或常氧条件培养。 培养24 h 或48 h 后,每孔加入5 mg·mL-1MTT 试剂20 μL,继续孵育4 h 后,吸去上清。 每孔加入150 μL DMSO,孵育20 min。用酶标仪测定574 nm 处吸光值,每个复孔的吸光值取平均值,计算各组细胞存活率。 计算公式:细胞存活率(CV)=样品组吸光值(OD1)·对照组吸光值(OD0)-1×100%。
1.9 细胞摄取实验
制备FITC 染料标记的脂质体LEP-FITC 和LEHP-FITC。 将处于对数生长期的小鼠乳腺癌细胞(4T1)按每孔1×105个接种到6 孔板中,放入培养箱培养过夜。 分别加入含5 μg·mL-1的LEP 或LEHP 的基础培养基,继续培养12 h,将含有药物的培养基吸出。 用PBS 洗涤3 次后,将细胞消化并用成像流式细胞仪检测。
1.10 细胞水平ROS 检测
通过DCFH-DA 探针(活性氧检测试剂盒)检测药物刺激下细胞产生的ROS 的含量。 将处于对数生长期的小鼠乳腺癌细胞(4T1)按每孔1×105个接种到6 孔板中,放入培养箱培养过夜。 分别加入含5 μg·mL-1的LEP 或LEHP 的基础培养基,继续培养12 h,将含有药物的培养基吸出。 用PBS 洗涤3 次后,加入含有DCFH-DA 的基础培养基继续培养20 min。 用PBS 洗涤3 次后,将细胞从6 孔板中消化处理后,并用成像流式细胞仪检测。
1.11 统计学分析
实验数据采用GraphPad Prism 9 软件和SPSS 22.0 软件进行数据统计和分析,符合正态分布的计量资料用均数±标准差(±s)表示,多组间的比较采用单因素方差分析(one-way ANOVA),组件两两的比较采用独立样本t检验,若不符合正态分布则用秩和检验,P<0.05 表示具有统计学差异。
2 结果
2.1 脂质体最优制备条件筛选
按照不同配方制备脂质体,并检测其PTX 包封率和Hb 含量。 由于在使用纳米挤出机时无法隔氧操作,多次实验发现血红蛋白浓度>3 mg·mL-1时,存在挤出难度大和实验重复性差的问题,因此最终选择配方为DPPC、DOPE 和胆固醇摩尔比为7 ∶2 ∶1,水化介质Hb 浓度为3 mg·mL-1(表1)。
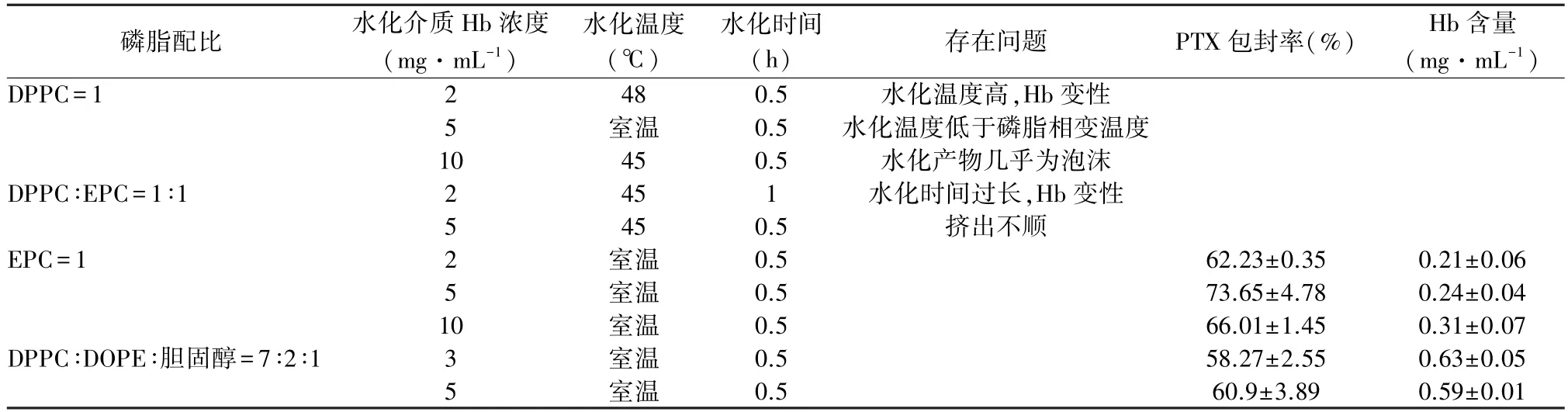
表1 不同配方制得脂质体(n=3)Table 1 Liposomes of different formulations(n=3)
2.2 脂质体表征及包封率
采用2.1 中最优配方制备脂质体LEP 和LEHP,通过动态光散射法(dynamic light scattering,DLS)检测脂质体的粒径尺寸分布(表2)。 LEP 和LEHP 粒径分别为(168.90±3.36)nm 和(189.17±8.22)nm,多分散系数为0.15±0.012 和0.14±0.023。 通过HPLC 检测PTX 浓度, LEP 和LEHP的PTX 包封率分别为(83.32±4.43)%和(58.27±2.55)%。 结果表明能够通过经典薄膜法同时包封PTX 和Hb,获得粒径均一的脂质体。
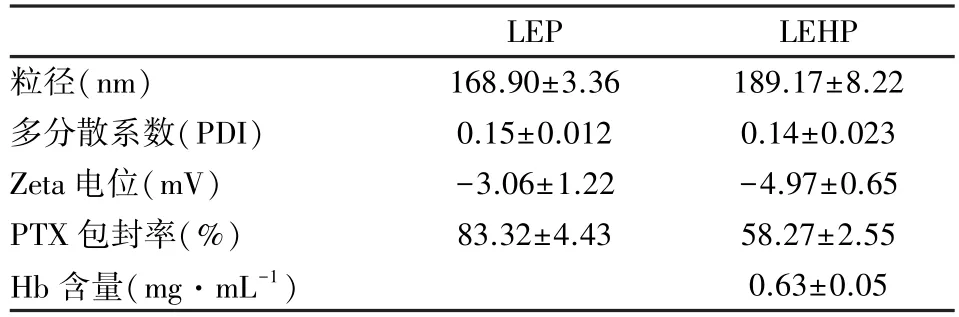
表2 脂质体表征及包封率(n=3)Table 2 Characterization and encapsulation efficiency of liposomes(n=3)
2.3 细胞毒性实验(MTT)
采用MTT 法检测不同药物对4T1 细胞的抑制作用,低氧或常氧条件下,4T1 细胞与不同浓度LEP 及LEHP 培养24 h(图1A)或48 h(图1B)后的细胞存活率,细胞存活率越低说明药物杀伤作用越强。 24 h 时,PTX 浓度为10 μg·mL-1时,常氧条件下LEHP 对4T1 细胞的杀伤作用强于LEP(P<0.05);PTX 浓度为100 μg·mL-1时,低氧条件下LEHP 对4T1 细胞的杀伤作用强于LEP(P<0.05)。48 h 时,低氧条件下不同浓度PTX 时,LEHP 对4T1 细胞的杀伤作用都强于LEP(P<0.05)。
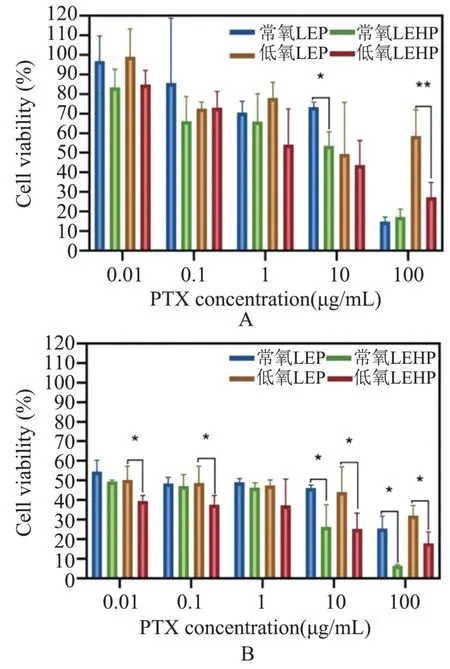
图1 常氧或低氧条件下小鼠4T1 乳腺癌细胞存活率Figure 1 Survival rate of mouse 4T1 breast cancer cells under normoxia or hypoxia conditions
2.4 小鼠4T1 乳腺癌细胞ROS 荧光定量
小鼠4T1 乳腺癌细胞与LEP 和LEHP 孵育4 h后,成像流式细胞仪检测4T1 细胞ROS 荧光量代表性图像,第1 列(Ch02)显示细胞ROS 荧光图像,第2 列(Ch04) 显示细胞的明场图像,第3 列(Ch02/Ch04)显示明场细胞与ROS 荧光的合并图像。 4T1 细胞与LEP(n= 2 645) 和LEHP(n=3 221)孵育4 h 后,荧光值分别为(0.78±0.16)×108和(1.43±0.16)×108(P<0.05)(图2)。
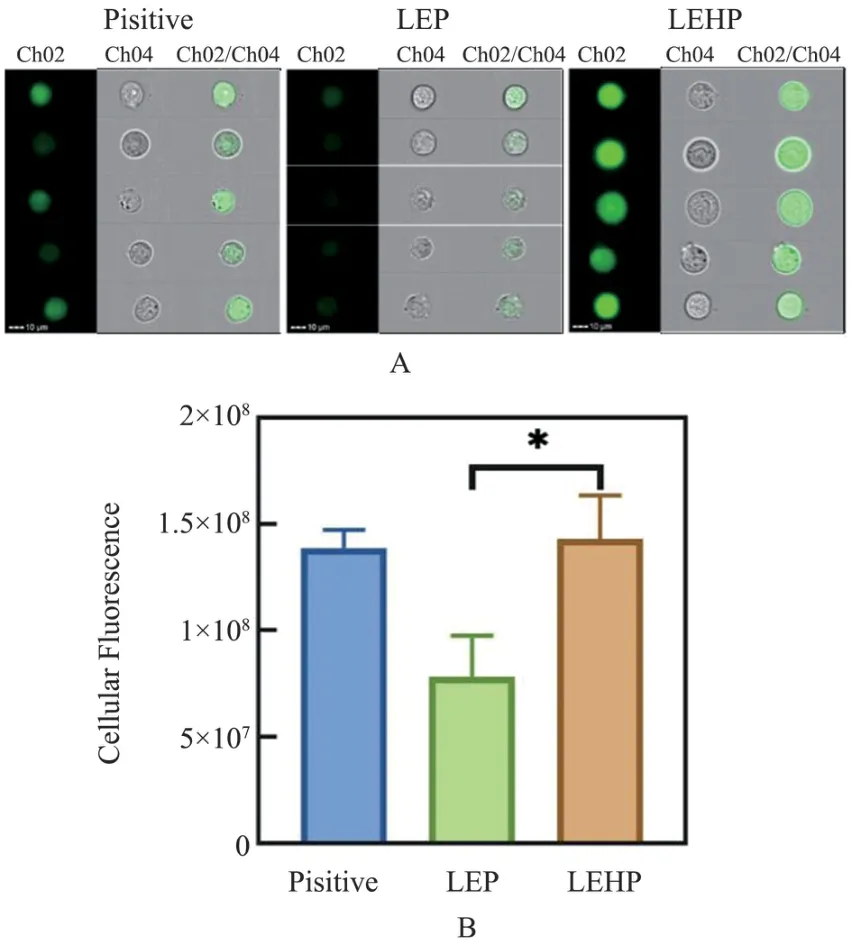
图2 与脂质体孵育4 h 后,小鼠4T1 乳腺癌细胞ROS 含量Figure 2 ROS content of mouse 4T1 breast cancer after 4 h incubation with liposomes
2.5 cells 小鼠4T1 乳腺癌细胞对脂质体的摄取
成像流式细胞仪检测4T1 细胞摄取脂质体的代表性图像,第1 列(Ch01)显示细胞的明场图像,第2 列(Ch02)显示被摄取的脂质体荧光图像,第3列(Ch01/Ch02)显示明场细胞与被摄取脂质体荧光的合并图像。 小鼠4T1 乳腺癌细胞对LEP 和LEHP 的摄取率(%)分别为43.8±2.5 和51.4±1.6(P<0.05)(图3)。
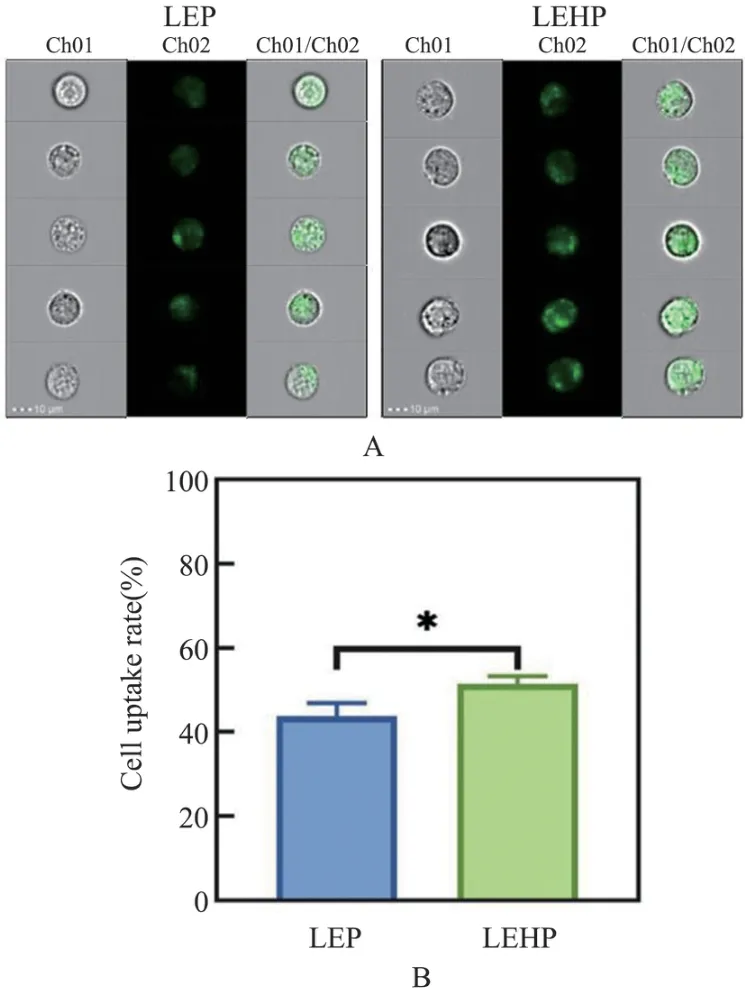
图3 小鼠4T1 乳腺癌细胞对脂质体的摄取实验Figure 3 Characterization of mouse 4T1 breast cancer cells uptake of liposomes
3 讨论
缺氧是实体瘤的特征之一,与肿瘤化疗抵抗密切相关,因此,可以通过改善肿瘤部位缺氧提高化疗疗效。 Ohguri 等[16]利用高压氧联合化疗药卡铂,在小鼠鳞状细胞癌中能减缓肿瘤生长,高压氧治疗虽然能增加肿瘤等低氧组织的氧含量,但会整体提高全身各组织的氧含量,导致较强的全身毒性,存在一定局限性。 Song 等[17]制备了1 种全氟碳纳米粒增敏肿瘤放疗,利用全氟碳分子释放氧气改善肿瘤缺氧从而增强肿瘤疗效,然而全氟碳只能通过氧浓度梯度释放氧气,效率低下。 上述方式的氧气递送效率低,且可能造成全身毒副作用,因此,有必要开发更安全高效的递氧方式。 本研究引入Hb,具有生物相容性好,高氧分压结合氧,低氧分压释放氧的特点,能安全有效的改善肿瘤缺氧微环境。 本研究选用的DOPE 磷脂是1 种pH 响应磷脂,酸性条件下脂质体负载正电,在肿瘤组织pH呈弱酸性的条件下不稳定,其磷脂双分子层容易破坏从而释放药物,能使制备的脂质体获得靶向肿瘤的能力,提高肿瘤部位药物富集量,能同时将氧气和化疗药物递送至肿瘤部位,改善肿瘤缺氧导致的化疗抵抗,提高化疗疗效,降低药物全身毒性[18-19]。脂质体制备的水化过程中通常需要在磷脂相变温度以上进行,而血红蛋白不稳定,且易氧化成高铁血红蛋白而失去携释氧功能,由于加热可能会导致Hb 的变形,结合表一的结果,我们选择在室温条件下进行水化。 本研究制备的脂质体粒径均在(100~200)nm 之间,且粒径分布集中。 肿瘤细胞为了快速生长,会大量分泌血管内皮生长因子等与血管生成有关的生长因子,而新生的肿瘤血管血管通透性强,同时,肿瘤组织因缺少淋巴管导致淋巴回流受阻,这一特点能使纳米载体更易穿过肿瘤血管壁,在肿瘤组织中富集且不被淋巴回流带走,长期存在于肿瘤组织,称为高通透长滞留效应(enhanced permeability and rention effect, EPR 效应),能使纳米载体被动靶向肿瘤组织[20-21]。 有研究证明,当载药NPs 粒径<20 nm,更易通过外渗和肾脏排出,如果粒径>200 nm 则更易被网状内皮系统捕获,因此在20 ~200 nm 之间的NPs 能具有更好的EPR 效应和更长的血液半衰期[22-25]。 通过考察脂质体的粒径、多分散系数及药物包封率,最终确定最优配方为DPPC、DOPE 与胆固醇摩尔比为7 ∶2 ∶1,紫杉醇用量为3 mg,水化介质为3 mg·mL-1Hb-PBS 溶液,水化温度为室温,水化时间为0.5 h,制备的脂质体具有稳定均一的粒径、良好的药物包封率,且能被动靶向肿瘤组织,实现氧载体和化疗药在肿瘤部位富集并发挥疗效的作用。
MTT 实验结果中低氧条件下细胞存活率高于常氧条件下,表明低氧会导致化疗药物细胞毒性降低,为肿瘤低氧的微环境诱导肿瘤产生化疗抵抗提供了证据。 LEHP 组引入Hb,能通过供氧克服低氧环境,从而逆转低氧条件下肿瘤的耐药,因此低氧条件下LEHP 的细胞毒性较LEP 显著提高。 Yang等[26]制备了同时负载Hb 和化疗药多柔比星的脂质体,在多种肿瘤细胞系的MTT 实验中均表现出更强的肿瘤杀伤作用,也表明Hb 供氧可以缓解低氧条件,逆转低氧诱导的肿瘤化疗耐药。 ROS 实验结果(图2A)能明显看出LEHP 组ROS 荧光强于LEP 组,约为LEP 组的1.8 倍,表明LEHP 组能产生更多ROS,与相关报道一致[27]。 ROS 主要包括羟自由基(·OH)、超氧阴离子(O2·-)、单线态氧和过氧化氢(H2O2)等,可以氧化破坏主要的细胞成分,最终导致肿瘤细胞死亡[28-30]。 我们通过低渗法提取的血红蛋白溶液包含了葡萄糖氧化酶(GOx)、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)等,GOx 能催化葡萄糖生成H2O2,在消耗肿瘤细胞中葡萄糖的同时为芬顿反应提供了H2O2。同时,血红蛋白中富含Fe2+,与肿瘤微环境中大量存在的H2O2发生芬顿反应产生羟基自由基(·OH)和Fe3+,Fe3+可以与H2O2或超氧自由基(·)反应被还原成Fe2+,而后继续发生芬顿反应,该循环被称为Harber-Weiss 反应[31]。 肿瘤的化学动力治疗(CDT)氧化应激引起肿瘤细胞损伤从而协同化疗药提高抗肿瘤疗效。 CDT 具有较高的肿瘤特异性,是利用肿瘤内H2O2发生芬顿反应产生ROS 破坏肿瘤细胞蛋白质和DNA 来杀死肿瘤细胞的新型肿瘤治疗策略,具有特异性高、毒副作用低且ROS 产率高等优势[32]。 内源性H2O2被基于铁的芬顿反应转化为高氧化的·OH,最终诱导细胞内氧化应激[33]。 细胞摄取实验结果可以清楚的看到LEP 和LEHP 在4T1 细胞中的分布(图3A),通过成像流式细胞仪将4T1 细胞对LEP 和LEHP 的摄取率进行定量分析(图3B),结果表明LEHP 组的摄取率高于LEP 组。 LEHP 的供氧作用、高ROS 产率及较高的细胞摄取率能更好地抑制肿瘤细胞的生长。
在本研究中,我们针对肿瘤微环境设计了1 种多功能LEHP,由pH 响应磷脂组成,同时负载了氧载体血红蛋白和化疗药物紫杉醇,能被动靶向肿瘤部位递送氧气改善肿瘤缺氧,用于克服肿瘤缺氧导致的耐药问题,提高化疗药物的疗效,实现安全有效的抗肿瘤治疗,有望成为1 种优良的肿瘤药物递送载体。
利益冲突说明/Conflict of Interests
所有作者均声明不存在利益冲突。
伦理批准/Ethics Approval
实验动物的管理和使用已通过中国医学科学院输血研究所伦理审查委员会评审(审批号:NO:2022036)。
作者贡献/Authors' Contribution
游训仪:实验设计、实验实施、实验数据分析、论文撰写;朱珂慧:实验设计;肖晶:实验实施;吴嘉康、郑诗凡、张阿龙:实验数据分析;王红、钟锐:论文校对;曹晔、刘嘉馨:论文审核、资金提供。

