淋巴细胞亚群及免疫球蛋白在孤独症谱系障碍儿童中的表达及临床意义
郭雪松,缪文静,冯秀娟,王大海,王春艳,陈丽晔
(首都医科大学附属北京儿童医院黑龙江医院/哈尔滨医科大学附属第六医院江南院区 康复科,黑龙江 哈尔滨,150010)
孤独症谱系障碍(ASD)是一种有生物学基础的神经发育障碍,特征包括社会交流、社会互动持续存在缺陷以及受限、重复的行为、兴趣和活动模式[1]。随着ASD病因学研究的不断深入,免疫学说被认为是ASD发病机制的主要因素之一,也是解释临床表型差异和病情严重程度等的一种方法[2]。相关研究[3]显示,ASD患者往往存在免疫失调,可引起淋巴细胞亚群及免疫球蛋白(Ig)表达异常,并发生多种淋巴细胞产生细胞因子失衡等现象,且促炎分子产生增多可能是ASD发生和病情加重的重要危险因素。本研究检测ASD患儿和健康体检儿童外周血淋巴细胞亚群及Ig表达水平并分析ASD患儿的免疫学病因,以期探寻儿童ASD潜在的生物学标志物,为儿童ASD的病因诊断和疗效判断提供参考依据。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年12月在本院康复科就诊的75例ASD患儿纳入研究组,其中男54例,女21例,平均年龄(2.95±0.20)岁。另选取同期在本院健康体检的75例儿童纳入对照组,其中男48例,女27例,平均年龄(3.10±0.65)岁。2组儿童性别、年龄比较,差异无统计学意义(P>0.05)。研究组纳入标准:符合美国《精神障碍诊断与统计手册》第5版(DSM-Ⅴ)中的ASD诊断标准,并应用国际通用儿童孤独症评定量表(CARS)协助诊断者。排除标准:① 聋哑儿童; ② 患有肿瘤或其他严重躯体疾病者; ③ 合并其他广泛性发育障碍者; ④ 合并21-三体综合征等遗传性疾病者; ⑤ 单纯语言发育障碍及其他诊断不明确的精神障碍性疾病患者。
1.2 方法
所有研究对象于禁食水4 h后抽取空腹静脉血4 mL,血液标本于2 h内进行检测。使用流式细胞仪以散射比浊法检测IgG、IgM、IgA水平,以四色免疫荧光抗体标记-流式细胞技术检测淋巴细胞亚群CD3+、CD4+、CD8+、CD56+CD16+、CD19+绝对计数,分别记录检测结果。通过国际通用的儿童孤独症评定量表(CARS)判断ASD患儿病情严重程度,量表总分最高为 60分,总分30~36分且少于5项的评分高于3分,为轻中度ASD,总分>36分且至少有5项的评分高于3分,为重度ASD。
1.3 统计学分析

2 结 果
2.1 淋巴细胞亚群绝对计数比较
研究组CD3+、CD4+绝对计数低于对照组,差异有统计学意义(P<0.05); 研究组CD8+绝对计数低于对照组,CD56+CD16+、CD19+绝对计数高于对照组,但差异无统计学意义(P>0.05),见表1。

表1 2组儿童外周血淋巴细胞亚群绝对计数比较 个/μL
2.2 Ig水平比较
研究组IgA、IgG、IgM水平低于对照组,差异有统计学意义(P<0.05),见表2。
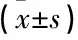
表2 2组儿童Ig水平比较 g/L
2.3 Ig水平与ASD病情严重程度的相关性分析
Pearson相关性分析结果显示,IgA水平与CARS总分呈显著负相关(r=-0.317,P=0.034),见图1; IgG、IgM水平与CARS总分均无相关性(r=-0.098、0.024,P=0.551、0.884)。
2.4 淋巴细胞亚群与ASD病情严重程度的相关性分析
Pearson相关性分析结果显示,淋巴细胞亚群CD3+、CD4+、CD8+、CD19+、CD56+CD16+绝对计数均与CARS总分无相关性(r=0.130、0.095、0.081、-0.228、0.083,P=0.393、0.535、0.597、0.132、0.589)。
3 讨 论
近年来,儿童ASD患病率呈逐年增高趋势,根据世界卫生组织(WHO)统计结果,全球儿童ASD估计患病率为0.76%[4]。美国疾病控制和预防中心(CDC)统计结果显示美国8岁儿童中约有1/36被诊断出ASD[5],中国目前的ASD估计患病率为0.7%[6]。ASD患病率逐年增高的原因可能与ASD识别、筛查、临床诊断方法不断增多,越来越多的既往被忽视的轻型病例被诊断出来有关。ASD病因复杂,目前多数学者认为遗传、神经、免疫和环境因素可能在ASD发病中共同发挥重要作用[7-8],其中免疫学说近年来越来越受到重视(免疫功能障碍能够导致神经系统损伤,引发神经发育障碍,从而出现ASD核心症状)。但ASD的确切病因迄今尚未阐明,且缺少辅助诊断及判定疗效的生物学指标,治疗手段以康复训练对症治疗为主,对于核心症状仍缺乏行之有效的治疗药物,治疗周期长,患者家庭经济负担重。因此,进一步探索ASD的病因与机制,寻找可辅助诊断ASD及判定疗效的生物学指标,对于ASD的预防、早期诊断和对因治疗尤为重要。
MOLLOY C A等[9]研究发现,ASD患者的总淋巴细胞水平下降,T淋巴细胞水平异常。GUPTA S[10]发现,约35%的ASD患儿存在CD4+T细胞减少现象。ASHWOOD P等[11]研究发现,确诊ASD儿童CD4+Th细胞分泌的细胞因子白细胞介素(IL)-1β、IL-6、IL-8和IL-12p40水平显著升高,而这些细胞因子水平升高与ASD核心症状和异常行为的加重有关。相关研究[12]显示,ASD患者存在淋巴细胞亚群失衡现象,淋巴细胞功能发生改变,尤其是T细胞亚群。本研究结果显示,研究组CD3+、CD4+绝对计数均低于对照组,差异有统计学意义(P<0.05),与既往研究[10]结论一致,提示ASD患儿存在总T淋巴细胞、辅助T细胞降低情况和细胞免疫功能异常。本研究结果还显示,研究组CD8+、CD56+CD16+、CD19+绝对计数与对照组比较,差异无统计学意义(P>0.05),与既往研究[10]结论不完全一致,考虑与ASD患儿具有临床表型异质性及样本量相对较少、数据可能存在偏倚有关,有待未来扩大样本量继续深入研究。
WARREN R P等[13]发现,约有20%的ASD患者IgA水平低下,且该缺陷与人白细胞抗原-DR相关。既往研究[14-15]发现,ASD患者血浆Ig水平降低,各型Ig比例改变,其中IgG、IgM水平降低,且其降低与ASD行为检查表(ABC量表)得分呈负相关。但考虑到ABC量表是家长问卷形式的ASD筛查量表,具有一定主观性和局限性,本研究选用国际通用的ASD诊断量表CARS,可通过观察孩子自主行为进行评估,避免了家长主观性偏差分析。本研究结果显示,研究组IgA、IgG、IgM水平均低于对照组,差异有统计学意义(P<0.05),说明ASD患儿血清中存在初次免疫应答及再次免疫应答异常,且存在体液免疫功能异常情况。本研究还发现,CARS总分与IgA水平呈显著负相关,而CARS评分越高表示ASD核心症状越严重,提示IgA水平越低的ASD患儿病情越严重,从另一角度验证了ASD患儿存在Ig异常表达和体液免疫功能异常情况。但本研究并未发现IgG、IgM水平与CARS总分(ASD病情严重程度)具有相关性,亦未发现淋巴细胞亚群水平与CARS总分(ASD病情严重程度)具有相关性,与既往研究结论不同,考虑与研究对象年龄范围不同及样本量不同有关,有待进一步扩大研究对象年龄范围及样本量深入探究。
本研究发现,ASD患儿外周血淋巴细胞亚群绝对计数及Ig水平异常,存在细胞免疫及体液免疫功能障碍,临床医师可将部分淋巴细胞亚群绝对计数及Ig检测指标(CD3+、CD4+、IgA、IgG和IgM)作为辅助诊断ASD的潜在生物学指标。IgA水平降低的ASD患儿病情更严重,故IgA可以作为判定不排除免疫学病因的ASD患儿病情严重程度的生物学指标之一,此类患儿治疗前后检测IgA表达水平可判定病情轻重程度,达到评估疗效的目的,从而更好地指导临床治疗。
相关研究[16-17]证实免疫功能障碍与ASD行为特征之间的联系及其在识别具有特定免疫表型ASD中的作用。研究[18]发现,常用的体液免疫谱(IgA、IgG和IgE)检测能够识别退行性ASD儿童,敏感性为79%,特异性为83%,支持该疾病的自身免疫发病机制。长期以来,ASD一直被认为与大脑中各种组织发育异常有关。相关研究[19]报道,在6个月至4岁的自闭症患儿中,蛛网膜下腔脑脊液增加。死亡ASD患者大脑和脑脊液中可发现促炎细胞因子、激活的小胶质细胞和星形胶质细胞,这是神经炎症的迹象[20]。研究[21]证实,成年ASD患者脑脊液中的细胞因子谱发生改变。此外,抗炎与促炎细胞因子失衡引起的免疫改变以及转录因子信号通路的调节与ASD的发生有关[22]。ASD目前尚无可彻底治愈的方法,近年来提出的免疫系统功能障碍或可成为一个潜在的治疗靶点[23-24]。2018年MELAMED I R等[25]应用高剂量Ig进行免疫治疗,改善了部分ASD患者重复刻板行为及社会交流障碍等临床症状。一项关于静脉注射Ig治疗ASD的荟萃分析[24]显示,ASD患儿总IgG水平较低,IgG4亚类水平较高,但各研究之间存在差异,总体而言Ig治疗是一种有效的ASD潜在治疗方法。此外,研究[26-28]报道了干细胞移植在ASD患者中的临床应用效果,其利用基于干细胞免疫调节特性的细胞疗法在细胞水平上解决了神经发育异常问题,这些与ASD免疫学病因相关的免疫治疗有望为未来ASD的靶向药物治疗提供指导方向。
综上所述,ASD儿童外周血中淋巴细胞亚群及Ig表达水平异常,且这些异常所致免疫功能障碍与儿童ASD发病密切相关,CD3+、CD4+、IgA、IgG和IgM可作为儿童ASD免疫学病因筛查及辅助诊断的潜在生物学指标。检测外周血淋巴细胞亚群绝对计数及Ig水平变化,可进一步辅助判断ASD患儿是否存在免疫学病因及病情轻重程度,未来临床医师或可通过免疫治疗改善ASD患儿的核心症状,为ASD的靶向治疗提供科学的参考依据。由于研究对象年龄范围相对局限,样本量相对较少,且未能开展中枢免疫细胞相关检查,本研究尚存在一定局限性,未来应扩大研究对象年龄范围及样本量开展多中心随机双盲研究及动物模型实验进一步验证。

