脑心肌炎增强型绿色荧光蛋白嵌合病毒的构建
徐超 杨晓炼 朱书
摘 要 携带增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP)的脑心肌炎(Encephalomyocarditis virus,EMCV)嵌合病毒是研究该病毒体内外生物学特性的有力工具。因此,本研究基于前期构建的巨细胞病毒(Cytomegalovirus,CMV)感染性克隆,在EMCV基因组2A蛋白序列之后插入EGFP基因片段,并将重组质粒转染BHK-21细胞,获得携带EGFP的嵌合病毒。通过荧光定量PCR(real-time PCR)、间接免疫荧光(Indirect immunofluorescence assay,IFA)及半数组织细胞感染量测定(Median tissue culture infective dose,TCID50)等方法对拯救病毒的基因组复制、蛋白表达及病毒粒子的感染性进行测定,结果证实嵌合病毒能够在BHK-21细胞上成功表达EGFP并产生完整的病毒粒子。然而,相较于野生型亲本拯救病毒,嵌合病毒在BHK-21细胞上的复制能力降低,并且在连续传代后逐渐失去绿色荧光信号,表明嵌合病毒中EGFP基因的插入对EMCV病毒粒子的组装释放具有不良影响,并在传代过程中逐渐累积导致EGFP功能丧失的缺失和突变。
关键词 脑心肌炎病毒; 增强绿色荧光蛋白; 嵌合病毒
脑心肌炎病毒(Encephalomyocarditis virus,EMCV)是一种人兽共患病毒,属于微RNA病毒科心病毒属,与同科的脊髓灰质炎病毒、肠道病毒71型以及柯萨奇病毒一样,是通过粪口途径传播的病毒之一。EMCV具有广泛的宿主嗜性,主要感染啮齿类、猪及灵长类动物,并导致腦炎、心肌炎、生殖障碍和糖尿病等多系统疾病。
携带绿色荧光蛋白(GFP)的嵌合病毒是研究病毒感染、复制以及致病性的有力工具,是插入病毒基因组的一种常用外源基因。Engel-herbert等[1]利用重组新城疫病毒中GFP的自发荧光,对器官外植体和原代气管细胞中被病毒感染的细胞进行追踪。GFP也为流式细胞术监测感染提供了一种简便、直接、快速的方法。如Dominguez等[2]利用流式细胞术检测重组痘苗病毒中的GFP标记,并将其与细胞类型特异性标记物结合使用,显示了其在研究病毒趋化性中的实用性。此外,利用GFP能用来直接观测病毒在细胞间的传播,如Duprex等[3]拯救了一株表达增强型绿色荧光蛋白的重组麻疹病毒,借助共聚焦显微镜实时监测嵌合病毒感染人星形细胞瘤细胞后在细胞间的传播。Plattet等[4]在犬瘟热病毒中插入了一段EGFP序列,从而能够敏感地追踪活细胞中病毒的感染,继而研究病毒在自然宿主中的持续感染和毒力。可见,插入了外源GFP片段的嵌合病毒,能够为相关病毒的体内外研究提供巨大便利。
因此,本研究基于前期构建的CMV感染性克隆,在EMCV基因组2A蛋白序列之后插入EGFP基因片段,并将重组质粒转染BHK-21细胞,以期获得携带EGFP的嵌合病毒,为开展EMCV的感染特性、致病机制和相关疾病模型构建等研究提供有力工具。
1 材料与方法
1.1 细胞、病毒和试验动物
BHK-21细胞购于中国科学院细胞库(ATCC)编号为GNHa10;EMCV BJC3毒株由中国农业大学农业部动物流行病学重点实验室分离和鉴定,浙江大学肠道微生物互作与动物健康实验室保存(以下称本实验室);实验动物:无特定病原体(Specific Pathogen Free,SPF)级别的6~8周龄C57BL/6J小鼠购买于南京模式动物所,在独立通风笼具(IVC)中饲养。
1.2 载体和菌株
pRK5-EGFP模板质粒:由本实验室保存;平末端T载体pEASY-Blunt购自擎科生物技术有限公司;大肠杆菌DH5α购于全式金生物技术有限公司。
1.3 主要试剂
高保真PCR酶、无缝克隆试剂盒购自擎科公司;胶回收试剂盒购自美国OMEGA生物技术公司;去内毒素质粒大提试剂盒购自美国OMEGA生物技术公司;质粒大提试剂盒购自德国QIAGEN生物公司;THUNDERBIRD Probe One-step qRT-PCR Kit:购自日本TOYOBO公司;反转录试剂盒:购自InvitrogenTM公司;EMCV VP1、VP2蛋白的鼠源单克隆抗体(McAb)、EMCV阴性SPF鼠血清:由本实验室制备保存;HRP标记的兔抗鼠IgG、IgA、IgM二抗:购自Abcam公司。
1.4 引物设计
在EMCV的2A序列后插入EGFP基因(将EGFP的终止密码子突变成了GAA)和 T2A基因,设计引物见表1。
1.5 扩增模板质粒pRK5-EMCV的引物
根据EMCV-BJC3株基因组序列,将2A序列之前的片段分成两段进行扩增。首先,在模板质粒pRK5-EMCV的3′端序列和第1~29位碱基处设计引物F(1~29),在模板质粒的第3 955~ 4 005位碱基设计引物R1(3 955~4 055),利用引物F/R1扩增EMCV基因组中约4 000 bp大小的片段。其次,在3 955~4 005处设计引物F1(3 955~4 005),与引物R1互补,并在模板质粒第4 764~4 787位碱基处和EGFP的第1~21位设计引物R2(4 764~4 787+EGFP),利用F1和R2可得到约850 bp大小的片段。利用F/R1和F1/R2这两对引物便可将EMCV的2A序列之前的片段扩增下来,引物序列见表1,均由杭州有康公司合成。[FL)]
1.6 扩增外源片段EGFP和T2A的引物
在模板质粒4 764~4 787和EGFP的第1~21位碱基处,设计与R2互补的引物F2(4 764~ 4 787+EGFP),在EGFP序列的第697~717位和T2A(共51个核苷酸)的第1~42位碱基处设计引物R0,并将EGFP末端的终止密码子突变为GAA,同时,在T2A的第20~51位碱基和模板质粒第4 788~4 812位处设计引物R。
首先利用引物F2/R0扩增EGFP片段,然后利用引物F2/R在EGFP片段末端连接T2A片段,经过两次扩增,可得到含有 EGFP+T2A的基因片段。引物序列见表1,均由杭州有康公司合成。
1.7 外源片段的扩增
利用引物F/R1,扩增模板质粒,获得大小为4 kb的片段EMCV-4000;利用引物F1/R2扩增模板质粒,获得大小为850 bp 的片段EMCV-850;利用引物F2/R0和F2/R扩增获得含有EGFP和 T2A基因的片段EGFP-T2A-820。使用I-5TM 2×High-Fidelity Master Mix(擎科公司)进行扩增,将PCR产物用于琼脂糖凝胶电泳和片段回收,获得上述3个片段。由于获得的3个片段之间含有互补的序列,利用融合PCR进行连接。利用琼脂糖凝胶电泳分离鉴定融合PCR产物,切取目的片段回收并测定浓度,获得连接后的全长大小约为5 kb。最后将插入片段和线性化的模板质粒进行同源重组,将重组质粒转染感受态细胞,冻存保存。
1.8 重组质粒的鉴定
首先设计鉴定引物F和R,采用PCR凝胶电泳对电泳结果进行鉴定分析,其次将PCR产物克隆培养,送公司测序,最后对比酶切图谱进行 分析。
1.9 嵌合病毒拯救及毒力检测
采用去内毒素的质粒大提试剂盒(QIAGEN Plasmid Maxi Kit)提取含有重组嵌合病毒基因全长的EMCV-EGFP质粒,并利用分光光度计测定获得的质粒浓度。利用脂质体2000(Lipofectamine 2000,LIP 2000)轉染试剂进行转染,每隔一段时间观察细胞病变(cytopathic effect,CPE)、增强绿色荧光蛋白表达和转染效率,以确定病毒拯救成功与否。
1.10 重组质粒转染BHK-21细胞后的RNA拷贝数检测
F0代将“1.9”的细胞转染36 h后,用TRIzol法提取RNA,并使用DNaseⅠ(RNase-free)对RNA进行纯化,取适量处理后的RNA,利用real-time PCR检测嵌合病毒EMCV-EGFP的RNA拷贝数。 F1代将重组质粒EMCV-EGFP转染BHK-21细胞36 h后,收取转染后细胞样品,反复冻融3次,离心去除细胞碎片后,取上清接种于BHK-21细胞。于接种36 h后取细胞上清,利用TRIzol法提取RNA,利用real-time PCR检测嵌合病毒EMCV-EGFP的RNA拷 贝数。
1.11 嵌合病毒感染BHK-21细胞后的病毒滴度测定
F0代将BHK-21细胞按照适当密度接种于96孔细胞培养板,取“1.9”中转染后36 h细胞上清样,用2%DMEM按照10-2到10-10进行10倍梯度稀释,100 μL/孔接种于96孔板的细胞上,最后一列加2%DMEM作为阴性对照。于48 h后观察细胞病变并统计,计算TCID50。F1代将重组质粒EMCV-EGFP转染BHK-21细胞36 h后,收取转染后细胞样品,反复冻融3次,离心去除细胞碎片后,取上清接种于BHK-21细胞。于接种36 h后取细胞上清,用2%DMEM按照10-2到10-10进行10倍梯度稀释,100 μL/孔接种于96孔板的细胞上,最后一列加2%DMEM作为阴性对照。于48 h后观察细胞病变并统计,并计算TCID50。
2 结果与分析
2.1 重组质粒EMCV-EGFP的鉴定和测序分析
以重组质粒EMCV-EGFP为模板,利用引物F/R(序列见表1)对插入片段进行PCR扩增,PCR产物使用0.8%琼脂糖凝胶进行电泳鉴定大小,结果获得5 kb大小的目的条带,初步证明外源片段与模板质粒重组成功。
同时,将获得的重组质粒送测序验证(杭州有康公司),将测序结果与模板质粒pRK5-EMCV及EGFP、 T2A的基因序列进行比对,结果完全一致,表明外源片段EGFP和 T2A成功插入模板质粒,且没有发生突变。
2.2 嵌合病毒的拯救
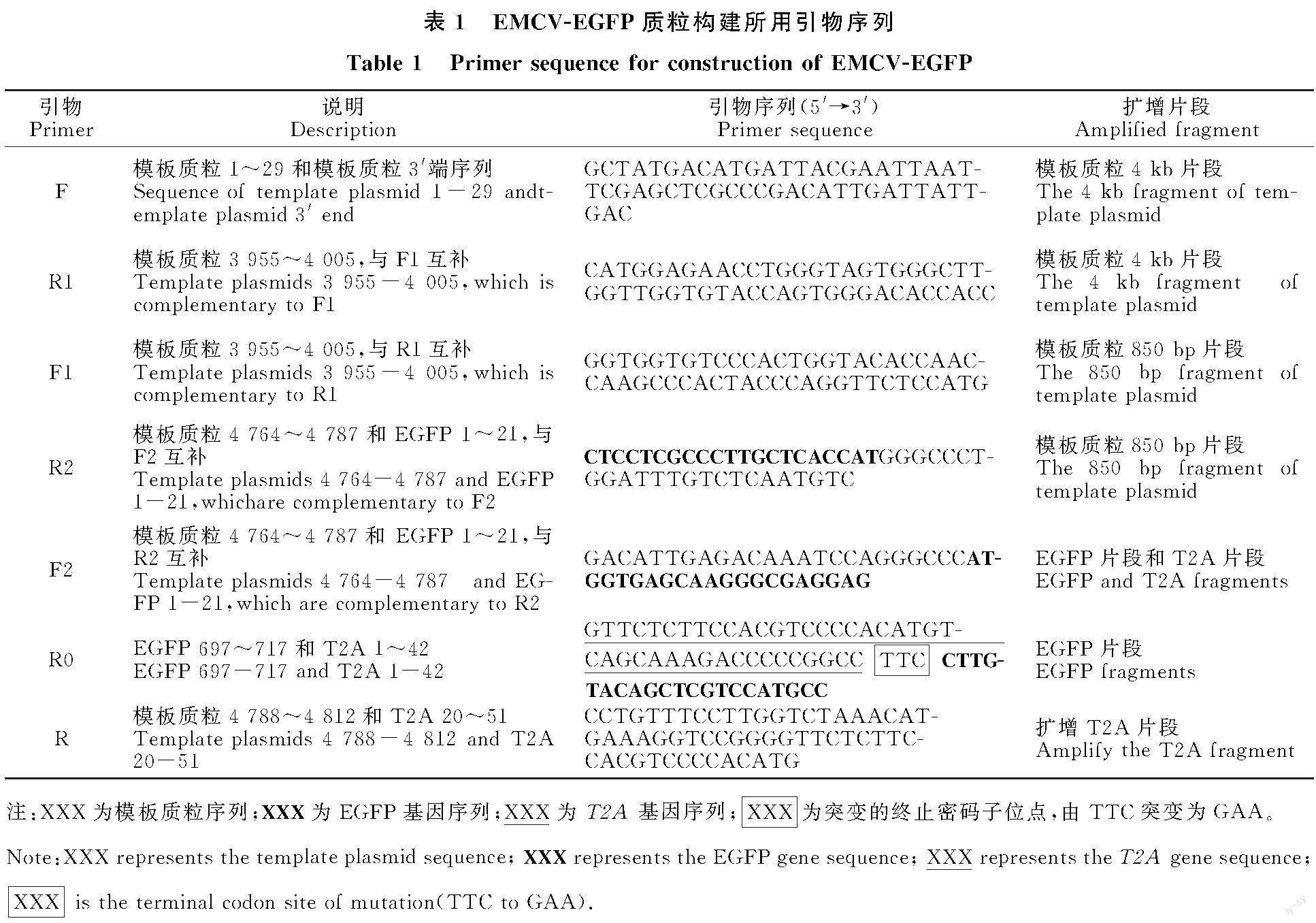
将重组质粒EMCV-EGFP转染BHK-21细胞后,观察是否导致细胞病变,并在荧光显微镜下观察EGFP的表达情况(图1)。
结果显示,阳性对照EMCV-RV感染的细胞在16 h开始出现病变,至24 h细胞完全病变,而EMCV-EGFP孔在24 h时几乎没有看到细胞病变,大约在36 h开始出现少量病变。
阳性对照pRK5-EGFP质粒在转染16 h便出现荧光,在24 h左右达到最大值,EMCV-EGFP在24 h时开始有绿色荧光蛋白表达, 在36 h左右达到最大值,但荧光数量和强度要低于pRK5-EGFP孔。
以上结果说明,相对于拯救病毒EMCV-RV,嵌合病毒在BHK-21细胞上的感染增殖能力下降,对BHK-21细胞的毒力减弱。
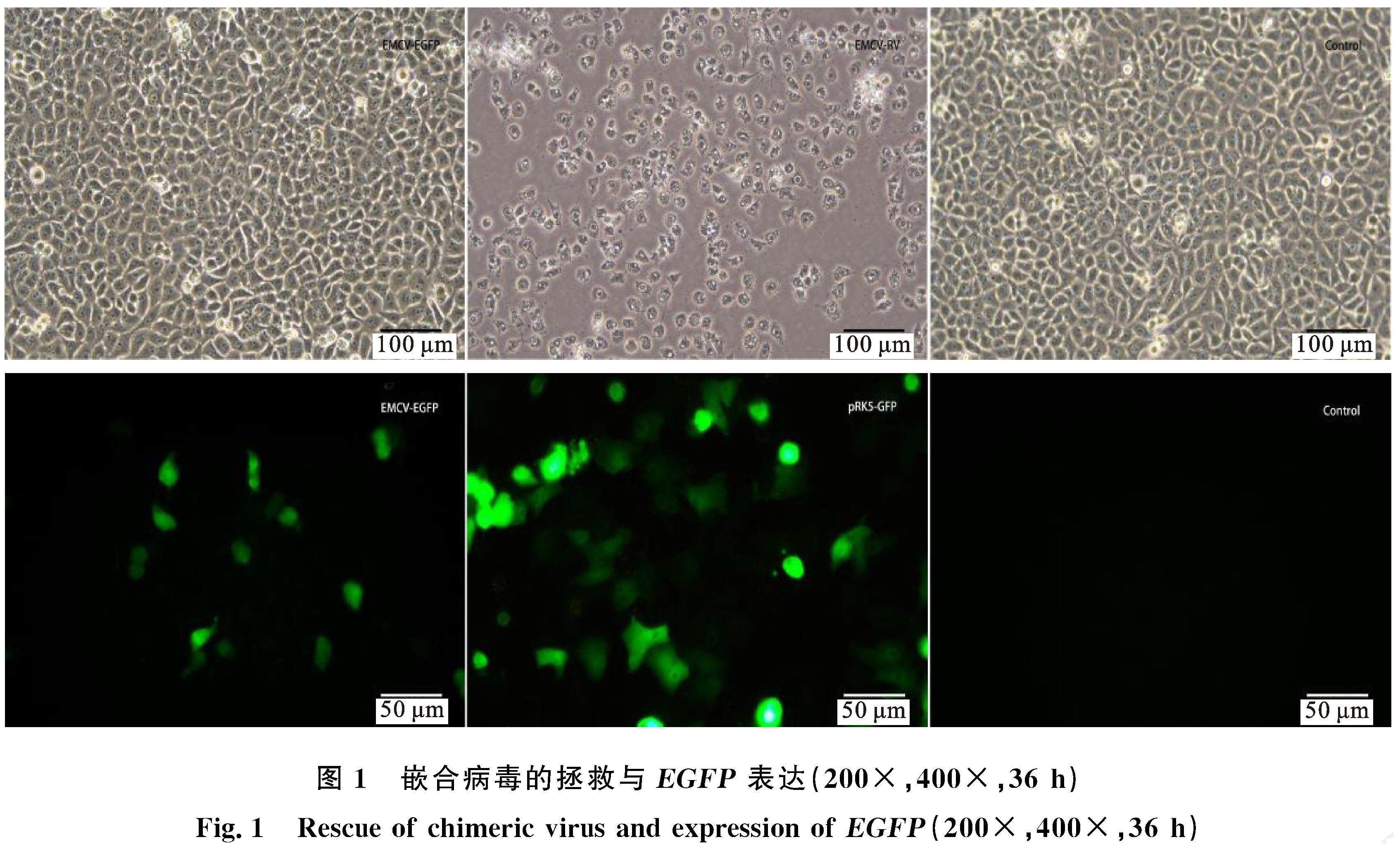
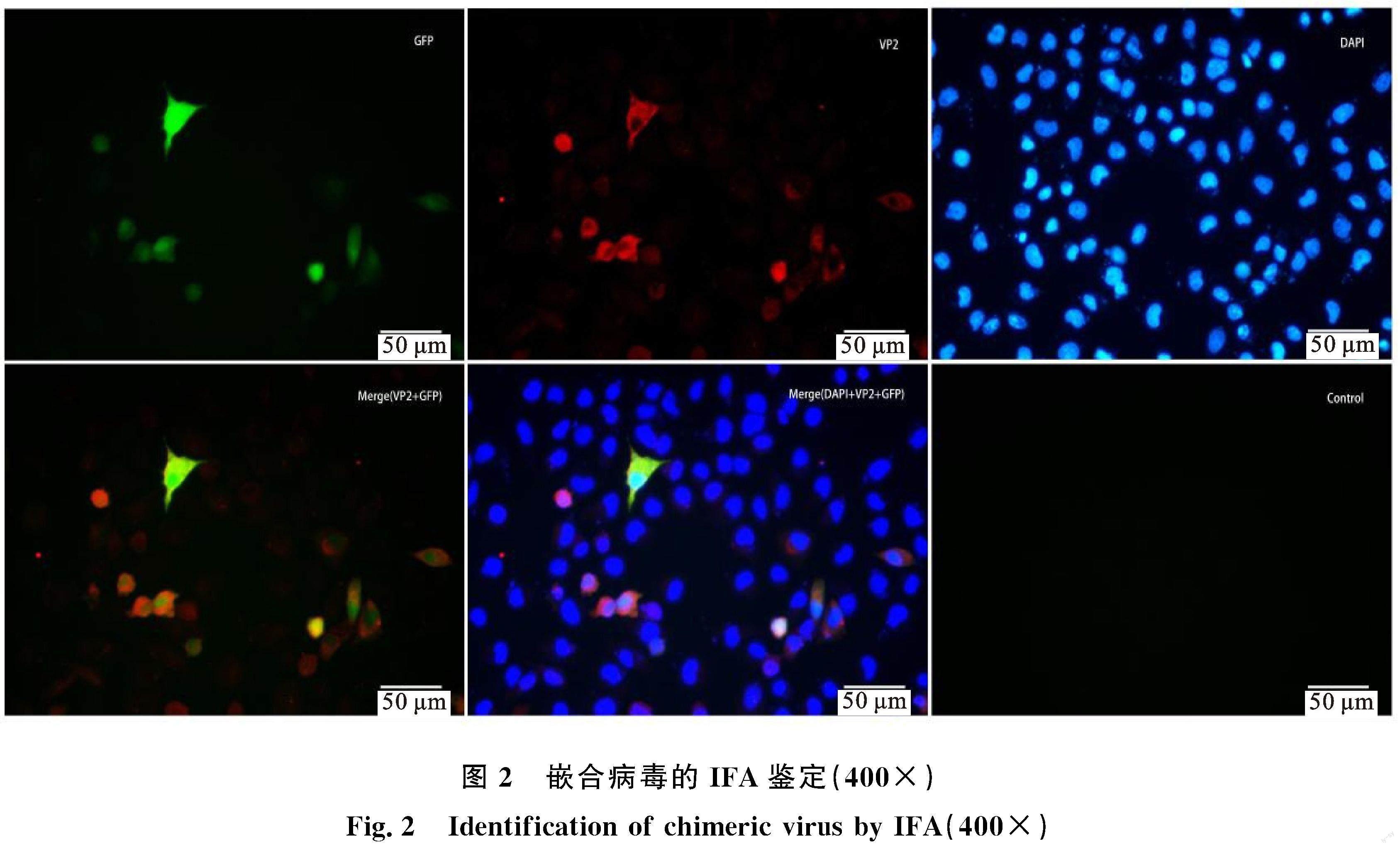
2.3 免疫荧光(IFA)检测嵌合病毒蛋白的表达
将EMCV-EGFP质粒转染BHK-21细胞后24 h的样品做IFA,结果如图2所示。可见,EMCV的衣壳蛋白VP2(红色荧光标记)在细胞内表达,而插入的EGFP在同一细胞内发出绿色荧光,说明插入片段能够伴随着病毒的复制而表达。[FL)]
2.4 嵌合病毒的基因组RNA拷贝数检测
将重组质粒EMCV-EGFP和野生型感染性克隆质粒pRK5-EMCV转染BHK-21细胞后,在36 h收样,并取冻融液提取RNA并用DNsae纯化,以去除质粒对病毒RNA检测的干扰,然后利用real-time PCR检测嵌合病毒EMCV-EGFP的RNA拷贝数,3次重复试验的检测结果见表2。
结果表明,EMCV-EGFP转染BHK-21细胞后仍然能够产生子代病毒RNA,但是相对于野生感染性克隆质粒pRK5-EMCV来说,RNA拷贝数有所下降。
2.5 嵌合病毒感染BHK-21细胞后的病毒滴度测定
将重组质粒EMCV-EGFP和野生型感染性克隆质粒pRK5-EMCV、突变感染性克隆质粒EMCV-T776A转染BHK-21细胞后,36 h取样,检测F0代病毒滴度;同时继续接种细胞,检测F1代病毒滴度,统计结果如表3所示。
拯救病毒和突变病毒在转染F0代均能检测到病毒粒子,且在F1代时病毒滴度增加了约100倍,但是嵌合病毒EMCV-EGFP在F0代和F1代均只能检测到低水平的病毒滴度,说明嵌合病毒感染BHK-21细胞并产生完整病毒粒子的能力下降。
3 讨 论
一般来说,要检测细胞或者组织内的病毒粒子,主要通过检测病毒蛋白或者核酸的水平来确定。而另一种方法则是在病毒基因组内插入外源基因标记,从而间接检测病毒感染情况。增强型绿色荧光蛋白(EGFP)已经被广泛应用于多种病毒的标记,对于体外或者体内感染细胞的鉴定十分方便直观。
本研究构建了带有EGFP标记的EMCV嵌合病毒,能够产生病毒基因组RNA拷贝且能产生完整病毒粒子,借助荧光显微镜可以在被感染的细胞内观测到EGFP的表达。然而,相较于野生型亲本拯救病毒,嵌合病毒在BHK-21细胞上的复制能力降低,并且在连续传代后逐渐失去绿色荧光信号,表明嵌合病毒中EGFP基因的插入对EMCV病毒粒子的组装释放具有不良影响,并在传代过程中逐渐累积了导致EGFP功能丧失的缺失和突变。
一方面,对于微RNA病毒科的病毒来说,基因大小的增加,会对完整病毒粒子的包装产生影响。有研究表明,比脊髓灰质炎病毒(Polioviruses)基因长度多17%的重组病毒可以正常复制和包埋,但是插入的基因片段对病毒复制会产生不利影响。然而,如果将脊髓灰质炎病毒或者门戈病毒(Mengovirus)的基因延长20%以上,会妨碍病毒粒子的包装,从而影响完整病毒粒子的产生[5-6]。与脊髓灰质炎重组病毒有关的研究表明,外源性病毒结构可能会对病毒的复制周期产生干扰[7-8]。比如当泰勒病毒(Theilers virus)的基因组增加了724个碱基(nt)时,病毒的复制会受到一定的抑制[9];当门戈病毒的基因组增加459 nt时,与亲本病毒相比,重组病毒的复制推迟且产量有所下降[10]。同样可以推测,在EMCV中插入长度约为700 bp的外源EGFP片段,对EMCV的病毒复制周期产生了影响,并且抑制了完整病毒粒子的包装和释放。
另一方面,嵌合病毒EMCV-EGFP在BHK-21细胞上生长缓慢且难以产生完整病毒粒子的原因可能是插入的EGFP片段对2A蛋白的功能产生了影响。EMCV的2A蛋白基因位于病毒衣壳蛋白基因VP1之后,它是一种17 ku的小蛋白(图3),由143个氨基酸组成,具有高度碱性,被认为是EMCV除了L蛋白外的第二个病毒安全蛋白[11]。有研究证实,2A是影响EMCV致病性的关键蛋白,野生型EMCV能导致小鼠急性死亡,但是2A蛋白缺失的毒株却对小鼠无明显毒性作用,不导致其死亡[12]。在体外,2A蛋白缺失的病毒会影响病毒粒子的释放,并且细胞出现病变的时间延后,细胞存活率增加,这与前述研究结果相吻合,在2A蛋白后插入了外源片段的嵌合病毒在BHK-21细胞上也表现出与之相似的特性。此外,2A蛋白还能抑制细胞凋亡(图4)。当2A蛋白的功能受到影响时,病毒在细胞内的复制引起宿主细胞启动凋亡程序,从而抑制了病毒的进一步增殖[13]。
总之,本研究在基于CMV启动子构建的EMCV感染性克隆基础上,使用了融合PCR的方法插入外源EGFP片段,此构建策略使得插入的外源基因不会引入任何冗余片段,减少了对病毒基因组的影响,且试验操作相对简单易行。本研究已证实嵌合病毒能够在BHK-21细胞上增殖,且能够在荧光显微镜下观测到EGFP的表达,接下来将进一步优化嵌合病毒的构建方法,并研究低代病毒对动物靶器官的感染能力,實现对体内病毒感染的追踪,研究病毒的发病和传播机制,为相关疾病模型的深入研究提供有力工具。
参考文献 Reference:
[1] ENGEL-HERBERT I,WERNER O,TEIFKE J P,et al.Characterization of a recombinant Newcastle disease virus expressing the green fluorescent protein[J].Journal of Virological Methods,2003,108(1):19-28.
[2] DOMINGUEZ J,LORENZO M M,BLASCO R.Green fluorescent protein expressed by a recombinant vaccinia virus permits early detection of infected cells by flow cytometry[J].Journal of Immunological Methods,1998,220(1/2):115-121.
[3] DUPREX W P,MCQUAID S,HANGARTNER L,et al.Observation of measles virus cell-to-cell spread in astrocytoma cells by using a green fluorescent protein-expressing recombinant virus[J].Journal of Virology,1999,73(11):9568-9575.
[4] PLATTET P,ZWEIFEL C,WIEDERKEHR C,et al.Recovery of a persistent Canine distemper virus expressing the enhanced green fluorescent protein from cloned cDNA[J].Virus Research,2004,101(2):147-153.
[5] ALEXANDER L,LU H H,WIMMER E.Polioviruses containing picornavirus type 1 and/or type 2 internal ribosomal entry site elements:genetic hybrids and the expression of a foreign gene[J].Proceedings of the National Academy of Sciences of the United States of America,1994, 91(4):1406-1410.
[6] BINDER JJ,HOFFMAN M A,PALMENBERG A C.Genetic stability of attenuated mengovirus vectors with duplicate primary cleavage sequences[J].Virology,2003,312(2):481-494.
[7] MATTION N M,REILLY P A,DIMICHELE S J,et al.Attenuated poliovirus strain as a live vector:expression of regions of rotavirus outer capsid protein VP7 by using recombinant Sabin 3 viruses[J].Journal of Virology,1994,68(6):3925-3933.
[8] MUELLER S,WIMMER E.Expression of foreign proteins by poliovirus polyprotein fusion:analysis of genetic stability reveals rapid deletions and formation ofcardioviruslike open reading frames[J].Journal of Virology,1998,72(1):20-31.
[9] ZHANG L,SATO S,KIM J I,et al.Theilers virus as a vector for foreign gene delivery[J].Journal of Virology,1995,69(5):3171-3175.
[10] ALTMEYER R,ESCRIOU N,GIRARD M,et al.AttenuatedMengo virus as a vector for immunogenic human immunodeficiency virus type 1 glycoprotein 120[J].Proceedings of the National Academy of Sciences of the United States of America,1994,91(21):9775-9779.
[11] AGOL V I,GMYL A P.Viral security proteins:counteracting host defences[J].Nature Reviews Microbiology,2010,8(12):867-878.
[12] CAROCCI M,CORDONNIER N,HUET H,et al.Encephalomyocarditis virus 2A protein is required for viral pathogenesis and inhibition of apoptosis[J].Journal of Virology,2011,85(20):10741-10754.
[13] EDINGER A L ,THOMPSON C B.Death by design:apoptosis,necrosis and autophagy[J].Current Opinion Cell Biology,2004,16(6):663-669.
Construction of Encephalomyocarditis Virus for Enhancement of Green Fluorescent Protein Chimeric Virus
Abstract Chimeric Encephalomyocarditis Virus (EMCV) with an enhanced green fluorescent protein (EGFP) insertion is a powerful tool for investigating biological characteristics both in vitro and in vivo. In this study,we introduced the EGFP coding gene at the downstream flank of the genome sequence that encodes EMCV 2A protein on the basis of previously constructed cytomegalo virus(CMV)-driven infectious clone. The EGFP chimeric virus was obtained by transfecting BHK-21 cells with the recombinant plasmid.We evaluated genomic replication,protein synthesis,and the infectivity of chimeric viral particles through real-time PCR,immunofluorescence assay (IFA),and TCID50 assay. The collective data demonstrated that recombinant plasmid transfection resulted in viable chimeric virus progenies expressing EGFP in BHK-21 cells. However,the chimeric virus exhibited hampered replication capacity and gradually diminished green fluorescence signals through passages. This suggests that EGFP genetic insertion impaired the assembly and release of chimeric virus particles,and the accumulated depletion and mutation during continuous passaging gradually led to the malfunction of EGFP.
Key words Encephalomyocarditis virus; Green fluorescent protein enhancement; Chimeric virus

