水仙环素的抗肿瘤活性及机制研究进展
杨 敏 ,林琪琪 ,刘丹丹 ,周宏宇
(1)昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2)昆明医科大学现代生物医药产业学院,云南 昆明 650500)
据研究表明,在我国,每年有近300 万人因恶性肿瘤而死亡,仅次于心脑血管疾病[1]。根据世界卫生组织的数据,每年死于癌症的人数超过800 万,约占全球死亡总数的13%。据估计,未来几十年内,癌症确诊人数将持续上升[2]。但由于肿瘤细胞具有不同亚群,一些亚群凭借其异质性,可以逃避靶向药物的杀伤[3];当前的靶向药物开发不够;已开发的药物选择性差、副作用强,肿瘤的治疗面临多重困难。因此寻找更具选择性的靶向肿瘤细胞的有效抗癌药物极为重要。
水仙环素(narciclasine,NCS,图1)[4]是一种天然植物生长抑制剂,存在于包括水仙在内的石蒜科开花植物中。NCS 于1967 年首次从几种水仙属的球茎中分离出来[5],已被证明具有抗肿瘤[6]、抗炎[7]、抑制血管生成[8]和抗病毒[9]的活性。美国国家癌症研究所(national cancer institute,NCI)在 60 种特定人类肿瘤细胞系中进行筛选发现,NCS 对各种癌细胞系具有广泛的细胞毒性[10]。另有研究显示NCS 对肿瘤细胞显示出较高的细胞毒性和选择性。体内抗肿瘤研究也显示,口服或注射NCS 均能显著抑制肿瘤生长,并提高荷瘤小鼠存活率[11]。
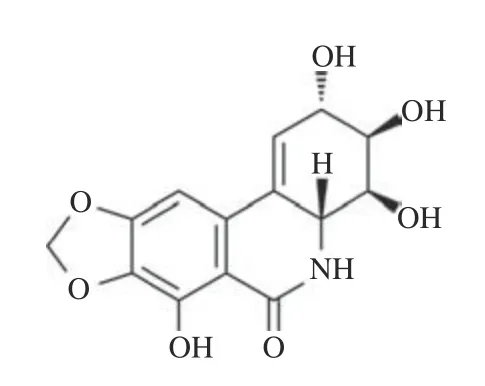
图1 水仙环素的化学结构[4]Fig.1 Chemical structure of NCS
综上所述,NCS 具有较强的体内外抗肿瘤活性,且相比于其它细胞毒类化合物,具有选择性好、安全性高的特点[12-13]。NCS 主要通过诱导肿瘤细胞凋亡和抑制肿瘤细胞增殖来实现其抗肿瘤作用,目前这种选择性的细胞毒作用在临床肿瘤治疗上是最为理想的[14],因此,NCS 有望成为临床上预防和治疗癌症的有效药物。尽管NCS 的抗肿瘤作用显著,但其潜在的抗肿瘤靶点和机制仍然知之甚少。因此有必要对NCS 抗肿瘤活性与机制进行深入研究,以发现其抗肿瘤靶点,这对NCS 类抗肿瘤新药的研究具有重要的意义。本文就NCS 近年来的抗肿瘤活性与机制研究进展进行系统阐述。
1 NCS 抑制乳腺癌细胞的作用及其分子机制
1.1 NCS 通过抑制蛋白质合成抑制乳腺癌细胞生长
Ceriotti 等[5]的研究显示,当以低剂量皮下给药时,NCS 对S-180 小鼠腹水瘤细胞显示出有效的抗有丝分裂活性。马德里生物学研究所的研究人员发现,NCS 的抗肿瘤以及许多其它生物活性与NCS 对真核生物核糖体蛋白合成的有效抑制有关。另外,该研究人员进一步评估了NCS 对HeLa 细胞生长以及对细胞DNA、RNA 和蛋白质合成的影响,结果表明,NCS 对HeLa 细胞表现出强大的生长抑制活性,这是由于NCS 能抑制细胞蛋白质和DNA 合成,而RNA 合成不受影响,并且抑制蛋白质合成所需的浓度范围与完全抑制HeLa 细胞生长所需的最小抑制浓度(minimum inhibitory concentration,MIC)值较为一致[15]。
1.2 NCS 通过调节AMPK-ULK1 信号轴以诱导乳腺癌细胞自噬依赖性细胞凋亡
使用MTT 法测定NCS 对MCF-10A 乳腺细胞和一组乳腺癌细胞系(MCF-7、MDA-MB-231、MDA-MB-468、BT-483、BT-549 以及 HCC1937)的细胞毒性作用,结果显示NCS 不影响MCF-10A 细胞的增殖,但可显著抑制其它所有乳腺癌细胞的增殖,尤其是HCC-1937 和MDA-MB-231 细胞。这表明NCS 对乳腺癌细胞具有选择性的细胞毒作用。另外,在HCC-1937 和MDA-MB-231 细胞中,NCS 能够显著诱导细胞自噬[16]。
三阴性乳腺癌(triple-negative breast cancer,TNBC)是预后最差的乳腺癌亚型之一,具有对化疗反应差、侵袭性和转移可能性高的特点。目前的研究发现,NCS 以剂量依赖性方式抑制TNBC细胞增殖并诱导细胞自噬和细胞凋亡。体内外研究结果表明,NCS 通过调节AMPK-ULK1 信号通路从而抑制TNBC 细胞增殖,并诱导自噬依赖性细胞凋亡[16]。
1.3 NCS 通过靶向STAT3 抑制乳腺癌细胞
信号转导及转录激活蛋白(signal transducer and activator of transcription 3,STAT3)被认为是一个潜在的抗肿瘤药物治疗靶点。研究显示,在广泛的人类恶性肿瘤中,包括肺癌、前列腺癌、乳腺癌、结直肠癌、胃癌、肝癌、黑色素瘤、卵巢癌、神经胶质瘤和胰腺癌等,STAT3 被持续或过度激活,并且与不良的临床预后有关[17-18]。研究显示,NCS 可以靶向MCF-7 细胞中STAT3 并抑制其磷酸化,而不影响STAT3 的总蛋白。然而,在他莫昔芬耐药的MCF-7/TR 细胞中,NCS 不仅抑制STAT3 的磷酸化,而且还通过蛋白酶体途径降解STAT3 总蛋白,显示出更好的细胞毒性。此外,另有研究揭示NCS 靶向STAT3 并抑制其在MCF-7 细胞中的磷酸化和活化,并通过活性氧(reactive oxygen species,ROS)依赖性蛋白酶体途径促进STAT3 总蛋白降解[19]。
1.4 NCS 通过下调CDC2 表达抑制乳腺癌细胞
细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)是细胞分裂周期基因(cell division cycle gene 2,CDC2)的表达产物,通过与细胞周期蛋白Cyclin B 结合从而激活自身的激酶活性。在细胞周期进程中,CDK1 与周期蛋白Cyclin B 结合形成有丝分裂促进因子(mitosis-promoting factor,MPF)发挥蛋白激酶活性,促进细胞周期的G2-M 期的转换。研究结果表明,NCS 对人乳腺癌MDA-MB-231 细胞产生抑制作用是通过抑制CDC2 的表达并阻滞细胞周期于G2/M 期实现的[20]。
1.5 NCS 通过抑制拓扑异构酶(topoisomerase,Topo)Ⅰ抑制乳腺癌细胞
DNA 复制过程中双链被分离,这种分离导致在复制叉之前形成DNA 正超螺旋,并在其后面形成子链DNA 相互缠绕[21-22]。如果形成的正超螺旋得不到松弛,复制叉的进展将受到阻碍,而未能重新连接的子链则会阻止细胞分裂的必要条件-基因组分离[23]。Topo 是负责控制DNA 拓扑结构的重要蛋白质,它不仅能有效地解决DNA 的拓扑问题,释放DNA 正负超螺旋的碱基张力,还能让DNA 复制、转录、翻译等细胞的基本生命活动顺利进行。有研究结果表明NCS 可与细胞Topo I的酶活性中心Ⅲ区域结合,阻碍Topo I 与DNA 结合,继而作为阻遏剂抑制Topo I 功能,导致DNA损伤[20]。
2 NCS 抑制结肠癌细胞的作用及其分子机制
NCS 可抑制结肠癌细胞的黏附与侵袭。基质金属蛋白酶(matrix metalloproteinases,MMPs)中MMP-1、MMP-2、MMP-7、MMP-9 和MMP-13是结肠癌预后不良的标志物[24]。这些蛋白质中的每一种都消化细胞外基质的一种成分,促进肿瘤细胞的内渗和外渗[25-26]。具体来说,MMP-1 和MMP-13 是胶原酶,MMP-2 是明胶酶,MMP-7消化多种蛋白质,包括胶原蛋白、明胶、层粘连蛋白、蛋白聚糖、纤连蛋白和弹性蛋白等。MMP-1 还会诱导与EMT 和转移相关的PI3K/Akt 信号传导[27]。研究显示,NCS(0.08µM)显著减少了两种细胞系(HCT-116 和LoVo 细胞)中MMP-1,MMP-2 和MMP-7 的分泌[28]。
细胞因子水平是结直肠癌患者总体或无病生存的预测因子,特别是白细胞介素-2(interleukin-2,IL-2),白细胞介素-6(interleukin-6,IL-6),白细胞介素-8(interleukin-8,IL-8),趋化因子配体-4(chemokine ligand-4,CCL-4),趋化因子配体-22(chemokine ligand-22,CCL-22),Fms 相关酪氨酸激酶3 配体(fms-like tyrosine kinase 3 ligand,FLT3L),γ 干扰素(interferon-γ,IFNγ),血管内皮生长因子(vascular endothelial growth factor,VEGF)和五聚蛋白3(Pentraxin 3)。重要的是,除了肿瘤微环境和炎症外,IL-6 和IL-8 在促进结直肠癌迁移和转移过程中也起着至关重要的作用[29-31]。数据表明,NCS 会减少与结直肠癌患者预后不良相关蛋白Pentraxin 3 和VEGF 的表达。
3 NCS 抑制胃癌细胞的作用及其分子机制
为了研究NCS 对胃癌细胞的影响,有学者[32]对中等和低分化型的BGC-823 和SGC-7901 胃癌细胞株,高度分化的MGC-803 和MKN28 细胞进行实验,发现NCS 可抑制胃癌细胞增殖,促进胃癌细胞的凋亡,并显示剂量和时间依赖性的特点。进一步的实验表明,其促进自噬蛋白微管相关蛋白1 轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ),自噬相关蛋白-5(autophagy related protein-5,Atg-5)和Beclin-1 的水平,降低了自噬转运蛋白p62 的表达,并增加了自噬流[32]。
细胞自噬是在自噬相关基因控制下使用溶酶体降解受损细胞器和大分子物质的过程,这是细胞的一种自我保护机制[33-34]。一方面,自噬可以更好地帮助肿瘤细胞适应外部压力并促进癌细胞增殖、侵袭以及增强其耐药性[35-36]。另一方面,当自噬持续激活时,它可以诱导癌细胞的自噬死亡[37-38]。研究表明,Akt/mTOR 信号传导通路与自噬密切相关[39-40]。NCS 能显著抑制胃癌细胞中AKT 和mTOR 的磷酸化,但不影响Akt 和mTOR总蛋白的表达水平;并且NCS 是通过抑制胃癌细胞中Akt/mTOR 通路从而诱导自噬、促进胃癌细胞凋亡,最终抑制胃癌细胞增殖[32]。
4 NCS 抑制黑色素瘤细胞的作用及其分子机制
因为黑色素瘤对促凋亡刺激有内在的抵抗力,所以对辅助治疗的反应率很低。有研究表明[41],NCS 通过靶向真核翻译延伸因子(eukaryotic translation elongation factor 1A,eEF1A),可以部分地克服这种抗性。在黑色素瘤细胞系中,NCS 对细胞生长抑制的IC50值在30~100 nm 之间,但对正常的非癌细胞的生长影响较小。在无毒剂量下,NCS 可显著提高大脑中携带转移性抗凋亡黑色素瘤异种移植物的小鼠的存活率。50 nM 的NCS 靶向eEF1A 诱导明显的肌动蛋白细胞骨架解体,导致胞质分裂受损和蛋白质合成受损(延伸和启动步骤)[41]。
5 NCS 抑制多形性胶质母细胞瘤细胞的作用及其分子机制
有研究发现,NCS 对人多形性胶质母细胞瘤表现出显著的细胞抑制作用,这种抑制作用与NCS 对有丝分裂率的明显抑制以及有丝分裂持续时间显著增加有关[42]。
研究表明,NCS 处理可增加细胞质中含肌动蛋白的应激纤维的数量和厚度。各项数据显示,经NCS 处理后的丝切蛋白(Cofilin),其磷酸化的增加至少维持了3 h。Cofilin,是主要LIM 结构域激酶(lim kinase,LIMK)的底物[43-44],不仅是Rho激酶(rho-associated kinase 1,ROCK1)也是磷酸丝氨酸/苏氨酸蛋白激酶的下游效应器。最近的研究表明,Cofilin 途径的总体活性决定了肿瘤细胞的侵袭性和转移性表型[45]。蛋白印迹结果表明,100 nmol/L NCS 可显著并迅速增加GL19 多形性胶质母细胞瘤细胞中磷酸丝氨酸/苏氨酸蛋白激酶、ROCK1 以及磷酸化LIMK1/2 的表达。瞬时激活RhoA 后,可诱导细胞中应力纤维和粘附复合物的形成,而各种Rho 亚型也与细胞迁移有关[46]。Rho GTP 酶家族还参与细胞骨架结构,细胞周期控制和基因表达[47]。因此,通过评估NCS 对RhoA 的影响,发现它明显增加了RhoA 在人多形性胶质母细胞瘤细胞中的活性。
以上研究证明,NCS 对人多形性胶质母细胞瘤表现出显著的细胞抑制作用是由于NCS 对Rho/ROCK/LIMK/cofilin 信号通路的调节导致肌动蛋白应激纤维稳定性和增殖灶粘附的增加[42]。
6 NCS 抑制口腔癌细胞的作用及其分子机制
NCS 可抑制人口腔癌细胞的运动,NCS 处理24 h 后的3 种细胞系(SAS、SCC-47、SCC-9)的运动能力降低是呈剂量依赖性的,并且NCS 对SAS和SCC-47 细胞系的影响大于SCC-9 细胞系。一项研究发现,经过NCS 的处理,细胞上皮标志物ZO-1 升高,但间充质标志物β-连环蛋白和N-钙粘蛋白减少。该研究证明了NCS 通过调节EMT(epithelial-mesenchymal transition,EMT)从而抑制口腔癌细胞的迁移以及侵袭[48]。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径是将细胞外信号转换为细胞内反应的关键信号级联。MAPK 相关蛋白参与细胞凋亡、增殖、自噬和转移的调节[49]。有研究发现,在SAS 和SCC-47 细胞中,用高剂量的NCS 处理后,口腔癌细胞中磷酸化细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)下调,而用不同剂量的NCS 处理后,磷酸化p38和磷酸化c-Jun 氨基端激酶(c-jun n-terminal kinase,JNK)则上调。为研究ERK、p38 和JNK与NCS 抑制细胞迁移之间的相关性,该研究在进一步的实验中使用ERK 抑制剂(U0126)、p38 抑制剂(SB203580)和 JNK 抑制剂(SP600125)。结果表明,U0126 而非 SB203580 或 SP600125 可与NCS 联合对抗癌细胞转移。以上研究表明,NCS可通过抑制ERK 信号通路从而抑制口腔癌细胞的转移。同时该研究还发现,组织蛋白酶(Cathepsin,CTSB)参与NCS 在口腔鳞状细胞癌中的抗转移作用[48]。
7 NCS 抑制原发性渗出性淋巴瘤细胞的作用及其分子机制
原发性渗出性淋巴瘤(primary effusion lymphoma,PEL)是一种侵袭性疾病,属于非霍奇金淋巴瘤的一种亚型,用常规化疗治疗时预后极差。Gopalakrishnan R 等[50]发现NCS 在低纳摩尔浓度下对PEL 表现出选择性细胞毒性,并且伴随着多聚二磷酸腺苷核糖聚合酶(poly adp-ribose polymerase,PARP)的裂解、半胱氨酸蛋白酶-3/7(caspase-3/7)的激活和膜联蛋白表面表达的增加,NCS 在G1 期阻止细胞周期进程并在PEL 中诱导细胞凋亡。进一步研究发现,NCS 处理既不诱导PEL 中KAPOSI 氏肉瘤相关疱疹病毒(KSHV)反式激活因子RTA(ORF50 )蛋白(KSHVRTA/ORF50)的表达,也不诱导PEL 中感染性KSHV 病毒粒子的产生。MYC 基因是一种属于编码核蛋白的癌基因,调节许多细胞活动,包括信号转导、细胞周期、增殖、分化和凋亡。MYC 在许多癌症中失调,并且与几乎三分之一的癌症有关[51]。尽管细胞中MYC 基因组位点在PEL 中结构完整,却存在MYC 的过度表达。有研究已经证明下调 MYC 表达的化合物对PEL 有效且具有选择性[52]。在Gopalakrishnan R 等[50]的研究中测试了NCS 及其结构类似物对包含5 种血液恶性肿瘤的一组细胞系(BC-1、BC-3、BCBL-1、JSC-1、BCP-1、VG-1、APK-1、UMPEL-1、UMPEL-3、DG-75、L428、L1236、MM1S、U266、RS4-11)的影响,结果表明,虽然以上所有癌细胞系都对NCS 及其结构类似物敏感,但PEL 衍生细胞系(BC-1、BC-3、BCBL-1、JSC-1、BCP-1、VG-1、APK-1、UMPEL-1、UMPEL-3)对NCS 及其结构类似物更加敏感。该研究还进一步证明了NCS 对PEL 的抑制活性与其下调 MYC 的能力有关。
8 小结
作为一种体外强效抗肿瘤药物,NCS 具有选择性高、作用广泛的特点,是理想的抗肿瘤候选药物。在体外抗肿瘤实验中,NCS 能阻滞肿瘤细胞周期,同时诱导肿瘤细胞凋亡、自噬,并且抑制肿瘤细胞的侵袭和转移等。其抗肿瘤效果是多方面多路径协同作用的,然而NCS 影响各通路的相关性并未明确阐述。同时,目前其体内抗肿瘤活性及确切的作用靶点还有待深入研究。对NCS抗肿瘤的不同机制以及作用靶点的探索将有利于开拓抗肿瘤药物研发的新方向。
综上所述,NCS 具有较强的体外抗肿瘤活性,具备一定的临床应用价值和潜力,但根据国内外有关NCS 的研究,其体内研究不够深入。因此,目前仍然需要更多的研究考察NCS 的体内抗肿瘤活性以及安全性。

