鸡减蛋综合征病毒中和性单克隆抗体的制备、鉴定及在双抗体夹心ELISA 中的应用
魏 蔷,李青梅,金前跃,宋亚鹏,白怡霖,张改平,
(1.河南省农业科学院 动物免疫学重点实验室/河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002;2.河南农业大学 牧医工程学院,河南 郑州 450002;3.郑州大学 农学院,河南 郑州 450001)
鸡减蛋综合征(Egg drop syndrome,EDS)是由减蛋综合征病毒(EDSV)感染引起的疾病。EDSV 感染会影响蛋鸡的生产能力,导致它们产出软壳、薄壳或无壳的蛋,并且蛋鸡的产蛋率也会显著下降,使养鸡业蒙受巨大的经济损失。EDS 于1976 年由荷兰科学家VAN ECK 等[1]首次发现并报道,随后世界各地相继分离出多株该病毒。在我国,李刚等[2]于1992 年从南京某发病鸡场分离到EDSV。目前,减蛋综合征已经成为世界范围内引起产蛋损失的主要病因之一。
EDSV 是一种无囊膜的双链DNA 病毒,具有典型的腺病毒形态。五邻体(Penton)、六邻体(Hexon)和纤维蛋白(Fiber)是腺病毒的3 个主要结构蛋白。Penton 和Fiber 以非共价键连接形成的复合物构成EDSV 二十面体的12 个顶点,Fiber 以三聚体的形式存在并向外伸展,形成纤突。纤维蛋白由3 个部分组成:N 端尾区(Tail)、多个三连β 螺旋重复片段构成的柄区(Shaft)和一个C 端的球状头区(Knob)。与其他腺病毒类似,纤维蛋白可能直接与宿主细胞表面受体相互作用,因而能够高效诱导机体产生病毒中和抗体[3-5],是最有效的保护性抗原以及血清学检测中的理想靶标。
单克隆抗体可在快速诊断疫病方面发挥关键作用,对于开发精确、灵敏和快速的诊断技术至关重要。在血清学试验中,EDSV 和其他禽腺病毒会有一定程度的交叉反应。因此,为了建立高特异性、高敏感性的EDSV 快速检测方法,克服潜在的交叉反应,应当使用抗EDSV 的单克隆抗体进行检测。以之前证明能够诱导机体产生高水平中和抗体的EDSV 纤维蛋白作为免疫原免疫BALB/c 小鼠,通过细胞融合和间接酶联免疫吸附试验(Indirect enzyme-linked immunosorbent assay,iELISA)以及间接免疫荧光试验(Indirect immunofluorescence assay,IFA)筛选,制备抗EDSV 的单克隆抗体,旨在为免疫检测试剂开发提供技术支撑,同时为EDSV 中和抗原表位研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞和病毒 小鼠骨髓瘤细胞株SP2/0、EDSV 127株(GenBank accession number:AC_000004)均由本实验室保存。鸭胚成纤维(Duck embryo fibroblast,DEF)细胞使用10~12 日龄鸭胚按常规方法制备[6]。
1.1.2 供试动物 6~8 周龄的雌性BALB/c 小鼠及经产母鼠均购自郑州大学医学院实验动物中心。
1.1.3 试剂 抗EDSV 阳性鼠血清由本实验室保存;商品化抗His 标签单克隆抗体购自Proteintech公司;DyLight 488 标记的兔抗鼠IgG 购自Abbkine公司;弗氏完全佐剂及弗氏不完全佐剂、PEG1500、HT、HAT 培养基购自Sigma 公司;RPMI 1640 培养基、FBS 胎牛血清购自Gibco 公司;DNA 提取试剂盒购自天根公司。
1.2 方法
1.2.1 重组EDSV 纤维蛋白的鉴定 参考本实验室此前文献报道方法[4],利用大肠杆菌表达系统表达、纯化得到重组EDSV 纤维蛋白。重组纤维蛋白的纯度及状态采用SDS-PAGE 鉴定,同时因纤维蛋白具有血凝活性,采用血凝试验(Hemagglutination,HA)鉴定重组蛋白血凝活性的方法测定其含量。
1.2.2 小鼠免疫 将5 只BALB/c 小鼠随机分为免疫组(4 只小鼠)和对照组(1 只小鼠)。免疫组共进行4 次免疫,免疫EDSV 纤维蛋白抗原,对照组皮下注射PBS。首次免疫采用弗氏完全佐剂,其余3 次免疫采用弗氏不完全佐剂,免疫时采用皮下多点注射,免疫剂量20 μg/只,免疫间隔21 d。在第4 次免疫后的14 d,收集小鼠的血清样本,并使用iELISA和IFA方法测定血清中的抗体效价。选择效价最高的小鼠进行细胞融合。在进行细胞融合之前,向小鼠腹腔注射不含佐剂的重组纤维蛋白,即每只小鼠以50 μg的纤维蛋白进行超免。超免3 d后,无菌条件下取出小鼠的脾脏,并制备脾脏细胞用于后续的细胞融合试验。
1.2.3 细胞融合及阳性杂交瘤细胞株筛选 超免后第3天,选取小鼠将其脱颈处死,按常规方法进行细胞融合[7]。使用含有HAT选择剂的培养基稀释融合细胞,并将其均匀分布到96孔细胞培养板中。培养10 d 后,使用纤维蛋白包被酶标板,采用iELISA方法鉴定杂交瘤细胞上清液。同时,使用IFA 方法对iELISA 方法检测所得阳性孔进行复检。选择经iELISA 法及IFA 法检测均为阳性的孔,扩大培养至24 孔板。在对24 孔杂交瘤细胞上清进行iELISA 和IFA 复测后,选择强阳性孔,使用有限稀释法连续进行亚克隆,最终得到能够稳定分泌EDSV 抗体的单克隆杂交瘤细胞株。
1.2.4 IFA 鉴定 按常规方法制备DEF 细胞,将细胞均匀加入96孔细胞培养板,培养1 d后(汇合度达到80%),每孔接种200 TCID50EDSV,继续培养48 h。以4%多聚甲醛固定细胞,随后加入0.1%Triton X-100通透,之后加入5%的脱脂奶粉于37 ℃封闭1 h。PBS 漂洗后,加入待测样品,37 ℃孵育30 min,PBS漂洗6 次,按照每孔50 μL 的量向细胞培养孔中加入1∶1 000 稀释的DyLight 488 标记的兔抗鼠IgG,37 ℃孵育30 min,弃去溶液,PBS 洗6 次,每孔加入100 μL PBS,置于倒置荧光显微镜下观察。
1.2.5 单克隆抗体腹水的制备及效价测定 预先对经产母鼠腹腔注射灭菌液体石蜡,10 d 后,向每只小鼠腹腔注射0.5 mL 处于对数生长期的单克隆抗体杂交瘤细胞(约3×106个细胞)。8~14 d 后,采集腹水,12 000 r/min 离心15 min,吸取上清保存于-20 ℃备用。同时使用iELISA 法及IFA 法检测腹水效价。
1.2.6 Western blot 鉴定单克隆抗体的反应性 取纤维蛋白加入上样缓冲液,高温加热后进行SDSPAGE 电泳,转印至PVDF 膜后,用5%脱脂奶粉37 ℃封闭2 h,随后试验组使用单克隆抗体腹水为一抗,阳性对照组使用商品化抗His 标签单克隆抗体为一抗,二者均采用HRP 标记的羊抗鼠IgG 为二抗,进行Western blot检测。
1.2.7 单克隆抗体的EDSV 中和效价检测 将倍比稀释后的单克隆抗体腹水与200 TCID50的EDSV 等体积混合,37 ℃孵育1 h;弃去DEF 细胞培养板(汇合度达到80%)中的培养基,每孔加入100 μL 的上述混合物,37 ℃孵育2 h;PBS漂洗后,加入RPMI 1640培养基,继续培养48 h。参照IFA 方法对细胞进行处理,检测时以阳性小鼠血清为一抗,DyLight 488标记的兔抗鼠IgG 为二抗,依据检测结果采用Reed-Muench法计算抗体中和滴度。
1.2.8 单克隆抗体的亚型鉴定 采用Proteintech 公司的单克隆抗体亚型鉴定试剂盒进行单克隆抗体的亚型鉴定,按照产品说明书进行操作。
1.2.9 使用棋盘法对单抗进行配对试验 利用GE Hitrap protein G 预装柱纯化单克隆抗体腹水,得到纯化后的单克隆抗体。利用Lightning-Link 试剂盒标记单克隆抗体,得到HRP标记的单克隆抗体。使用棋盘法对单克隆抗体进行配对试验。将HRP 偶联标记的单抗作为检测抗体;以未偶联HRP组的单抗包被酶标板捕获抗原用。利用1 μg/mL 的捕获单抗包被酶标板,每孔100 μL,4 ℃包被过夜;PBST 洗板3 次后,5%脱脂奶粉封闭,37 ℃温箱孵育2 h;洗板5 次后甩干,加入EDSV 纤维蛋白,质量浓度为1 μg/mL,37 ℃温箱孵育1 h;洗板后,加入检测抗体,工作浓度同为1 μg/mL,37 ℃静置1 h;显色:加入TMB显色,100 μL/孔,避光显色10 min;利用酶标仪测定OD450值。
1.2.10 基于单克隆抗体9G12和10E11的双抗体夹心ELISA 方法的建立 将单克隆抗体10E11作为捕获抗体,HRP-9G12作为检测抗体,建立双抗体夹心ELISA 方法,应用于EDSV 的检测。棋盘法确定10E11 和HRP-9G12 的最适反应浓度,对封闭液和封闭时间、包被抗体包被条件、抗原与捕获抗体的反应时间、显色时间进行优化。优化后的检测条件:使 用2 μg/mL 的10E11 包 被 酶 标 板,每 孔100 μL,4 ℃包被过夜;PBST 洗板4次后,5%脱脂奶封闭,37 ℃孵育2 h;洗板5 次后,加入待测样品,37 ℃温箱孵育1 h;洗板4 次后,加入稀释过的检测抗体HRP-9G12(0.8 μg/mL),每孔100 μL,37 ℃孵育1 h;洗板3 次后,加入TMB 显色,100 μL/孔,避光显色10 min;随后加入50 μL/孔终止液,酶标仪测定OD450值。使用该双抗体夹心ELISA 方法检测30 份EDSV 阴性样品,确定cut-off 值,cut-off 值=OD450平均值+3×标准差。
1.2.11 基于单克隆抗体9G12和10E11的双抗体夹心ELISA 方法的初步应用 将12 只SPF 鸡分成2组,试 验 组9 只,肌 肉 注 射 攻 毒200 μL EDSV(TCID50=10-6.4/mL),对照组3 只,注射PBS,攻毒后7 d取肝脏病料。取0.2 g病料加入1 mL PBS进行研磨,10 000 r/min 离心5 min,上清用双抗体夹心ELISA 方法进行抗原检测,沉淀使用DNA 提取试剂盒进行DNA 提取,随后采用荧光定量PCR 方法[4]进行抗原检测。
2 结果与分析
2.1 EDSV纤维蛋白的纯化与鉴定
利用大肠杆菌表达系统表达、制备EDSV 纤维蛋白,SDS-PAGE结果表明,重组纤维蛋白分子质量约为30 ku,纯化后蛋白质纯度可达95%以上。此外,在常温条件下,即便在SDS 存在的情况下,纤维蛋白仍以三聚体的形式存在(图1A),表明纯化所得纤维蛋白具备三聚体天然状态[8-11]。与EDSV 病毒粒子类似,纯化所得纤维蛋白能够凝集鸡红细胞,血凝效价为1∶27(图1B)。

图1 重组EDSV纤维蛋白SDS-PAGE鉴定及血凝活性检测结果Fig.1 Results of SDS-PAGE and hemagglutination assay of recombinant EDSV fiber protein
2.2 EDSV纤维蛋白免疫BALB/c小鼠血清效价
将第4 次免疫后14 d 的小鼠血清倍比稀释,分别用iELISA 和IFA 对免疫鼠及阴性鼠进行血清抗体效价检测。iELISA 结果表明,4 只免疫鼠血清的抗体效价均较高,2 号鼠和4 号鼠的血清抗体效价达到了1∶409 600(表1)。IFA检测结果显示,4只免疫鼠中同样可检测到高抗体效价,其中1 号鼠和4号鼠IFA效价达到了1∶12 800(表2)。因此,后续选择4号免疫鼠进行超免,用于取脾脏细胞制备杂交瘤细胞。
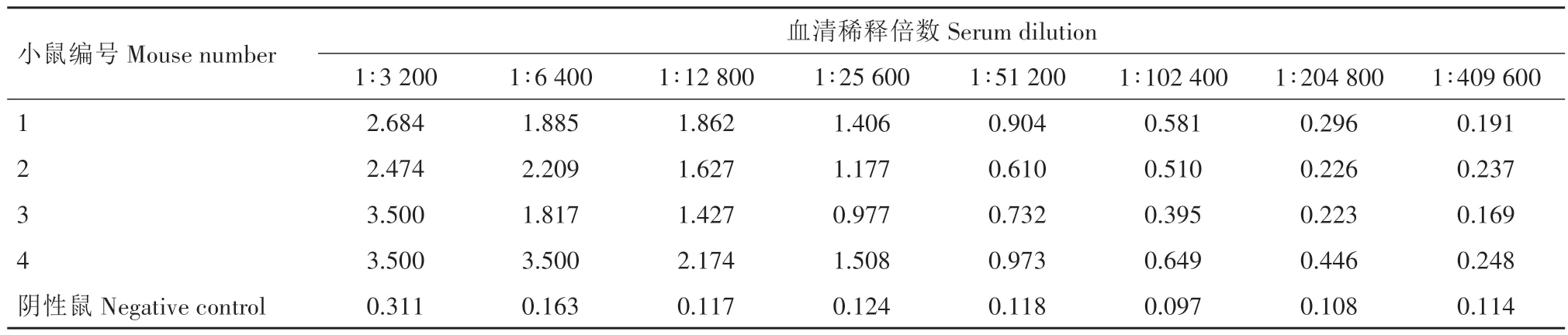
表1 EDSV纤维蛋白免疫鼠多克隆抗体血清iELISA效价Tab.1 The iELISA titers of polyclonal serum from mice immunized with EDSV fiber protein
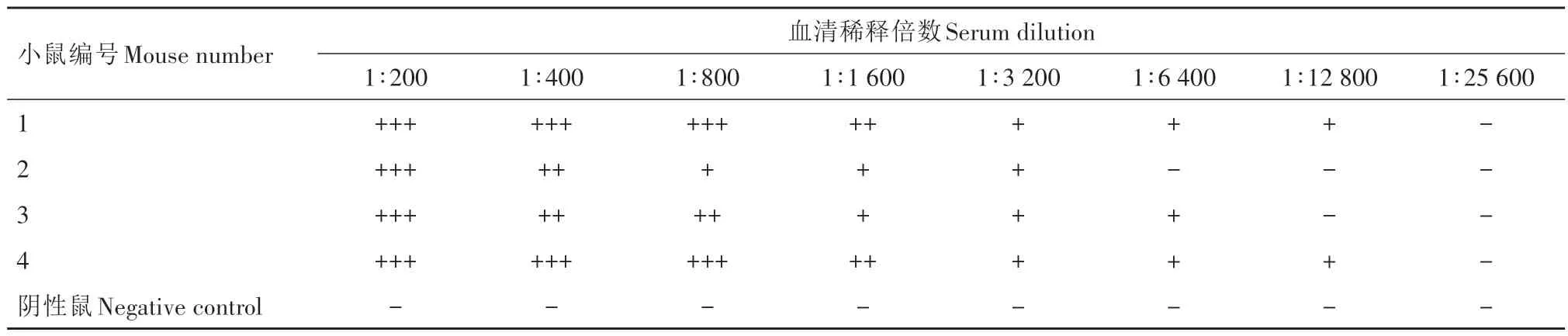
表2 EDSV纤维蛋白免疫鼠多克隆抗体血清IFA效价Tab.2 The IFA titers of polyclonal serum from mice immunized with EDSV fiber protein
2.3 抗EDSV中和性单克隆抗体的筛选
杂交瘤细胞生长10 d 后,利用iELISA 方法及IFA 方法筛选阳性杂交瘤细胞株,扩大培养后,再次复检,对强阳性孔进行亚克隆,收集单克隆杂交瘤细胞培养上清。将细胞培养上清与200 TCID50的EDSV 等体积混合,随后采用1.2.7 所述EDSV 中和效价检测方法检测细胞培养上清中单克隆抗体的中和活性,最终筛选得到2 株具有中和EDSV 感染活性的单克隆抗体9G12 和10E11。再次进行IFA验证,结果显示,单克隆抗体9G12 和10E11 均能与EDSV发生特异性反应(图2)。

图2 EDSV单克隆抗体9G12和10E11 IFA检测结果Fig.2 Detection of Monoclonal antibodies 9G12 and 10E11 against EDSV by IFA
2.4 抗EDSV中和性单克隆抗体腹水效价
利用iELISA 及IFA 方法分别检测9G12 和10E11 单克隆抗体腹水的效价,结果如表3 所示,iELISA 检测9G12 和10E11 单克隆抗体的腹水效价分别为1∶128 000 和1∶1 020 000;IFA 效价分别为1∶2 000和1∶8 000。

表3 单克隆抗体腹水iELISA及IFA效价Tab.3 Determination of monoclonal antibody ascites titers by iELISA and IFA
2.5 抗EDSV中和性单克隆抗体中和效价
将9G12 和10E11 的单克隆抗体腹水2 倍比系列稀释后与200 TCID50的EDSV 等体积混合,采用1.2.7所述EDSV中和效价检测方法进行检测。结果表 明,9G12 和10E11 的 中 和 效 价 分 别 为1∶27和1∶24。
2.6 抗EDSV中和性单克隆抗体的反应性
向纯化所得EDSV 纤维蛋白样品中加入上样缓冲液,高温加热后进行SDS-PAGE 电泳,转印至PVDF 膜后,5%脱脂奶粉37 ℃封闭2 h,随后试验组使用单克隆抗体腹水9G12 和10E11 作为一抗进行检测,对照组使用商品化抗His 标签单克隆抗体作为一抗进行检测。检测结果表明,试验组单克隆抗体9G12 和10E11 均不能识别变性的纤维蛋白(图3A、3B),对照组抗His 标签单克隆抗体则可以识别变性的纤维蛋白,且由于样品中仍有少量纤维蛋白聚体存在,Western blot 分析结果显示2 条带(图3C)。由于9G12 和10E11 在iELISA 及IFA 试验中与纤维蛋白及EDSV 均能产生特异性反应,但在Western blot 鉴定中却不识别变性的纤维蛋白,由此推断,9G12和10E11识别的纤维蛋白抗原表位为构象表位。
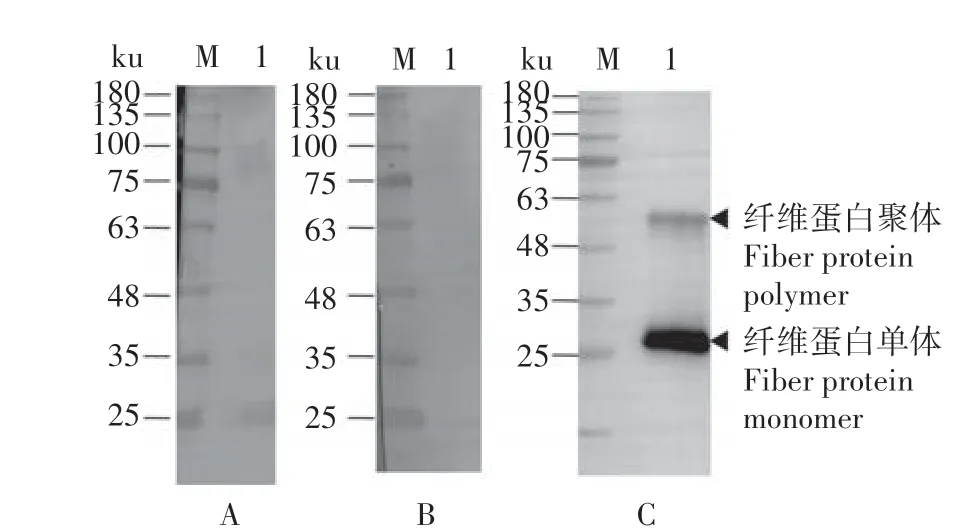
图3 抗EDSV中和性单克隆抗体对变性EDSV纤维蛋白的Western blot检测结果Fig.3 Western blot results of the recombinant EDSV fiber protein detected by the neutralizing monoclonal antibodies against EDSV
2.7 抗EDSV中和性单克隆抗体的亚型鉴定
单克隆抗体9G12和10E11属于同种抗体亚型,其重链均为IgG1亚型,轻链均为Kappa型。
2.8 抗EDSV中和性单克隆抗体配对的结果
通过棋盘法对5株HRP标记单抗和5株未标记单抗进行配对,当中和性单克隆抗体10E11 作为捕获抗体时,均有阳性信号,但是HRP-9G12 作为检测抗体和10E11 配对时,OD450值是最高的(表4)。因此,选择单克隆抗体10E11 作为捕获抗体,HRP-9G12作为检测抗体,建立双抗体夹心ELISA方法。
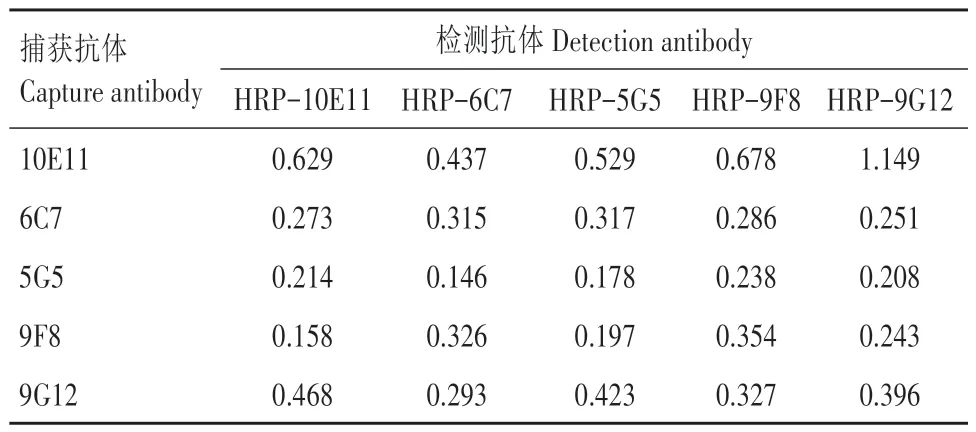
表4 抗EDSV中和性单克隆抗体配对的结果Tab.4 Pairing results of neutralizing monoclonal antibody against EDSV
2.9 基于抗EDSV 中和性单克隆抗体9G12 和10E11的双抗体夹心ELISA方法的应用
通过检测30份EDSV 阴性样品的OD450值,确定该双抗体夹心ELISA 方法的Cut-off 值为0.215。在病料检测中,12 份样品的ELISA 检测结果见图4,88.9%(8/9)的攻毒样品检测为阳性,100%(3/3)的对照组样品检测为阴性。荧光定量PCR 检测结果显示,100%(9/9)的攻毒样品检测为阳性,100%(3/3)的对照组样品检测为阴性。以荧光定量PCR 检测结果为标准,双抗体夹心ELISA 方法的检测结果符合率为91.7%(11/12)(表5)。
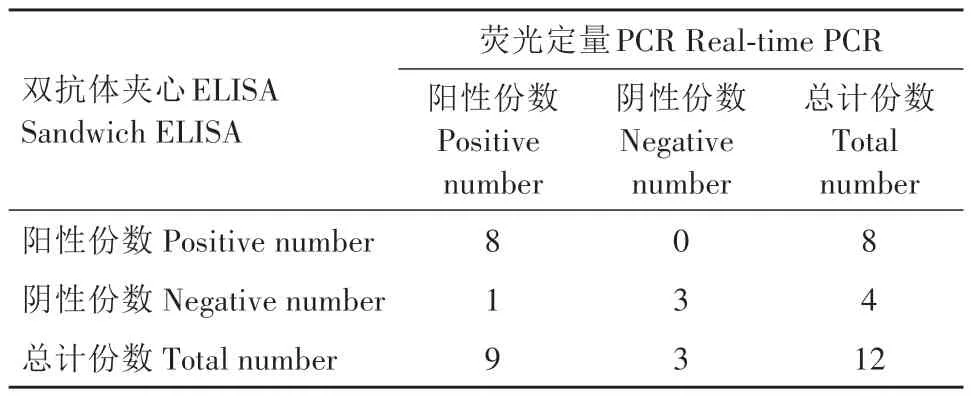
表5 双抗体夹心ELISA方法与荧光定量PCR方法检测结果Tab.5 Results of sandwich ELISA and real-time PCR methods

图4 双抗体夹心ELISA方法对12份样品的检测结果Fig.4 Determination of 12 samples by the sandwich ELISA method
3 结论与讨论
减蛋综合征是蛋鸡养殖行业重点防治疾病之一,养鸡场一旦有蛋鸡感染EDSV,可造成严重的经济损失。单克隆抗体对于建立特异、敏感、快速检测EDSV 的方法尤为重要。孔德迎等[12]使用纯化的EDSV 病毒为免疫原,筛选得到5 株单克隆抗体,通过ELISA 方法鉴定其特异性,但并未对单克隆抗体的中和活性进行表征,并且未建立高特异性、高敏感型的检测方法。与其他禽腺病毒类似,纤维蛋白是EDSV 的主要结构蛋白,能够诱导机体产生特异性中和抗体,是制备EDSV 单克隆抗体的理想抗原[13-15]。本实验室前期利用大肠杆菌表达系统制备了EDSV 重组纤维蛋白,具备天然三聚体结构,且在SDS 存在的条件下仍能维持其天然状态,甚至在高温加热后仍然有少量聚体存在,表明其具有较高的稳定性,同时该重组蛋白具有类似天然EDSV 病毒粒子凝集鸡红细胞的HA 活性,能够诱导机体产生高水平中和抗体[4]。综上,纯化所得重组纤维蛋白是理想的免疫原。因此,本研究利用该重组纤维蛋白作为免疫原,最终筛选得到2 株稳定分泌中和性单克隆抗体的杂交瘤细胞株9G12和10E11。
本研究在纯化纤维蛋白的基础上进行了血凝效价的测定,并以此作为免疫单位,避免了以目的蛋白含量为免疫单位时存在的问题。不同批次蛋白质纯度不同导致目的蛋白含量难以确定,而利用血凝效价则直接可以判断免疫原的含量,保证目的蛋白含量稳定。制备的单克隆抗体9G12 和10E11经iELISA 及IFA 检测,结果显示,单克隆抗体与重组纤维蛋白及EDSV 病毒粒子均发生特异性反应,表明这2株单克隆抗体能够识别二者天然状态下的抗原表位。但是Western blot 结果表明,9G12 和10E11 不能识别变性的重组纤维蛋白,表明变性条件下抗体识别的纤维蛋白抗原表位发生了变化,导致变化后的表位无法被单克隆抗体识别,从而揭示出这2株单克隆抗体识别的表位为构象型表位。单克隆抗体中和效价测定显示,9G12 的中和效价为1∶27,10E11的中和效价为1∶24,这表明9G12具有更高的中和EDSV病毒感染活性。
目前,EDSV 的检测方法主要是HA 及荧光定量PCR 等[16-21]。HA 方法检测每次均需要取用新鲜的鸡红细胞,不利于临床大批量简便操作,且无法排除其他有血凝活性病毒的干扰。虽然荧光定量PCR 方法灵敏度高、特异性强,但是其检测过程复杂,需要专业仪器及专业人员操作,通常用于实验室检测,因此不利于临床快速诊断。相比之下,ELISA方法具有操作简便、灵敏度高、特异性强等特点。免疫胶体金技术具有操作简便、成本低、反应快、不依赖于特殊的仪器设备、用肉眼即可对结果进行判读的特点,且同时具有良好的特异性和敏感性。以本研究筛选的单克隆抗体为分子基础建立胶体金免疫层析试纸条或建立ELISA 检测方法,可实现临床上准确、快速检测EDSV,具有重要的应用价值。在本研究中,以单克隆抗体10E11 作为捕获抗体,HRP-9G12作为检测抗体,初步建立了双抗体夹心ELISA方法。将该双抗体夹心ELISA方法应用于EDSV 抗原检测,在临床病料检测中与荧光定量PCR检测结果的符合率为91.7%。
综上所述,本研究成功筛选到2 株识别EDSV纤维蛋白构象表位的中和性单克隆抗体,为EDSV纤维蛋白中和表位鉴定奠定了基础,为EDSV 抗原的临床检测提供了技术支持。

