生物炭内源溶解性有机物的释放对RhB吸附的影响
陈卫鹏,李亚如,张晓东
(上海理工大学环境与建筑学院,上海 200093)
生物炭(biochar,BCs)是生物质限氧热解产生的富碳物质[1],因其来源广泛和吸附性能强等优点,被认为是一种前途光明的吸附剂[2]。季雪琴等[3]研究发现,水稻秸秆BCs对阳离子染料亚甲基蓝和阴离子染料日落黄的吸附主要分别通过离子交换作用和π-π相互作用。李妍等[4]研究发现,核桃壳粉和核桃壳BCs均能有效去除水体中的有机染料[亚甲基蓝、孔雀石绿、甲基橙和罗丹明B(RhB)]。这些研究主要集中于有机染料在BCs上的吸附机理。事实上,当BCs用于控制环境污染物时,会释放出其内源的溶解有机物(dissolved organic matter,DOM),其可能会影响污染物的吸附[5]。因此,有必要考虑DOM在吸附过程中的影响。
DOM是一种具有高活性官能团的物质,其组成和含量受诸多因素的影响[2],例如原料类型、环境条件和热解温度[6]。Yang等[2]研究发现,浸提液pH高的低温BCs能释放更多的DOM。Huo等[7]通过三维荧光技术发现了垃圾填埋场DOM的组成和含量随着填埋场年龄的增加发生变化。近几年里关于DOM的研究主要集中于其对重金属(如Cu[8]、Pb[9]、Cd[10]和Cr[11])、抗生素(四环素[12]、磺胺甲恶唑和氯霉素[2])等吸附的影响。目前BCs中DOM对有机染料吸附影响的研究有限,且尚不清楚DOM如何影响有机染料吸附。因此,本文通过比较BCs和酸改性生物炭(acid modified biochar,ABCs)对污染物的吸附差异,研究在吸附过程中所释放的DOM对BCs吸附污染物的影响。
在近几年里有机染料被广泛应用于各行业,全球每年会消耗掉几十万t染料,并且部分排入废水中,造成严重的环境安全问题[13]。同时由于有机染料本身具有高毒性和难生物降解等性质,也会对人体产生危害[14]。其中RhB作为一种被广泛应用且具有代表性的阳离子有机染料[15],是一种极易溶于水的紫红色粉末,具有高毒性和难生物降解等性质,严重危害环境安全[16],也会刺激人体皮肤、眼睛等部位,并造成感染[17]。因此,近年来RhB所造成的环境问题引起了广泛的关注。
本研究以玉米秸秆(corn straw,CS)和松木锯末(pinewood sawdust,PS)作为原料,在300、500、700 ℃ 3个温度下制备BCs来提取DOM,并结合元素分析、DOC测定、紫外可见光谱、荧光光谱等表征技术。其目的旨在:(1)探究原料类型和热解温度对BCs特性以及DOM理化性质的影响;(2)研究DOM的释放对BCs和ABCs吸附有机染料(RhB)的影响;(3)揭示DOM对BCs吸附RhB的影响机制。
1 材料与方法
1.1 试验材料
CS和 PS分别购自河北省石家庄市和邢台市。称取一定量的CS(或PS),置于管式炉中加热至300、500、700 ℃,升温速率为10 ℃/min,保温2 h。冷却后取出BCs,并分别命名为CS300、CS500、CS700(或PS300、PS500、PS700)。
1.2 DOM的提取
将BCs研磨过100目筛并与去离子水混合搅拌,质量体积比为=1∶100,放入水浴锅中超声1 h,然后在(25±1) ℃和180 r/min下振荡72 h,最后通过0.45 μm纤维素膜,滤液放置于4 ℃冰箱中保存,并分别命名为CDOM300、CDOM500、CDOM700(或PDOM300、PDOM500、PDOM700),将过滤后的BCs放入烘箱中干燥。
1.3 BCs酸改性
将过滤干燥好的BCs与HCl和HF混合液[c(HCl)∶c(HF)=1 mol/L∶1 mol/L]以质量体积比为1∶20混合,并在摇床上以180 r/min运行1 d。用去离子水洗涤BCs直至溶液中pH不变,并在80 ℃干燥BCs,分别命名为ACS300、ACS500和ACS700(或APS300、APS500和APS700),密封避光储存。
1.4 材料表征
通过元素分析仪来表征BCs和DOM的元素组成。使用扫描电子显微镜(SEM)观察BCs表面形态。通过BET表面分析仪估计BCs比表面积和孔体积。使用总有机碳分析仪分析样品的溶解有机碳(DOC)浓度。用紫外可见分光光度计测定DOM的化学特性。使用荧光分光光度计测量DOM样品的荧光激发发射(EEM)光谱。激发波长(Ex)和发射波长(Em)分别为200~500 nm和250~600 nm,间隔分别为5 nm和2 nm,扫描速度设定为12 000 nm/min,激发和发射狭缝宽度固定为10 nm。
1.5 吸附试验
BCs吸附试验:为了确定吸附平衡时间,将0.1 g BCs(或ABCs)与100 mL(10 mg/L)的RhB混合,置于振荡器中,在(25±1)℃下以180 r/min振荡,并分别在10、30、60、90、120 min时取上清液通过0.45 μm过滤器,用紫外分光光度计在554 nm测定RhB浓度。为了验证BCs释放的DOM的影响,将0.1 g BCs(或ABCs)与100 mL的RhB(20、50、70、100、120、150 mg/L)混合,振荡2 h,其他条件同上。
DOM添加吸附试验:为了探究所释放的DOM对BCs吸附RhB的影响,将0.1 g ABCs与50 mL的RhB(20 mg/L)和50 mL DOM(20 mg C/L)混合,并设置空白样品(无DOM),在(25±1) ℃下以180 r/min振荡,并分别在10、30、60、90、120、150、180、210、240 min时取上清液通过0.45 μm过滤器,采用紫外可见分光光度计测定RhB浓度。为了探究DOM浓度对BCs吸附的影响,将0.1 g ABCs与50 mL的RhB(20 mg/L)和50 mL DOM(0、5、10、15、20、30 mg C/L)混合,振荡210 min,取上清液测定RhB浓度。为了探究DOM与RhB之间的关系,将50 mL(5 mg C/L)多种DOMs与50 mL(1 mg/L) RhB混合振荡,并分别在10、30、60、90、120 min时取上清液,测量RhB浓度和溶液反应前后的三维荧光光谱。
2 结果与讨论
2.1 BCs特点
2.1.1 元素分析
如表1所示,除PS300和APS300外,其他BCs和ABCs中元素含量均为C>O>H>N,且随着热解温度的升高,所有BCs和ABCs呈现出相同的变化趋势,例如C元素和灰分含量增加,H、O元素含量减少。这与许冬倩[18]的结论一致,这是由于生物质的有机组分在热解过程中被破坏,大量产物挥发。通常H/C、O/C、(N+O)/C值用于表征样品的碳化程度、芳香性、亲水性与极性[19-20]。表1中H/C、O/C和(N+O)/C值随着温度的升高均呈现下降趋势,表明BCs和ABCs的芳香性增强,亲水性和极性减弱。这是由于高温使得纤维素等物质发生了脱甲基化反应,大量含氧官能团脱离[21]。其中所测到的H/C值非常低(10%),表明BCs和ABCs碳化程度高,具有高度芳香化结构。结果表明BCs和ABCs的热解过程是极性、亲水性减弱,芳香性增强的过程。

表1 BCs和ABCs的元素组成
2.1.2 SEM
如图1所示,BCs表面普遍存在不规则褶皱,形态差异比较明显。此外,BCs表面随着热解温度的升高出现一些大小不一的圆形孔洞,其表面粗糙度也随之增大。这是由于BCs热解所释放的热量破坏了其表面结构[22]。与BCs相比,ABCs表面产生了更多的微孔,有利于提高污染物的吸附效率。这是由于酸洗去除了表面杂质,使孔隙结构更加暴露[23]。结果表明,BCs的表面结构受热解温度和原料类型的影响。

图1 BCs和ABCs的SEM图(1 000倍)
2.1.3 BET
如表2所示,随着热解温度的升高,BCs的比表面积、总孔体积和平均孔径也随之增大,ABCs的平均孔径随之下降,其他与BCs变化趋势一致。这可能与热解过程中组分的挥发和BCs中纤维管状结构有关[22]。在高热解温度下(500 ℃和700 ℃),ABCs的比表面积和总孔体积普遍高于BCs,但平均孔径普遍低于BCs,表明酸洗对BCs表面性质影响较大。
2.2 DOM的性质
如表3所示,不同来源的DOM中DOC含量差异明显(CDOM:37.60~93.75 mg C/L,PDOM:30.60~61.25 mg C/L),这是由于原料组成和热解条件的影响。随着温度的升高,CDOM中DOC浓度显著下降,而PDOM浓度先下降后上升。这是由于纤维素和半纤维素的热解产物在高温下大部分挥发了。DOM浓度的增加可能是由于低温产物在高温下发生二次反应[24]。CDOM和PDOM之间的浓度差随着温度的升高而减小。这是由于CS(9%)和PS(28%)中木质素在高温下会形成丰富的石墨结构,阻碍了DOM的释放[25]。这与Liu等[26]结果一致,相比富含纤维素和半纤维素(38.9%~48.2%)的花生壳等原料,富含木质素(45.2%)的糠醛渣纳米BCs含量更低。250 nm和365 nm处的吸光度比(E2/E3)可以用于表征DOM的相对分子质量,E2/E3与分子量成反比关系[25]。CDOMs和PDOMs的E2/E3分别为2.00~3.95和2.00~4.00。Han等[25]发现纤维素、半纤维素和木质素BCs的E2/E3为3.32~10.71。这表明DOMs的相对分子质量可能与这3种生物聚合物组成有关。随着温度的升高,CDOM和PDOM的E2/E3值增加,SUVA254值减小,表明CDOM和PDOM的相对分子质量减少,芳香性和腐殖化指数下降,这可能是由于难以降解的大分子物质逐渐分解成小分子物质。结合表1和表3,发现DOMs的H/C、O/C和(N+O)/C的变化趋势与其相应BCs相反。这与Yang等[2]研究结果一致,即随着温度的升高,BCs与其相应DOM的H/C、O/C和(N+O)/C呈现相反的变化趋势。结果表明DOM的理化性质受到热解温度和原料类型的影响。

表3 DOM的理化性质
如图2所示,CDOM和PDOM的EEM光谱呈现出相似的组成。CDOM300和PDOM300在区域Ⅰ(Ex=200~250 nm;Em=280~330 nm)、Ⅱ(Ex=200~250 nm;Em=330~380 nm)、Ⅲ(Ex=200~250 nm;Em=380~550 nm)、Ⅳ(Ex=250~400 nm;Em=280~380 nm)和Ⅴ(Ex=250~400 nm;Em=380~550 nm)处均有明显的荧光峰,分别代表芳香性蛋白质类物质(Ⅰ和Ⅱ)、富里酸类物质(Ⅲ)、可溶性微生物副产物(Ⅳ)和腐植酸类物质(Ⅴ)[27],其中Ⅲ和Ⅴ处的荧光峰最明显。PDOM500在Ⅰ、Ⅱ和Ⅳ处有微弱的荧光峰,表明存在芳香性蛋白质类物质和可溶性微生物副产物。而CDOM500、CDOM700和PDOM700仅在Ⅰ处有不明显的荧光峰,表明存在芳香性蛋白质类物质。这些结果表明低温热解制备的CDOM和PDOM的主要组分是富里酸类物质和腐植酸类物质。Cao等[22]发现BCs所释放的DOM中主要荧光组分有富里酸类、腐植酸类、色氨酸类、酪氨酸类组分,其中富里酸类和腐植酸类峰占大多数。随着热解温度的升高,富里酸类物质和腐植酸类物质减少,仅存在少量芳香性蛋白质类物质,这与前面DOM浓度分析结果一致。Gui等[28]发现,在较高的热解温度(>500 ℃)下,腐植酸类物质和富里酸类物质的含量随着热解温度的升高而减少。结果表明DOMs的荧光组分与热解温度密切相关。

图2 DOM的EEM光谱(5 mg C/L)
2.3 DOM释放对BCs吸附RhB的影响机制
2.3.1 吸附动力学
如图3所示,BCs和ABCs吸附平衡时间有所不同,其中RhB在ABCs的吸附平衡时间主要为90 min[图3(c)和图3 (d)],其在BCs的吸附平衡时间延迟到120 min[图3(a)和图3(b)]。吸附动力学的回归系数表明,BCs吸附RhB的吸附动力学过程可以用准二级模型(R2>0.996 0)解释,而ABCs吸附RhB的吸附动力学过程更符合准一级动力学模型(R2>0.998 5)。

图3 BCs和ABCs吸附RhB动力学
2.3.2 吸附等温线
如图4所示,BCs对RhB的平衡吸附量随着溶液中RhB浓度的增加而增加,这是由于RhB浓度的增加导致BCs与RhB的相互作用速率提高,增强了吸附能力。相关系数表明BCs对RhB的吸附更符合Freundlich模型(R2>0.900 0)。结合吸附动力学模型的分析,推测BCs对RhB的吸附过程为异质表面的化学吸附。结合BCs的元素分析,发现RhB的吸附量与BCs的(N+O)/C值呈负相关。这与Yang等[2]研究结果一致,即疏水相互作用和BCs中有机组分可能在吸附过程中起决定性作用,表明BCs的吸附机制主要通过π-π相互作用来实现。

图4 BCs和ABCs吸附RhB等温线
ABCs对RhB的平衡吸附量要明显高于BCs(图4),且吸附量差随着RhB浓度的增加而增加。ABCs的比表面积和总孔体积远大于BCs,但平均孔径要小于BCs (表2)。结合BET分析和吸附动力学模型的分析,推测ABCs优异的吸附能力是由于其多孔结构,ABCs对RhB的吸附机制主要通过其物理性质实现。因此,推测BCs和ABCs在吸附动力学和等温线上的差异可能是由于DOM的释放和DOM与RhB之间的相互作用。基于这些结果,进一步探究DOMs对BCs和ABCs吸附过程中的影响机制。
2.4 DOM对BCs吸附过程中的影响机制
根据TOC测试结果,即低温BCs(300 ℃)比高温BCs(500 ℃和700 ℃)能释放出更多的DOM,选择CS300和PS300作为两种原料的代表,来进行DOM添加吸附试验。对比添加/未添加DOM溶液的吸附动力学可以发现,DOM的添加明显抑制了RhB在ACS300和APS300上的吸附能力,吸附平衡时间从90 min延迟到210 min,同时吸附量也显著下降(ACS300∶7.04 mg/g→3.72 mg/g、APS300∶6.51 mg/g→2.89 mg/g)(图5),这表明DOM在吸附过程中起到重要作用。相关系数表明ACSs和ACSs+DOM的吸附动力学更符合准二级模型(R2>0.969 1)。结合BCs的吸附动力学模型,结果表明DOM的添加改变了ABCs的吸附机制。

图5 DOM对ABCs吸附RhB的影响
如图6所示,对于初始RhB质量浓度为10 mg/L的ACS300和APS300,当DOM质量浓度从0增加到30 mg C/L时,ACS300和APS300对RhB的平衡吸附量从7.86 mg/g和6.41 mg/g分别降到2.26 mg/g和1.61 mg/g,结果表明DOM的添加会抑制ABCs对RhB的吸附,且抑制程度随着DOM浓度的增加而增加。这可能是由于DOM与RhB之间的络合作用,由于亲水性DOM含有较多的含氧官能团,可通过一些非疏水作用与RhB形成络合物,络合产物难以被BCs吸附。

图6 不同浓度DOM对ABCs吸附RhB的影响
如图7所示,在DOM吸附试验中,120 min时DOMs对RhB的吸附率为14.29%~30.77%,表明DOM在BCs吸附RhB过程中会对RhB产生络合作用。结合DOM浓度的增加会抑制BCs对RhB的吸附,可以表明DOM与RhB的络合物对BCs吸附亲和力低。结合DOM添加对RhB的吸附量降低量(ACS300∶3.32 mg/g、APS300∶3.62 mg/g)、RhB吸附量(ACS300∶7.86 mg/g、APS300∶6.41 mg/g)与DOM吸附率之间定量关系,发现ABCs对少量DOM的吸附使得ABCs难以同时吸附相对大量的RhB。这可能是由于RhB在BCs表面与DOM竞争吸附。因此,可以得出结论,一方面,RhB在BCs表面与DOM竞争吸附;另一方面,DOMs与RhB发生络合作用,络合产物难以被BCs吸附。

图7 不同种类DOM对RhB的吸附
为了了解RhB与DOM的结合机制,将RhB与DOM混合反应,对RhB-DOM混合体系进行EEM测试,分析比较RhB与DOM的结合强度。如图8所示,DOM对RhB吸附120 min后,CDOM300、CDOM500、PDOM300和PDOM500的EEM光谱中Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ处荧光强度均有不同程度的下降,Ⅲ和Ⅴ处下降最明显,而CDOM700和PDOM700仅Ⅲ和Ⅴ处有较明显下降,表明RhB可以与DOM发生相互作用,主要反应的荧光组分为腐植酸类和富里酸类物质。这与Yang等[2]研究结果一致,即DOM中腐植酸类和富里酸类物质抑制BCs吸附氯霉素。
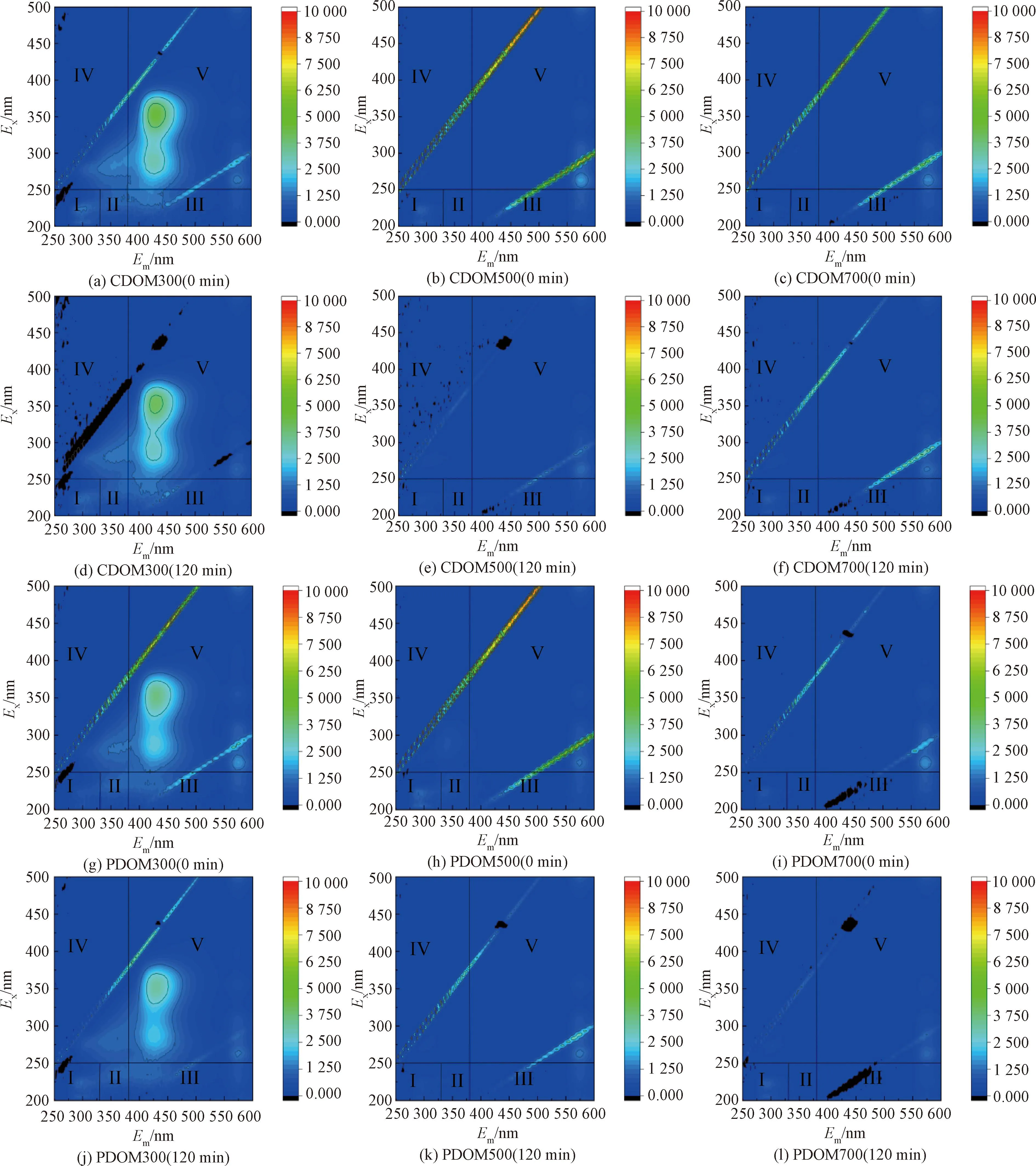
图8 不同种类DOMs对RhB的EEM光谱
结合前面DOM的理化性质和相应的BCs吸附能力,发现BCs对RhB的吸附量与 DOMs的(O+N)/C值呈正相关,即BCs对RhB的吸附量与DOMs的极性指数成正相关。其次结合DOMs的荧光组分和BCs吸附能力,BCs对RhB的吸附量与DOMs中的富里酸类物质和腐植酸类物质量成负相关,且富里酸类物质和腐植酸类物质可以与RhB发生猝灭反应,表明富里酸类物质和腐植酸类物质会抑制BCs对RhB的吸附。
3 结论
(1)表征分析表明BCs及相应DOM的理化性质均受到热解温度和原料类型的影响,随着热解温度的升高,BCs的表面粗糙度、比表面积、总孔体积和平均孔径均发生变化,BCs与相应DOMs的H/C、O/C和(N+O)/C的变化趋势相反,DOMs组分的荧光强度降低。
(2)TOC分析和EEM光谱表明低温BCs(CDOM300:93.75 mg C/L;PDOM300:61.25 mg C/L)比高温BCs(CDOM500、CDOM700为43.95、37.60 mg C/L;PDOM500、PDOM700为30.60、36.35 mg C/L)能释放出更多的DOM,低温BCs(CDOM300和PDOM300)所释放出DOM的主要组分是富里酸类物质和腐植酸类物质。
(3)吸附动力学和吸附等温线研究表明,DOMs的加入会抑制BCs对RhB的吸附,延长吸附平衡时间(90 min→210 min)和降低吸附量(ACS300∶7.86 mg/g→2.26 mg/g;APS300∶6.41 mg/g→1.61 mg/g)。原因一方面是RhB在BCs表面会与DOM竞争吸附;另一方面是DOMs会与RhB发生络合作用(吸附率:14.29%~30.77%),络合产物难以被BCs吸附。
(4)DOM紫外分析和EEM光谱表明BCs对RhB的吸附量与DOM的(O+N)/C值呈正相关,与DOM中的富里酸类物质和腐植酸类物质含量成负相关,RhB可以与DOM的荧光组分(主要是富里酸类物质和腐植酸类物质)发生猝灭反应。

