闽楠bZIP基因家族的鉴定与表达分析
万露露, 王中煊, 沈 军, 曹泽宇, 陈世品, 苏小青
(1.福建农林大学林学院;2.福建农林大学兰科植物保护与利用国家林业和草原局重点实验室; 3.福建农林大学园艺学院,福建 福州 350002)
转录因子一般由4个区域,包括DNA结合基序、转录激活基序、核定位信号和寡聚化位点,共同调节各种生物学过程。根据蛋白序列保守结构域的不同,可以分为不同的转录因子家族[1]。碱性亮氨酸拉链(basic leucine zipper,bZIP)转录因子是真核生物中存在的成员最多、最保守的基因家族之一。bZIP蛋白的保守结构域由碱性氨基酸区域(basic amino acid region,BR)和亮氨酸拉链区(leucine zipper area,LZ)组成。碱性氨基酸区域(N-X7-R/K-X9)位于C端,是严格保守的基本DNA结合区,与DNA启动子区域内特定的序列结合;亮氨酸拉链区(L-X6-L-X6-L)位于N端,是由亮氨酸或异亮氨酸、缬氨酸组成的七肽重复序列,形成同源二聚体。植物的bZIP蛋白与ACGT核心顺式作用元件如ABRE、G-box、C-box、a-box、AACGTT、GCN4基序的DNA序列结合,调节下游基因的表达,从而参与包括盐、干旱、水涝等多种非生物胁迫响应过程[2]。目前,已有许多真核生物的bZIP基因家族在全基因组范围内被成功鉴定,在拟南芥(Arabidopsisthaliana)、番茄(Solanumlycopersicum)、水稻(Oryzasativa)、葡萄(Vitisvinifera)、大豆(Glycinemax)中分别发现75、69、89、55、131个bZIP家族成员[1]。研究表明,该转录因子广泛参与非生物胁迫响应。例如,在盐胁迫下,拟南芥AtbZIP17能直接或间接调控盐胁迫应答基因,从而参与盐信号反应[3]。在干旱胁迫下,水稻OsbZIP12和OsbZIP46受脱落酸(abscisic acid,ABA)信号强诱导[4]。而番茄bZIP中的转录因子SIAREB既参与干旱反应,又对盐胁迫反应起作用[1]。在冷胁迫下,水稻OsbZIP52在冷反应中表达量降低,起到了负调控作用;大豆GmbZIP1在寒冷、干旱和盐胁迫下,表达量增高,使得植物的耐受性增强[5]。因此,bZIP在植物的生长发育和逆境胁迫中起重要作用。
闽楠(Phoebebournei)是樟科楠属的常绿高大乔木,其木材芳香耐久,质地细腻,强抗腐蚀,用途广泛且具有巨大的经济价值。闽楠生长较为缓慢,根系的发育对于其生长尤为重要。本研究通过对闽楠bZIP转录因子家族成员的基因及蛋白理化性质、基因结构和保守结构域进行系统分析,结合不同程度水分胁迫下的转录组数据,以及qRT-PCR验证试验,探究该家族成员在水分胁迫下的表达情况,旨在为进一步探究闽楠根系抵御逆境胁迫因子的分子机制提供参考。
1 材料与方法
1.1 bZIP基因家族成员鉴定
从Pfam网站(https://pfam.xfam.org/)下载闽楠PbbZIP(PhoebebourneibZIP)基因家族的HMM模型文件(PF00170、PF07716、PF03131和PF12498)。同时,从TAIR网站(https://www.arabidopsis.org/)下载拟南芥bZIP基因家族的蛋白序列。接着,使用HMMER软件从闽楠蛋白序列中检索bZIP蛋白,并以拟南芥bZIP蛋白序列为索引在闽楠蛋白文件中进行blast分析(E<1e-5)。对HMM与blast两种方法鉴定出的蛋白序列取交集,然后使用MEME(https://meme-suite.org/)、CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)进一步验证序列是否含有bZIP的保守结构域。最后,使用在线工具ExPASy(https://www.expasy.org/)分析蛋白理化性质,使用WoLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.2 系统进化树构建
对拟南芥的bZIP蛋白序列使用MEGA11软件(https://megasoftware.net/)中CLustalX程序默认参数进行多序列比对,采用邻近法(neighbor-joining method)构建系统发育树。参数设定为1 000 bootstrap、p-distance模型和pairwise deletion。然后将其保存为Newick格式,并使用evolview(https://www.evolgenius.info/)对系统发育树进行美化。
1.3 生物信息学分析
使用MEME软件对PbbZIP蛋白序列进行20个motif分析,再使用TBtools软件的gene structure view(advanced)功能进行进化树、保守基序和基因结构三合一可视化。将PbbZIP蛋白作为研究对象,选定模式植物拟南芥作为物种参数,在STRING(https://cn.string-db.org/)网站进行蛋白互作网络分析。然后使用TBtools提取PbbZIP基因转录起始上游2 000 bp的序列作为基因的启动子,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其顺式作用元件进行预测。最后,对结果进行整理,使用TBtools软件绘制热图。
1.4 基因表达分析
试验材料从福建省林业科学研究院移植到福建农林大学下安图书馆旁大棚内,选取3年生健康闽楠幼苗300株(均为优良家系),经过半年的缓苗期后,在2021年7月29日至2021年8月25日期间进行干旱和水涝处理。干旱处理分别进行了0、3、6、9 d,复水后第3天采集根样本。水涝处理分别进行了0、7、14、21、28 d,对根系和植株进行取样。所有样品均保存在-80 ℃冰箱内。随后,由深圳华大基因科技有限公司采用基于第2代测序技术的Illumina HiSeq测序平台进行转录组测序。从转录组数据中获取PbbZIP的表达丰度值FPKM(fragments per kilobase per million),并通过log2(FPKM+1)计算表达差异程度。最后,使用TBtools软件绘制基因表达量热图。
1.5 RNA提取、cDNA合成以及qRT-PCR验证
闽楠根系7个时期(干旱胁迫下处理0、3、6、9 d及复水后第3天, 水涝胁迫下处理7、14 d)的样品各称取0.1~0.2 g,在液氮中快速研磨,使用天根试剂盒提取闽楠根部总RNA。使用1%琼脂糖凝胶电泳检查RNA的完整性,并使用紫外分光光度计测定其浓度和纯度,合格的RNA用于反转录反应。使用TAKARA试剂盒合成cDNA,并将所得的cDNA标本储存在-20 ℃的冰箱内。选用RG6(maker00023565)作为内参基因[6]。挑选PbbZIP15(maker00019047)和PbbZIP40(maker00043020)基因做qRT-PCR验证(表1)。
2 结果与分析
2.1 bZIP基因家族鉴定与理化性质
在闽楠全基因组数据中共鉴定52个bZIP基因,分别命名为PbbZIP01-PbbZIP52。这些PbbZIP基因编码的氨基酸数量差异较显著,范围从133个(PbbZIP43)到839个(PbbZIP15),平均蛋白长度为336个氨基酸,分子质量15 275.22 u(PbbZIP43)~88 925.04 u(PbbZIP15),理论等电点4.78(PbbZIP40)~11.45(PbbZIP12)。在这52个成员中,19个蛋白为碱性蛋白,其余为酸性蛋白。所有蛋白的不稳定系数大于40,因此均为不稳定蛋白。脂肪系数为47.35(PbbZIP38)~94.87(PbbZIP12)。亲水性-0.964(PbbZIP21)~-0.391(PbbZIP01),均为亲水蛋白。亚细胞定位预测表明:有50个基因被定位在细胞核中,仅1个(PbbZIP20)定位在细胞质中,1个(PbbZIP30)定位在内质网中(表2)。
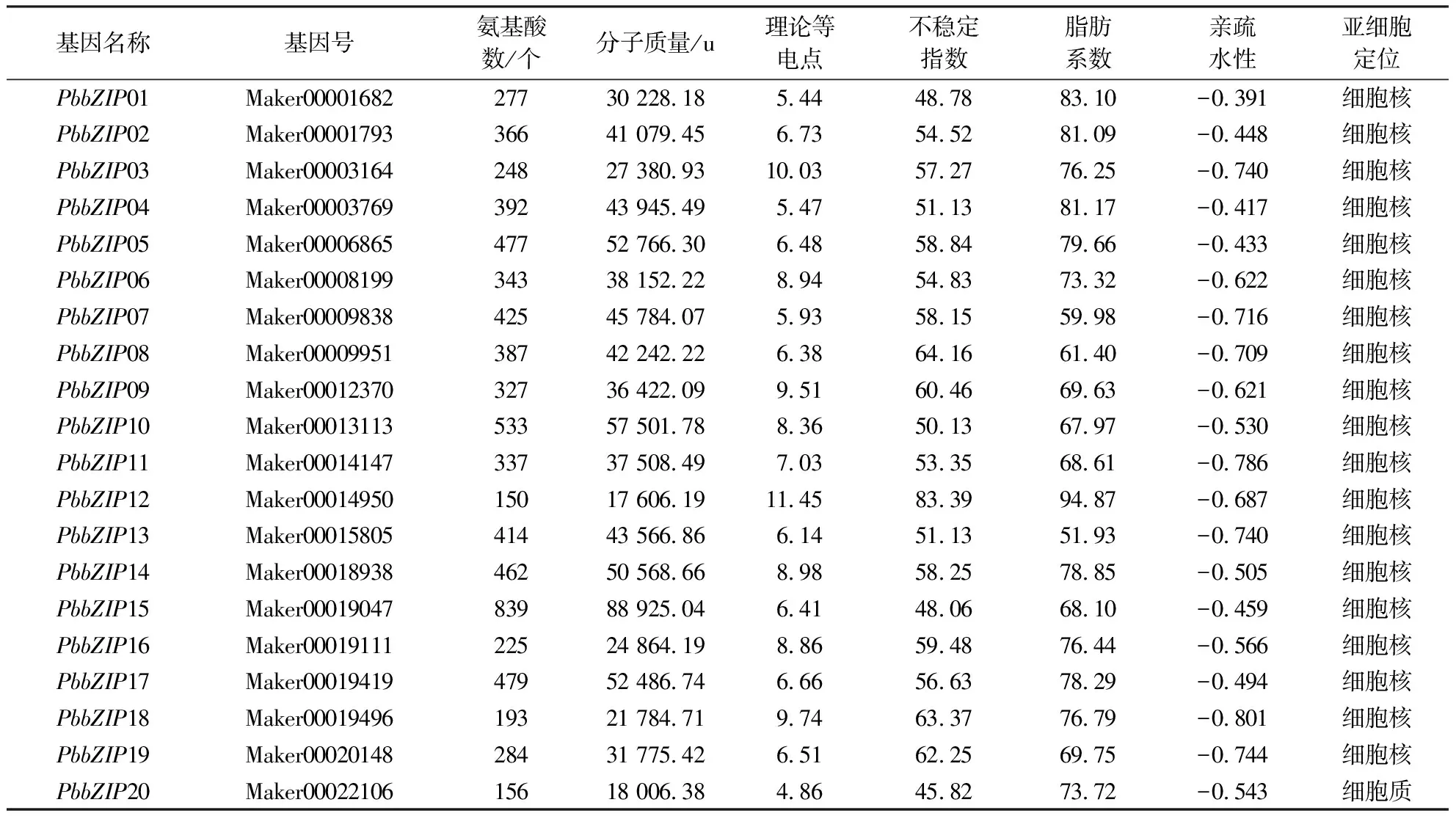
表2 PbbZIP蛋白理化性质Table 2 Physicochemical properties of PbbZIP protein
2.2 系统进化关系
构建闽楠(52个)与拟南芥(75个)之间bZIP基因家族的系统进化发育树(图1),基于前人在拟南芥中75个AtbZIP成员分类关系的研究[7],将闽楠与拟南芥聚类,52个PbbZIP被分为10个亚家族(A-I, K和S),分别为A(8)、B(1)、C(4)、D(8)、E(2)、F(2)、G(5)、H(3)、I(10)、K(1)、S(8)。其中,I组的数量最多,A组、D组和S组的数量次之,B组和K组仅含有1个基因。进化树显示闽楠和拟南芥基因在各个分支分布均匀,表明它们具有相似的进化方式。在拟南芥种子发育后期,A组基因成员大多在ABA或应激信号传导中起作用;D组基因成员参与抵御病原体和发育两个不同过程,如AtbZIP46参与调控拟南芥的花器官数量;G组成员主要与光响应启动子调控有关,也可能在种子成熟过程中发挥作用;H组成员较少,主要参与光形态建成;I组成员可能在韧皮部和维管组织中发挥作用;S组成员广泛参与寒冷、干旱胁迫等响应机制;其他组成员的主要功能还有待进一步探究[1,3-4,8]。
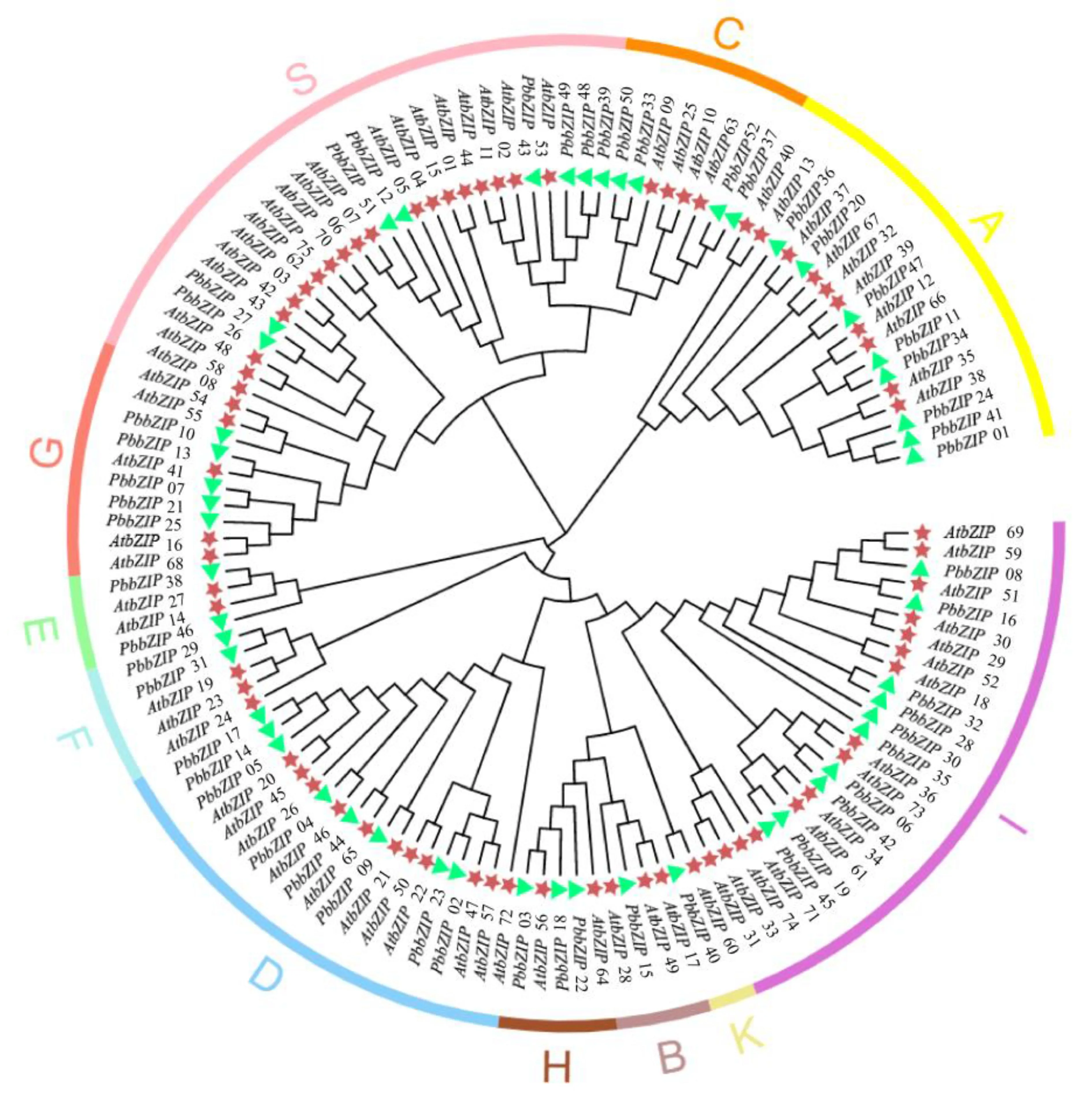
PbbZIP01、11、20、24、34、36、41、47归为A族;PbbZIP15归为B族;PbbZIP33、37、50、52归为C族;PbbZIP02、04、05、09、14、17、23、44 归为D族;PbbZIP38、46归为E族;PbbZIP29、31归为F族;PbbZIP07、10、13、21、25归为G族;PbbZIP03、18、22归为H族; PbbZIP06、08、16、19、28、30、32、42、45、61归为I族;PbbZIP40归为K族;PbbZIP12、26、27、39、43、48、49、51归为S族。 在内圈里绿色三角形代表闽楠,红色五角星代表拟南芥。
2.3 保守基序及基因结构
利用TBtools软件对52个PbbZIP基因的系统发育树、基因结构和保守基序进行分析。结果表明,同一分支或同一亚科具有相同的基序和基因结构。所有成员均含有Motif1,表明Motif1对应典型的碱性氨基酸保守结构域。PbbZIP的外显子数为1~10个。PbbZIP05的外显子最多(10个),PbbZIP32、PbbZIP29以及S亚家族的成员中外显子数都只有1个。S组成员无内含子,这表明PbbZIP基因功能具有多样性。
2.4 蛋白互作网络
蛋白互作网络分析表明,PbbZIP转录因子之间具有紧密的联系,PbbZIP49、PbbZIP22、PbbZIP10处于互作网络的中心,是联系各个蛋白的关键结点。这些关键的PbbZIP转录因子主要与ABI3(abscisic acid insensitive 3)、气孔调节因子1(stomatal opening factor 1, OST1)、病程相关基因非表达子1(nonexpressor of pathogenesis-related genes 1, NPR1)、BBX21(B-box基因家族成员,B-box21)、COP1(constitutive photomorphogenic 1)相互作用。ABI3是拟南芥ABA信号转导过程中的关键转录因子,参与植物的多个生长发育过程。OST1属于植物特有的SnRK2激酶家族,对于非生物的逆境响应有着重要作用。NPR1参与多个抗病信号转导通路,调节植物整体的抗病性。BBX21是一种B-box锌指转录因子,能够促进植物光形态建成。COP1属于保守的RING 型E3泛素连接酶,参与光信号转导、生物节律等过程。这些蛋白与bZIP转录因子相互作用,在闽楠根系的水分胁迫响应中起到了关键作用。
2.5 启动子顺式调控元件
对52个PbbZIP基因上游的2 000个碱基对的启动子区域进行了启动子元件的鉴定,共鉴定出36种顺式元件,其功能注释分为光响应(15种)、植物生长(4种)、胁迫响应(4种)、激素反应元件(9种)和其他(3种)。在PbbZIP的启动子区域共鉴定出413个光响应元件,G-box元件最多(112个),其中,PbbZIP10有10个。鉴定出69个植物生长响应因子,CAT-box元件最多(27个)。鉴定出230个胁迫响应元件,其中包含129个用于厌氧诱导(119个ARE和10个GC-motif),22个参与防御和压力反应的顺式作用元件(TC-rich repeats),41个干旱胁迫响应元件(MBS),38个低温响应元件(LTR)。此外,还鉴定出328个植物激素反应元件,如105个参与ABA反应的元件(ABRE),98个参与茉莉酸甲酯反应的元件(TGACG-motif有48个,CGTCA-motif有50个),51个赤霉素反应元件(22个P-box、16个GARE-motif和13个TATC-box),48个水杨酸反应相关元件(TCA-element)和23个生长素相关元件(11个TGA-element和12个AuxRR-core)。其他元件共鉴定出43个(15个A-box、20个CCAAT-box、8个AT-rich element)。表明PbbZIP基因不仅在光响应和胁迫响应中起作用,对于闽楠的生长发育也至关重要。
2.6 水分胁迫下的表达
在不同的水分胁迫条件下,闽楠根系中的bZIP基因家族的表达模式呈现出明显的变化(图2)。在干旱胁迫下的D1时期,PbbZIP14、PbbZIP17、PbbZIP24、PbbZIP50、PbbZIP36、PbbZIP15、PbbZIP40、PbbZIP08、PbbZIP32的表达量较高;D2时期,PbbZIP14、PbbZIP17、PbbZIP24、PbbZIP36、PbbZIP15、PbbZIP40、PbbZIP08的表达量较高;D3时期,PbbZIP14、PbbZIP17、PbbZIP24、PbbZIP49、PbbZIP15、PbbZIP40的表达量较高;D4时期,PbbZIP17、PbbZIP15、PbbZIP40的表达量较高。而在水涝胁迫下,大部分基因呈现下调表达模式,但也有少数基因的表达量较高,例如W1时期的PbbZIP14、PbbZIP21、PbbZIP33、PbbZIP49、PbbZIP15基因和W2时期的PbbZIP21、PbbZIP33、PbbZIP39、PbbZIP49、PbbZIP15基因。因此,在干旱胁迫下应重点关注PbbZIP17、PbbZIP15、PbbZIP40基因;在水涝胁迫下应重点关注PbbZIP15基因。在整个水分胁迫过程中,PbbZIP15基因均保持较高的表达量。
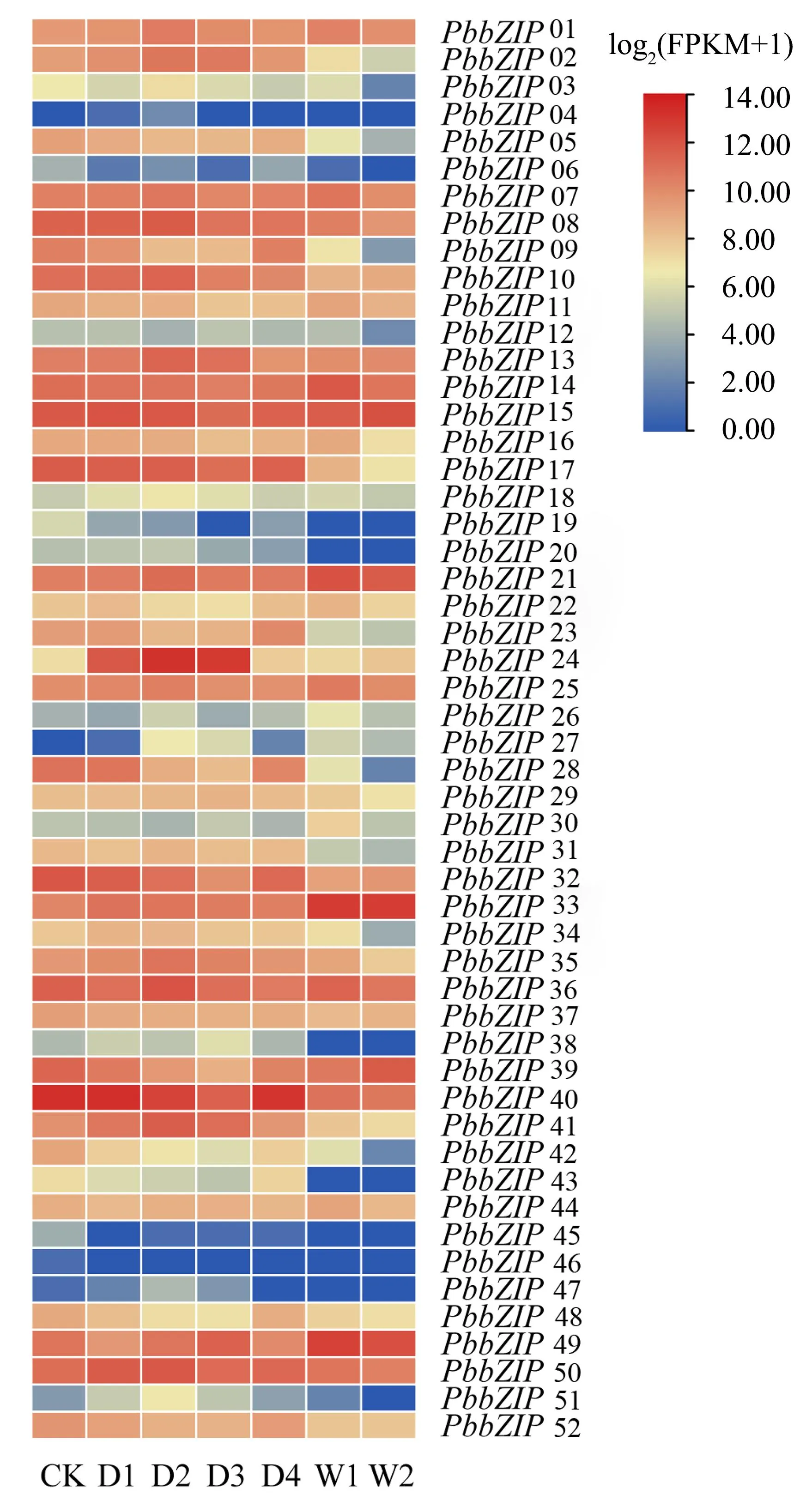
D1:干旱3 d;D2:干旱6 d;D3:干旱9 d;D4:复水后3 d; W1:水涝7 d;W2:水涝14 d。
2.7 qRT-PCR验证
挑选2个有代表性的基因(PbbZIP15和PbbZIP40),利用qRT-PCR试验验证基因的表达水平。结果(图3)表明:PbbZIP15在干旱和水涝的胁迫下均有较高的表达量;而PbbZIP40在干旱胁迫下的表达量较高。qRT-PCR试验结果验证了这2个基因在闽楠根系水分胁迫条件下的相对表达量趋势,与转录组数据中的FPKM表达模式一致。这表明转录组数据是可靠的。
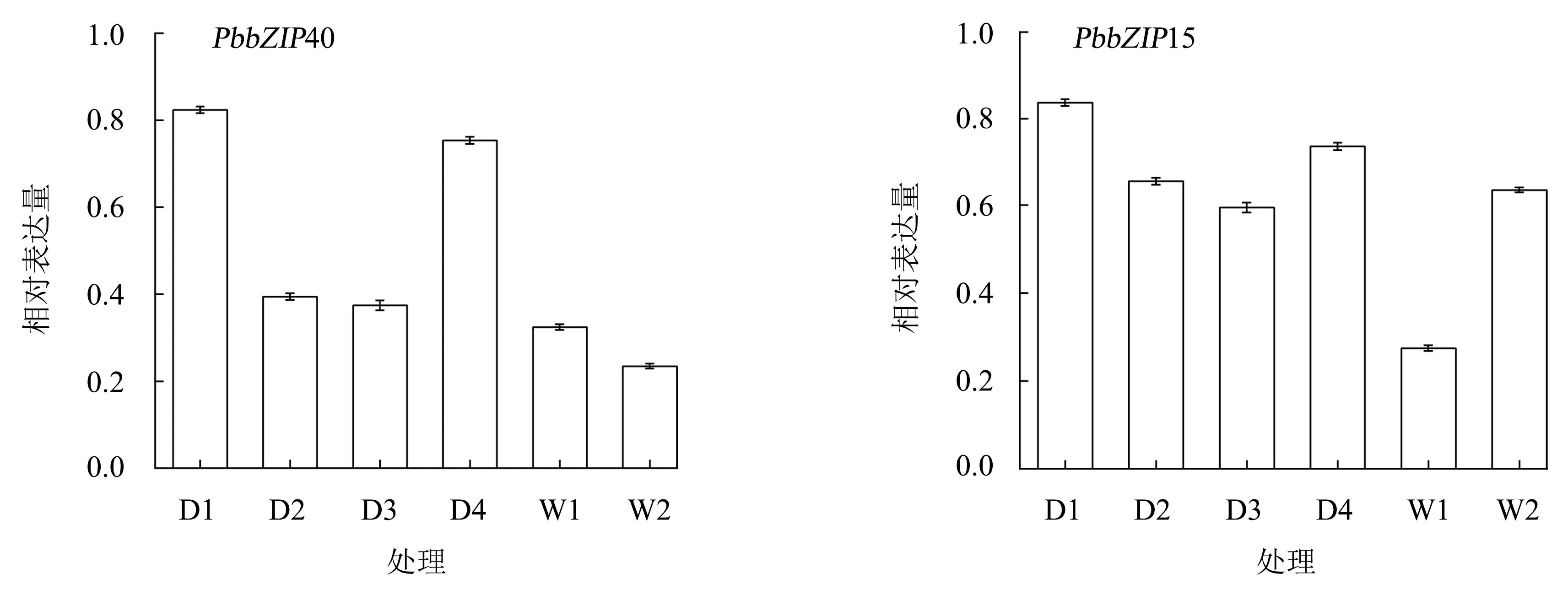
D1:干旱3 d;D2:干旱6 d;D3:干旱9 d;D4:复水后3 d;W1:水涝7 d;W2:水涝14 d。
3 讨论与结论
闽楠全基因组的测序已经完成[9],但目前关于闽楠基因家族的研究较少,仅有TPS、PLR、NF-Y和WRKY基因家族有相关报道[10-13]。本研究利用生物信息学方法,基于闽楠全基因组数据,共鉴定出了52个bZIP转录因子,鉴定出的基因数量与其他的木本植物不同。在油桐(Verniciafordii)、白烨(Betulapendula)、银杏(Ginkgobiloba)、杨树(Populus)中分别鉴定出50、47、40、86个[14-16]。表明闽楠与其他植物之间的差异。
在闽楠中鉴定出的52个PbbZIP基因被划分为10个亚家族,这些基因在系统发育树中属于同一亚科,基因关系相对保守,与拟南芥的划分一致[7]。同类的亚家族基因成员也具有相似的功能。拟南芥中的一些bZIP基因家族成员已经被证实在干旱、高盐胁迫下发挥重要作用[17-18],因此可以推测闽楠中同类的基因可能具有相似的功能。D组成员主要在抵抗病原体和植物发育中起作用。S组中的基因在蔗糖代谢中起作用,在花的特定部位特异性表达,在胁迫处理下,bZIP同源基因也能被激活转录。因此可以推测闽楠中的直系同源基因也可能参与相似的调控途径。闽楠bZIP基因家族序列长度差异显著,在同一个组内长度相对保守。内含子与外显子个数均有差异,结构具有复杂性,存在没有内含子的bZIP基因,在其他植物中也发现有同样的情况[19]。蛋白互作网络分析表明,PbbZIP与OST1、NPR1、ABI3等互作,暗示其共同参与根系的水分胁迫响应。研究表明,植物bZIP基因家族可与ABRE元件、G-box元件结合,通过ABRE表达的基因受bZIP类转录因子的调控[8]。如在拟南芥中部分bZIP转录因子可与ABRE元件结合,激活ABRE元件驱动的基因表达,提高对于各种非生物胁迫的抗性。本试验在闽楠中也鉴定出大量的ABRE元件和G-box元件,推测PbbZIP转录因子通过与启动子区域的G-box元件结合,调控目的基因的表达。
PbbZIP基因在6个不同时期的表达量热图表明,在水分胁迫下,大部分基因随着干旱或水涝天数的增加,表达量呈下降趋势。但仍有基因在水分胁迫下表现出一定的抗性。例如,PbbZIP40基因在干旱胁迫下表达量较高,说明它可能是重要的抗旱基因。从系统发育树可知AtbZIP60与PbbZIP40在同一分支上,属于K组。在其他植物中,K组基因的数量也相对较少,这表明K组基因可能在植物的抗逆境过程中发挥着重要的作用[18,20]。此外,PbbZIP15在干旱和水涝胁迫下均表现出较高的表达量,表明它在闽楠根系水分胁迫中也可能是一个重要的抗性基因。在枣的研究中,ZjbZIP11已被证实是抗性基因[18],PbbZIP15与ZjbZIP11属于同源基因,因此推测PbbZIP15也可能具有类似的功能。在萝卜的研究中,RsbZIP059基因同属B组基因,该基因被证实在萝卜主根的热胁迫和盐胁迫响应中起关键作用[20]。因此,推测bZIP的B组基因在果实发育以及外界非生物胁迫中具有重要的调控作用。
本研究首次基于全基因组数据对闽楠的bZIP基因家族进行了筛选与分析,探究了该基因家族在水分胁迫下的响应机制,同时筛选出了2个重要的抗性基因。这可为进一步研究其调控机制提供重要的理论基础。

