基于临床-影像组学列线图模型鉴别局灶性机化性肺炎与肺腺癌
刘云泽,李宬润,郭俊唐,刘 阳
中国人民解放军总医院1研究生院,2第一医学中心胸外科,北京100853
肺癌是死亡率第1的恶性肿瘤,近年来我国肺癌发病率呈明显上升趋势[1,2]。随着CT检查的普及,越来越多的肺孤立性小结节被查体发现,性质难以明确。机化性肺炎是一种肺良性病变,往往迁延不愈,难以吸收,病因尚不明确,病理上包括肺泡间隙、支气管腔中的息肉样肉芽组织,以及伴有慢性炎症改变的肺泡间隔增厚[3,4],其中局灶性机化性肺炎(FOP)这一亚型,占比10%~15%[5],在初诊时,患者多没有症状,影像学也很难与周围型肺腺癌(LUAD)鉴别,即使正电子发射计算机断层显像CT(PETCT)对于良恶性结节的区分效能也较为有限[6],更何况想要细化区分为良性结节的某一亚种。部分FOP患者会以“疑似肺癌”为初步诊断,进行手术切除,术后病理证实为机化性肺炎[7]。影像组学[8]可以将医学图像信息转化为高通量的数据信息,包括纹理参数、形状特征等,对病灶进行精准、客观、定量评价[9],随着影像组学的发展,很多临床医生肉眼不易捕捉的信息,可以被有效的提取到,在临床初诊存疑的情况,可以对诊断起到辅助作用,增加诊断的准确率,避免不必要的手术[10,11]。目前国内外研究较少,且此类研究多为宽泛的良恶性鉴别,并未具体到发病率不低的机化性肺炎;或者单纯通过影像组学标签进行鉴别,并未纳入临床因素的分析。为了提高FOP与LUAD的鉴别率,本研究回顾性分析同期住院的FOP患者和周围型LUAD患者资料,建立由临床特征和影像组学标签组成的风险预测模型,从而获得两种疾病的术前判别。
1 资料和方法
1.1 一般资料
初步选取本院2019年1月1日~2022年12月31日经术后病理确诊的124 例FOP 和随机抽取1000 例LUAD患者资料。入组标准:年龄为18~80岁;行肺切除手术后有明确的病理诊断;肺部结节为单发;术前行平扫CT检查,CT图像质量可靠,无明显伪影;初诊患者,无其他肿瘤病史,病灶未经穿刺及放化疗、免疫治疗;所有入组患者肺部无明显间质纤维化、肺气肿、肺大疱、弥漫性炎症等严重影响图像均质性改变疾病。排除标准:CT影像及临床病历资料不全;肺部病变为非结节状;结节最大直径大于3 cm。本研究病例影像和病理对应图像(图1)。
1.2 检查方法
1.2.1 CT检查 采用philips brilliance ict 512层螺旋CT机,扫描参数为:管电压120 kV,0.2 s/圈,80 mm准直,扫描矩阵为512×512,图像常规层厚5 mm,1.5 mm薄层肺窗及纵隔窗重建,螺距0.75患者体位仰卧位,双手臂贴耳侧,头侧先入,嘱患者吸气、屏气,吸气末扫描。
1.2.2 图像分割 将患者原始Dicom 数据,导入3D slicer 5.2.2 中,在3D slicer 中调整统一灰度参数(W:1400 L:-500)后。对患者术前平扫CT的1.5 mm薄层图像进行手动分割。应用勾画工具中的自由勾画,放大图像3倍,由以上2名具有阅片资质的临床医师或影像医师分别沿肿块边缘逐层勾画并保存感兴趣区(ROI),并融合生成三维的感兴趣体积(VOI),两位医生收到的病例为随机顺序,平均分成两份,勾画两份病例间隔超过14 d。
1.3 统计学方法
采用python 3.7+SPSS 23.0软件进行特征提取及统计学分析。正态分布的计量资料采用均数±标准差表示,非正态分布的资料采用M(Q1,Q3)表示,计数资料采用例数或百分比表示,对相关临床特征及各项检验指标采用单因素Logistic回归,将具有统计学差异的临床指标以及临床中可能具有区分价值的指标,进行多因素Logistic回归,Ρ<0.05为差异具有统计学意义。同时,基于肺部平扫CT进行影像组学特征提取。对2名医师提取的组学特征利用组内相关系数(ICC)进行一致性检验,筛选ICC<0.75 的特征淘汰。将相关特征经Z-score 标准化处理,对于重复性较高特征的经Spearman秩相关检验、聚类分析、过滤特征、样本可视化,构建数据后进行LASSO回归,进行5次交叉验证。应用临床特征及影像组学特征共同建立列线图模型。按照8∶2比例随机分成训练集和测试集,应用受试者操作特征(ROC)曲线评价模型在训练集和测试集的效能,测得灵敏度、特异度、准确率、阴性预测值、阳性预测值及ROC曲线下面积(AUC)。应用校准曲线评价影像组学评分的校准能力。
2 结果
2.1 一般资料
共收集1124例因肺结节行手术治疗的患者,机化性肺炎患者124例,根据纳入排除标准筛选出FOP60例,在应用倾向评分匹配1∶2筛选出LUAD120例。两组基线资料统计数据如表1。
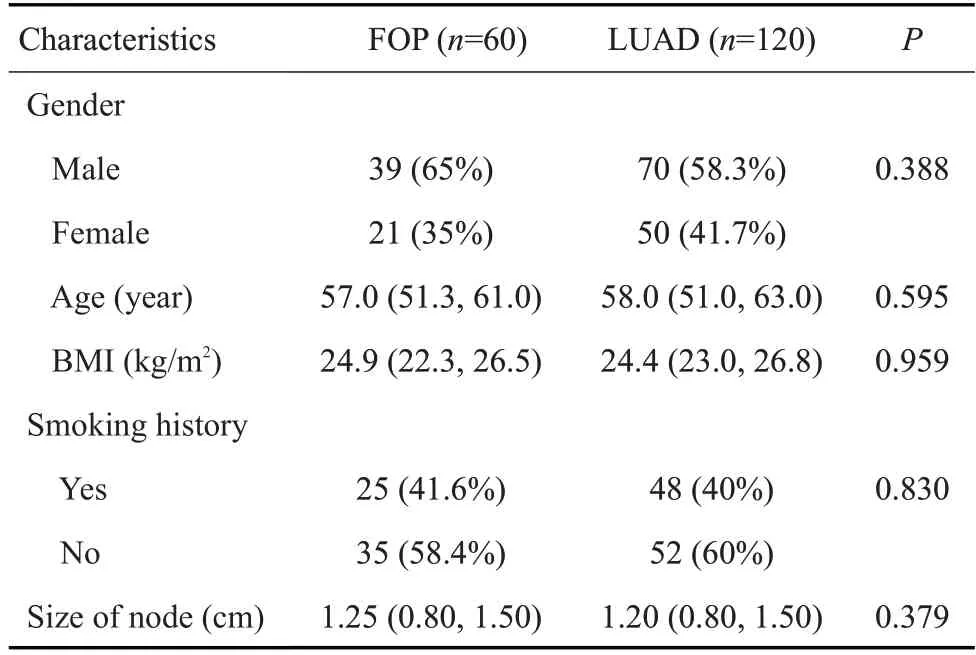
表1 基线资料统计表Tab.3 Baseline data of the patients with FOP and LUAD
2.2 特征提取和影像组学标签评分
将勾画好的VOI及原始Dicom文件进行影像组学特征提取,主要分为几何形状,强度,纹理特征三方面。利用灰度共生矩阵(GLCM)、灰度区域大小矩阵(GLSZM)、灰度游程矩阵(GLRLM)、邻域灰度差异矩阵(NGTDM)、灰度相关矩阵(GLDM)来计算,因为提取特征过多,为了防止过拟合,增加模型应用效能,通过多种方式降维,共得出30个系数非0的影像组学标签,其中系数前8位的是灰度游程矩阵中的灰度非均匀性,表示图像中灰度级强度的可变性;灰度级大小区域矩阵特征中的尺寸区域非均匀性,表示测量图像中大小区域体积的可变性,值越低表示大小区域体积越均匀;原始图像形状的球形度,表示VOI表面的曲率;一阶特征峰度,表示图像ROI 中值分布的“峰值”的量度;灰度共生矩阵特征中的相关性信息度量;在小波变换中,三个维度均使用高通滤波器,相邻灰度差矩阵的粗糙度;灰度级大小区域矩阵特征中小尺寸区域分布的量度,数值越大表示区域越小,纹理越精细”灰度级大小区域矩阵特征中的区域熵(图2、3)。
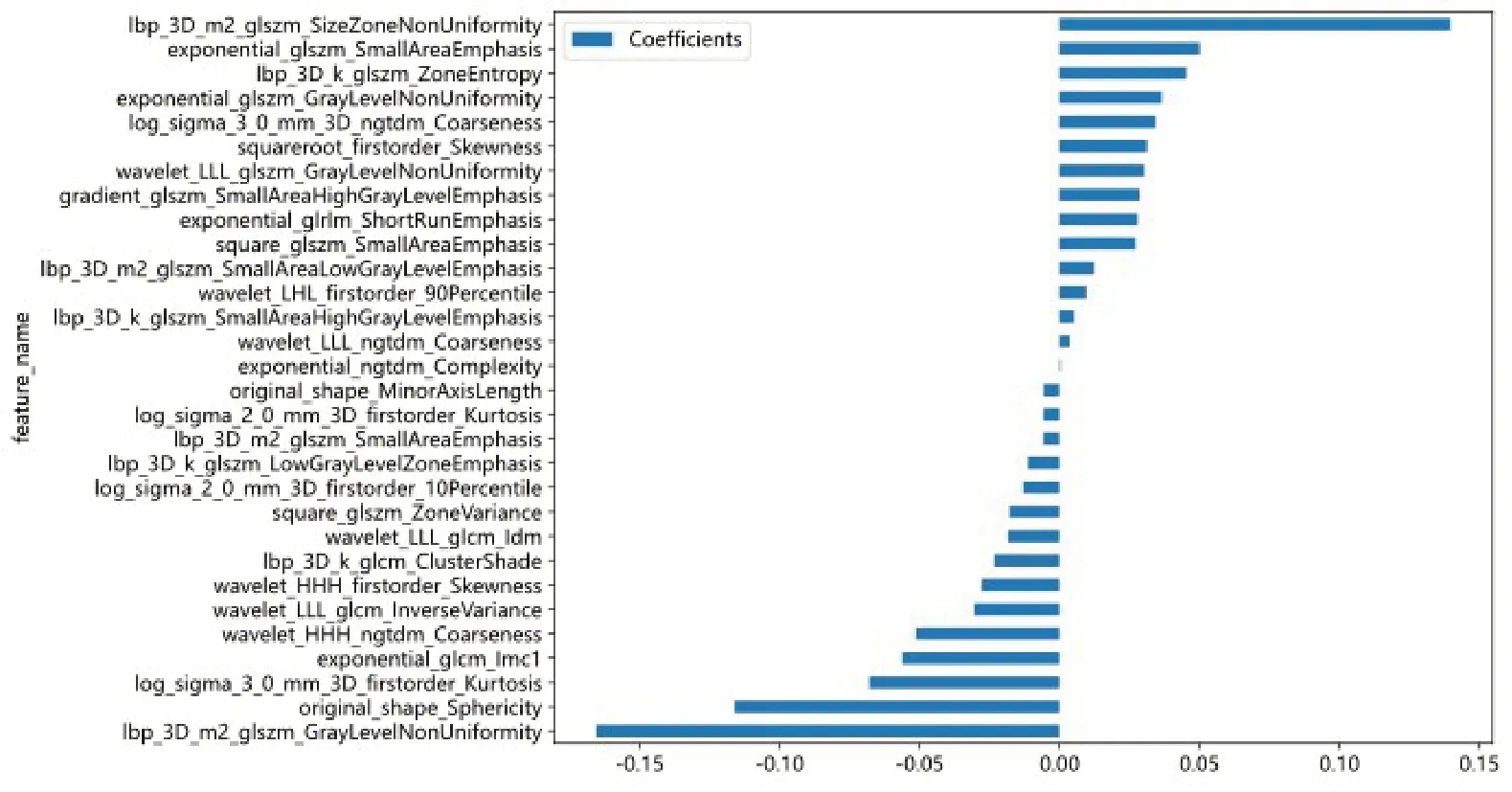
图2 用于构建模型的影像组学标签Fig.2 Radiomics labels used for model construction.
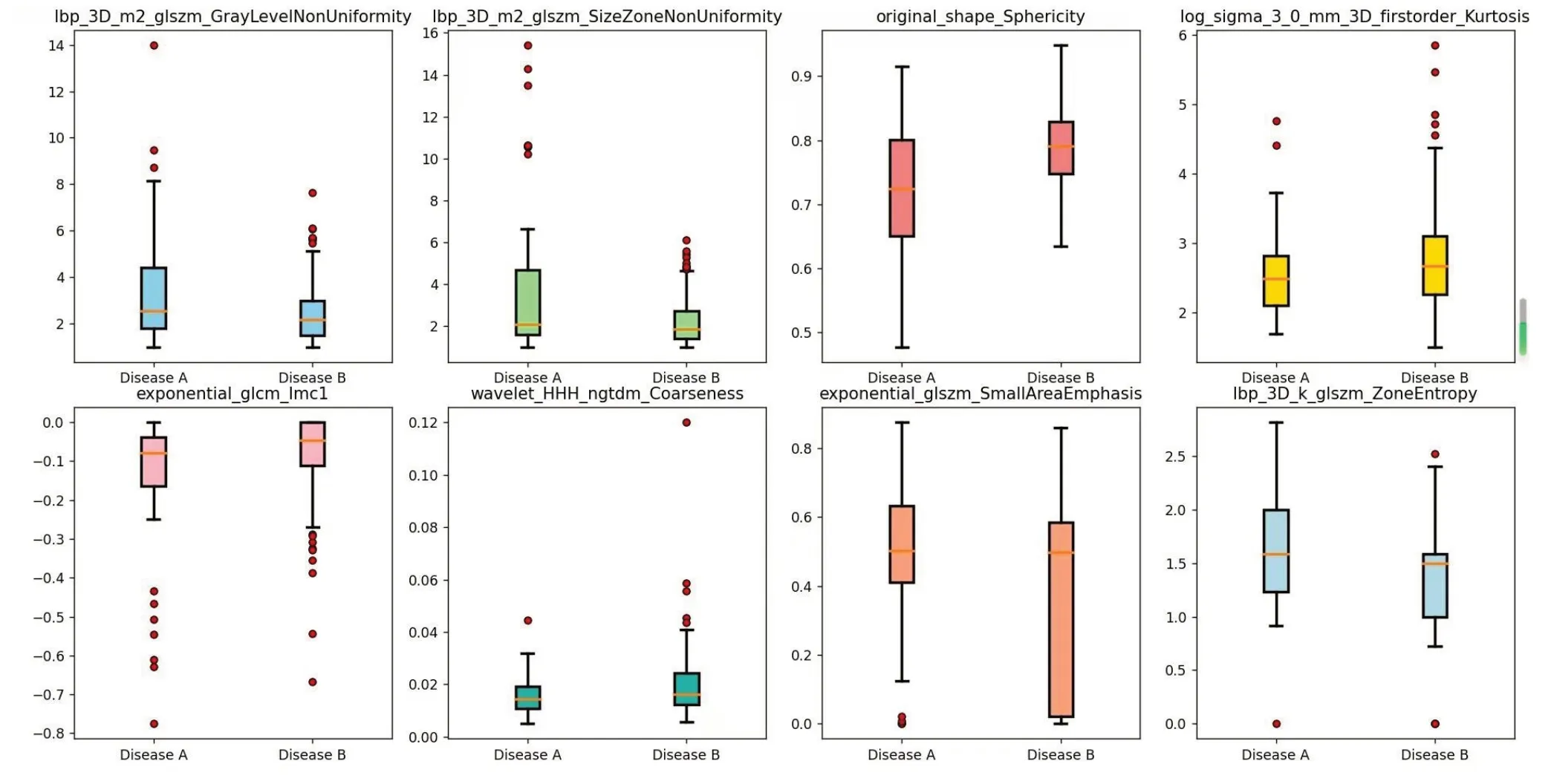
图3 影像组学标签对于区分两种疾病的箱线图统计表Fig.3 Box chart statistics table of radiomics labels used to distinguish DiseaseA(FOP)and Disease B(LUAD).
2.3 临床危险因素分析
结果显示“过敏史”[OR=2.739,95%CI(1.177~6.375)]在两组数据中,差异具有统计学意义(Ρ=0.016,表2),通过单因素分析筛选可能作为危险因素的指标,与检验学指标一同纳入多因素Logistic回归,选入水准α=0.05,剔出水准α=0.1,发现“过敏史”为FOP的危险因素,即“有过敏史”罹患FOP的风险更高(表3)。
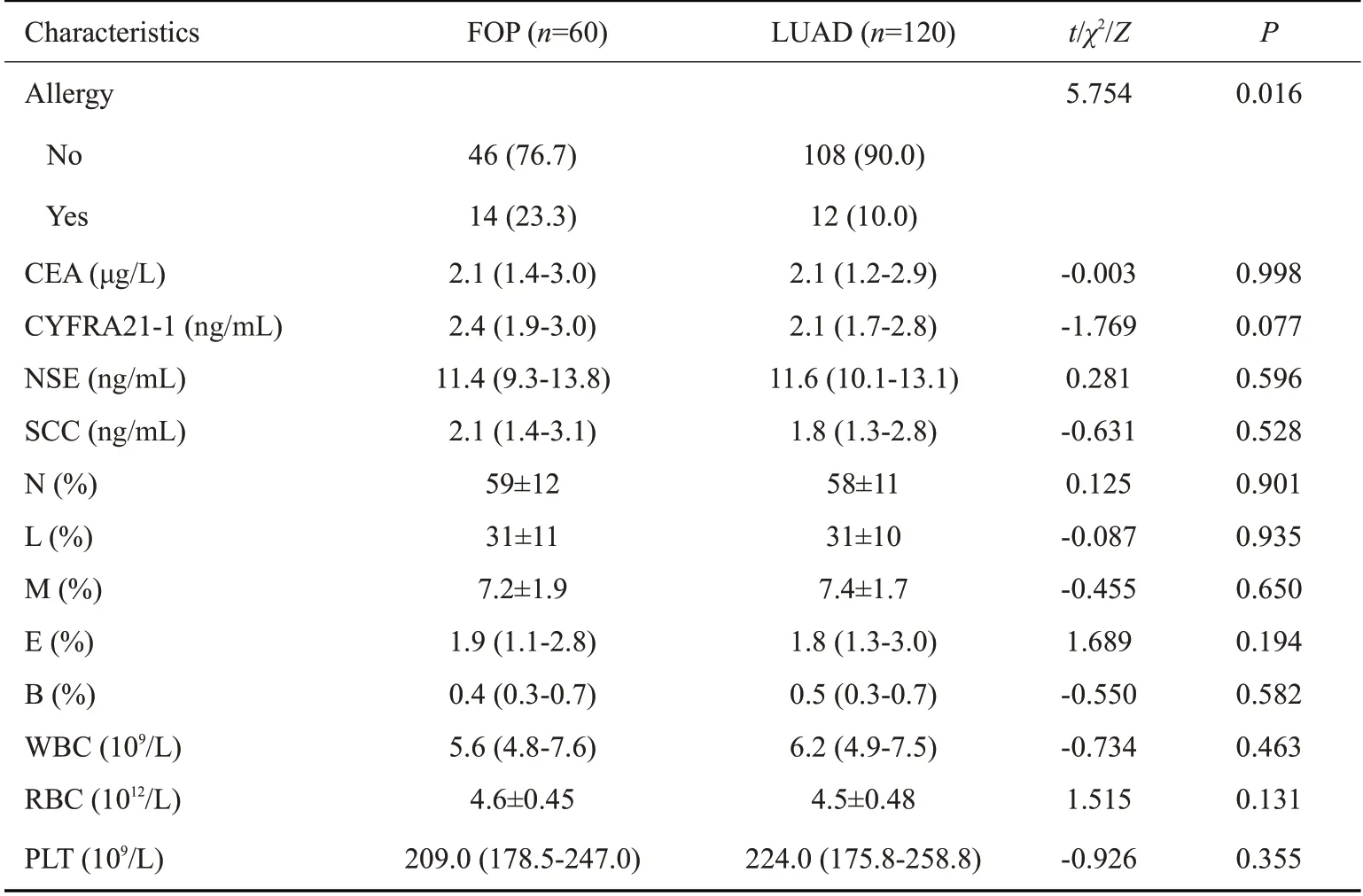
表2 临床资料统计表Tab.3 Clinical data the patients with FOP and LUAD
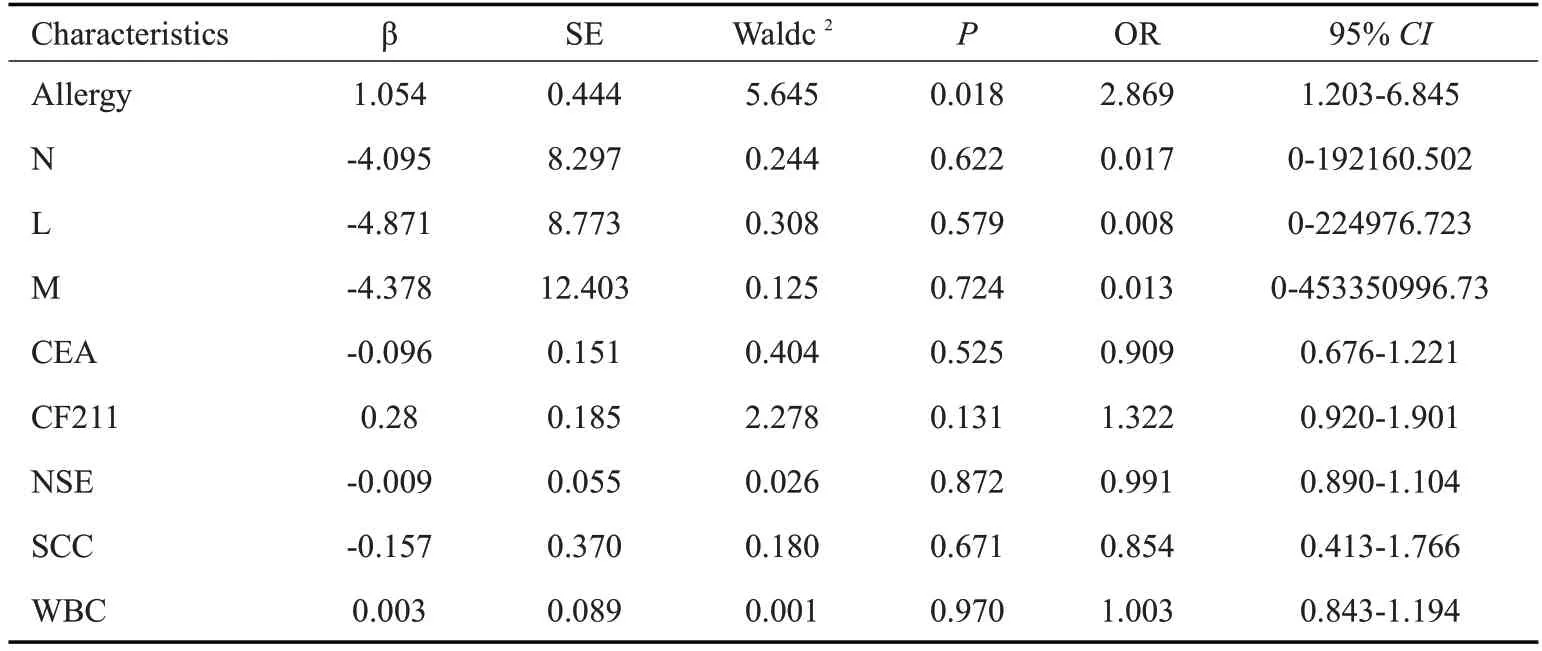
表3 Logistic回归分析Tab.3 Multivariate logistic regression analysis
2.4 模型构建与评价
在训练数据集上建立基于Logistic回归分析的临床-影像组学的列线图模型。在测试集中检查了列线图模型的诊断效果。采用受试者工作特征(ROC)曲线和ROC曲线下面积(AUC)评估识别效果。计算校准曲线,比较预测结果与观测结果的一致性,并采用Hosmer-Lemeshow分析拟合评价。训练集中预测模型的ROC曲线下面积(AUC)为0.909(95%CI:0.8550~0.9627)、测试集为0.901(95%CI:0.8030~0.9989)。模型在训练集敏感度、特异性及准确率分别为85.4%、83.5%、84.0%,测试集分别为94.7%、70.6%、83.3%(图4~6)。
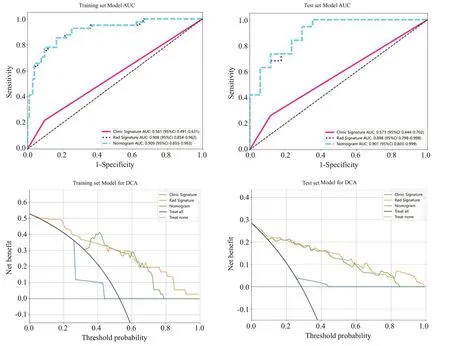
图5 训练集和测试集的ROC曲线及DCA曲线Fig.5 ROC and DCAof the training and test datasets.
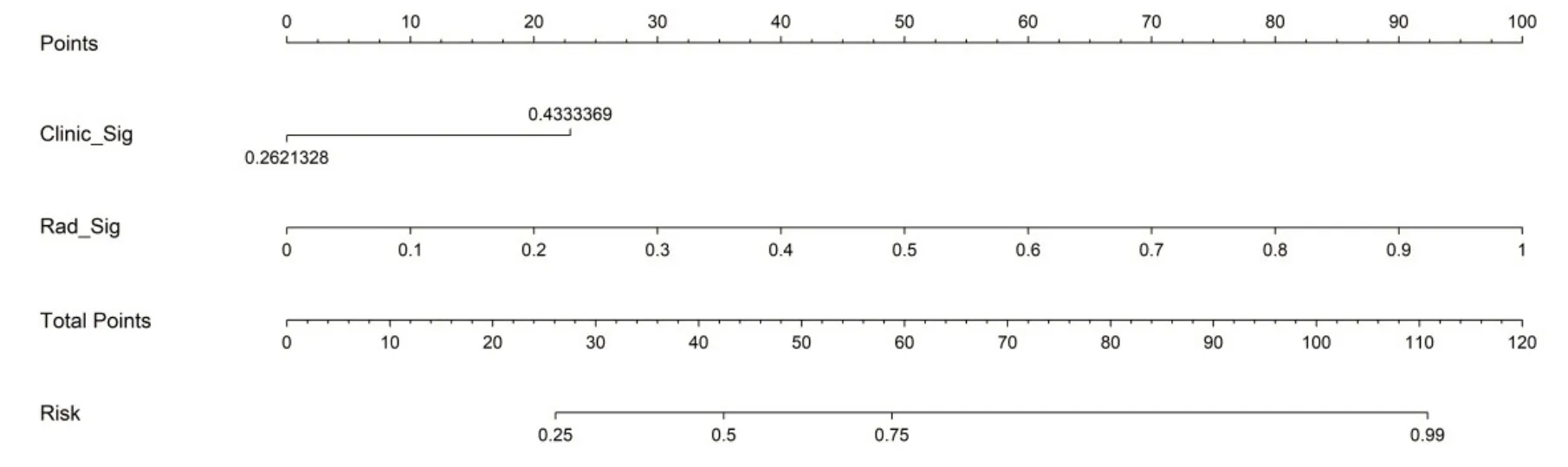
图6 基于临床-影像组学,鉴别局灶性机化性肺炎和肺腺癌的列线图模型Fig.6 Nomogram model based on clinical-radiomics for differentiating FOP from LUAD.
3 讨论
低剂量CT筛查可以明显降低肺癌死亡率[12],随着“新冠后时代”的到来,越来越多的人进行肺部低剂量CT检查,从而也有更多意外的肺部结节被发现[13]。在体检偶然发现的肺部结节当中,最常见的恶性结节是LUAD。基于现有的医学影像特征分析研究,某些多维纹理特征能够准确反映病变组织的病理学信息[14],已有研究使用影像组学模型区分肺部结节良恶性、治疗前后变化、预测疾病预后[15-18],但是精准针对某一种肺部良性结节的诊断模型却很少。据报道,有些患者新冠感染后,可能会出现继发的机化性肺炎[19],作为一种病理诊断,其中包含亚型-局灶性机化性肺炎(FOP),很容易与周围型肺腺癌混淆。根据已经发表的文献,机化性肺炎的内科疗法,尤其是激素冲击治疗,对于相当一部分病例有较好效果[4,20]。对于此类疾病,目前仍然只能依靠明确的病理结果作为诊断金标准,而获取病理的过程中,可能会造成一定的风险[21],目前研究表明,有一些无创检查,可以提高诊断此病的概率,比如灌注CT[22]。如果可以在术前确诊,可以避免过度医疗所造成的创伤。
本文分别从临床和影像组学入手,尝试建立一个有利于区分FOP和LUAD的组合模型。临床指标方面,本研究发现,在“过敏史”上,两种疾病有明显差异。在以往的研究[17,18,23,24]中,本项指标并未被纳入统计。而在我们的研究中,罹患机化性肺炎的病人,有着更高的食物药物过敏或者罹患过敏性疾病的概率。有文献报道,机化性肺炎有较高的比例,继发于免疫相关疾病,且应用激素治疗,有望治愈[4,20],说明此项指标可能为鉴别两种疾病的重要依据之一,并且在临床初诊时,此指标容易获得,不会增加额外的风险或者费用。在Hawkins和Selvam的两项研究中[17,25],研究者用影像组学标签进行了肺结节良恶性的鉴别,得到了具有较好的诊断效能的模型,可是因为良性结节包含种类繁多,而建立模型的结节内容未进行设定,造成了一定程度上的不稳定性;本研究因为针对病理明确的单种良性结节进行建模,具有更好的诊断效能和说服力。确定构建列线图的临床指标后,再进一步进行影像组学相关研究。在勾画VOI上,本研究为两名医生手动勾画,相较于目前应用更为广泛的人工智能勾画,准确性有大幅度提升。为减小误差,采用ICC衡量两位医生的勾画组间差异。第二步再从肺部平扫CT原始影像数据及VOI中提取出glrlm、glszm、ngtdm、shape、firstorder、glcm、gldm 这7 组共1835个特征,经过多种方式降维。尤其是LASSO 回归,为目前常用的特征筛选方法,应用增加约束条件和构建惩罚函数的办法,压缩系数,将很多无关紧要的自变量系数压缩为0,最终得到30个系数非0的特征,在训练集基于python建立鉴别FOP及LUAD的临床-影像组学的列线图模型,应用测试集进行验证,获得诊断模型,帮助临床医生提供更精准的临床决策。
最终得出的逻辑回归线性模型(LR),训练集ROC曲线下面积0.909,测试集为0.901,且有较高的敏感性与特异性,CT影像组学对于肺结节良恶性的判别一直是一个热点话题,早期有学者研究基于CT特征辨别FOP[26],但是CT特征的判读具有一定的主观性,相较于影像组学,标准性较差,且影像组学特征标签具有更高的诊断效能。目前也有一些研究基于深度学习对于肺部结节的良恶性进行判断[27],良好的深度学习模型确实对术前诊断有很大帮助,但是深度学习模型的不足也是显而易见的,得出的模型不具有可解释性,需要的样本量较大,对于临床数据量不足的疾病,如FOP,深度学习模型往往不能得到令人满意的结果。本研究中筛选出的影像组学特征,“GraylevelNonUniformity,灰度游程矩阵中的灰度非均匀性。”、“SizeZoneNonUniformity,灰度级大小区域矩阵特征中的尺寸区域非均匀性。”等用于建模的影像组学标签,具有明确可解释的意义,这也使得得出的结论更具有可靠性和实用性。也可以更好的对临床决策进行指导。本研究的优点在于通过临床-影像组学模型鉴别FOP和LUAD,数据量相较于以往研究较多,对于鉴别诊断也更有针对性[28,29];其次,本研究建立的列线图模型具有较高的诊断效能,为一种无创且易于执行的术前辅助诊断工具,有望在临床上使得部分疑诊患者避免不必要的手术治疗和穿刺病理活检所带来的风险[30],为部分非癌患者提高随访观察的信心,转而进行尝试性药物治疗或者进一步检查,如灌注CT等[22]。根据2017年Lambin提出的评估体系细则[31],本项研究在影像组学评估体系中,完成的评价标准较多,可以认为具有一定的说服力与验证效能。
但是本研究也有一些不足:本研究为单中心研究,在未来的研究中考虑纳入多中心、更大的样本量数据,完善外部验证;作为回顾性研究,可能存在不可避免的选择偏差,未来需要进行前瞻性研究验证;本研究只应用了一种成像方式,如果可以对其他方式,如PETCT进行结合,扩展影像数据库,可能会得到更有价值的模型。
综上所述,因为临床上没有对于局灶性机化性肺炎的明确诊断办法,在临床医生初诊存疑的情况下,可以使用本模型,加强诊断效能,使得部分患者获益。