磁场成骨效应在口腔领域的应用及机制研究进展
陈金泉, 刘宇妍, 王国庆, 孙秀梅
吉林大学口腔医院正畸科,吉林 长春(130021)
磁场可远程为细胞、组织提供磁刺激。目前,磁场的生物安全性已被证实[1]。由于具有良好的抗炎作用[2]、促血管生成作用[3]和促成骨作用,磁场被应用在骨质疏松症、骨折愈合、骨关节炎、糖尿病伤口愈合和癌症等多种疾病的治疗中。与药物、手术和其他物理方法相比,磁场具有无创性的优势。近年来,磁场被逐步引入口腔领域,其促成骨作用在口腔正畸、种植、颌面外科等领域有一定的应用前景。然而,磁场对骨组织的生物学效应并没有统一的定论,一方面归因于不同组织来源细胞的生理特性具有差异性,如磁化率;另一方面是由于磁场参数不同,包括磁场强度、频率、波形、作用时间和方式等。本文将介绍磁场的成骨效应在口腔领域的应用研究,并深入探讨磁场对骨组织细胞的生物学效应及其分子机制,以期为口腔疾病的治疗提供参考。
1 磁场成骨效应在口腔领域的应用研究
1.1 磁场加速正畸牙移动
在正畸治疗过程中,一些并发症如龋白斑和牙根吸收的发生风险常随着治疗周期的延长而增加。研究发现20 ~ 204 mT 的静磁场(static magnetic field,SMF)可显著增加小鼠的牙移动速率和移动量[4]。2022 年,Bhad 等[5]对脉冲电磁场(pulsed electromagnetic field,PEMF)的牙移动效应进行临床研究,发现在0.5 mT、1 Hz 的PEMF 环境中尖牙远移量显著增加。这些研究表明,不同类型的磁场都具备促进牙槽骨改建、加速正畸牙移动的潜能,有望缩短正畸的治疗周期,减少正畸并发症的发生,间接提高患者的治疗积极性和依从性。与手术手段相比,磁场能有效减小组织损伤和疼痛。然而,与其他加速正畸牙移动的非手术辅助手段如激光[6]等比较,磁场是否具有优势仍是个未知的问题。
1.2 磁场促进骨整合
骨整合影响种植体的生物学稳定性。Nayak等[7]将磁性愈合基台引入临床,结果发现,PEMF能有效减少骨质流失,提高即刻种植体的稳定性。磁场的促骨整合作用有利于降低植体松动的风险。对于骨结构恶化的糖尿病患者和骨质疏松症患者,PEMF 和SMF 也能发挥促成骨作用,抑制骨结构恶化和骨丢失,并且这种抑制作用具有强度依赖性[8-9]。磁场的成骨潜能或许有利于提高骨质疏松症患者和糖尿病患者的的种植成功率,可进一步设计实验将磁性愈合基台应用在骨质疏松模型或糖尿病模型中进行验证。
1.3 磁场提高牵张成骨的效果
牵张成骨术可有效延长和重塑骨骼,对颌骨严重畸形的患者具有重要意义。现有研究认为,磁场可加速牵张成骨模型的骨形成,缩短牵张成骨所需的时间[10]。目前,一些团队已经成功开发出磁激活的牵张成骨器。Kadlub 等[11]在尸体模型上验证了这类装置植入人体的可行性。磁场或可成为牵张成骨的辅助治疗手段,缩短牵张成骨的疗程,为临床提供新的可能性。
1.4 磁场促进骨折愈合
磁场作为骨折愈合的辅助治疗手段已有多年的临床应用历史。1.5 mT 的静磁场能促进小鼠骨折模型的骨形成和骨折修复,显著增强骨的生物力学性能[12]。Oltean-Dan 等[13]认为,在骨折愈合的早期即应用高频PEMF 可高效地促进大鼠的骨折愈合。然而如何针对不同的骨折类型,规范选择磁场类型及参数,仍需进一步研究。
2 磁场对骨组织细胞的生物学效应
随着研究的深入,磁场促进颌骨与牙槽骨的骨改建、骨整合和骨再生的作用已得到实验和临床的广泛认可。磁场的成骨效应在细胞层面表现为磁场对骨组织细胞的生物学效应。磁场通过调控成骨细胞和破骨细胞参与的成骨和骨吸收来实现骨代谢的调控。
2.1 磁场对骨组织细胞代谢的生物学效应
骨组织细胞是磁场调控骨代谢的靶细胞,主要包括成骨细胞、破骨细胞和骨细胞。这些骨组织细胞对磁场的反应具有差异性:磁场环境下,成骨细胞的成骨作用得到增强,骨细胞的凋亡率降低,而破骨细胞的功能活动则在不同的研究中有不同的表现。
成骨细胞来源于间充质干细胞,是介导骨形成的主要功能细胞。大量研究证明磁场能显著上调碱性磷酸酶、Runt 相关转录因子2、骨桥蛋白、骨钙素等成骨相关因子的表达,促进间充质干细胞的成骨分化和成骨细胞的骨形成。磁场通过调节细胞周期,促进成骨相关细胞增殖;通过上调整联蛋白和钙粘蛋白受体的表达,恢复炎症环境中的细胞粘附力。磁场优异的成骨性能和促细胞粘附作用,使磁性支架材料能促进颌骨缺损的修复,在骨组织再生工程中具有广阔的应用前景[14]。磁场对成骨细胞系的形态和取向也有影响:PEMF 可显著拉长成骨细胞的初级纤毛[15],有利于提高细胞对磁刺激的敏感性,还能容纳更多从细胞质移位的信号分子;而强SMF 暴露可让MC3T3-E1 细胞变成棒状,并朝着与磁场平行的方向定向[16],推测与MC3T3-E1 的磁化率各向异性有关。在这些研究中,使用的成骨细胞系主要包括:小鼠MC3T3-E1细胞[17]、大鼠颅骨成骨细胞[16]和人松质骨成骨细胞[18];使用的间充质干细胞主要为骨髓来源[19],牙源性间充质干细胞如牙周膜干细胞[20]和牙髓干细胞[14]则较少,这可能是由于骨髓间充质干细胞的分离培养的历史更为悠久,技术更为成熟。虽然牙源性间充质干细胞与骨髓间充质干细胞具有相同的特征,但是牙源性间充质干细胞更易获得且拥有更高的生长潜力和稳定性[21]。磁场作用下的牙源性细胞的成骨潜能值得深入研究。
目前,磁场对破骨细胞的影响仍无定论。有研究认为磁场对破骨细胞无影响[22-23]。也有研究认为磁场可促进破骨细胞生成,解除高糖条件对破骨细胞功能的抑制[24]。但更多的研究认为磁场在促进成骨的同时通过抑制破骨细胞的功能减少骨吸收[25-27]:一是抑制破骨细胞的分化成熟,抑制破骨前体细胞的融合,减少破骨细胞的伸展,缩小F-肌动蛋白环;二是抑制破骨细胞活性,降低破骨细胞中的线粒体含量,同时升高ATP 水平;三是加速破骨细胞的凋亡。这些矛盾结果的产生一方面可能是由于实验环境的不同,如高糖、低压低氧等;另一方面也可能是由于磁场类型和磁场参数的不统一;此外,在一些实验中发现,磁场对破骨细胞的作用还会受到其他细胞的影响[28]。破骨细胞功能的失调是骨质疏松症等代谢性骨病发生骨质恶化的重要原因。目前,基于生物材料的治疗策略已经成为治疗骨质疏松症的研究热点[29]。磁场对破骨细胞功能的抑制和对成骨细胞成骨作用的上调对调节骨稳态和逆转骨质疏松症有重要意义,磁场或可成为提高这些生物材料治疗效果的辅助技术。
骨细胞是维持成熟骨新陈代谢的主要细胞,然而磁场对骨细胞的生物学效应的相关研究较少。现有研究显示,16 T 的静磁场可显著提高骨细胞的活力并抑制其凋亡;此外,还可影响细胞骨架,促进微丝和微管的重排。进一步研究发现其机制可能是SMF 通过促进铁摄取和减少铁排泄,增加骨细胞中的铁含量[30]。与SMF 类似,15 Hz 0.5 mT 的PEMF 也可以抑制细胞凋亡,调节细胞骨架分布,但当强度增大至3 mT 后,反而会促进骨细胞的凋亡[28]。
2.2 磁场参数对骨组织细胞的生物学效应
磁场强度、频率、波形、作用时间和方式等参数的不同会对实验结果产生影响。依据现有研究,对静磁场成骨效应的最佳参数的观点主要是:弱SMF(<1 mT)和中等强度的SMF(1 mT~1 T)和强SMF(1 ~ 5 T)可促进骨形成[31],增加成骨细胞数量并促进成骨,减少破骨细胞数量并降低骨吸收。PEMF 调控成骨的最佳频率为7.5 ~ 75 Hz;当强度小于2.5 mT 时,PEMF 对细胞的作用以成骨为主,上调成骨细胞的成骨活动,同时抑制破骨细胞介导的骨吸收,骨形成大于骨吸收;当强度大于3 mT 时,破骨细胞的功能活动随之增强,开始促进破骨细胞的形成,骨吸收增多[32]。此外,采用间歇暴露的方式更利于成骨。这些对骨效应最佳参数的研究有一定的临床意义,或可为临床医生提供参考,例如,在骨折愈合的早期,选择大于3 mT 的PEMF,加速破骨细胞对骨碎片的吸收,随后选用小于2.5 mT 的PEMF 上调成骨细胞的活动,抑制破骨细胞的骨吸收,加速骨折愈合[33]。磁场对骨组织细胞的生物学效应是磁场应用于口腔领域的基础,深化不同磁场参数对骨组织细胞反应的认识,能为口腔医学的发展带来更多的可能。
3 磁场调控骨代谢的分子机制
磁场通过调控骨组织细胞的功能活动介导成骨-破骨平衡,其中涉及复杂的分子机制(图1)。目前的研究主要聚焦于磁场如何由物理信号转换为生物可识别的电信号及磁场调控骨代谢的相关信号通路。
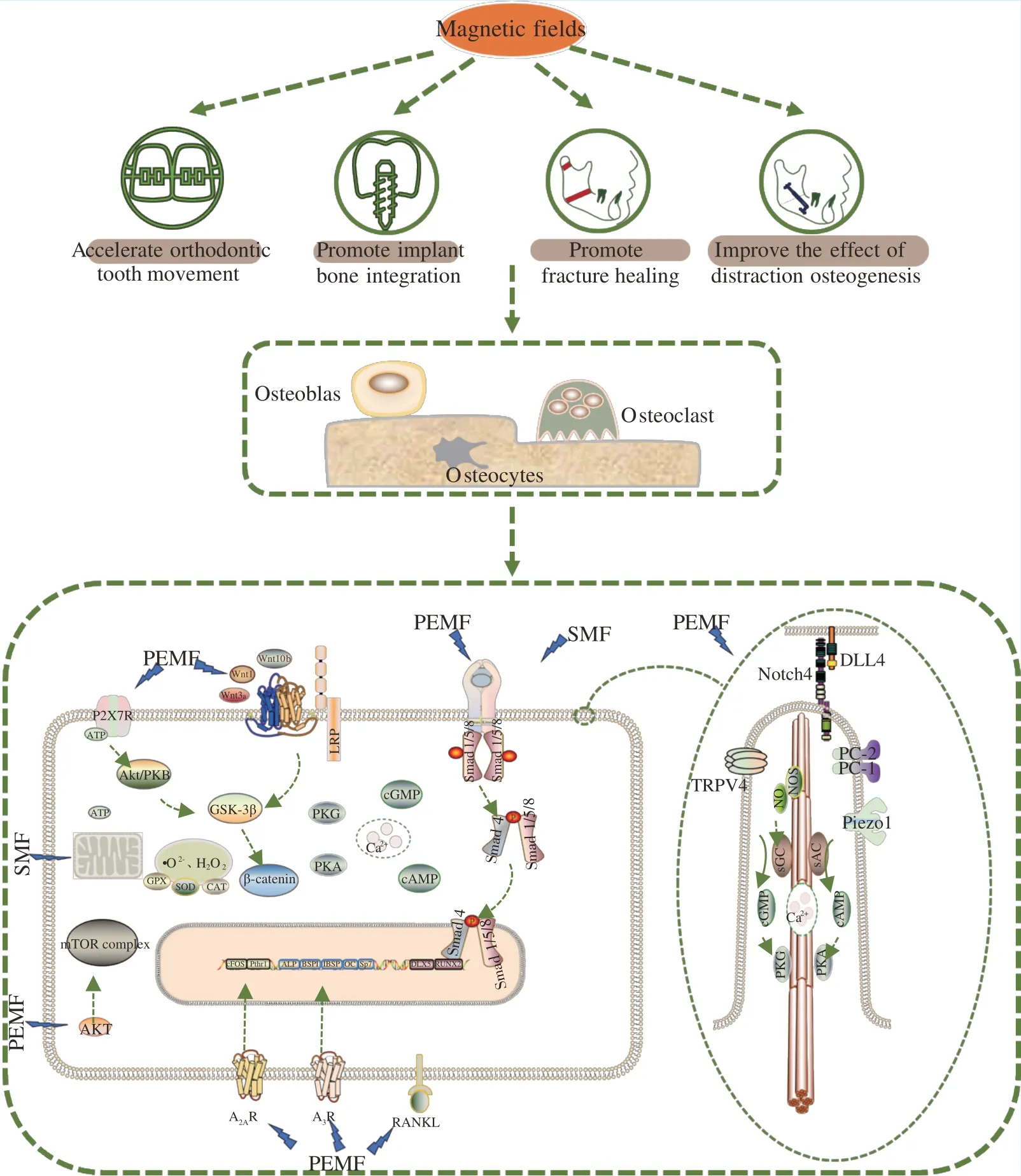
Figure 1 Application and mechanism of osteogenesis effect of magnetic field in oral field图1 磁场成骨效应在口腔领域的应用及机制
3.1 磁刺激转换为生物学信号的机制
迄今为止,国内外学者对骨组织细胞感知、响应磁场的方式进行了许多研究:Yamaguchi-Sekino等[34]认为,SMF 通过位移电流、洛伦磁力和自由基对效应等机制影响骨组织,而PEMF 与骨组织相互作用的机制是电感耦合。2021 年,孙骞等[35]提出,细胞通过组装蛋白分子链感应微环境机械力学性质,将力学信号转导为电信号。磁场产生的洛伦磁力有可能通过这些蛋白分子链传递至细胞内,有待进一步研究证明。
PEMF 转换为生物学信号的机制与初级纤毛密切相关,其对成骨细胞、骨细胞和破骨细胞的调控依赖于初级纤毛的功能完整性[28,36]。初级纤毛是一种机械/化学传感器,富含蛋白质复合物,具有接收并转导外部电磁信号的独特能力。许多离子通道受体,特别是钙通道如多囊蛋白1(polycystin1,PC-1)/多囊蛋白2(polycystin2,PC-2)[37]、瞬时受体电位香草酸亚型4(transient receptor potential vanilloid 4,TRPV4)[38]和Piezo1[39]定位于初级纤毛之中。PC-1 和PC-2 组成的多囊藻毒素复合物是缺氧条件下负责翻译PEMF 物理信号的主要单位。PC-1/PC-2 复合物将PEMF 信号转化为细胞内生物信号后,激活细胞内sAC/cAMP 信号传导,最终抑制成骨细胞谱系中缺氧诱导因子-1α 的表达[23]。sAC 在检测纤毛钙离子浓度的动态变化中起扮演着重要角色。有证据表明,sGC 亦定位于初级纤毛中,0.6 mT、50 Hz 的PEMF 通过激活NOS/NO/sGC/cGMP/PKG 信号通路刺激成骨分化[15]。作为瞬时受体电位离子通道家族的一员,TRPV4 由于可控制活化T 细胞因子c1 的转录和钙内流,在破骨细胞的分化中起重要作用。而1 mT、40 Hz 正弦磁场可抑制破骨细胞中TRPV4 的表达,继而降低活化T细胞因子c1 的表达[25]。Piezo1 是一种机械门控阳离子通道,其独特的弯曲叶片和以L1342 和L1345为枢轴的长梁形成杠杆式装置,介导阳离子的选择性渗透[40]。研究发现,16 Hz 的PEMF 可诱导间充质干细胞中Piezo1 的表达,进而介导Ca2+内流,促进成骨细胞的增殖分化[41]。这些结果证实了初级纤毛在磁信号转导中的重要作用,为阐释细胞接收和转导磁信号的机制提供了新思路。同时提示PC-1/PC-2、TRPV4 和Piezo1 是磁场调控骨代谢的潜在靶点,对磁场的临床应用具有重要意义。
关于SMF 转换为生物信号的相关研究较少。SMF 对细胞的主要影响是诱导膜重新定向和变形[16]。膜受体和离子通道的变化影响磁信号的机械转导过程。T 型钙通道是一种低电压门控通道,有文献报道,当间充质干细胞上的T 型钙通道受到抑制时,SMF 的促增殖作用会消失[42]。SMF 对间充质干细胞的生物学作用离不开T 型钙通道,但T 型钙通道是否能直接感知SMF 目前仍不得而知,SMF 实现物理信号转变为生物信号的机制仍有待阐明。
3.2 磁场介导的信号通路
3.2.1 P2 嘌呤能受体信号通路 P2 嘌呤能受体与骨重建和机械转导密切相关。研究发现,机械刺激可通过诱导骨组织细胞释放ATP,激活细胞膜上的P2 受体,诱导下游通路的激活,进而调控骨代谢[43]。Zhang 等[44]证明了1 mT、15 Hz 的PEMF 对P2X7 受体的上调,并发现PEMF 通过激活Akt/GSK3β/β-catenin 轴调控成骨。Hollenberg 等[12]发现10 G 的SMF 在诱导成骨分化时会增加线粒体膜电位和呼吸复合物I 的活性。这些证据提示线粒体可能是磁场调控骨代谢的靶点,通过生成ATP参与P2 嘌呤能受体介导的信号通路。
由于呼吸链电子漏机制的存在,线粒体在氧化磷酸化过程中常生成活性氧(reactive oxygen species,ROS)。ROS 介导的氧化还原信号传导对成骨细胞的增殖分化有重要意义[45]。Ehnert 等[18]发现16 Hz 的PEMF 可诱导成骨细胞生成ROS 如·O2-和H2O2,ROS 进而作为信号分子介导成骨。磁场对线粒体的激活可能是活性氧生成的重要原因,此外,还与铁代谢有关。研究发现,0.4 ~ 0.7 T 的SMF 可上调铁蛋白重链1 的表达,增加骨组织中的铁含量,并通过激活核因子E2 相关因子2/血红素加氧酶1 途径来调节氧化还原状态[24]。虽然一定浓度的ROS 在细胞成骨分化中必不可少,但较高水平的ROS 会诱导破骨细胞介导的骨吸收,过量的ROS 甚至会引起细胞凋亡。研究发现,SMF 和重复、短期的PEMF 刺激可上调抗氧化酶如谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶的表达,提高酶活性,降低ROS 水平[18,26]。磁场或可成为炎症环境中促进骨形成的一种有效手段。
3.2.2 腺苷受体信号通路 腺苷受体在骨代谢中起重要作用。现有研究认为,PEMF 作用下,A2A对细胞分化的调控与cFos 和PTHR1 相关通路有关,而A3 则通过调节ALP,BSPI,IBSP,OC 和SP7来发挥作用[17]。磁场对骨代谢的效应可部分归因于对腺苷受体的调节。
3.2.3 TGF-β 受体信号通路 转化生长因子-β(transforming growth factor-β,TGF-β)受体信号通路在骨稳态中起关键作用。TGF-β 超家族包括两大家族——TGF-β/activin 家族和BMP 家族,是成骨分化的重要调节因子。研究发现,中等强度SMF 可上调BMPR2 的表达[46],而1.5 mT、75 Hz 的PEMF 则可上调BMPI 型受体中的ALK2[19]。此外,这两种磁场对TGF-β 的下游信号通路的激活也已被证实。一是激活经典的Smad 依赖性通路,上调Smad4 和磷酸化的Smad2/3、Smad1/5/8 水平,进而促进Smad 复合物核移位,增加成骨转录因子DLX5和RUNX2 的基因表达。二是激活p38-MAPK 信号通路,增加p38 MAPK 的磷酸化水平[19,46]。
3.2.4 mTOR 通路和Notch 通路 哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,可感知环境条件的变化,是细胞生长、增殖、分化和凋亡等过程中的关键调节因子。研究发现,0.4 mT、10 Hz 的PEMF 可通过激活mTOR 信号通路促进成骨细胞的增殖并增加骨形成[47]。然而,mTOR 信号在成骨过程中具有双重作用:mTOR 复合物1 的激活利于前成骨细胞增殖的同时还会通过激活STAT3/p63/Jags/Notch 途径阻止成骨细胞分化和成熟。目前,磁场对Notch 信号通路的激活已被证实:1.5 mT、75 Hz 的PEMF 在初级纤毛中上调DLL4 配体和Notch4 受体的表达,激活Notch 信号通路,进而诱导成骨细胞分化[48]。Ma 等[49]研究发现,mTOR 通路对骨再生的调节作用还涉及神经支配。神经系统对骨代谢和骨再生具有重要的支配与调节作用,磁场诱导的骨效应与mTOR 介导的感觉神经的分泌活动是否具有关联性亦是一个值得研究的方向。
除以上信号通路,磁场对骨代谢的调控还涉及Wnt 信号通路[22]、NO 信号通路[15]和RANK 信号通路[25]。从物理信号到电信号的转变,经各种受体层层传递并形成级联式反应进而改变基因表达,磁场最终实现对骨代谢的调控。
4 小 结
磁场具有良好的生物学效应,在加速正畸牙移动、促进骨整合和骨折愈合、提高牵张成骨效果等方面有一定的潜能,有望应用于口腔正畸,种植,颌面外科等领域。磁场良好的促成骨作用、抗炎作用和促血管生成作用使磁场在骨组织再生和牙周组织再生中具有广阔的前景。然而磁场骨效应的作用机制目前尚未明确,深入研究磁场的信号转导机制及效应分子,寻找磁场的作用靶点,可为磁场在口腔领域的应用提供新思路,为口腔疾病的治疗提供理论基础。在目前对作用机制的探索中,针对口腔骨组织和牙源性细胞的研究相对较少,这可能是受限于培养技术的成熟程度。口腔颌面部骨组织与身体其他部位的骨相似,磁场的调控机制亦有共通之处。然而,与其他来源的细胞相比,牙源性细胞的获取创伤性更小,拥有更高的稳定性和成骨潜能。在未来的研究中,可多尝试利用牙源性细胞和组织研究磁场的骨效应。另外,还可尝试寻找合适的药物与磁场联合应用放大磁场的骨效应,有待学者们进一步研究。
【Author contributions】Chen JQ wrote the article.Liu YY and Wang GQ collected the references and revised the article.Sun XM conceptualized and revised the article.All authors read and approved the final manuscript as submitted.

