2型糖尿病性周围神经病合并胰岛素抵抗病案——仝小林院士教学查房实录
连心逸,刘文科,田佳星,史丽伟,倪博然,倪 青
(中国中医科学院广安门医院,北京 100053)
近30年来,我国糖尿病发病率呈逐年上升态势,其发病率自1980年的0.67%[1]逐渐上升至11.2%,其中以2型糖尿病(diabetes mellitus type 2, T2DM)为主[2]。T2DM的病因和发病机制目前尚不明确,但多与胰岛素抵抗(insulin resistance,IR)及胰岛素分泌减少有关[3],且IR常贯穿于T2DM发病的全过程[4],而随疾病进程往往产生以糖尿病性周围神经病(diabetic peripheral neuropathy, DPN)等慢性并发症。因此,改善IR对于T2DM患者的血糖控制乃至预防并发症的发生发展都具有至关重要的作用,然而其病程发展趋势在不同体质的糖尿病患病群体中是不同的,治疗要点也往往有所区别,现介绍我院内分泌科T2DM性周围神经病合并IR患者一例,围绕患者病程进展诊疗要点邀请仝小林院士指导诊疗。
1 住院病例
宋某,女,64岁。主诉:间断口干13年,双下肢酸胀1年,加重2月。现病史:于2009年5月无明显诱因出现口干、易饥、视物模糊、小便量多,自测空腹血糖16.7 mmol·L-1,遂就诊于宣武医院,查空腹血糖16~17 mmol·L-1,餐后血糖21~22 mmol·L-1,完善相关检查后诊断为“2型糖尿病”,予口服盐酸二甲双胍片,每次1 g,每日3次,控制血糖,自述空腹血糖可控制在7~8 mmol·L-1。服药1年后体质量由46.5 kg(BMI 19.11 kg·m-2)降低至43.5 kg(BMI 17.87 kg·m-2),遂自行停药。2012年患者于宣武医院调整控糖方案为阿卡波糖片每次100 mg,三餐随餐嚼服,后于2015年3月因口干查空腹血糖22 mmol·L-1,遵医嘱在原方案基础上加用吡格列酮片每次30 mg,每日1次,服药后出现双下肢水肿,服药3 d后自行停药,自测空腹血糖在8~9 mmol·L-1。2015年5月因血糖控制不佳、3个月内体质量下降3 kg(BMI 16.64 kg·m-2)于我科就诊,查糖化血红蛋白12.3%,更改控糖方案为门冬胰岛素30注射液早晚各4 iu皮下注射控制血糖,自测空腹血糖10~11 mmol·L-1,餐后血糖10~12 mmol·L-1,后因血糖逐渐升高将门冬胰岛素30注射液改为早餐前12 iu,晚餐前6 iu皮下注射,于2016年诊为“2型糖尿病周围神经病”“2型糖尿病周围血管病变-双侧颈动脉硬化伴斑块”。2017年反复出现心慌、汗出等低血糖症状,曾出现夜间空腹血糖偏低4次,最低血糖为2.0 mmol·L-1,遵医嘱将门冬胰岛素30注射液改为早晚各6 iu餐前皮下注射,自述血糖控制在空腹10~11 mmol·L-1,餐后10~12 mmol·L-1。2017—2019年患者体质量逐渐上涨至45 kg(BMI 18.49 kg·m-2),于2019年再次住院诊为“2型糖尿病性视网膜病变”,调整控糖方案为门冬胰岛素注射液三餐前8 iu,甘精胰岛素注射液10 iu 睡前皮下注射,血糖控制不佳,现控糖方案为门冬胰岛素注射液早餐前12 iu,午餐前10 iu,晚餐前12 iu,甘精胰岛素注射液12 iu 睡前皮下注射,自测空腹血糖餐前6~7 mmol·L-1,餐后7~9 mmol·L-1。2019—2022年体质量不断上涨,3年体质量增加累计15 kg(BMI 24.65 kg·m-2)。1年前出现双下肢酸胀,未予重视,未行系统诊治。2个月前出现口干、双下肢酸胀加重,未系统监测血糖,现为求进一步系统治疗收入我科。
入院症见:口干不欲饮,时有口苦,双下肢酸胀,以大腿及小腿后侧为甚,自觉下肢灼热,头沉、时有颈部畏寒,双眼干涩,视物模糊,畏光流泪,多眵,时有畏热,偶胸闷气短,每日散步锻炼1 h。纳可,眠一般,时有多梦,大便偏干,日一行,小便调。舌色暗红,边有齿痕,苔薄白,舌下静脉迂曲。左脉细弦,右脉细滑。
既往史:2012年发现血尿酸升高,未予治疗,控制饮食后复测正常。2015年诊为甲状腺多发囊实性结节;2019年诊为高脂血症、支气管炎;2020年诊为高血压,血压最高达146/70 mm Hg(1 mm Hg≈0.133 kPa),服用缬沙坦胶囊后血压控制在110~120/50~70 mm Hg。2020年诊为骨质疏松。
查体:血压(BP)153/70 mm Hg,身体质量指数(BMI)25.06 kg·m-2,腰围95 cm,臀围86 cm,腰臀比1.10;精神可,手指肌肉减少。双下肢皮肤颜色暗,可见胫前色素斑,胫部无汗毛。双足大趾指甲呈灰黑色。双肺叩诊呈清音,双侧呼吸音清,双肺未闻及干湿性啰音及胸膜摩擦音。心音可,律齐,心率每分钟77次,各瓣膜区未闻及病理性杂音。腹平,柔软,压痛阴性、反跳痛阴性,腹部未触及包块。双踝部肌肉萎缩,双足呈鹰爪足,双足大趾外翻。双足皮温稍减低,足背动脉搏动未见明显异常,双侧下肢无水肿,双侧下肢皮温未见明显异常,双侧踝反射减弱,左侧下肢振动觉减弱,右侧下肢振动觉未见明显异常,左侧针刺痛觉减弱,右侧针刺痛觉未见明显异常,双侧温度觉未见明显异常。10 g尼龙丝实验阴性。
影像及实验室检查:糖化血红蛋白8.1%,生化全项,其中白蛋白(albumin, ALB)38.0 g·L-1,总胆固醇(total cholesterol, TC)5.61 mmol·L-1,葡萄糖(glucose, GLU)7.16 mmol·L-1,高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)1.01 mmol·L-1,低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)3.43 mmol·L-1,三酰甘油(triglyceride, TG)2.62 mmol·L-1,极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol, VLDL-C)1.19 mmol·L-1,尿酸(uric acid,UA)253 umol·L-1,糖化白蛋白(glycated albumin,GA)17.90%;肿瘤标志物:神经元特异性烯醇化酶测定(neuron-specific enolase, NSE)16.8 ng·mL-1;血常规+CRP、甲状腺功能、甲状腺抗体、红细胞沉降率、女性激素、BNP、尿蛋白分析、胰岛抗体四项、便常规未见明显异常。患者2015年、2020年、2022年葡萄糖耐量测定情况,见图1。
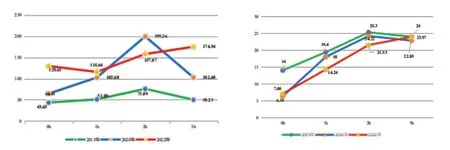
图1 葡萄糖耐量试验曲线
胸部高分辨CT平扫:1)左肺舌叶实性变范围略缩小,考虑慢性炎症;2)双肺微小结节,大致同前,必要时复查;3)双肺陈旧病变同前。乳腺超声:左乳腺多发低回声结节(BI-RADS:3类)。颈动脉超声:双侧颈动脉硬化伴右侧斑块形成。甲状腺超声:甲状腺多发囊实性结节(TI-RADS分级:2级)。
中医诊断:消渴病痹症,脾虚气滞挟瘀证。西医诊断:2型糖尿病,2型糖尿病性周围神经病,2型糖尿病性周围血管病-双侧颈内动脉硬化伴斑块,2型糖尿病性心脏病,2型糖尿病性视网膜病变,高脂血症,高血压1级(很高危),骨质疏松,房性期前收缩(房性早搏),冠状动脉供血不足,代谢综合征,非毒性多个甲状腺结节 ,乳房结节,支气管炎,肺结节。
治疗计划:根据糖尿病相关诊疗指南,予以控糖、调脂、控制血压等规范治疗。
中医治疗:以健脾行气,活血化瘀为法,方用身痛逐瘀汤加味,药物组成:白术15 g,川芎6 g,桃仁10 g,茯苓15 g,红花10 g,当归12 g,醋香附6 g,牡丹皮15 g,赤芍12 g,白芍12 g,牛膝10 g,桂枝6 g,每日1剂,水煎服,早晚分服。
2 查房笔记
2022年10月10 日13时,仝小林院士听取病历汇报后,床旁查看患者,重点询问了患者既往体质量情况、吸烟饮酒病史、饮食习惯、疾病发生发展情况,随后检查患者的舌象、脉象。患者既往否认烟酒史,患病初时嗜食冰冷,现喜食辛辣,进食时间不规律,确诊2型糖尿病时体质量46.5 kg,现体质量61 kg,发病时形体偏瘦,随着病程进展体质量不断增加,虽增加胰岛素剂量但血糖仍控制欠佳,提示患者自IR发生起胰岛功能下降明显。
患者为中老年女性,患病初时嗜食冰冷,现喜食辛辣,进食时间不规律,损伤脾胃,脾气不足,运化失司,阳气郁闭,脏腑失养,发为消渴,阳郁络脉瘀热发为消渴病痹症。脾气不足,水湿内生,故见体型肥胖、喜热饮;阳气郁闭,郁热内生,故自觉四肢温热但无明显发热;脾虚气行不畅血行瘀滞,加之热郁而致络脉瘀热,故见自觉下肢灼热;血不利则为水,故见下肢酸胀。结合舌色暗红,边有齿痕,苔薄白,舌下静脉迂曲,左脉细弦,右脉细滑,四诊合参,诊为消渴病痹症,证属脾虚热郁挟瘀证,病性虚实夹杂,病位主要在脾胃,治以健脾升阳,清热祛瘀为法,方用升阳益胃汤加减。患者注射胰岛素后逐渐出现体质量上涨等脾虚、运化失常的表现,胰岛素抵抗不断加重,补益脾气是核心治法。拟定处方:黄芪24 g,生晒参9 g,麸炒白术15 g,黄连片18 g,清半夏9 g,陈皮9 g,天花粉30 g,羌活9 g,独活9 g,北柴胡6 g,桑枝30 g,水蛭粉6 g,鸡血藤15 g,生姜2片,大枣3枚。7剂,每日1剂,早晚分服。
本次查房目的包括中医如何认识T2DM合并IR、如何认识瘦型糖尿病和肥胖型糖尿病的区别、如何改善DPN症状、中医如何改善IR,如何提高中医诊疗T2DM及其相关并发症的临床疗效进行展开。
3 病例治疗要点与难点分析
3.1 瘦型糖尿病与肥胖型糖尿病辨异
按照患者体型可将糖尿病初步划分为瘦型糖尿病和肥胖型糖尿病。瘦型糖尿病患者胰岛功能衰竭速度快、伴有IR,甚至初期便能表现出胰岛功能损伤,其主要与遗传和情志因素相关,其中情志因素对血糖影响显著。IR大致可分为受体前抵抗、受体抵抗和受体后抵抗三个类型,其中受体前胰岛素抵抗与情绪关系最为密切。肥胖型糖尿病呈渐进趋势,胰岛功能的衰竭相对较慢,因此除关注患者当下体质量外也需要关注患者体质量的动态变化及情志因素对血糖控制和IR的影响。
该患者发病之初BMI 19.11 kg·m-2,疾病进展过程中体质量由46.5 kg降低至43.5 kg,考虑发病之初为瘦型糖尿病,且患病期间患者精神压力大,故而IR相对明显。患者注射胰岛素后逐渐出现乏力、自觉下肢灼热等脾虚热郁症状,并出现体质量逐渐增长至61 kg、血糖难以控制等临床表现,由此也说明IR不断加重。本例患者发病时体质量偏低,后逐渐出现体质量上涨,长期情志不舒,胰岛素抵抗贯穿疾病始终,故在治疗时应以改善胰岛素抵抗为目标,把握疾病发展脉络。
3.2 T2DM合并IR从脾论治
T2DM合并IR可考虑从脾论治。从脏腑功能的角度看,脾虚、脾不散精而致脏腑功能受损是糖尿病发生的病机关键,是胰岛素抵抗发生的始动因素[5]。《素问经脉别论》 有云:“ 饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺”。由此说明脏腑功能的正常运转有赖于脾之运化输布。在病理状态下脾胃受损、脾失健运则水谷精微不能“灌溉四旁”,从而导致疾病的进一步发展。而胰岛素抵抗则是由于脾气不足、脾胃运化失司而致水湿内停,从而导致体质量上涨并产生血糖进一步升高等病理现象。
患者既往嗜食冰冷辛辣,饮食不规律,加之情志不舒忧思伤脾,故见口干不欲饮,随着病情进展,虚损逐渐加重,痰湿内停,故而出现体型肥胖、喜热饮,治疗应注重从脾论治,处方中宜加入黄芪、党参、白术类药物,从脾出发,改善胰岛素抵抗。
3.3 态靶辨治T2DM合并IR
态靶辨证是仝小林院士按照中医思维审视疾病全过程,理清疾病发展各阶段,归纳其核心病机提出的以态为基,以症为靶的理论[6],其中,“态”是疾病某阶段的整体概括,具有“状态、动态、态势”三层含义,“靶”包括对疾病具有特定疗效的“病靶”,对临床症状具有特定缓解效果的“症靶”,以及对理化指标、影像学检查等具有特殊效应的“标靶”[7]。在治疗中把握疾病“态”的同时有的放矢,直指靶标方能取得佳效。
对于T2DM的诊治,仝院士根据其病程进展特点归纳出郁、热、虚、损四个核心状态,在糖尿病早期,饮食不节加之外界因素影响,气、血、痰、湿等郁滞不通,而成“郁”,并产生脾胃升降失和、肝疏泄不及等情况,在治疗时常采用行气开郁、辛开苦降法;在糖尿病中期,各种病理产物郁而化热,从而形成胃热、燥热、湿热、血热等多种病理状态,在治疗时常用清热之法;糖尿病中期郁热日久病性由实转虚,伤阴伤阳为其主线,在此阶段仝院士常以健脾温阳益肾法治疗。糖尿病晚期损及脉络出现多系统并发症时,则应将并发症的治疗放在首位以达态靶通调的目的[8]。针对IR,仝院士以胃肠实热、肝胃郁热为态,针对标靶,胃肠实热、大便秘结者将大黄黄连泻心汤作为基础方清胃健脾化浊;肝胃郁热、腹型肥胖、腰臀比大者采用大柴胡汤、清热降浊方清肝和胃化浊[9-10]。
3.4 糖络并治指导DPN诊治
仝院士认为DPN属糖尿病并发症之一,处于四期中的“虚、损”阶段[11-12],属于“糖络病”的范畴,在治疗时应注重“治络”,补“虚”态、通“瘀”态,以活血化瘀通络为主要治法[13]。糖络病可以根据络脉瘀滞程度分为络滞、络瘀、络闭。络滞期多见肢体末端或冰凉刺痛或灼热疼痛,病位局限,病在皮肉,属气虚血瘀者予黄芪桂枝五物汤,属气郁化火证予升阳散火汤及升阳益胃汤;络瘀期气虚更甚,除痛觉、温度觉异常外,还出现麻、木等感觉异常,此阶段以麻、木、痛、凉为主,病位扩大至肘膝关节以下,病入气血,由络滞发展到络瘀,阳虚寒凝证予大乌头煎、瘀血阻络证予身痛逐瘀汤;晚期气血阴阳俱虚,五脏六腑皆损,痰瘀毒邪稽留,闭塞损伤络脉,此阶段症状除麻木疼痛、冰凉灼热等感觉障碍外,常出现肢体痿弱,病至筋骨,由络瘀进一步发展成络闭、络损,主要证见痰瘀互结者予仝氏化痰行瘀汤,肝肾亏虚者予三痹汤[14]。其中以黄芪桂枝五物汤基础上加减组成的糖痹方是仝小林教授治疗DPN的靶方[15],用药时以鸡血藤、川芎、桑枝等可通经络之“瘀”态,配合他药辨证随症加减往往取得佳效。
患者患病初期嗜食冰冷,四肢温热,随着病程推进,逐渐转变为嗜食温热,而四肢仍然温热。此为升阳益胃汤的典型表现,即脾虚热郁的证候。此外,用药方面应重视活血化瘀药物以及藤类药物的应用,特别是对络脉有作用的活血药,如鸡血藤、首乌藤等可舒筋活血。若患者出现络脉瘀热表现,可选用络石藤、忍冬藤等药物。
患者服药后症状明显缓解,血糖控制尚可,予以出院。出院后患者间断服用中药,于我科规律复诊,目前病情稳定,血糖及并发症病情控制可。
4 思考体会
4.1 糖尿病与IR相关研究
IR与糖尿病的发生发展密不可分,在治疗中改善IR对于控制血糖、预防远期并发症具有重要意义。在一项涉及142位新诊断为T2DM患者的研究中,患者的稳态模型胰岛素抵抗指数(HOMA-IR)与BMI、HbA1c呈正相关,β细胞功能指数(HOMA-β)与HbA1c呈显著负相关,与空腹C肽及2小时C肽呈显著正相关[16],由此可见胰岛素抵抗对糖尿病患者血糖控制具有至关重要的价值。在杨晨[17]在446名T2DM患者的研究中发现,IR组患者较非胰岛素抵抗组BMI、UA、FPG、TC、TG水平升高且更容易合并DPN。因此改善IR对于缓解代谢综合征及预防糖尿病相关并发症同样具有明显价值。
4.2 态靶辨治DPN合并IR提高疗效
仝小林院士态靶通调的辨治思路也体现在临床治疗的过程中。升阳益胃汤是治疗脾虚热郁的经典方剂。针对患者体型肥胖、喜热饮等脾虚症状,仝院士运用黄芪、生晒参、白术补益脾气,而针对由嗜食冰冷转变为嗜食温热、四肢仍温的热郁症状,方中选用羌活、柴胡升阳散火;同时,在治疗周围神经病变时,仝院士从络病角度入手,重视活血化瘀药物,尤其是走经络的藤类药物的应用,方选鸡血藤活血祛瘀、舒筋活络。针对本例IR较为明显的患者,仝院士则强调此时降血糖不宜增加胰岛素用量,否则反而可能导致体质量进一步上涨从而加重胰岛素抵抗,在方中采用靶药黄连降低血糖,并与生姜以3:1比例配伍,取其去性存用之意[18]。现代药理研究[19]结果也表明,黄连中的小檗碱可通过直接或间接升高蛋白激酶C的活性、促进胰岛素分泌、抑制蔗糖酶及麦芽糖酶活性、减少肠道对葡萄糖吸收等多途径发挥降糖作用。《丹溪心法》有云:“肥白人多痰”,故而在改善IR时同样需要关注化痰祛湿,方中选用清半夏、陈皮健脾燥湿化痰从而达到减重效果。
4.3 IR是DPN发生的危险因素
IR及BMI上升可能与DPN有关。糖尿病患者体内过多的过氧化产物丙二醛(MDA)会减少清除氧自由基的超氧化物歧化酶(SOD),启动氧化应激机制,通过干扰胰岛素信号传导而导致IR诱发DPN[20]。胰岛素受体底物位于PI3K-Akt通路上游,有研究[21]表明,通过鼻内给胰岛素能够保护PI3K通路,最终保护糖尿病小鼠的周围神经传导速度以及运动能力。胰岛素抵抗状态代表低度炎症的存在,可能通过影响内皮功能,导致微血管并发症,进而导致DPN[22]。一项涉及1 477名糖尿病患者的研究[23]显示BMI与DPN的发生发展呈正相关。DPN往往被认为与炎症反应有关,而另一项涉及200名DPN患者的横断面研究[24]也显示BMI与ESR和CRP水平升高相关。本患者发病时虽体型偏瘦,但随着体质量不断增加、IR进展、胰岛功能下降,多方因素综合导致了DPN的发生。
4.4 神经微血管损伤与DPN密不可分
神经内膜微血管损伤是DPN的重要病理机制。糖尿病患者由于血糖、血脂异常伴随血液流变学改变,其往往可使DM患者微循环处于高凝及高黏滞状态,从而导致微血管内血栓形成并引起神经内膜缺血缺氧、毛细血管基底膜增厚、血管内皮细胞增生、透明变性、糖蛋白沉积、管腔狭窄等病理结果并最终导致周围神经低灌注,形成周围神经病[25]。此外,神经微血管病变导致的管腔狭窄会使得活性氧自由基产生增加并导致氧化应激,而自由基的增加可直接损伤神经组织的蛋白质、核酸、脂质,干扰线粒体呼吸链,造成神经结构和功能的损害[26]。因此,在周围神经病治疗中注重态靶结合,从络病活血化瘀角度改善血液高凝状态也同样符合现代医学的认知。
5 小结
综上,T2DM在治疗时应根据瘦型或肥胖型进行辨治,在控制血糖的同时注重IR对血糖及神经的影响。在瘦型胰岛素抵抗的治疗上,使用态靶辨治,注重补脾益气,同时从络病角度出发,适当应用活血化瘀通络的“治络”之药,糖络并治、态靶同调,积极解决患者胰岛素抵抗、血糖异常等多种问题方能取得佳效。

