基于16S rRNA高通量测序技术初步探讨双歧杆菌乳杆菌三联活菌片对系统性红斑狼疮模型小鼠MRL/lpr肠道菌群的影响
张永玉 龚娅 刘荣碧 陈虎林 李湖帆 陈昌明
【摘 要】目的:基于16S rRNA高通量测序技术初步探讨双歧杆菌乳杆菌三联活菌片(金双歧)对系统性红斑狼疮模型小鼠MRL/lpr肠道菌群的影响。方法:将12只6~8周龄雌性SPF级MRL/lpr小鼠随机分为模型对照组和金双歧高、中、低剂量组,每组3只,以3只雌性6~8周龄SPF级BALB/C小鼠作为空白对照组。适应性喂养3 d后,金双歧高、中、低剂量组分别以金双歧溶液234 μg、78 μg、
26 μg灌胃,模型对照组及空白对照组每日灌胃等量生理盐水。灌胃1周后,从12只MRL/lpr小鼠和
3只BALB/C小鼠的粪便中提取DNA,对核糖体RNA V3-V4区进行扩增,进行高通量测序得到原始数据,通过生物信息学的方法对数据进行质控过滤,对样品Alpha/Beta多样性进行分析以及后续差异分析。结果:Chao1、ACE、Shannon、Simpson指数的Alpha多样性分析显示,5组之间差异无统计学意义(P > 0.05)。灌胃后,金双歧高、中、低剂量组Neisseria、Pseudomonas、Haemophilus的相对丰度明显低于模型对照组
(P ﹤ 0.05);金双歧中剂量组Actinobacteriota的相對丰度高于模型对照组、金双歧高剂量组、金双歧低剂量组(P ﹤ 0.05);与空白对照组比较,金双歧高、中、低剂量组及模型对照组unidentified-Blautia
的相对丰度降低(P ﹤ 0.05)。结论:金双歧高、中、低剂量灌胃后,使Neisseria、Pseudomonas、Haemophilus、
Lachnospira等有害菌的丰度下调。金双歧低剂量灌胃后,有益菌Fusobacteriota上调,说明金双歧能影响系统性红斑狼疮模型小鼠MRL/lpr的肠道菌群。
【关键词】 系统性红斑狼疮;双歧杆菌乳杆菌三联活菌片;金双歧;肠道菌群;MRL/lpr小鼠
Preliminary Study of the Effect of Live Combined Bifidobacterium and Lactobacillus Tablets on Intestinal Microflora in MRL/lpr Mouse Model with Systemic Lupus Erythematosus Based on 16S rRNA High Throughput Sequencing Technology
ZHANG Yong-yu,GONG Ya,LIU Rong-bi,CHEN Hu-lin,LI Hu-fan,CHEN Chang-ming
【ABSTRACT】Objective:Based on 16S rRNA high-throughput sequencing technology,to study the effect of Live Combined Bifidobacterium and Lactobacillus Tablets(Golden Bifid)on intestinal microbiota in MRL/lpr mouse model with systemic lupus erythematosus.Methods:Twelve female SPF grade 6-8-week-old MRL/lpr mice were randomly divided into a model control group and high-dose,medium,and low-dose groups of Golden Bifid,with three mice in each group.Three female SPF grade 6-8-week-old BALB/C mice were used as the blank control group.After three days of adaptive feeding,the high-dose,medium,and low-dose groups of Golden Bifid were treated with Golden Bifid Solution(234 μg,78 μg,
26 μg)respectively.The model control group and blank control group were given an equal amount of physiological saline by gavage daily.After one week of gastric lavage,DNA was extracted from the feces of 12 MRL/lpr mice and 3 BALB/C mice.The V3-V4 region of ribosomal RNA was amplified and high-throughput sequencing was performed to obtain the raw data.The data was filtered through bioinformatics methods for quality control,and the Alpha/Beta diversity of the samples was analyzed and subsequent differential analysis was performed.Results:The Alpha diversity analysis of Chao1,ACE,Shannon,and Simpson indices showed no statistically significant differences between the five groups(P > 0.05).After gastric lavage,the relative abundance of Neisseria,Pseudomonas,and Haemophilus in the high-dose,medium,and low-dose groups of Golden Bifid was significantly lower than that in the model control group(P < 0.05).The relative abundance of Actinobacteriota in the medium-dose group of Golden Bifid was higher than that in the model control group,the high-dose and low-dose groups of Golden Bifid(P < 0.05).Compared with the blank control group,the high,medium,and low-dose groups of Golden Bifid and the model control group showed a decrease in the relative abundance of unidentified Blautia bacteria(P < 0.05).Conclusion:After gastric lavage of the high,medium,and low-dose groups of Golden Bifid,the abundance of harmful bacteria such as Neisseria,Pseudomonas,Haemophilus,and Lachnospira was downregulated.After gastric lavage of the low-dose group of Golden Bifid,the beneficial bacterium Fusobacteriota was upregulated,indicating that Golden Bifid can affect the intestinal microbiota of MRL/lpr mouse model with systemic lupus erythematosus.
【Keywords】 systemic lupus erythematosus;Live Combined Bifidobacterium and Lactobacillus Tablets;Golden Bifid;intestinal microbiota;MRL/lpr mice
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫功能紊乱的疾病,患者产生大量自身抗体,形成抗原抗体免疫复合物,沉积于靶器官,进而出现各种器官损害[1]。SLE患者常使用糖皮质激素治疗,但有研究表明,使用糖皮质激素治疗的SLE患者容易发生情绪情感障碍,大多数患者心理、社会功能方面在一定程度上受到影响[2],因此仍需寻找新的治疗方法。大量研究表明,与健康人群相比,SLE患者肠道菌群的组成和多样性存在差异,这与SLE的发生、发展有着密切联系[3-5]。双歧杆菌乳杆菌三联活菌片(金双歧)是一种含有3种正常菌群的微生态制剂,可纠正人肠道菌群紊乱,研究证明,金双歧可使患者体内的内毒素产生减少,保护肠黏膜,减少有害菌的繁殖[6]。金双歧还可维持胃内微生态平衡,常被人们用于治疗各种胃肠道疾病,疗效显著[7]。MRL/lpr小鼠是一种自发性SLE模型小鼠,其血清学、免疫学等疾病特点与人类SLE临床表现极为相似[8],因此,MRL/lpr小鼠是研究SLE的理想动物模型,而目前暂无研究将金双歧与MRL/lpr小鼠肠道菌群进行联系,本研究初步探讨金双歧对SLE模型小鼠MRL/lpr肠道菌群的丰度、物种组成及多样性的影响,进一步揭示金双歧对MRL/lpr小鼠肠道菌群的影响,并为微生物群在SLE的治疗提供新的理论依据与研究价值。
1 实验材料
1.1 实验动物 雌性SPF级MRL/lpr小鼠12只,
6~8周龄,体质量27~33 g,雌性SPF级BALB/c小鼠3只,6~8周龄,体质量17~18 g,均由斯贝福(北京)生物技术有限公司提供,实验动物生产许可证号SCXK(京)2019-0010。实验动物饲养于贵州中医药大学甲秀校区实验动物研究所内,动物饲养室保持(23±1.5)℃,相对湿度(45±15)%。小鼠适应性喂养3 d后进行实验。所有小鼠的喂养严格遵守贵州中医药大学伦理委员会规章制度执行,实验动物使用许可证号SYXK(黔)2021-0005。
1.2 实验试剂与仪器 金双歧(内蒙古双奇药业股份有限公司,批号202301042);DNA提取试剂盒(天根生化科技北京有限公司,批号DP328);Qubit dsDNA Assay Kit(美国Life Technologies公司,批号Q32854);Tks Gflex DNA Polymerase(日本Takara公司,批号R060B);台式高速冷冻离心机(天津一方科技有限公司,型号5418);QIAxtractor(天根生化科技北京有限公司,型号SN 002358);超微量分光光度计(美国Thermo Fisher公司,型号NanoDrop 2000);Hiseq测序仪(美国Illumina公司,型号2500)。
2 方 法
2.1 实验分组与样品采集 将12只雌性SPF级MRL/Lpr小鼠随机分为模型对照组和金双歧高、中、低剂量组,每组3只,分别定义为a1-a3、b1-b3、c1-c3、d1-d3组,3只雌性SPF级BALB/c小鼠为空白对照组,命名为e1-e3组。
小鼠适应性喂养3 d后开始灌胃给药,空白对照组和模型对照组按照小鼠体质量每日0.1 mL·(10 g)-1生理盐水灌胃,金双歧高、中、低剂量组每日分别给予234 μg、78 μg、26 μg金双歧灌胃,灌胃周期为2周。灌胃1周后,各组对每只小鼠采集3~4粒粪便至无菌EP管中冷冻送检,用于肠道菌群分析,分别命名为Zb1-Zb3、
Zc1-Zc3、Zd1-Zd3、Ze1-e3,其中模型对照组分别取灌胃3 d、1周、2周后的小鼠粪便进行送检,命名为Za1-Za9。
2.2 生物信息学分析
2.2.1 数据处理统计 NovaSeq测序生成原始双端序列,称之raw data。首先使用cutadapt、DADA2、Qiime2(2020.11)等软件对raw data进行质量过滤,降噪,拼接及去嵌合体等质控分析,得到代表序列及ASV丰度表格。再使用Qiime2(2020.11)软件包挑选出各个ASV的代表序列与Silva(version 138)数据库进行比对注释,得到相关信息。
2.2.2 ASV分类 使用QIIME2(2020.11)中DADA2经过降噪,去除嵌合体后,对序列进行去重,每个去重的序列称为ASVs,或特征序列,这些序列在样本中的丰度表称为特征表。
2.2.3 群落结构分布 群落结构即生物群落,指在一个群落生物环境具有相互关系的所有生物。对21组数据在门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species)各个不同的分类层级,根据物种的相对丰度进行注释以及汇总,根据物种注释信息进行barplot统计,并提供根据相对丰度Abundance水平展示Heatmap图,使用Krona对物种注释结果进行可视化展示。
2.2.4 Alpha多样性分析 Alpha多样性指特定区域或生态系统中的多样性,是反映丰富度和均匀度的综合指标。丰富度主要表示样品中的物种种类即ASV数目,包括chao1指数和Ace指数。菌群多样性指数反映了丰富度和均匀度,包括Shannon指数和Simpson指数。此外,goods_coverage指数(菌群覆盖度指数)能反映样品中物种被检出的概率。本研究是对21组数据进行Alpha多样性分析,将样品进行分组,采用Kruskal-Wallis分析多樣性指数是否有显著差异。
2.2.5 Beta多样性 Beta多样性指不同生态环境中物种组成的差异,即不同样品之间的差异。本研究通过PCoA观察个体间的差异,运用NMDS分析使样品的空间差异性与原始矩阵的差异最小,用stress值衡量它们之间的差异性,采用Anosim分析进行非参数检验,检验组间差异是否显著大于组内差异,从而判断分组是否有意义。
3 结 果
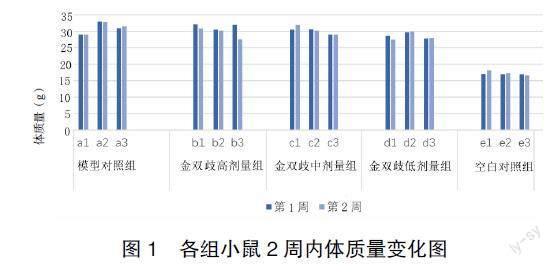
3.1 一般情况 空白对照组小鼠在2周实验中食物摄入量与饮水量正常,活动能力正常,体质量增加,模型对照组和金双歧高、中、低剂量组小鼠在灌胃2周后体质量无明显变化,所有小鼠活动力减弱,且模型对照组小鼠活动力较金双歧各剂量组小鼠减弱。各组小鼠体质量变化见图1。
3.2 16S rRNA测序结果分析 从21个样本中获得测序信息,经过数据过滤,得到干净的标签,范围为48 115~66 851,去除嵌合体序列,最后得到有效标签,范围为41 718~60 359。用Qiime2软件聚类生成ASV,各样本ASV个数分布在134~346。
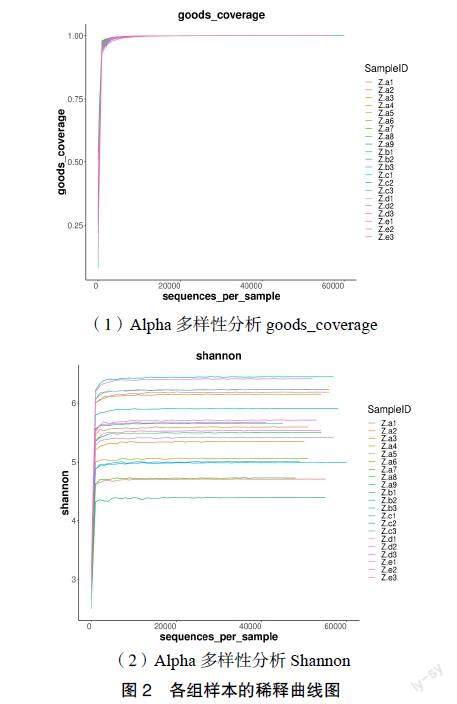
3.3 小鼠样本菌群的Alpha多样性分析 利用Alpha多样性指数Chao1绘制稀释曲线,可以观察到随着抽取tags数量增加,曲线趋于平缓,说明样品随着测序量的增加并不能发现更多的ASV,测序量达到饱和,能反映一定的群落丰富度。利用Shannon指数绘制曲线,从样品中抽取不同数量的tags数,分别计算Shannon指数,观察到当曲线趋于平坦时,表明本实验测序量足够大,可反映样品中绝大多数微生物物种信息。此外,利用goods_coverage指数绘制稀释曲线,观察到该指数越高越接近1,表明样品中序列未被检出的概率越低,能反映样本中物种的真实信息。见图2。
另外,与空白对照组比较,模型对照组小鼠肠道菌群的丰富度指数(Chao1及ACE)和多样性指数(Shannon及Simpson)差异无统计学意义(P > 0.05)。与模型对照组比较,金双歧低、中、高剂量组小鼠腸道菌群丰富度指数(Chao1及ACE)和多样性指数(Shannon及Simpson)差异无统计学意义(P > 0.05)。见表1。
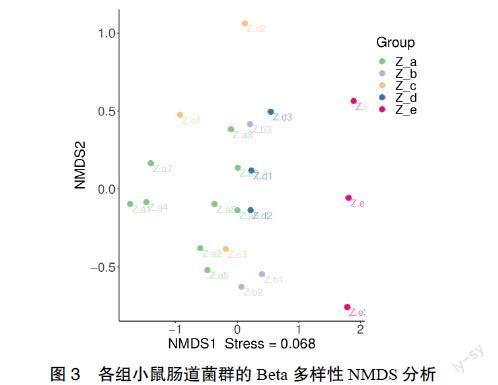
3.4 小鼠样本菌群的Beta多样性分析 通过Weighted UniFrac NMDS分析显示,模型对照组,金双歧高、中、低剂量组之间有一定重叠,但它们之间形成较能区分的5组整体肠道群落结构,并且stress = 0.068 < 0.2,故此分析较为可靠。见图3。
3.5 金双歧治疗前后小鼠肠道菌群差异分析 研究样本在门、纲、目、科、属、种5个水平的群落结构,本研究重点分析门、属、种3个水平。
3.5.1 在门水平上 探究金双歧对门水平上小鼠肠道菌群组成的影响,结合图4可知,5组样本在门水平检测结果中拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、热脱硫杆菌门(Desulfobacterota)、变形菌门(Proteobacteria)是最主要的门类,占比99%。梭杆菌门(Fusobacteriota)在空白对照组和金双歧低剂量组中比其余组更丰富(P < 0.05),而放线菌门(Actinobacteriota)在金双歧中剂量组比其余组相对丰度增加(P < 0.05)。
3.5.2 在属水平上 金双歧治疗前后的小鼠肠道菌群进行比较分析,5组样本在属水平检测结果中,Muribaculaceae、拟杆菌属(Bacteroided)、普雷沃菌属(Alloprevotella)为优势菌,见图5。金双歧高、中、低剂量组与模型对照组比较,劳尔氏菌属(Ralstonia)、奈瑟菌属(Neisseria)、假单胞菌属(Pseudomonas)、嗜血杆菌属(Haemophilus)的相对丰度降低(P < 0.05),金双歧低剂量组、空白对照组与其余组比较,邻单胞菌属(Plesiomonas)、产气单胞菌属(Aeromonas)、醋酸杆菌属(Cetobacterium)的相对丰度增加(P < 0.5);金双歧高剂量组与其余组比较,支原体(Mycoplasma)的相对丰度增高(P < 0.5);空白对照组与模型对照组比较,产粪甾醇真细菌(Eubacterium coprostanoligenes)的相对丰度增高(P < 0.5)。
3.5.3 在种水平上 5组样本在种水平检测结果中,Bacteroides-vulgatus-g-Bacteroides、Bacteroides-
sartoril-g-Bacteroides、Bacteroides-acidifaciens-g-Bacteroides、Bacteroides-coil-g-Eshherchia-Shigella为优势菌,见图6。金双歧高、中、低剂量组与模型对照组比较,Heamophilus-parainfluenzae-Haemophilus、Bacteroides-plebeius-Bacteroides、Ralstonia-insidiosa-Ralstonia、Bacteroides-barnesiae-Bacteroides、Pseudomonas-aeruginosa-Pseudomonas的相对丰度降低(P < 0.05);金双歧高、中、低剂量组和模型对照组与空白对照组比较,unidentified-Blautia的相对丰度降低(P < 0.05);金双歧低剂量组、空白对照组与其余组比较,uncultured-Bacterium-Cetobacterium、Plesiomonas-shigelloides-Plesiomonas、Aeromonas-veronii-Aeromonas的相对丰度增加(P < 0.05)。
4 讨 论
4.1 肠道菌群与SLE 目前许多研究发现,SLE患者出现了肠道菌群紊乱,而菌群紊乱与本病的发展存在着关联[3-5]。SLE患者由于正常的肠道菌群平衡被打破,肠道内具有促炎作用的菌群便会激活特异性免疫应答,从而使Ⅰ型干扰素、白细胞介素(IL)-12等炎症因子的表达增加,IL-10和转化生长因子-β抗炎因子的表达减少,进而使患者体内的炎症反应加重。还有研究发现,将SLE小鼠的粪菌移植到健康小鼠体内后,健康小鼠的免疫细胞会异常活化并产生Ⅰ型干扰素,并且健康小鼠会转变为SLE[9],因此,异常的肠道菌群可能也是SLE的发病机制之一。有研究证明,SLE患者厚壁菌门细菌减少,丁酸盐水平降低,炎症应答水平提高[10]。另有研究发现,SLE模型小鼠MRL/lpr与健康对照小鼠相比,毛螺菌属明显增加[11],而毛螺菌增多与疾病严重程度相关[12],因此,在维持机体健康等方面,正常的肠道菌群具有重要作用。
肠道菌群按照功能不同,可分为共生菌、益生菌和有害菌。益生菌可以改善营养消化、吸收,调节脂质代谢,还可发挥缓解炎症反应的作用。某些细菌的代谢产物也可通过调节机体内部分信号通路,达到保护机体健康的作用,如肠道代表物质丁酸盐、醋酸盐、丙酸盐等可诱导Tregs产生,从而促进机体产生保护性免疫反应[13-15],发挥抗炎作用。随着人们对肠道菌群的不断研究,双歧杆菌、乳酸菌等益生菌制剂被广泛用于临床。本研究推测金双歧益生菌制剂可改善SLE模型小鼠的肠道紊乱,为SLE患者提供另一种治疗方法。
4.2 金双歧对SLE模型小鼠肠道菌群的影响 本研究中小鼠肠道菌群的测序结果表明,金双歧对SLE小鼠肠道菌群总体的丰富度和多样性均无明显影响,推测金双歧可能是通过影响某些特定菌对肠道紊乱进行调节,在门水平上,空白对照组、金双歧低剂量组与其余组比较,梭杆菌门(Fusobacteriota)的相对丰度增加;金双歧中剂量组与其余组比较,放线菌门(Actinobacteriota)的相对丰度增加。在属水平上,金双歧高、中、低组与模型对照组比较,Ralstonia、Neisseria、Pseudomonas、Haemophilus、毛螺菌属Lachnospira降低,在种水平上,金双歧高、中、低剂量组与模型对照组比较,Heamophilus-parainfluenzae-Haemophilus、Bacteroides-plebeius-Bacteroides、Ralstonia-insidiosa-Ralstonia、Bacteroides-barnesiae-Bacteroides、Pseudomonas-aeruginosa-Pseudomonas的相对丰度降低。
流感嗜血杆菌(Haemophilus)是无动力、无芽孢的革兰阴性小杆菌,是人类上呼吸道正常菌群,主要寄居于口腔部,流感嗜血杆菌可引起脑膜炎、肺炎、鼻咽炎、关节炎、心包炎、鼻窦炎及中耳炎等。有研究还发现,在尿路感染中检出了副流感嗜血杆菌[16],奈瑟菌属(Neisseria)为革兰染色阴性双球菌,会导致人体患有淋病与脑膜炎等,流感嗜血杆菌和肺炎链球菌、脑膜炎奈瑟氏菌并称中枢神经系统感染的三大致病菌。本研究金双歧用药后,Haemophilus、Neisseria两种菌相对丰度降低,说明使用金双歧对这两种有害菌具有抑制作用。
假单胞菌(Pseudomonas)革兰阴性菌的条件致病菌,代表菌种为铜绿假单胞菌(PA),该菌属感染患者中,铜绿假单胞菌感染率最高。PA可通过产生脂多糖激活Toll样受体4信号转导通路引发炎症,导致炎症与抗炎反应失衡,激发炎症“瀑布样效应”,从而导致机体一系列的免疫炎性损伤,对于SLE患者炎症反应也是导致机体损伤的重要因素之一,而在该研究中,使用金双歧后SLE模型小鼠粪便中Pseudomonas的相对丰度下调。
梭杆菌门(Fusobacteriota)具有减轻结肠炎症的作用[17],金双歧中剂量组与模型对照组、金双歧高低剂量组相比,放线菌门(Actinobacteriota)的相对丰度增加,金双歧可能增加该有益菌含量,达到治疗SLE的作用;相关研究表明,Blautia.producta D4干预可抑制促炎细胞因子(包括IL-6、肿瘤坏死因子-α和IL-1β)的升高[18],而金双歧高、中、低剂量组,模型对照组與空白对照组比较,unidentified-Blautia的相对丰度降低,SLE模型小鼠与健康小鼠肠道菌群存在差异,该有益菌在健康小鼠中含量较多。
综上所述,金双歧高、中、低剂量组灌胃后,Neisseria、Pseudomonas、Haemophilus、Lachnospira等有害菌丰度下调。金双歧低剂量组灌胃后有益菌Fusobacteriota上调,SLE模型小鼠与健康小鼠肠道菌群存在差异。正常的肠道菌群在调节机体免疫功能等方面发挥重要作用,而金双歧作为一种可调节菌群紊乱的微生态制剂具有广泛的应用前景。但由于肠道菌群的庞大复杂,对其认识还是很有限,关于肠道菌群失调在SLE发病中潜在机制还需深入探讨,才能进一步优化SLE的治疗策略。
参考文献
[1] YUNG S,CHAN TM.Anti-dsDNA antibodies and resident renal cells:their putative roles in pathogenesis of renal lesions in lupus nephritis[J].Clin Immunol,2017,185(6):40-50.
[2] 张荣梅,杨蓓.肾移植术后患者焦虑、抑郁及疲乏对其健康影响的纵向研究[J].中华护理杂志,2019,54(12):1771-1776.
[3] LI Y,WANG HF,LI X,et al.Disordered intestinal microbes are associated with the activity of Systemic Lupus Erythematosus[J].Clin Sci(Lond),2019,133(7):821-838.
[4] 杨婷婷,高明利.肠道菌群与系统性红斑狼疮相关性的研究进展[J].风湿病与关节炎,2021,10(8):76-80.
[5] CHEN BD,JIA XM,XU JY,et al.An autoimmunogenic and proinflammatory profile defined by the gut microbiota of patients with untreated systemic lupus erythematosus[J].Arthritis Rheumatol,2021,73(2):232-243.
[6] 王慧,王小翠,童强,等.利拉鲁肽联合多烯磷脂酰胆碱对NAFLD患者血清抗氧化及炎性因子水平的影响[J].重庆医学,2021,50(2):234-237.
[7] BAHMANI S,AZARPIRA N,MOAZAMIAN E.Anti-colon cancer activity of Bifidobacterium metabolites on colon cancer cell line SW742[J].Turk J Gastroenterol,2019,30(9):835-842.
[8] 塞尔哈尔·特贾和费尔赫斯特·安娜-玛丽.模拟临床系统性红斑狼疮:相似之处,不同之处和成功案例[J].风湿病学(英国牛津),2017,56(Suppl 1):88-99.
[9] ZEGARRA-RUIZ DF,EI BEIDAQ A,INIGUEZ AJ,et al.
A diet-sensitive commensal Lactobacillus strain mediates TLR7-dependent systemic autoimmunity[J].Cell Host Microbe,2019,25(1):113-127.
[10] HUI WP,YU DP,CAO Z,et al.Butyrate inhibit collagen-induced arthritis via Treg/IL-10/Th17 axis[J].Int Immunopharmacol,2019,68(16):226-233.
[11] MU Q,TAVELLA VJ,KIRBY JL,et al.Antibiotics ameliorate lupus-like symptoms in mice[J].Sci Rep,2017,7(1):13675-13688.
[12] ZHANG HS,LIAO XF,SPARKS JB,et al.Dynamics of gut microbiota in autoimmune lupus[J].Appl Environ Microbiol,2014,80(24):7551-7560.
[13] WANG L,ZH L,IN S.Gut microbiota modulation on intestinal mucosal adaptive immunity[J].J Immunol Res,2019,3(10):1-10.
[14] KOSIEWICZ MM,DRYDEN GW,CHHABRA A,et al.Relationship between gut microbiota and development of T cell associated disease[J].FEBSLett,2014,588(22):4195-4206.
[15] ARPAIA N,CAMPBELL C,FAN X,et al.Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J].Nature,2013,504(7480):451-455.
[16] 原靈,董新平,谢一俊,等.从尿道炎阴道炎患者的尿液及阴道分泌物中检出副流感嗜血杆菌及其他病原菌[J].海峡预防医学杂志,2003,9(1):47-48.
[17] KANG Y,YANG G,ZHANG S,et al.Goji berry modulates gut microbiota and alleviates colitis in IL-10-Deficient mice[J].Mol Nutr Food Res,2018,62(22):e1800535-e1800565.
[18] MAO BY,GUO WL,CUI SM,et al.Blautia producta displays potential probiotic properties against dextran sulfate sodium-induced colitis in mice[J].Food Science and Human Wellness,2023,13(2):709-720.
收稿日期:2023-07-28;修回日期:2023-09-05