白细胞介素10受体A基因突变导致的极早发型炎症性肠病临床特点及基因分析
李玉佳 官德秀 郭 姝 郭 景 徐樨巍*
(1.国家儿童医学中心 首都医科大学附属北京儿童医院消化科,北京 100045;2.北京京都儿童医院消化科,北京 102208)
炎症性肠病(inflammatory bowel disease,IBD)是指原因不明的一组非特异性慢性胃肠道炎症性疾病,包括克罗恩病(Crohn′s disease,CD)、溃疡性结肠炎(ulcerative colitis,UC)和未定型IBD(IBD unclassified,IBDU)。极早发型炎症性肠病(very early onset IBD,VEO-IBD)是指年龄小于6岁的IBD儿童[1]。与成人IBD的不同之处在于,儿童IBD,尤其是VEO-IBD往往是由于单基因突变所致,被报道最多的是白细胞介素(interleukin,IL)10及其受体基因突变所致[1]。VEO-IBD患儿除常见的消化系统症状,如腹痛、腹泻、黏液血便外,常合并发热、贫血、生长发育迟滞、营养不良等[1],严重影响患儿的生长发育,VEO-IBD往往发病年龄早、病情重,病死率高[2],临床表现多样,可伴有肠外表现,部分患儿临床症状不典型,因其缺乏特异性的临床表现,病例数相对少,故在临床工作中诊断难度大,容易误诊、漏诊。延误诊断会直接影响患儿的预后,给患儿和家庭造成危害。本研究回顾性分析15例白细胞介素10受体A(interleukin 10 receptor A,IL-10RA)基因突变所致的VEO-IBD患儿的临床病历资料,总结其临床特点并分析其基因报告,进一步提高对本病的认知,为VEO-IBD患儿的早期诊断提供临床参考,早期识别、尽早完善基因检测明确诊断,对改善预后十分重要。
1 对象与方法
1.1 研究对象
本研究回顾性分析2007年3月到2019年5月首都医科大学附属北京儿童医院消化科确诊的30例VEO-IBD患儿,其中15例病因为IL-10RA基因突变所致的VEO-IBD患儿作为IL-10RA组,纳入标准:①年龄:0~6岁;②VEO-IBD的诊断符合 2019年发布的《儿童炎症性肠病诊断和治疗专家共识》的诊断标准[1];③经基因检测确定存在IL-10RA突变。15例经基因检测明确为非IL-10RA突变所致的VEO-IBD患儿作为对照组,入组标准符合IL-10RA组第①、第②条标准。本研究通过医院医学伦理委员会批准(批准文号:[2023]-E-072-R),通过查阅病历获取本研究患儿发病时的临床病历资料。本文为回顾性研究,经伦理委员会审查免除患儿家长知情同意。
1.2 研究方法
通过查阅病历,收集患儿的临床病历资料,包括:性别、年龄、起病年龄、家族史、入院时体格发育情况、实验室检查结果、胃肠镜检查结果、病理结果及基因检测结果进行回顾性分析。按照蒙特利尔标准和巴黎分型[3],CD 按照病变部位分型如下:回肠末段(L1)、结肠(L2)、回结肠(L3)、上消化道型(L4)。UC按照病变范围分为直肠(E1)、左半结肠(E2)、广泛结肠(E3)和全结肠(E4)。
评估营养不良[4]:测定患儿身高、体质量,采用Z评分法评估患儿营养状况,具体如下:Z评分=(体格指标实际测定值-体格指标参考值中位数)/体格指标参考值标准差,Z值在-2~+2之间为儿童体格生长正常。年龄别体质量Z评分(weight for age,WAZ)、年龄别身高/长Z评分(height for age,HAZ),Z值<-2为营养不良,WAZ<-2为低体质量,HAZ<-2为生长迟缓(反映儿童慢性营养不良)。
1.3 二代基因测序和验证
1.3.1 基因组 DNA 提取
经患者家属知情同意,抽取患儿、患儿父母的外周血各2 mL(EDTA 抗凝),用QIAamp 全血 DNA 提取试剂盒(德国Qiagen公司)按其说明书提取基因组 DNA。
1.3.2 目标基因捕获和高通量测序
应用 GenCap 液相捕获目标基因技术,捕获患儿所有基因编码外显子和侧翼区域,进行全外显子检测(北京迈基诺公司)。目标区域测序后,运用 BWA 软件比对到参考基因组上(hg19 版本),对测序深度、均一性、探针特异性等数据进行统计分析。
1.3.3 数据筛选和生物信息学分析
通过 Sentieon 软件的参数驱动程序检测单核甘酸多态性(single nucleotide polymorphism,SNP)和插入缺失突变(insertion deletion mutation,INDEL)的变异,并与多个数据库关联,如千人基因组、ESP6500、dbSNP、EXAC、gnomAD、内部数据库(Mygenotics),并用 REVEL、SIFT、PolyPhen-2、MutationTaster、GERP++等软件进行变异有害性预测。突变位点关联 HGMD 数据库,用 phenolyzer 和 exomiser 软件根据疾病表型关联基因,对变异位点和基因打分评估,获得致病性排序。最终筛选的潜在致病变异通过Sanger测序验证。
1.4 统计学方法
2 结果
2.1 IL-10RA组一般情况
IL-10RA组15例VEO-IBD患儿,其中男性9例(60%)、女性6例(40%);其中CD 11例(73%)、UC 4例(27%)。入院年龄2~15月龄,发病中位年龄2(1,3)月龄,诊断中位年龄6(5,8)月龄。4例(27%)患儿有家族史,其中1例患儿父亲有UC病史,3例患儿哥哥或姐姐因类似症状死亡。
2.2 IL-10RA组患儿的临床特点
本组VEO-IBD患儿临床表现多样,消化道症状依次为慢性腹泻(15/15例,100.0%)、便血(15/15例,100.0%);肠外表现依次为口腔黏膜溃疡(6/15例,40.0%)、皮肤红斑(5/15例,33.3%);肛周表现依次为直肠会阴瘘5例(5/15,33.3%),肛瘘4例(4/15,26.7%),肛裂3例(3/15,20.0%),直肠会阴瘘、皮赘并存1例(1/15,6.7%);全身表现依次为发热(15/15例,100.0%)、体质量减轻(15/15例,100.0%)、贫血(13/15例,86.7%)、营养不良(13/15例,86.7%)、脱水(12/15例,80.0%)、电解质紊乱(11/15例,73.3%)、生长发育迟缓(7/15例,46.7%)、低蛋白血症3例(3/15例,20.0%)、肝损害2例(2/15例,13.3%)。并发症方面,VEO-IBD患儿反复腹泻、免疫力低,容易合并感染,本研究中合并脓毒症5例(5/15例,33.3%)、肺部感染5例(5/15例,33.3%)、伪膜性肠炎2例(2/15例,13.3%),合并肠狭窄4例(4/15例,26.7%)。与对照组相比,从发病年龄方面来看,差异有统计学意义,IL-10RA突变组发病年龄更早;临床症状方面,两组患儿在发热、便血、皮肤改变、口腔溃疡、生长发育迟缓、合并感染方面差异无统计学意义,在肛周病变和营养不良方面,差异有统计学意义,IL-10RA突变组更容易出现肛周病变、营养不良。详见表1。
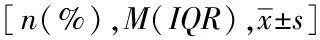
表1 IL-10RA突变组和非IL-10RA突变组VEO-IBD患儿临床特征比较
2.3 IL-10RA组患儿结肠镜检查结果及病理表现
本研究中15例患儿均进行结肠镜检查,镜下表现以结肠多发溃疡为主,多发深溃疡、浅溃疡,其次为炎性息肉,病变部位依次为L2(结肠型)6例、L3(回结肠型)5例、E3(广泛结肠)型4例,组织学检查发现隐窝脓肿、隐窝结构变形,15例均有中性粒细胞浸润。本研究中患儿结肠镜镜下与病理表现详见表2。

表2 15例IL-10RA突变所致VEO-IBD患儿的基本信息、临床表现、内镜及病理表现
2.4 VEO-IBD患儿部分实验室检查结果
实验室检查结果方面,30例患儿中,丙氨酸氨基转移酶、门冬氨酸氨基转移酶升高2例。便常规红白细胞增多。炎症指标均有不同程度增高,对比15例非IL-10RA突变组VEO-IBD患儿的实验室检验结果,比较患儿的炎性指标(白细胞、C反应蛋白、红细胞沉降率、IL-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、降钙素原、铁蛋白、血红蛋白、白蛋白及凝血指标(血小板计数、凝血酶原时间、活化部分凝血活酶时间),两组患儿在白细胞、C反应蛋白、IL-6、TNF-α、降钙素原、铁蛋白这几项炎症指标相比,差异有统计学意义,IL-10RA突变组明显高于非IL-10RA突变组。两组血小板数量均有升高,IL-10RA突变组凝血酶原时间和部分凝血活酶时间均明显延长。详见表3。
表3 IL-10RA突变组和非IL-10RA突变组VEO-IBD患儿部分实验室结果比较
2.5 IL-10RA组患儿的基因检测结果
本研究中15例VEO-IBD患儿突变基因均为IL-10RA,共检测到9个突变位点,13例复合杂合突变,2例纯合突变,2例纯合突变均为c.301c>T(p.R101W),13例杂合突变中6例突变类型为c.301c>T(p.R101W)和c.537G>A(p.T179T)。患儿均为非近亲结婚家庭。结果详见表4。
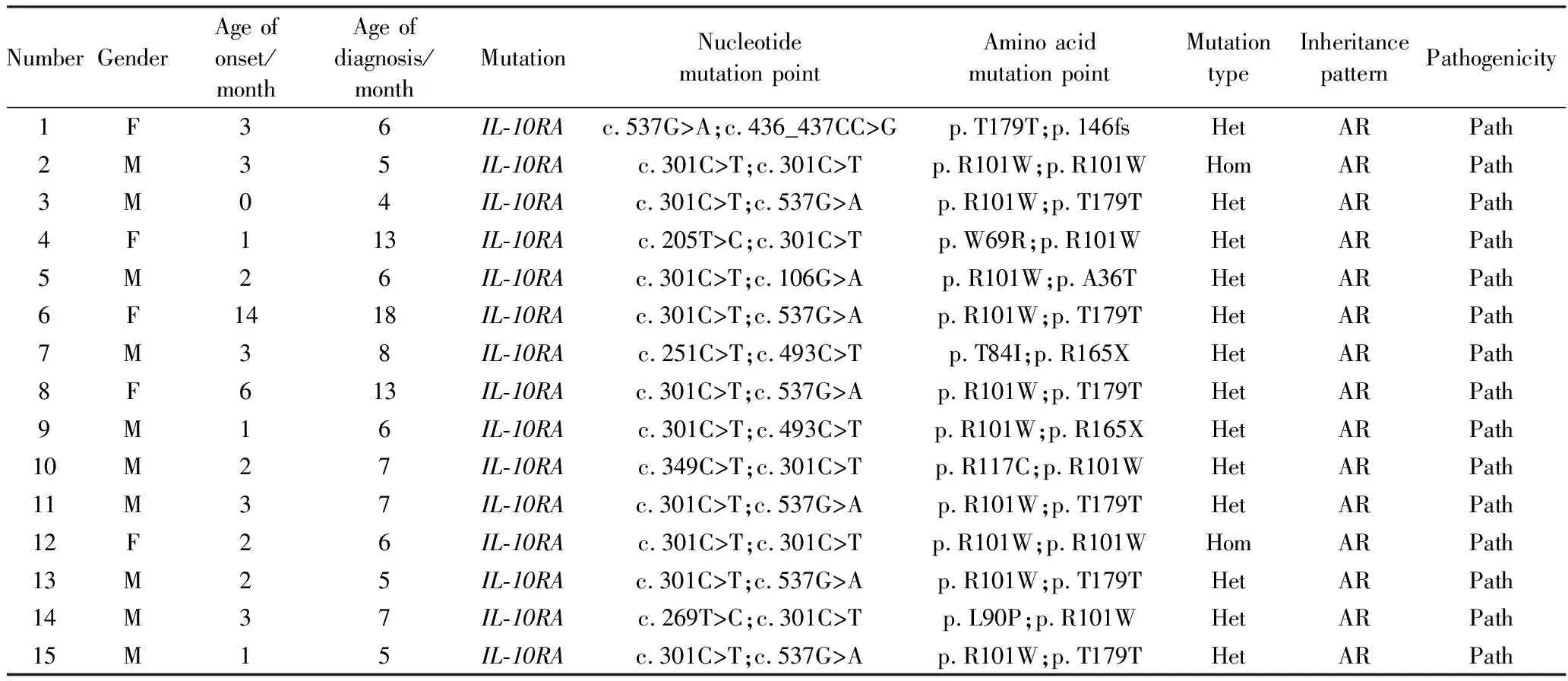
表4 IL-10RA组患儿基因检测结果
3 讨论
儿童IBD的发病率近年来呈逐年增加的趋势[5],病因不明确,通常认为与遗传和环境因素有关,VEO-IBD是指6岁以内发病的患儿[1],占儿童 IBD 的 4%~10%[6]。VEO-IBD往往是由于先天遗传性因素所致,2009年Glocker等[2]首次报道了IL-10RA基因突变导致的VEO-IBD 病例,目前为止,关于VEO-IBD的发病机制至少报道了与之有关的50余种单基因突变,如IL-10、IL-10R、FOXP3、XIAP、TTC37等[2],单基因突变是引起VEO-IBD的重要原因,并且这类患儿常规药物治疗通常疗效差,病死率较高[2]。报道最多的为IL-10及IL-10R基因突变导致的VEO-IBD病例,王福萍等[7]、潘思蕊等[8]、许永彬等[9]及苏雯等[10]均报道了VEO-IBD,经基因测序证实均存在IL-10RA基因突变。
IL-10RA基因突变为常染色体隐性遗传病,疾病表型为早发型炎症性肠病28型。IL-10主要由单核细胞、巨噬细胞、树突细胞、淋巴细胞、B淋巴细胞、肥大细胞、粒细胞、内皮细胞分泌,是人体重要的抗炎细胞因子。IL-10RA定位于染色体11q23.3,其基因编码一个578个氨基酸的蛋白,为一个90 000~110 000的糖基化蛋白,IL-10RA可以在造血组织、结肠上皮细胞、单核巨噬细胞表达,但在造血组织中表达水平比较低,每个细胞约表达100~800个分子,单核巨噬细胞表达最多[2]。IL-10是具有抗炎作用的细胞因子,会抑制过度的促炎反应维持体内平衡,与IL-10RA结合后激活信号传导通路,抑制促炎基因表达发挥抗炎作用,从而引起肠道发生严重免疫炎症反应[11]。据报道[7,10-12],目前为止,已知与 VEO-IBD 相关的基因变异作用主要通过以下几种途径:干扰肠上皮屏障功能、损害适应性免疫发展、IL-10和 IL-10R途径、影响吞噬细胞识别和细菌清除及自身免疫性疾病相关基因缺陷等。
以往的研究[12-13]表明,IL-10信号通路相关基因突变的患儿通常都是新生儿期起病,主要表现为结肠广泛病变和肛周病变。本研究中IL-10RA突变引起VEO-IBD的患儿发病中位年龄2(1,3)月龄,结肠镜下病变广泛,13例患儿有不同程度的肛周病变,与以往的研究[12-13]结果一致。本研究中VEO-IBD患儿消化道症状以慢性腹泻、便血为主;肠外表现为口腔黏膜溃疡、皮肤红斑,肛周表现依次为直肠会阴瘘、肛瘘、肛裂、皮赘;全身表现为发热、体质量减轻、贫血、营养不良、脱水、电解质紊乱、生长发育迟缓、低蛋白血症、肝损害。生长发育迟缓可能与发病年龄早、腹泻便血严重、摄入不足、营养素丢失严重有关。与非IL-10RA突变组相比,IL-10RA组更容易出现肛周病变,营养不良。既往Beser等[14]报道肛周病变更多见于IL-10或IL-10R基因突变患儿,其他文献[2,15-18]亦有类似报道。
2009年,Glocker等[2]首次报道证实IL-10R基因突变可以导致VEO-IBD,IL-10通路信号异常传导、转录激活蛋白磷酸化,TNF-α等表达异常增高,IL-10和受体结合后,激活JAK1和Tyk2信号通路,通过磷酸化转录因子STAT-3,激活下游的抗炎因子的表达,包括IL-6,IL-8和TNF-α等,从而起到抑制炎症的作用(图1)[19]。本研究中观察到的IL-6和TNF-α增高,说明IL-10突变导致的炎症因子增高是致病的重要环节。IL-10A受体突变后,导致IL-10对肠道炎症的调节作用失衡,临床表现为炎症反应过度,在临床上会有各种的临床表现。

图1 IL-10和IL-10R信号通路图示[19]
血小板参与凝血的各环节,其数量升高提示患儿处于高凝状态,本研究中对比两组患儿,两组在血小板数量方面差异无统计学意义。
本研究还存在不足之处,样本量小,还需进一步扩大样本量进一步研究对比。就目前的研究结果而言,在临床工作中,对于可疑VEO-IBD患儿,如发现患儿白细胞、C反应蛋白、IL-6、TNF、降钙素原、铁蛋白炎症指标明显升高,贫血、白蛋白减低、凝血功能异常,需提高警惕,在明确诊断的过程中,需考虑患儿是否存在IL-10RA突变。
本研究中15例IL-10RA基因突变患儿中13例为复合杂合突变,2例为纯合突变。其中c.301c>T(p.R101W)和c.537G>A(p.T179T)为最常见的突变位点。C.537G>A是编码区第 537 号核苷酸由鸟嘌呤变异为腺嘌呤,导致氨基酸改变,p.T179T(第179 号氨基酸由苏氨酸变异为苏氨酸)为同义突变,该变异不属于多态性位点,在人群中发生频率极低,与许永彬等[9]报道的2例新生儿期起病的IO-IBD患儿突变位点一致。临床表现方面,亦是在新生儿期即出现腹泻、便血。姜毅等[20]报道的5例新生儿期起病的VEO-IBD患儿,基因检测结果显示5例为IL-10RA基因突变,其中1例纯合突变,4例 复合杂合突变,4例杂合突变位点均有c.301c>T(p.R101W),与本研究中最常见的突变位点一致,临床表现方面5例均伴有不同程度的血便或便潜血阳性,主要表现有发热、贫血、口腔或肛周溃疡,均有体质量增长迟缓,与本研究一致。方优红等[21]报道的55例VEO-IBD患儿中,21例行基因检测,9例检出为单基因突变,其中4例为IL-10RA基因突变,临床表现以腹泻、便血为主,易合并营养不良、生长迟缓,肛周病变发生率高,与本研究一致。宫幼喆等[17]回顾性分析的39例VEO-IBD患儿,其中17例患儿进行基因测序,10例患儿为单基因突变,其中 7 例患儿为IL-10RA基因突变。一项关于中国儿童 VEO-IBD 的研究[22]中,显示IL-10RA突变率为 45.2% (42/93),其中 c.301C>T(p.R101W)和c.537G>A(p.T179T)是最常见的突变位点,与本研究常见突变点位一致。张伯玮等[23]报道的3例VEO-IBD患儿均为IL-10RA基因突变,c.301C>T(p.R101W)为最热点突变。谢雨婕等[24]报道的2例新生儿期起病的IL-10RA基因突变所致的VEO-IBD,其中1例基因突变位点为c.301C>T、c.537G>A,与本研究中常见突变位点相同,临床症状以反复腹泻、便血为主,存在营养不良、口腔溃疡、肛周脓肿,与本研究一致。
部分患儿合并肠狭窄与Pigneur等[25]、谢雨婕等[24]的IL-10或IL-10R基因突变所致VEO-IBD患儿内镜及病理表现一致。姜毅[20]等报道的IL-10RA突变患儿的结肠镜下表现、病理表现亦与本研究一致。Ye等[26]的研究中10例患儿发现隐窝/绒毛结构异常、炎性浸润。临床中高度怀疑VEO-IBD的患儿,除尽早完善基因检测外,同时结合消化内镜检查、HE染色分析以及特异性免疫组织化学检查可以进一步协助诊断、评估肠道病变严重程度。
本文通过总结分析15例IL-10RA基因突变所致VEO-IBD患儿的临床特点和基因检测结果,与非IL-10RA基因突变所致VEO-IBD患儿对比分析,发现IL-10RA基因突变所致VEO-IBD患儿具有发病年龄早的特点,在临床工作中对于生命早期反复出现腹泻、便血等消化道症状的患儿,尤其是病情相对严重、容易反复感染、存在肠外表现、肛周病变的患儿,炎症因子增高,凝血功能异常,需警惕单基因遗传病,尽早完善基因检测以明确病因,精准治疗,改善预后。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明李玉佳:研究选题和设计,数据分析整理,统计学分析,论文撰写及修改;官德秀:研究设计、指导;郭姝、郭景:数据收集与整理;徐樨巍:总体把关,研究指导,审定论文。

