慢阻肺合并呼吸衰竭患者血清ChE、PA、HMGB1 水平变化及临床意义
郭玉
(商丘市第一人民医院呼吸与危重症医学科,河南 商丘 476000)
我国慢性阻塞性肺病(Chronic obstructive pulmonary diseases,COPD)发病率约为8.2%~11.5%,主要特征为不完全持续进展性、可逆性气流受限,病理表现为肺实质、气道壁慢性结构破坏,随着病情进展可影响换气功能、通气功能,引发呼吸衰竭现象,危及患者生命安全[1]。COPD 患者反复出现肺部感染、低氧血症,可引起肺小动脉痉挛,增加血流阻力,诱发肺部动脉血管重塑,进而引起呼吸衰竭,炎性细胞介导的炎性反应、凝血功能异常,对评估呼吸衰竭患者病情进展及预测预后具有一定价值[2]。血清细胞因子可参与COPD 合并呼吸衰竭发生过程[3]。因而可通过检测血清细胞因子评估患者病情及预测患者预后,以指导临床制定针对性治疗方案。
呼吸衰竭患者中氧化应激反应、炎性反应持续升高,增加乙酰胆碱释放量,抑制胆碱酯酶(cholinesterase,ChE)活性[4]。前白蛋白(Prealbumin,PA)具有维持机体免疫功能蛋白活性作用,可清除外周循环有毒代谢物质,其水平降低可引起机体基础代谢失衡[5]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)水平升高可参与肺部疾病发生发展过程[6]。目前ChE、PA、HMGB1 与COPD 合并呼吸衰竭相关研究鲜见报道。
鉴于COPD 合并呼吸衰竭病情严重、预后不佳,寻找可有效判断患者预后的实验室指标,对临床治疗方案制定具有重要作用。本研究从血清ChE、PA、HMGB1 水平变化的角度探讨其对COPD 合并呼吸衰竭患者预后的预测价值。
1 资料与方法
1.1 一般资料
选取2021 年1 月至2022 年12 月本院收治的86例COPD 合并呼吸衰竭患者为研究组,依据病情程度[7]分为轻度17 例、中度24 例、重度45 例,选取同期本院收治的82 例单纯COPD 患者为对照组,同时选取同期于本院体检的健康志愿者56 例为健康组。
研究组:男54 例、女32 例,平均年龄65.13±2.63岁,平均体质量指数23.16±1.74 kg·m-2,平均COPD病程12.41±1.83 d,饮酒史35 例,吸烟史28 例,合并症:糖尿病26 例、高血压18 例。对照组:男56例、女26 例,平均年龄66.01±3.71 岁,平均体质量指数22.96±2.18 kg·m-2,平均COPD 病程13.01±2.63 d,饮酒史32 例,吸烟史26 例。合并症:糖尿病22例、高血压14 例。健康组:男38 例、女18 例,平均年龄65.96±2.85 岁,平均体质量指数23.01±1.88 kg·m-2,饮酒史20 例,吸烟史16 例。各组一般资料均衡可比(P>0.05)。本研究经本院伦理委员会批准。
纳入标准:符合COPD 诊断标准[8];符合呼吸衰竭诊断标准[9]:静息状态下动脉血氧分压<60 mmHg或动脉血二氧化碳分压>50 mmHg;签署知情同意书。排除标准:合并恶性肿瘤;既往免疫抑制剂治疗或器官移植治疗史者;合并其他肺部疾病者;入组前1 个月内接受过激素类药物治疗者;合并代谢性、自身免疫性疾病者;认知功能障碍、言语沟通障碍者;既往呼吸系统手术史者。
1.2 方法
1.2.1 治疗方法
参照《慢性阻塞性肺疾病诊治指南(2013 年修订版)》[10]进行治疗,包括维持水电解质平衡、解痉平喘、化痰止咳、抗感染、吸氧等。依据28 d 生存情况分为病死者、存活者。
1.2.2 评估患者临床症状、生理状态
治疗前采用COPD 评估测试(COPD Assessment Test,CAT)评估患者临床症状,共8 项,总分为40分,分值越高表明症状越严重[11]。急性生理学与慢性健康状况评分(Acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分包括3 部分,总分为71 分,分值越高表明生理状态越差[12]。
1.2.3 检测血清ChE、PA、HMGB1 水平
研究组于治疗前、治疗7 d 后、治疗14 d 后,对照组于入组时,健康组于体检当日,分别抽取空腹肘静脉血5 mL,以3500 r·min-1离心5 min,获取上清液后置于-80℃冰箱待测。采用比色法与Gi8200 全自动生化分析仪(美国雅培公司)检测血清ChE 水平,上海烜雅生物科技有限公司提供检测试剂盒。采用免疫比浊法检测血清PA 水平,杭州健立生物科技有限公司提供检测试剂盒。采用 ELISA 法检测血清HMGB1 水平,上海臻科生物公司提供检测试剂盒。
1.3 观察指标
(1)对比分析各组血清ChE、PA、HMGB1 水平。(2)分析研究组存活者、病死者治疗前、治疗7 d、治疗14 d 后血清各指标水平。(3)分析研究组治疗7 d、治疗14 d 后血清各指标水平对预后的预测价值。
1.4 统计学分析
2 结果
2.1 各组血清ChE、PA、HMGB1 水平及APACHEⅡ、CAT 评分比较
研究组血清ChE、PA 水平低于对照组、健康组,且对照组低于健康组;研究组血清HMGB1 水平高于对照组、健康组,且对照组高于健康组;研究组APACHEⅡ、CAT 评分高于对照组(P<0.05)。表1。
表1 各组血清ChE、PA、HMGB1 水平及APACHEⅡ、CAT 评分比较(±SD)

表1 各组血清ChE、PA、HMGB1 水平及APACHEⅡ、CAT 评分比较(±SD)
注:与健康组比较,*P<0.05;与对照组比较,#P<0.05。
2.2 研究组不同预后患者血清各指标水平
病死者治疗7 d、治疗14 d 后血清ChE、PA 水平低于存活者,HMGB1 水平高于存活者;存活者治疗14 d 后血清ChE、PA 水平高于治疗7 d 后,HMGB1水平低于治疗7 d 后(P<0.05),见表2。
表2 研究组不同预后患者血清各指标水平(±SD)
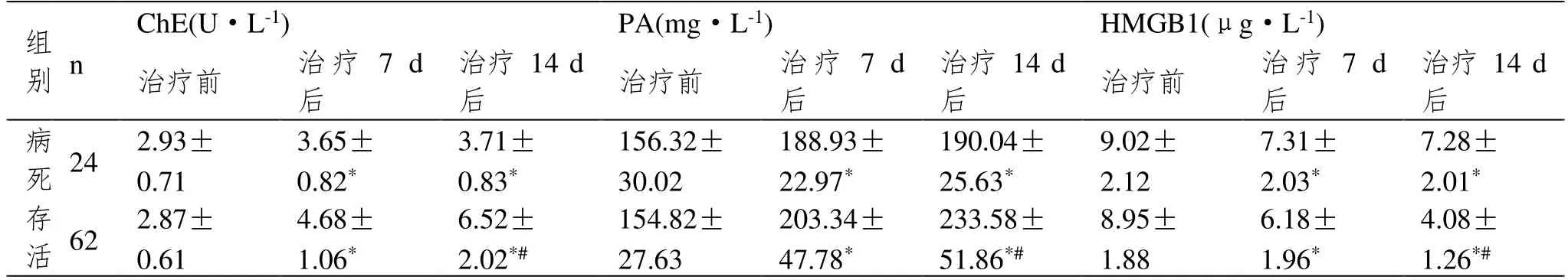
表2 研究组不同预后患者血清各指标水平(±SD)
注:与治疗前比较,*P<0.05;与治疗7 d 后比较,#P<0.05。
2.3 血清各指标对预后的预测价值
以病死者24 例为阳性样本,以存活者62 例为阴性样本。ROC 分析结果显示,治疗7 d、14 d 后血清ChE、PA、HMGB1 预测预后的AUC 大于单项指标预测,且治疗14 d 后血清ChE、PA、HMGB1 联合预测预后的AUC 大于治疗7 d 后血清ChE、PA、HMGB1联合预测(P<0.05),见图1、表3。

图1 治疗7 d 后、14 d 后血清各指标对预后的预测价值
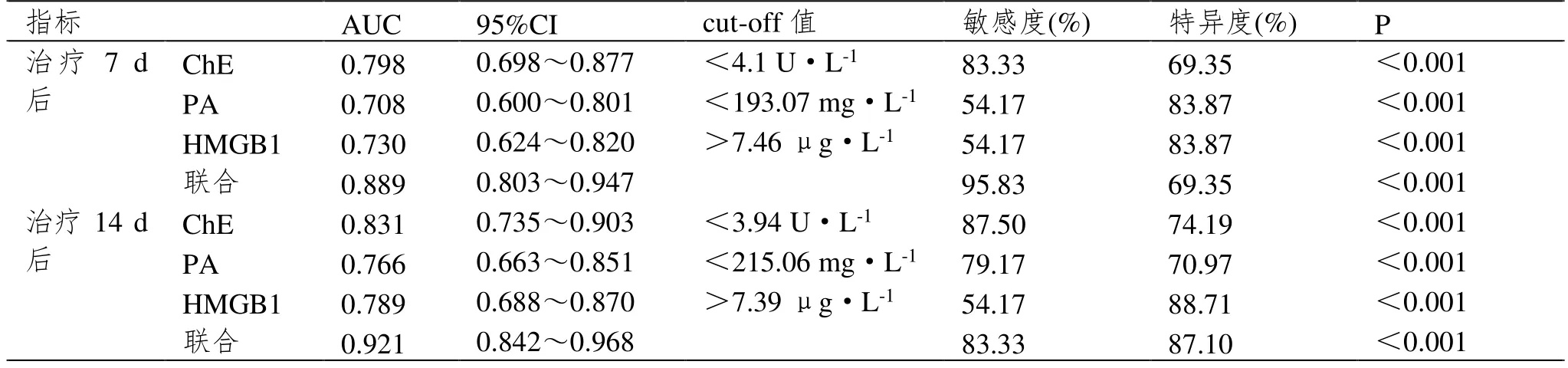
表3 血清各指标对预后的预测价值
3 讨论
细菌感染诱发菌血症时血清ChE 水平降低,其水平降低预示机体炎性反应加重,肺组织、细胞受损程度越严重,ChE 水平越低[13]。本研究结果显示,研究组血清ChE 水平低于对照组、健康组,且对照组低于健康组,提示ChE 水平降低与COPD 合并呼吸衰竭发生相关。COPD 合并呼吸衰竭患者较COPD 患者血清ChE 水平更低,可能是因为细菌毒素、病原菌感染等所致呼吸衰竭发作,机体短时间内发生严重全身应激反应,致使胆碱能通路活化,促进机体产生乙酰胆碱,抑制ChE 活性。PA 属于快速转运蛋白,可反映体内蛋白质代谢变化,其随肺功能严重程度加重而下降,若机体出现炎性反应时,PA 水平随着炎性反应加重而降低[14]。本研究结果显示,研究组血清PA水平低于对照组、健康组,提示PA 可参与COPD 合并呼吸衰竭发生发展过程。缺氧状态下患者营养摄入减少,肝合成能力降低,促使PA 水平降低,并可影响机体免疫能力、呼吸系统功能,减弱呼吸肌强度,降低呼吸肌耐力,促使COPD 病情加重,进而导致COPD 合并呼吸衰竭发生。
单核细胞接受刺激后可释放HMGB1,其与晚期糖基化终产物受体(RAGE)、Toll 样受体(TRLs)结合,促进肺泡内炎性介质聚集,引起气道平滑肌增生及纤维化,致使呼吸功能减退,引起呼吸衰竭发生[15]。本研究结果显示,研究组血清HMGB1 水平高于对照组、健康组,提示HMGB1 水平升高可能促进COPD合并呼吸衰竭发生。分析其原因可能为组织受损时单核巨噬细胞、受损细胞可分泌HMGB1,其与早期致炎因子形成正反馈环路,维持、放大炎性反应,并可作为趋化因子促进巨噬细胞迁移,直接损伤组织器官。ChE、PA、HMGB1 在炎性反应发生中的作用机制不同,本研究尝试性将其联合预测,结果显示治疗7 d、14 d 后血清ChE、PA、HMGB1 预测预后的AUC大于单项指标预测,提示联合检测ChE、PA、HMGB1对COPD 合并呼吸衰竭患者预后具有一定预测价值。
综上所述,血清ChE、PA、HMGB1 水平联合检测对患者预后具有较高预测价值,但关于其具体作用机制尚需进一步探究。

