贝莱斯芽孢杆菌BQ对党参根腐病病原菌抑制效应初探
王馨芳 张婉霞 史美玲 张梓坤 寇志安 田永强

摘要:将贝莱斯芽孢杆菌(Bacillus velezensis)BQ作为最新发现的潜力生防菌。通过平板对峙、孢子萌发、生防机制和离体防治试验检测该菌株对党参根腐病的防治效果。平板对峙试验表明,贝莱斯芽孢杆菌BQ可明显抑制党参根腐病病原菌尖孢镰孢菌DS的生长,菌丝生长抑制率达50.55%,对峙区菌丝发生明显形变;孢子萌发结果表示,贝莱斯芽孢杆菌BQ的代谢产物能有效抑制病原菌DS的孢子萌发;对贝莱斯芽孢杆菌的生防机制进行初探,贝莱斯芽孢杆菌BQ的代谢产物能引起病原菌DS的细胞膜通透性增加,从而导致核酸内容物释放量增加,细胞破裂至死亡。离体防治结果显示,贝莱斯芽孢杆菌BQ对党参根腐病的治疗效果达到46.13%,预防效果达到了63.62%。可见,贝莱斯芽孢杆菌BQ有防治党参根腐病的潜力,可作为生物防治剂进行开发。
关键词:党参;贝莱斯芽孢杆菌; 根腐病病原菌; 尖孢镰孢菌;生物防治;抑制效应
中图分类号:Q939.9;S567 文献标志码:A 文章编号:2097-2172(2024)02-0167-07
doi:10.3969/j.issn.2097-2172.2024.02.013
Evaluation on the Control Effects of Bacillus velezensis BQ
against Codonopsis pilosula Root Rot
WANG Xinfang, ZHANG Wanxia, SHI Meiling, ZHANG Zikun, KOU Zhian, TIAN Yongqiang
(College of Biological and Pharmaceutical Engineering, Lanzhou Jiaotong University, Lanzhou Gansu 730070, China)
Abstract: Bacillus velezensis BQ was regarded as the newly discovered potential biocontrol bacteria, and its control effects on root disease of Codonopsis pilosula was studied by the dual confrontation test, spore germination, biological control mechanism and in vitro control test. The results of the dual confrontation test showed that Bacillus velezensis BQ could obviously inhibit the growth of Fusarium oxysporum DS, the mycelium growth inhibition rate reached 50.55%, and the mycelium in the confrontation area was obviously deformed. The results of spores germination showed that the metabolites of Bacillus velezensis BQ could effectively inhibit the spores germination of pathogen DS. The metabolites of Bacillus velezensis BQ could increase the permeability of cell membrane of pathogenic bacteria DS, which led to the increase of nucleic acid release and cell rupture to death. In vitro control results showed that Bacillus velezensis BQ had a therapeutic effect of 46.13% and a preventive effect of 63.62% on Codonopsis pilosula root rot. Bacillus velezensis BQ has the potential to control Codonopsis pilosula root rot and can be developed as a biological control agent.
Key words: Codonopsis pilosula; Bacillus velezensis; Root rot pathogen; Fusarium oxysporum; Biological control; Inhibiting effect
黨参[Codonopsis pilosula (Franch) Nannf.]是桔梗科多年生草本植物,是中国传统的中药材之一,党参的根具有滋养脾肺、增强造血功能及免疫力的功效。甘肃是我国党参种植大省,党参种植面积约占全国的90%,已成为部分地区农户的主要收入来源[1 ]。然而近年来,由于连作等原因引起了党参的多种土传病害,导致党参幼苗存活率不高[2 ]。党参根腐病是由尖孢镰孢菌(Fusarium oxysporum)引起的最严重的党参土传病害之一,其孢子可在土壤中存活约8~10 a[3 ]。有研究证实,尖孢镰孢菌的孢子在根尖分泌物的驱化作用下发育成菌丝[4 - 6 ],随后尖孢镰刀菌通过分泌产生的细胞壁降解酶(Cell wall degrading enzymes,CWDEs)进入根部皮层[7 - 8 ],接着尖孢镰孢菌定殖在宿主植物体内,并产生植物毒素来帮助尖孢镰孢菌继续入侵。尖孢镰孢菌的大量生长和繁殖会产生大量化合物,从而堵塞植物的维管束,引起植物根系腐烂坏死[9 ]。
党参在幼苗阶段易被尖孢镰孢菌侵染,感染后根部维管束组织发生褐变,但茎叶部分无明显变化[10 - 11 ];随着病害加剧,植株茎叶部分迅速萎蔫枯萎,直至植株死亡,根部往往腐烂直至死亡[10, 12 - 13 ]。党参根腐病发病迅速,难以控制,能造成党参减产50%以上,经济损失严重[1 - 2 ]。党参根腐病感染初期较难发现,一旦发生后,除灌根外的其他传统方法达不到杀灭尖孢镰孢菌的目的。而化学农药的大量使用易导致土壤污染和作物的农药残留积累,对中药材的生产、质量和安全产生负面影响[14 - 15 ]。因此,党参生产上迫切需要一种环境上可接受、可靠有效的方法来防治党参根腐病。
在可持续农业中,微生物生物防治剂具有代替化学农药来防治植物病害的潜力,能有效抑制植物病原菌,并促进植物生长[16 - 17 ]。大多数用作生物防治剂的细菌菌株均属于芽孢杆菌[18 ]。芽孢杆菌的抗真菌活性与其抗真菌次级代谢产物有关,这些成分能抑制病原菌的繁殖、菌丝形变或破裂,或引起其核酸内容物的释放量增加,从而导致细胞内环境失衡甚至死亡[19 - 21 ]。贝莱斯芽孢杆菌(Bacillus velezensis)属芽孢杆菌属,其在繁殖与生长阶段能够分泌产生许多抗菌成分,且表现出广谱、高效的抗菌活性。贝莱斯芽孢杆菌的次生代谢产物含有多种蛋白酶、脂肽类抗生素等,而脂肽类抗生素是其最重要的抗菌物质[22 - 25 ]。有研究证明,贝莱斯芽孢杆菌对尖孢镰孢菌古巴专化型有较好的防治效果[26 ]。将贝莱斯芽孢杆菌的产物进行粗提后发现,其粗提物中含有抗菌脂肽类物质为Bacillomycin D 及Surfactin 等多个组分,能有效抑制尖孢镰孢菌的生长[27 ]。此外,贝莱斯芽孢杆菌对番茄灰斑病、小麦纹枯病等多种植物病害均有较好的防治效果[28 - 29 ]。
本研究利用实验室前期分离纯化得到的1株贝莱斯芽孢杆菌菌株BQ进行研究,初步探究了其对党参根腐病抗菌机理和防治效果,以期为贝莱斯芽孢杆菌菌株BQ应用于防治党参根腐病提供初步的理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种 供试菌株为贝莱斯芽孢杆菌BQ,来自兰州交通大学生物农药工程中心,保藏号为ACCC61708。通过对菌株BQ基因分析,证实菌株BQ为芽孢杆菌属贝莱斯芽孢杆菌(Bacillus velezensis),对党参根腐病病原菌具有较强抑制作用。供试尖孢镰孢菌菌株DS自党参根腐病发病植株的根部分离筛选所得,对病原菌分离并通过过真菌形态学和16srDNA分子鉴定,最终确定菌株DS为尖孢镰孢菌,保存于兰州交通大学生物农药工程中心。
1.1.2 供试植株 一年生白条党参品种渭党2号,来自甘肃省渭源县党参种植基地。
1.1.3 供试培养基 LB培养基(固):蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L、琼脂 20 g/L,pH自然。LB培养基(液):蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L,pH自然。
马铃薯葡萄糖琼脂培养基(Potato dextrose ager,PDA):马铃薯200 g/L、葡萄糖 20 g/L、琼脂 20 g/L,pH自然。
1.2 实验方法
1.2.1 菌种培养 菌株BQ采用在LB固体平板上划线的方式接种传代。将菌株BQ接种至LB液体培养基,30 ℃下以180 rpm/min培养36~48 h来制备种子液。将种子液以V∶V=1∶10接种至LB液体培养基,在30℃下以180 rpm/min培养36~48 h,获得菌株BQ的发酵液。试验之前,需测定发酵液的细菌数并用LB液体培养基调节至1×109 CFU/mL。将病原菌DS的菌饼(直径为5 mm)接种至PDA培养平板的中心,在25 ℃条件下暗培养7 d进行繁殖。在菌落边缘取5个菌饼(直径为5 mm)接种至PDA培养基,在25 ℃条件下以180 rpm/min暗培养48 h,获得病原菌DS的發酵液。试验之前,也需测定发酵液的孢子数并用PDB培养基调节至1×105 CFU/mL。
1.2.2 平板对峙 在病原菌DS的平板边缘取菌饼(直径为5 mm)接种至PDA平板中心,挑取菌株BQ的菌落,在病原菌DS菌饼两侧距离平板边缘约1 cm的位置划线[30 ]。以仅接种病原菌DS菌饼的平板为对照,每处理重复3次。所有平板置于28 ℃下进行暗培养,直至对照组的DS菌丝生长到平板边缘。在光学显微镜下观察对峙区的病原菌菌丝。
1.2.3 孢子抑制 将菌株BQ的发酵液以5 000 rpm/min离心20 min后取上清液,将上清液用无菌滤膜(0.45 μm)过滤,获得菌株BQ的无菌上清滤液。将其无菌上清滤液用LB液体培养基稀释至浓度0.5%、1.0%、5.0%、50.0% 、100.0%(V/V)。将病原菌DS的发酵液和BQ菌株的无菌上清液滤液以V∶V=1∶1混合[无菌上清滤液的终浓度分别为0.25%、0.50%、1.00%、5.00%、50.00% (V/V)],并取2 mL加入24孔板的菌株中,在25 ℃条件下培养8 h。以空白LB液体培养基代替无菌上清滤液为对照(CK)。每处理组重复3次。在光学显微镜下观察DS的孢子萌发情况,并计算孢子萌发率和抑制率[31 - 32 ]。
孢子萌发率(%)=×100%
式中, G1是每处理组中观察得到的孢子总数,G2是每处理组中观察到的萌发的孢子数。
抑制率(%)=×100%
式中, C1是空白对照组的孢子萌发率,C2是各个处理组的孢子萌发率。
1.2.4 根腐病 病原菌细胞膜相对电导率和核酸内容物释放将病原菌DS的发酵液用2层无菌纱布过滤,得到DS的菌丝体。用10 mL无菌的磷酸盐缓冲液(PBS,100 mmol/L,pH 7.2)将菌丝体洗涤3次,之后将菌丝体置于100 mL的无菌PBS中,将无菌上清滤液以V∶V=1∶10接种至含菌丝体的PBS中,以含有等量LB液体培养基的PBS用作空白对照。每个处理组在28 ℃下以180 rpm/min在黑暗中培养,并分别在0、3、6、9、12、24 h后测定每个组的细胞外电导率(用梅特勒托利多电导率测定仪测定)和260 nm处的吸光度(德国斯派克光谱仪测定)[33 - 34 ]。每个处理重复3次。将培养24 h后获得的各处理组的病原菌DS菌丝在扫描电镜下观察。
1.2.5 防治效果 评价选取粗细大小一致的一年生党参根,清洗后分别用75%酒精消毒15 s,用30%次氯酸钠溶液消毒1 min,再用无菌水清洗3次。为测定菌株BQ对党参根腐病的治疗效果,在消毒后的党参根上进行针刺,并在每个伤口接种病原菌DS的菌饼(直径5 mm),使带有菌丝的一面紧贴伤口[35 ]。48 h后,取5 mL菌株BQ的发酵液均匀地喷洒在党参根表面。为测定菌株BQ对党参根腐病的预防效果,将党参根针刺后,先将5 mL菌株BQ的发酵液喷洒在党参根系表面,48 h后再接种病原菌DS的菌饼。以只接种 LB液体培养基为空白对照,以只接种病原菌DS菌饼的处理为阴性对照。各处理组内的党参均置于铺有无菌湿滤纸的平板(直径18 cm)内,在25 ℃黑暗中培养。培养7 d后,观测党参根系的发病情况,计算发病率、病情指数和防治效果[36 - 37 ]。每个处理组重复3次,每个处理组内包括10条一年生党参根。
党参根腐病分级标准为:0级,根部无病斑;1级,根系患病面积占1% ~ 10%,根系剖面无明显变化;2级,根部发病面积占11% ~ 20%,根部剖面开始变褐;3级,根部发病面积占20% ~ 30%,剖面变成褐色;4级,根部病变面积占30% ~ 40%,病变变软,整个根部变成褐色至黑褐色,甚至长出白色菌丝;5级,根部发病面积占40% ~ 50%,整个根部开始变软,菌丝覆盖面积扩大,根部变成黑褐色;6级,50% ~ 60%面积感染,整个根部开始软化腐烂,菌丝大面积覆盖;7级,根部发病面积占60%以上,根部腐烂,出现大量水渍[38 ]。
发病率=×100%
式中,D1是发病党参根系的数量,D2是调查的党参根系总数。
病情指数=×100
式中, E1是病害各个级别的发病党参根系总数,E2是病害相级别数值,E3是调查的党参根系总数,E4是最高级数值。
防治效果=×100%
式中,F1是阴性对照的病情指数,F2是处理组的病情指数。
2 结果与分析
2.1 平板对峙
菌株BQ对病原菌DS的对峙效果如封三图1所示,菌株BQ可明显抑制病原菌DS的生长。在培养7 d后,菌株BQ对病原菌DS菌丝的抑制率达到50.55%。在光学显微镜下观察菌丝结构可知,对照组的病原菌DS菌丝呈线状平滑生长,而处理组的病原菌DS菌丝发生了明显的形变,出现了出现了菌丝葫芦状膨大、节间缩小,以及出现了菌丝横断。表明菌株BQ對病原菌DS的生长状态具有一定影响,具有较强的生防潜力。
2.2 孢子萌发
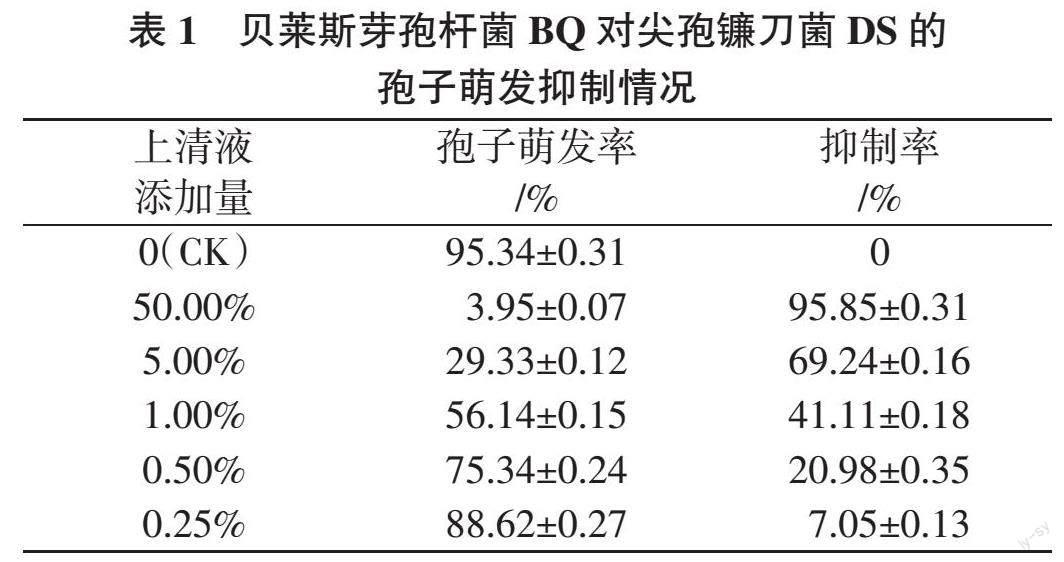
菌株BQ对病原菌DS的孢子萌发抑制效果如封三图2所示。与对照组相比,含有无菌上清液的培养基能显著抑制病原菌DS的孢子萌发。随着上清液添加比例的增加,菌株 BQ对DS分生孢子的抑制作用越来越强。当上清液添加量为50.00%(v/v)时,其抑制效果最强,孢子萌发抑制率达到(95.85±0.31)%;当上清液添加量降至1.00%时,抑制率仍高达(41.11±0.18)%(表1)。表明菌株BQ的代谢产物中含有的抗菌成分能显著抑制病原菌DS的孢子萌发,有作为生物防治剂进行开发的潜力。
2.3 细胞膜电导率和核酸内容物释放量
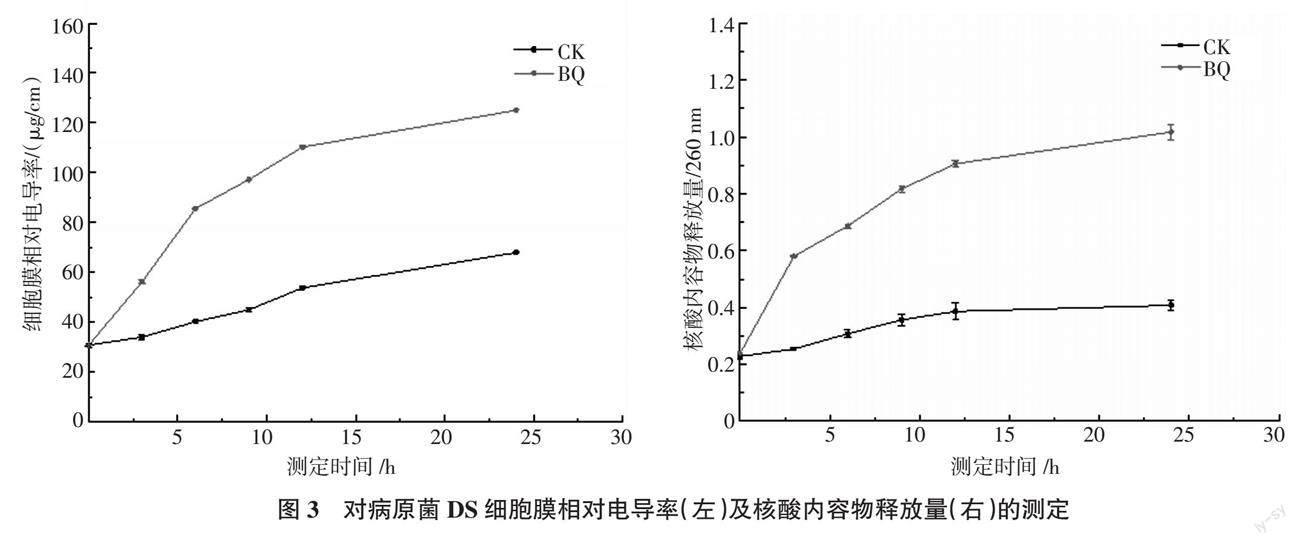
以菌株BQ的无菌上清液滤液对病原菌DS的细胞膜相对电导率及核酸内容物释放量来探究其对病原菌DS生长状态的影响,结果如图3所示,与对照组相比,菌株BQ的无菌上清液滤液能使病原菌DS的细胞膜相对电导率和核酸内容物含量显示出显著的上升趋势(P < 0.05)。这表明菌株BQ的发酵产物能破坏病原菌DS的细胞膜,从而使病原菌DS细胞膜通透性增加,以及核酸内容物释放加剧,并引起细胞破裂至死亡。
此外,扫描电镜的结果显示(封三图4),菌株BQ的无菌上清液滤液能显著改变病原菌DS菌丝的形态,能引起菌丝发生严重膨胀、起皱,并塌陷和断裂。相比之下,对照组中的菌丝表现为饱满、规则且光滑,并正常生长的状态。
综上可知,菌株BQ的发酵产物能大大影响病原菌DS的细胞膜通透性,从而影响菌体的生长状态,导致病原菌渗透压平衡紊乱,最终导致菌体破裂至死亡。
2.4 对党参根腐病的防治效果
以一年生健康党参离体根为材料,研究了贝莱斯芽孢杆菌菌株BQ对党参根腐病的防治效果,各处理组除空白对照组外,发病率均为100.00%(封三图5)。与空白对照组相比,阴性对照组表现出典型的党参根腐病的病理症状,其中根部腐烂并变成褐色,生长白色菌丝,7 d后维管束变褐色,病情指数高达70.73±1.07。而与阴性对照组相比,2个处理组内的菌株BQ均可以明显降低病害发生的严重程度。其中,治疗组BQ菌株对党参根腐病的防治效果为46.13%,党参根部表面病变较轻,但维管束内发生明显褐变,病情指数为38.10±0.87;在预防组中,BQ菌株对党参根腐病的防治效果为63.62%,党参根部表面病斑部位较少,维管束的褐变程度较轻,病情指数较低,仅为25.73±0.45(表2)。可知菌株BQ对党参根腐病有较好的防治效果,且预防效果强于治疗效果。
3 討论与结论
本研究发现,贝莱斯芽孢杆菌BQ对引起党参根腐病的尖孢镰孢菌DS菌丝生长和孢子萌发均具有明显的抑制作用。在平板对峙实验中,对峙区的尖孢镰刀菌DS菌丝发生了较大的形变,菌丝生长抑制率达50.55%,出现了菌丝葫芦状膨大、节间缩小,以及出现了菌丝横断。扫描电镜下更是观察到了菌丝变粗及内容物泄漏,以及菌丝横断。以上结果表明贝莱斯芽孢杆菌BQ及其代谢产物能对尖孢镰刀菌DS的生长状态造成较大影响,其次级代谢产物中含有能破坏菌丝生长的成分。此外,随着菌株BQ无菌上清液比例的增加,对病原菌DS的孢子萌发表现出较强的抑制作用,这表明菌株BQ分泌出了能有效抑制病原菌DS抗真菌物质的代谢产物。
生防菌的抗真菌活性与其能引起病原菌分生孢子结构破坏和细胞膜破裂的抗真菌次级代谢产物有关[21, 39 - 40 ]。结合对引起党参根腐病的病原菌尖孢镰孢菌DS菌丝的相对电导率和核酸内容物释放量的测定,贝莱斯芽孢杆菌菌株BQ对病原菌尖孢镰孢菌DS细胞膜通透性及核酸内容物释放量均有较大影响,从而导致细胞渗透压紊乱。综合以上结果可知,无菌上清液滤液破坏了尖孢镰孢菌的细胞膜完整性,导致菌丝通透性增加和核酸内容物渗漏,从而导致细胞内环境失衡甚至死亡。这些结果与先前研究的结论一致,即细胞质渗漏是由细胞质膜的渗透性增加引起的[19 - 20, 41 ]。
此外,从对党参根腐病离体防治的防治效果来看,对党参根腐病的治疗效果达到46.13%,预防效果达到了63.62%,可见贝莱斯芽孢杆菌菌株BQ有着良好的治疗效果和预防效果,且预防效果优于治疗效果。有研究认为,拮抗菌对病原菌的保护作用优于治疗作用,这意味着先进的接种细菌具有强大的定殖能力[42 ],但这些推测有待进一步验证。
综上所述,贝莱斯芽孢杆菌BQ对党参根腐病具有较好的防治效果,对引起党参根腐病的病原菌尖孢镰孢菌DS有抑制作用,能有效抑制其菌丝生长及孢子萌发。此外,通过对其抗菌机理初步探索发现,贝莱斯芽孢杆菌BQ的次级代谢产物含有的抗菌成分,能增加尖孢镰孢菌DS的菌体细胞膜通透性和加剧核酸内容物释放,并引起细胞破裂至死亡。可见,贝莱斯芽孢杆菌BQ有防治党参根腐病的潜力,可作为生物防治剂进行开发加以利用。
参考文献:
[1] 李成义,刘书斌,李 硕,等. 甘肃党参栽培现状调查分析[J]. 中国现代中药,2016,18(1): 102-105.
[2] 孙新荣,仲彩萍,张西梅,等. 甘肃定西地区党参根腐病病原鉴定与防治研究[J]. 植物保护,2020,46(5): 290-297.
[3] 王飞燕. 香蕉尖孢镰刀菌fpd1基因敲除与功能研究[D]. 海口:海南大学,2015.
[4] OSPINA-GIRALDO M D, MULLINS E, KANG S. Loss of function of the Fusarium oxysporum SNF1 gene reduces virulence on cabbage and Arabidopsis[J]. Current Genetics, 2003, 44(1): 49-57.
[5] DI PIETRO A, GARC?魱A-MACEIRA F I, M?魪GLECZ E, et al. A MAP kinase of the vascular wilt fungus Fusarium oxysporum is essential for root penetration and pathogenesis: Fusarium MAPK is essential for pathogenesis[J]. Molecular Microbiology, 2004, 39:1140-1152.
[6] MARR?魬 M T, VERGANI P, ALBERGONI F G. Relationship between fusaric acid uptake and its binding to cell structures by leaves of Egeria densa and its toxic effects on membrane permeability and respiration[J]. Physiological and Molecular Plant Pathology, 1993, 42(2): 141-157.
[7] GORDON T R. Fusarium oxysporum and the Fusarium Wilt Syndrome[J]. Annual Review of Phytopathology,2017,55(1): 23-39.
[8] RODR?魱GUEZ-G?魣LVEZ E, MENDGEN K. The infection process of Fusarium oxysporum in cotton root tips[J]. Protoplasma, 1995, 189(1): 61-72.
[9] THATCHER L F, GARDINER D M, KAZAN K, et al. A highly conserved effector in fusarium oxysporum is required for full virulence on arabidopsis[J]. Molecular Plant-Microbe Interactions■, 2012, 25(2): 180-190.
[10] 孫新荣,张西梅,高薇薇,等. 甘肃党参根腐病发生危害与防治[J]. 陕西农业科学,2019,65(12): 90-91.
[11] CORRELL J C. The relationship between formae speciales, race, and vegetative compabitility groups in fusarium oxysporum[J]. Phytopathology, 1991, 9(81): 1061-1064.
[12] MARTINS O M, TAKATSU A. DOEN?覶AS DE HORTALI?覶AS NO AMAP?魣[J]. Fitopatol.bras, 1990, 15(4):357-358.
[13] 李聚奎. 园林树木根腐病发生及防治对策研究[J]. 智慧农业导刊,2021,1(16): 54-56.
[14] MALIK Z, AHMAD M, ABASSI G H, et al. Agrochemicals and soil microbes: interaction for soil health[J]. Xenobiotics in the Soil Environment: Monitoring,Toxicity and Management, 2017, 49: 139-152.
[15] DHANANJAYAN V, JAYANTHI P, JAYAKUMAR S, et al. Agrochemicals impact on ecosystem and bio-monitoring[J]. Resources use efficiency in agriculture, 2020, 7(35): 349-388.
[16] PANTH M, HASSLER S C, BAYSAL-GUREL F. Methods for management of soilborne diseases in crop production[J]. Agriculture, 2020, 10(1): 16.
[17] BROTMAN Y, LISEC J, MERET M, et al. Transcript and metabolite analysis of the Trichoderma-induced systemic resistance response to Pseudomonas syringae in Arabidopsis thaliana[J]. Microbiology, 2012, 158(1): 139-146.
[18] FRAVEL D R. Commercialization and implementation of biocontrol[J]. Annu. Rev. Phytopathol., 2005, 43: 337-359.
[19] WANG J, ZHANG J, MA J, et al. The major component of cinnamon oil as a natural substitute against Fusarium solani on Astragalus membranaceus[J]. Journal of Applied Microbiology, 2022, 132(4): 3125-3141.
[20] JI D, CHEN T, MA D, et al. Inhibitory effects of methyl thujate on mycelial growth of Botrytis cinerea and Possible mechanisms[J]. Postharvest Biology and Technology, 2018, 142: 46-54.
[21] JANGIR M, PATHAK R, SHARMA S, et al. Biocontrol mechanisms of Bacillus sp., isolated from tomato rhi-zosphere,against Fusarium oxysporum f. sp. lycopersici[J]. Biological Control,2018,123: 60-70.
[22] X. H C, A. K,R. S, et al. Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens[J]. Journal of Biotechnology, 2009, 140(1):27-37.
[23] ZHAO J, LI Y, ZHANG C, et al. Genome shuffling of Bacillus amyloliquefaciens for improving antimicrobial lipopeptide production and an analysis of relative gene expression using FQ RT-PCR.[J]. Journal of industrial microbiology & biotechnology, 2012, 39(6): 889-896.
[24] ADENIJI A A, Aremu O S, Babalola O O. Selecting lipopeptide、 roducing, Fusarium: uppressing Bacillus spp.: Metabolomic and genomic probing of Bacillus velezensis NWUMFkBS10.5[J]. MicrobiologyOpen, 2019, 8(6): e00742.
[25] 任建雯,罗云艳,冯印印,等. 贝莱斯芽孢杆菌RJW-5-5的分离鉴定及细菌素、抗菌肽基因簇挖掘[J]. 微生物学通报,2021,48(3): 742-754.
[26] 曹 禺. 芽孢杆菌Y6和F7防治番茄青枯病和香蕉枯萎病的研究[D]. 广州:华南农业大学,2018.
[27] 郭 蔓,张朝正,赵 華. 贝莱斯芽孢杆菌抑尖孢镰刀菌脂肽类物质的鉴定[J]. 中国酿造,2021,40(12): 35-39.
[28] 索雅丽,李术娜,李红亚,等. 番茄灰霉病菌颉颃菌株的筛选及功能基因的分析[J]. 中国植保导刊,2010,
30(8): 7-10.
[29] 夏明聪,邓晓旭,齐红志,等. 贝莱斯芽孢杆菌YB-145对小麦纹枯病的防治效果及促生作用[J]. 河南农业科学,2021,50(10): 76-83.
[30] CHEN L, HENG J, QIN S, et al. A comprehensive understanding of the biocontrol potential of Bacillus velezensis LM2303 against Fusarium head blight[J]. PloS one, 2018, 13(6): e0198560.
[31] SIMONETTI E, ROBERTS I N, MONTECCHIA M S, et al. A novel Burkholderia ambifaria strain able to degrade the mycotoxin fusaric acid and to inhibit Fusarium spp. growth[J]. Microbiological research, 2018, 206: 50-59.
[32] PINTO C A, MOREIRA S A, FIDALGO L G, et al. Effects of high pressure processing on fungi spores: Factors affecting spore germination and inactivation and impact on ultrastructure[J]. Comprehensive reviews in food science and food safety, 2020, 19(2): 553-573.
[33] ZHAO Z, SHANG X, LAWOE R K, et al. Anti-phytopathogenic activity and the possible mechanisms of action of isoquinoline alkaloid sanguinarine[J]. Pesticide biochemistry and physiology, 2019, 159: 51-58.
[34] WANG J, ZHANG J, MA J, et al. The major component of cinnamon oil as a natural substitute against Fusarium solani on Astragalus membranaceus[J]. Journal of Applied Microbiology, 2022, 132(4): 3125-3141.
[35] SAUDE C, HURTADO-GONZALES O P, LAMOUR K H, et al. Occurrence and characterization of a Phytophthora sp. pathogenic to asparagus(Asparagus officinalis) in Michigan[J]. Phytopathology, 2008, 98(10): 1075-1083.
[36] SINGH V, SHARMA N, SINGH S. A review of imaging techniques for plant disease detection[J]. Artificial Intelligence in Agriculture,2020,4: 229-242.
[37] XIE G, CUI H, DONG Y, et al. Crop rotation and intercropping with marigold are effective for root-knot nematode (Meloidogyne sp.) control in angelica (Angelica sinensis) cultivation[J]. Canadian Journal of Plant Science, 2016, 97(1): 26-31.
[38] 张建强. 党参根腐病生防菌的促生防病效果及机理研究[D]. 兰州:兰州交通大学,2021.
[39] XU W, WANG K, WANG H, et al. Evaluation of the biocontrol potential of Bacillus sp. WB against Fusarium oxysporum f. sp. niveum[J]. Biological Control, 2020,
147: 104288.
[40] WU Y, ZHOU J, LI C, et al. Antifungal and plant growth promotion activity of volatile organic compounds produced by Bacillus amyloliquefaciens[J]. MicrobiologyOpen, 2019, 8(8): e813.
[41] LEWIS J A, ROBERTS D P, HOLLENBECK M D. Induction of cytoplasmic leakage from Rhizoctonia solani hyphae by Gliocladium virens and partial characterization of a leakage factor[J]. Biocontrol Science and Technology, 1991, 1(1): 21-29.
[42] PENG Z, MAO X, JIANG H, et al. Evaluation of biological control strain MT-06 for managing cucumber powdery mildew by pot tests and its colonization measurement on cucumber[J]. Acta Agriculturae Zhejiangensis, 2012, 24(4): 624-629.

