乳酸菌协同发酵玉米蛋白水解物工艺条件优化及其对抗氧化活性影响
丛珊滋,曹雨佳,张欣欣,李冠龙,刘晓兰 ,胡楠
(1.齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔 161006)
玉米蛋白水解物(corn protein hydrolysates,CPH)是玉米蛋白经蛋白酶酶解后得到的低分子量寡肽混合物,其氨基酸种类多,能够满足人体日常所需,促进人体健康。玉米蛋白水解物具有多种生物活性,如抑制血管紧张素转换酶活性、抗氧化、解酒护肝、抗疲劳等[1]。然而,在玉米蛋白水解物的制备过程中,存在生物活性释放程度低、味苦等问题[1-2],极大地影响了其发展。
发酵可以较好地解决玉米蛋白水解物目前加工中存在问题。玉米蛋白水解物通过发酵可以进一步分解其中的大分子蛋白,增强其生物活性,而且发酵过程中产生的风味物质可中和玉米蛋白水解物原有的苦味,使产品的口感更柔和,容易被消费者接受。随着人们健康意识的增强,发酵产品的市场需求也在逐渐扩大,特别是益生菌发酵产品备受消费者的青睐。益生菌可以定殖于人体内,从多方面改善人体健康状况,如促进营养物质的消化吸收、改善胃肠道菌群微环境、调节免疫力、抗氧化、减轻内毒素等[3]。乳酸菌是目前常被应用于食品工业中的益生菌,乳酸菌发酵可以提高食品的营养价值、抑制有害菌的繁殖[4],改善原料的风味,如保加利亚乳杆菌可以去除牛奶的生臭味,并产生微弱的香味[5],增强保藏性。乳酸菌常用的发酵形式主要是单一菌种发酵或混合菌种发酵[6]。与单一菌种发酵相比,混合菌种发酵更具优势,一是益生菌活性更高,发酵效果更好,这是由于微生物之间可以相互利用代谢产物或交换信号分子,从而相互促进生物转化,产生更好的发酵效果;二是复合的微生物菌群对外界环境更具耐受力[7]。在发酵乳的生产中常用嗜热链球菌和保加利亚乳杆菌协同发酵,菌株之间可以互利共生,在发酵过程中,可以利用彼此的代谢产物来促进各自的生长[8]。杭锋等[9]发现混合乳酸菌间存在协同作用,互相促进,使得生长繁殖速度显著增加,并且混合菌种发酵的产品酸度是单一菌种发酵的2 倍,同时还延迟了酸化现象。基于乳酸菌在发酵食品中的优点,科研人员对其发酵蛋白水解物的能力做了相关研究。Oliveira 等[10]发现酪蛋白酶解物对酸奶中嗜热链球菌的生长具有明显的促进作用。张根生等[11]研究发现含金属硫的蛋白鸡蛋水解物有利于动物双歧杆菌和嗜酸乳杆菌生长,且混合菌种发酵增殖效果优于单一菌种发酵。段旭昌等[12]利用乳酸菌发酵法改良甲鱼蛋白酶解液的风味,发现大部分的苦味氨基酸被转化,使甲鱼酶解液的整体风味得到了明显改善。方磊等[13]利用嗜酸乳杆菌制备发酵大豆蛋白肽,发现其能增强小鼠机体的免疫力和抗疲劳能力。目前,国内外关于乳酸菌发酵玉米蛋白水解物的研究报道较少。
本研究利用课题组前期从野生果实表皮上筛选出的鼠李糖乳杆菌YY-15(LactobacillusrhamnoseYY-15)和发酵乳杆菌YY-16(LactobacillusfermentumYY-16)为发酵菌株,以玉米蛋白水解物为发酵原料,通过单因素试验和响应面试验优化发酵工艺参数,并对发酵后产品的氨基酸和抗氧化能力进行分析,旨在为玉米蛋白水解物在食品领域的开发和利用开辟新的途径。
1 材料与方法
1.1 菌种与样品
鼠李糖乳杆菌(LactobacillusrhamnoseYY-15,保藏号CGMCC NO.26821)、发酵乳杆菌(LactobacillusfermentumYY-16,保藏号CGMCC NO.26822):保藏于中国普通微生物菌种保藏管理中心;玉米蛋白水解物干粉:黑龙江省玉米深加工理论与技术重点实验室自制。
1.2 主要试剂
MRS 肉汤培养基、MRS 固体培养基:北京索莱宝科技有限公司;果葡糖浆F55(55% 果糖,40% 葡萄糖,5% 低聚糖):湖北千凤香食品有限公司;1,1-二苯基-2-三硝基苯肼(1,1 - diphenyl - 2 - picrylhydrazyl radical,DPPH)、菲啰嗪:生工生物工程(上海)有限公司;硫酸亚铁、过氧化氢、水杨酸:天津市科密欧化学试剂有限公司。所用试剂均为分析纯。
1.3 仪器与设备
恒温培养摇床(ZWY-211B):上海智城分析仪器制造有限公司;隔水式恒温培养箱(GSP-9270MBE):上海博迅实业有限公司;喷雾干燥器(B-290):瑞士BUCHI公司;超净台(SW-CJ-2FD):苏净安泰空气技术有限公司;全自动高压灭菌器(XS-500):日本KAGOSHIMA公司;多功能酶标仪(EnSpire):珀金埃尔默仪器有限公司;全自动氨基酸分析仪(1-8900):日本日立公司。
1.4 试验方法
1.4.1 菌种的活化
分别挑取1~2 环保藏的菌株YY-15 与YY-16 转接于MRS 肉汤培养基中,37 ℃培养24 h。分别吸取0.1 mL 菌液至20 mL MRS 肉汤培养基中,37 ℃培养12 h,连续活化2~3 次,作为种子培养液,备用。
1.4.2 试验工艺流程
CPH 干粉→溶解→添加碳源→灭菌→接菌→发酵→成品。
操作要点如下。
溶解:将CPH 和去离子水按一定料液比(g/L)进行混合。
灭菌:将CPH 溶液在121 ℃、30 min 条件下进行灭菌处理。
接菌:在无菌环境中,将活化后的菌株YY-15 与YY-16 按照一定体积比接种到玉米蛋白水解物溶液中,体系中初始活菌数约为106CFU/mL。
1.4.3 抗氧化活性的测定
抗氧化活性参考刘玥等[14]的方法,测定乳酸菌协同发酵玉米蛋白水解物发酵前后对DPPH 自由基、·OH、·O2-的清除能力和Fe2+螯合能力,并计算IC50值。
1.4.4 总酸的测定
根据Hu 等[15]的方法进行总酸测定,结果以乳酸计。
1.4.5 乳酸菌活菌数的测定
根据Hu 等[16]的方法进行乳酸菌活菌计数。
1.4.6 氨基酸的测定
采用全自动氨基酸分析仪,利用酸水解法测定氨基酸含量。
1.4.7 感官评价
感官评价小组由10 名食品专业人员组成,乳酸菌发酵玉米蛋白水解物的感官评价标准见表1。

表1 乳酸菌发酵玉米蛋白水解物的感官评价标准Table 1 Sensory evaluation standard of CPH fermented by lactic acid bacteria
1.4.8 单因素试验
基础发酵条件:菌株YY-15 与YY-16 体积比3∶1,玉米蛋白水解物浓度20%(质量体积比),接种量4%(体积分数),果葡糖浆添加量4%(体积分数),发酵温度37 ℃,发酵时间24 h。
以乳酸菌发酵玉米蛋白水解物中的活菌数、总酸含量(以乳酸计)、感官评分以及DPPH 自由基清除能力(蛋白浓度1 mg/mL)为指标,分别对菌种体积比(1∶0、3∶1、2∶1、1∶1、1∶2、1∶3、0∶1)、接种量(1%、2%、3%、4%、5%、6%、7%)、果葡糖浆添加量(1%、2%、3%、4%、5%、6%、7%)、发酵时间(16、20、24、28、32、36、40、44、48 h)、发酵温度(35、37、39、41、43 ℃)和CPH 浓度(10%、20%、30%、40%、50%、60%、70%)进行单因素试验。
1.4.9 响应面试验
在单因素试验的基础上,选取发酵温度、接种量、CPH 浓度和果葡糖浆添加量为自变量,以乳酸菌协同发酵玉米蛋白水解物对DPPH 自由基清除能力为响应值,设计四因素三水平的响应面试验。响应面试验设计因素与水平见表2。
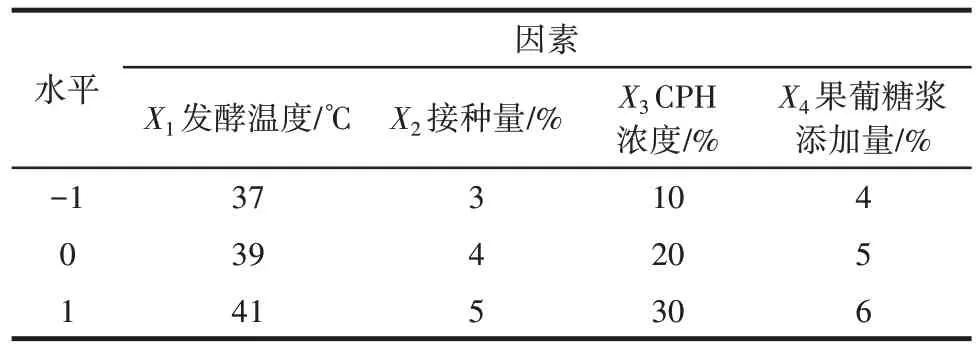
表2 响应面试验设计因素与水平Table 2 Factors and levels of response surface test design
1.5 数据处理
利用Design-Expert version 8.0.6 软件进行Box-Behnken 试验设计。使用Office 2021 对数据及图片进行处理,SPSS Statistics 20.0 对结果进行单因素方差分析(ANOVA),当P<0.05 时表明数据间存在显著差异。
2 结果与分析
2.1 乳酸菌协同发酵玉米蛋白水解物单因素试验
2.1.1 菌种体积比对乳酸菌协同发酵玉米蛋白水解物的影响
在CPH 浓度20%、果葡糖浆添加量4%、接种量4%、发酵温度37 ℃、发酵时间24 h 的发酵条件下,研究菌株YY-15 和YY-16 不同体积比对乳酸菌协同发酵玉米蛋白水解物影响,结果如图1 所示。
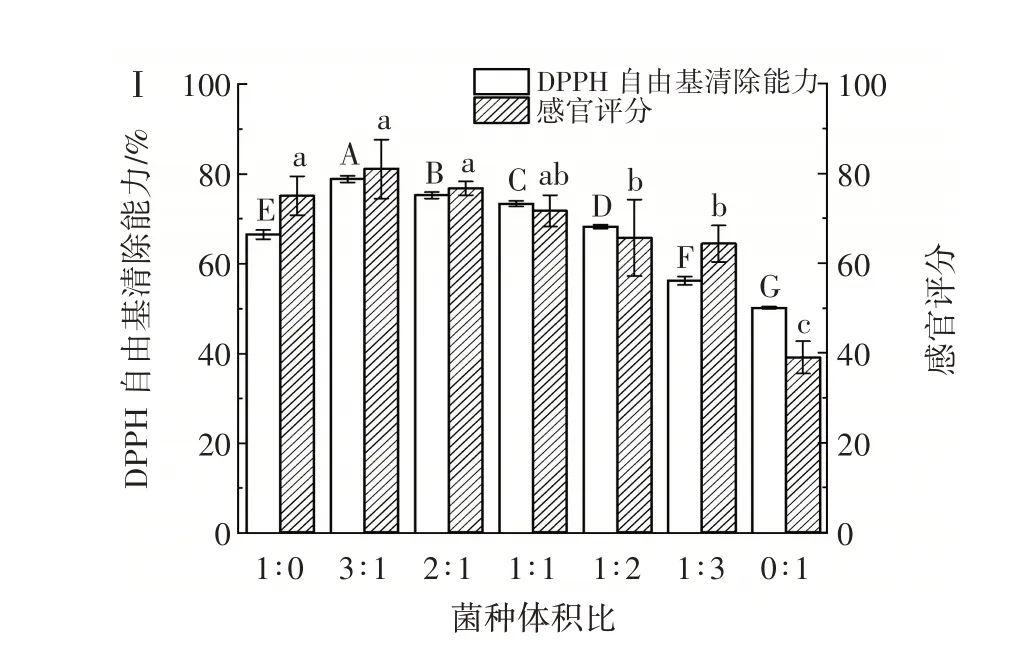
图1 菌种体积比对乳酸菌发酵玉米蛋白水解物的影响Fig.1 Effect of strain ratio on CPH fermented by lactic acid bacteria
鼠李糖乳杆菌和发酵乳杆菌是食品发酵中常用的菌株,也是具有较强益生性和稳定遗传性的益生菌[17]。在发酵食品中,乳酸菌表现出其重要发酵特性和生理功能的前提是完成菌体的大量增殖。因此,在乳酸菌协同发酵玉米蛋白水解物过程中,需将乳酸菌活菌数作为重要考察指标。
由图1 可以看出,各试验组在发酵24 h 后乳酸菌活菌数均能达到108CFU/mL 以上,表明菌株YY-15和YY-16 能够较快适应玉米蛋白水解物的发酵环境,从而快速完成菌体增殖。与单一菌种发酵相比,混合菌种发酵中的乳酸菌活菌数均显著提高(P<0.05)。当菌株YY-15 与YY-16 体积比为3∶1 时,发酵后乳酸菌活菌数达到最大值,为2.4×109CFU/mL,是菌株YY-15、YY-16 单一菌种发酵的3.73 倍和9.49 倍,可见,菌株YY-15 和YY-16 具有一定的共生性,可以相互促进生长。混合菌种发酵可以有效提高发酵液中水解酶的含量,并且弥补了单一菌种发酵产生胞外酶系不全面的缺点,对发酵基质营养转化效率更高,提高发酵效率[18]。
本研究中鼠李糖乳杆菌和发酵乳杆菌具有相似的生长条件,其均能利用相似的底物进行发酵。尹彦洋等[19]研究了鼠李糖乳杆菌和嗜酸乳杆菌的共生关系,发现两株菌具有相似的生长条件,均能利用单糖进行发酵。鼠李糖乳杆菌的终端产物乳酸可以缩短嗜酸乳杆菌的发酵时间,嗜酸乳杆菌可降解蛋白质产生多种氨基酸,为鼠李糖乳杆菌提供氮源,说明二者具有良好的共生发酵能力。但是目前对于鼠李糖乳杆菌和发酵乳杆菌的相互作用机制报道较少。
鼠李糖乳杆菌属于同型乳酸发酵菌株,其终产物大部分为L-乳酸,发酵乳杆菌是专性异型乳酸发酵菌株,代谢产物较为丰富,除乳酸外,还产生乙醇、乙酸和二氧化碳等其他物质[20]。Driehuis 等[21]最早将同型乳酸发酵和异型乳酸发酵两类菌株结合使用,结果发现混合菌种发酵相比于布氏乳杆菌单独发酵的乳酸含量明显增加。本研究中,当菌株YY-15 与YY-16 体积比为3∶1 时,发酵24 h 后乳酸菌活菌数和总酸含量均达到最大值,显著高于两株菌单独发酵的总酸含量(P<0.05),与Driehuis 等[21]报道结果一致。使用两种类型的乳酸菌混合发酵,可以使其优势结合,同型乳酸发酵菌可以控制前期发酵,抑制杂菌生长;专性异型乳酸发酵菌在发酵后期会产生更多的风味物质,赋予产品独特的风味[22],在感官评价结果中也验证了这一说法,并且当菌株YY-15 与YY-16 体积比为3∶1 时,感官评分最高,为81.00。当菌种体积比为1∶1~1∶3 时,乳酸菌活菌数和总酸含量随YY-16 添加量的增加而降低,这可能是由于YY-16 添加量过多,形成了优势菌群,抑制YY-15 的生长,两株菌的共生平衡被打破。综合考虑,选择鼠李糖乳杆菌YY-15 和发酵乳杆菌YY-16 菌种体积比为3∶1 进行后续的发酵试验。
2.1.2 接种量对乳酸菌协同发酵玉米蛋白水解物的影响
在菌株YY-15 与YY-16 体积比为3∶1、CPH 浓度20%、果葡糖浆添加量4%、发酵温度37 ℃、发酵时间24 h 的发酵条件下,研究不同接种量对乳酸菌协同发酵玉米蛋白水解物的影响,结果如图2 所示。
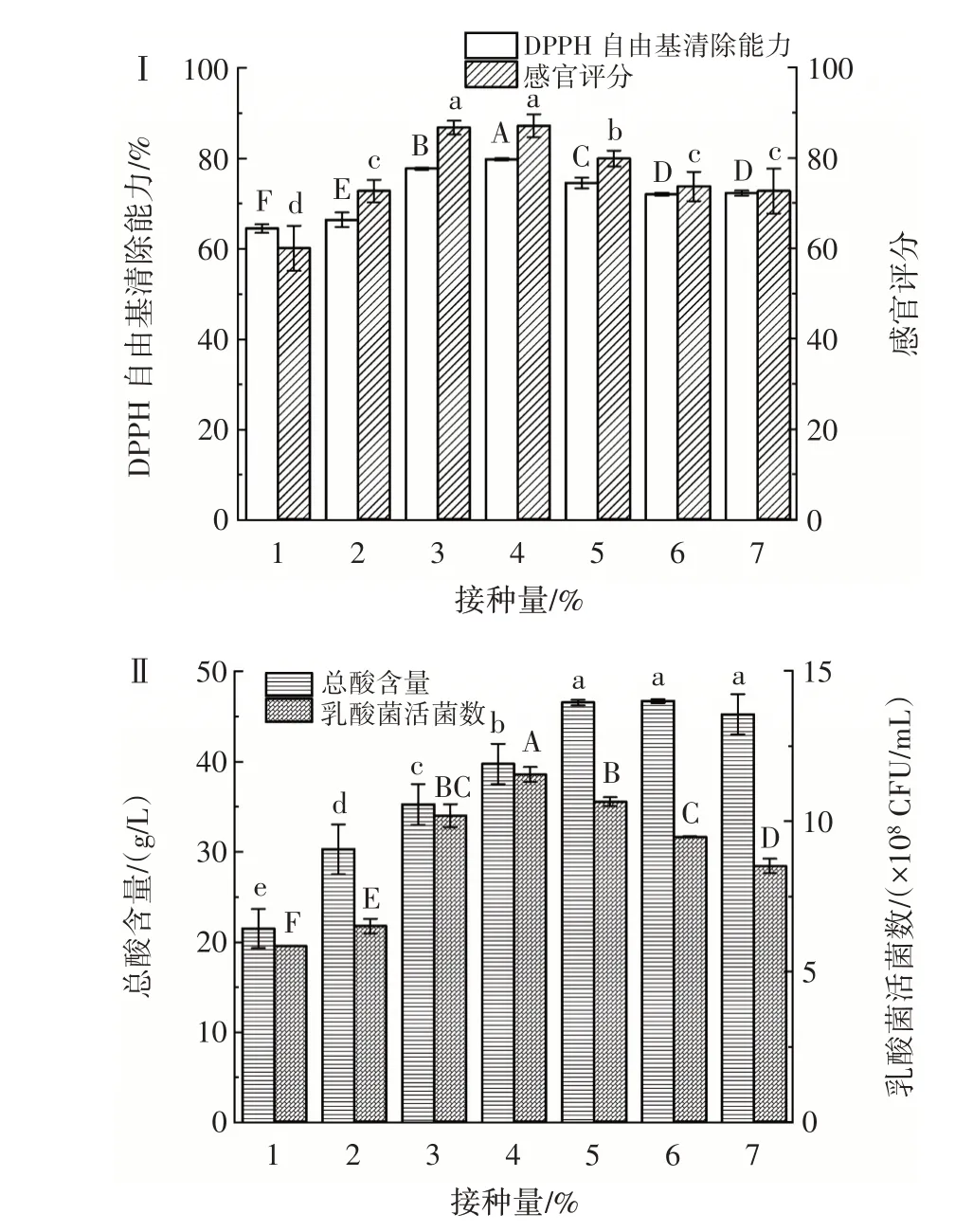
图2 接种量对乳酸菌发酵玉米蛋白水解物的影响Fig.2 Effect of inoculation amount on CPH fermented by lactic acid bacteria
由图2 可知,随着接种量的增加,乳酸菌活菌数和DPPH 自由基清除能力呈现先上升后下降的趋势。原因可能是接种量过低,乳酸菌产生胞外酶分解底物的速率不能满足乳酸菌大量增殖的需求;或是接种量过高,鼠李糖乳酸菌生长代谢旺盛,产生大量的乳酸,使发酵液pH 值迅速降低,抑制发酵乳酸菌的生长,延长发酵时间,最终导致乳酸菌活菌数和DPPH 自由基清除能力降低。当接种量为4% 时,乳酸菌发酵玉米蛋白水解物的乳酸菌活菌数达到最大值,为1.15×109CFU/mL,同时,DPPH 自由基清除能力和感官评分也达到最大,与陈莹艳[23]的研究结果相似。总酸含量随接种量的增加呈先持续升高后趋于平缓的趋势,当接种量大于5%后总酸含量略有下降,各组间无显著性差异(P>0.05)。结合感官评分结果可知,总酸积累不足,发酵产品的口感寡淡,风味不明显,难以掩盖CPH 的苦味;总酸含量过高,亦会使发酵酸味过浓,影响其他风味,导致感官品质下降。综合判断,选取接种量3%、4%、5% 进行后续响应面优化试验。
2.1.3 果葡糖浆添加量对乳酸菌协同发酵玉米蛋白水解物的影响
在菌株YY-15 与YY-16 体积比3∶1、CPH 浓度20%、接种量4%、发酵温度37 ℃、发酵时间24 h 的发酵条件下,研究不同果葡糖浆添加量对乳酸菌协同发酵玉米蛋白水解物的影响,结果如图3 所示。
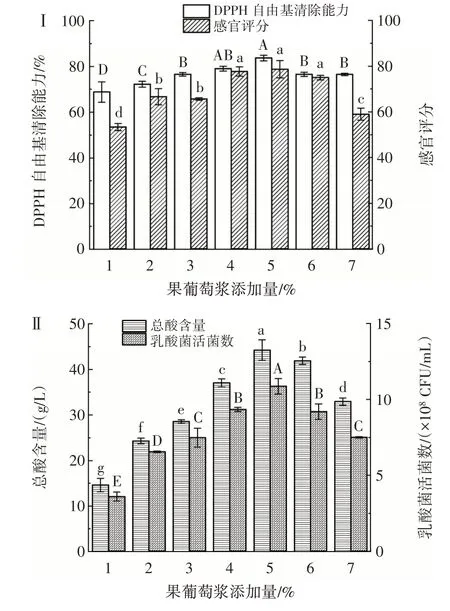
图3 果葡糖浆添加量对乳酸菌发酵玉米蛋白水解物的影响Fig.3 Effect of fructose syrup addition on CPH fermented by lactic acid bacteria
微生物生长过程中,既需碳源作为活动能量,又要氮源构成自己的细胞结构。玉米蛋白水解物中可溶性肽含量高,可以满足发酵氮源的需要。本研究中玉米蛋白水解物由于进行了去淀粉的处理,因此碳源含量较低,为保证发酵顺利进行,需要补充碳源。果葡糖浆是一种发酵行业常用的碳源补充剂,由于其中含有不同比例的果糖、葡萄糖和低聚糖,将其应用于发酵食品中不仅可以补充碳源,还可以改善产品的口感和功能性。
由图3 可以看出,随着果葡糖浆添加量的增加,总酸含量和乳酸菌活菌数呈先上升后下降趋势,均在果葡糖浆添加量为5% 时达到最高值。果葡糖浆添加量过少,乳酸菌生长所需能量不足,致使增殖能力下降,产酸过少,风味不足;果葡糖浆的渗透压高于双糖,添加过多则会导致细菌的细胞壁破裂,同时也会使酸甜比失调,口感过于甜腻。当果葡糖浆添加量为4%~6%时,乳酸菌发酵玉米蛋白水解物的酸甜适中,质地均匀,无分层和沉淀,感官评分较高。DPPH 自由基清除能力的变化规律与乳酸菌活菌数呈正相关,原因可能是由于乳酸菌自身具有一定的抗氧化能力,乳酸菌的数量增加,从而增强了发酵液的抗氧化能力;或是由于乳酸菌数量增加,发酵液中的蛋白酶含量增加,使发酵底物水解速度加快,更多的寡肽游离出来,增强了发酵液的抗氧化能力。由图3 可知,果葡糖浆添加量对DPPH 自由基清除能力的影响较小,但具有显著性差异。综合考虑,选取果葡糖浆添加量为4%、5%、6% 进行后续优化试验。
2.1.4 发酵温度对乳酸菌协同发酵玉米蛋白水解物的影响
在菌株YY-15 与YY-16 体积比为3∶1、CPH 浓度20%、接种量4%、果葡糖浆添加量5%、发酵时间24 h的发酵条件下,研究不同发酵温度对乳酸菌协同发酵玉米蛋白水解物的影响,结果如图4 所示。
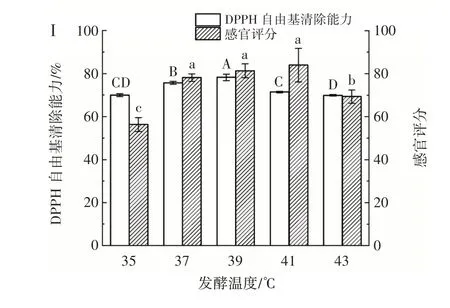
图4 发酵温度对乳酸菌发酵玉米蛋白水解物的影响Fig.4 Effect of fermentation temperature on CPH fermented by lactic acid bacteria
发酵温度偏高或偏低都会导致细胞生长代谢速率下降,影响发酵速度和产酸能力,不利于乳酸菌的生长[24]。由图4 可以看出,发酵温度对乳酸菌活菌数的影响较大,当发酵温度为35~39 ℃时,随着发酵温度的升高,乳酸菌活菌数显著上升,并在发酵温度为39 ℃时乳酸菌活菌数达到最大值,为9.8×108CFU/mL,继续升高发酵温度时,乳酸菌活菌数开始下降;总酸含量、DPPH 自由基清除能力与乳酸菌活菌数的变化规律相似。感官评分方面,除35 ℃和43 ℃时的感官评分较低外,发酵温度在37~41℃范围内的感官评分差异不显著(P>0.05)。发酵乳杆菌可在45 ℃以内的发酵温度下生长,其最适生长温度为41~42 ℃,而鼠李糖乳杆菌的最适生长温度为37 ℃,发酵温度过高时细胞内酶的催化能力会大大降低,甚至会导致其丧失催化活性,从而影响菌株的正常生长[25]。综合考虑,选取发酵温度为37、39、41 ℃进行后续响应面优化试验。
2.1.5 CPH 浓度对乳酸菌协同发酵玉米蛋白水解物的影响
在菌株YY-15 与YY-16 体积比为3∶1、接种量4%、果葡糖浆添加量5%、发酵温度39 ℃、发酵时间24 h 的发酵条件下,研究不同CPH 浓度对乳酸菌协同发酵玉米蛋白水解物的影响,结果如图5 所示。
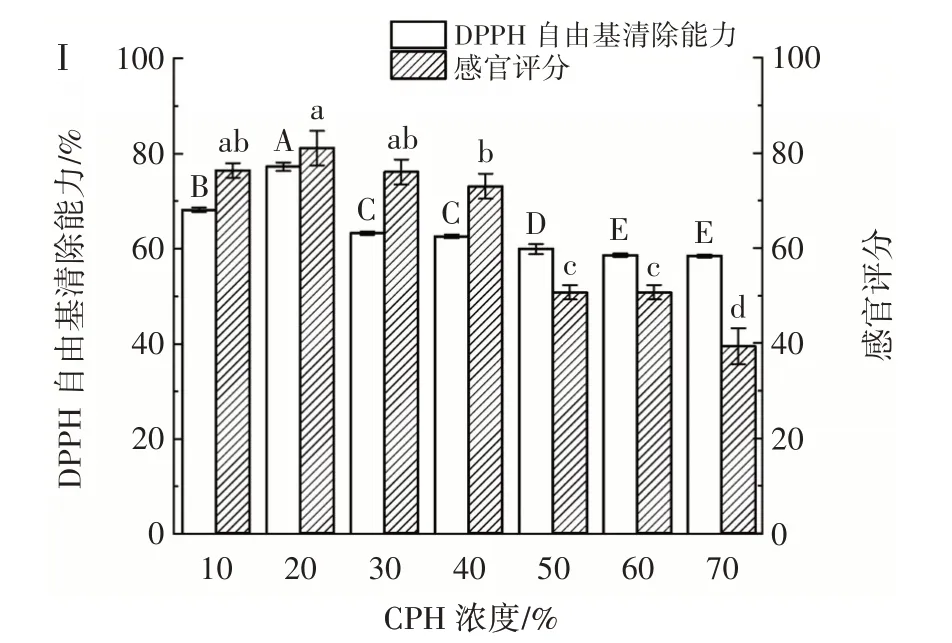
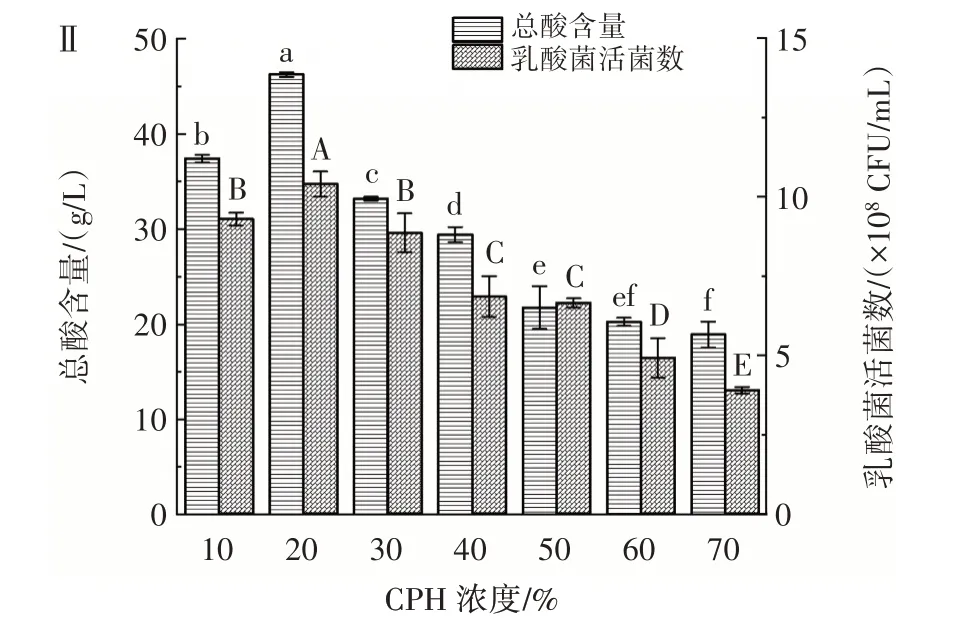
图5 CPH 浓度对乳酸菌发酵玉米蛋白水解物的影响Fig.5 Effect of CPH concentration on CPH fermented by lactic acid bacteria
在发酵体系中,底物的浓度直接影响乳酸菌的发酵能力。与大分子蛋白相比,CPH 是经酶解后得到的小分子肽类和氨基酸的混合物,可以直接被乳酸菌利用,提高发酵效率。由图5 可以看出,当CPH 浓度为20% 时,乳酸菌活菌数、感官评分、DPPH 自由基清除能力及总酸含量均达到最大值。且随着CPH 浓度逐渐增大,各指标均呈现下降趋势,这可能是由于过量的CPH 使菌体细胞内外渗透压升高,致使菌体破裂,从而使乳酸菌活菌数减少。同时,反应体系的黏度增大,整体流动性降低,CPH 与乳酸菌的接触面积变小,物质传递速率下降,降低代谢速率,也会导致DPPH 自由基清除能力、乳酸菌活菌数和总酸含量的下降。可见,适当浓度的CPH 具有促进乳酸菌生长的作用。目前,关于蛋白水解物促进乳酸菌生长可能的机制主要有:1)蛋白水解物作为氮源为益生菌的生长提供必需的氨基酸[26]。2)蛋白水解物可作为益生菌多肽转运系统的促进剂,即蛋白质分子进入益生菌细胞前,先由胞外蛋白酶将其水解成短的多肽片段,才能被发酵菌株吸收利用[27]。3)蛋白水解物可以提高发酵菌株在酸性环境中的耐受力,保持菌体数量[28]。但不同的蛋白水解物对菌株生长的促进作用不同,潘芬等[18]研究发现,豌豆蛋白水解物对鼠李糖乳杆菌、植物乳杆菌和嗜热链球菌未表现出促生长作用,而对保加利亚乳杆菌和双歧杆菌等有明显的促生长作用。玉米蛋白水解物不仅对发酵菌株有一定影响,对发酵产品的品质影响也较大。在较高的CPH 浓度下,发酵液颜色较深,极大地影响了产品的感官品质。综合考虑,选取CPH 浓度为10%、20%、30% 进行后续响应面优化试验。
2.1.6 发酵时间对乳酸菌协同发酵玉米蛋白水解物的影响
在菌株YY-15 与YY-16 体积比为3∶1、CPH 浓度20%、接种量4%、果葡糖浆添加量5%、发酵温度39 ℃的发酵条件下,研究发酵时间对乳酸菌发酵玉米蛋白水解物的影响,结果如图6 所示。

图6 发酵时间对乳酸菌发酵玉米蛋白水解物的影响Fig.6 Effect of fermentation time on CPH fermented by lactic acid bacteria
发酵时间可以反映乳酸菌发酵的完全程度。发酵时间过短,导致发酵不充分,产品的风味不足;发酵时间过长,乳酸菌大量死亡,乳酸不断累积,使产品口感刺激、品质下降[27]。由图6 可以看出,在发酵过程中,乳酸菌在CPH 中长势良好。乳酸菌活菌数在发酵48 h内,呈不断上升的趋势,总酸含量与乳酸菌活菌数表现出一致的变化趋势。而DPPH 自由基清除能力则在发酵24 h 时达到最大值,为75.73%,之后一直呈下降趋势。结合感官评分结果综合考虑,选择发酵时间24 h进行后续试验。
2.2 乳酸菌协同发酵玉米蛋白水解物响应面优化试验结果
在单因素试验结果的基础上,以DPPH 自由基清除能力(Y)为响应值,进行四因素三水平的响应面试验,结果见表3,方差分析见表4。
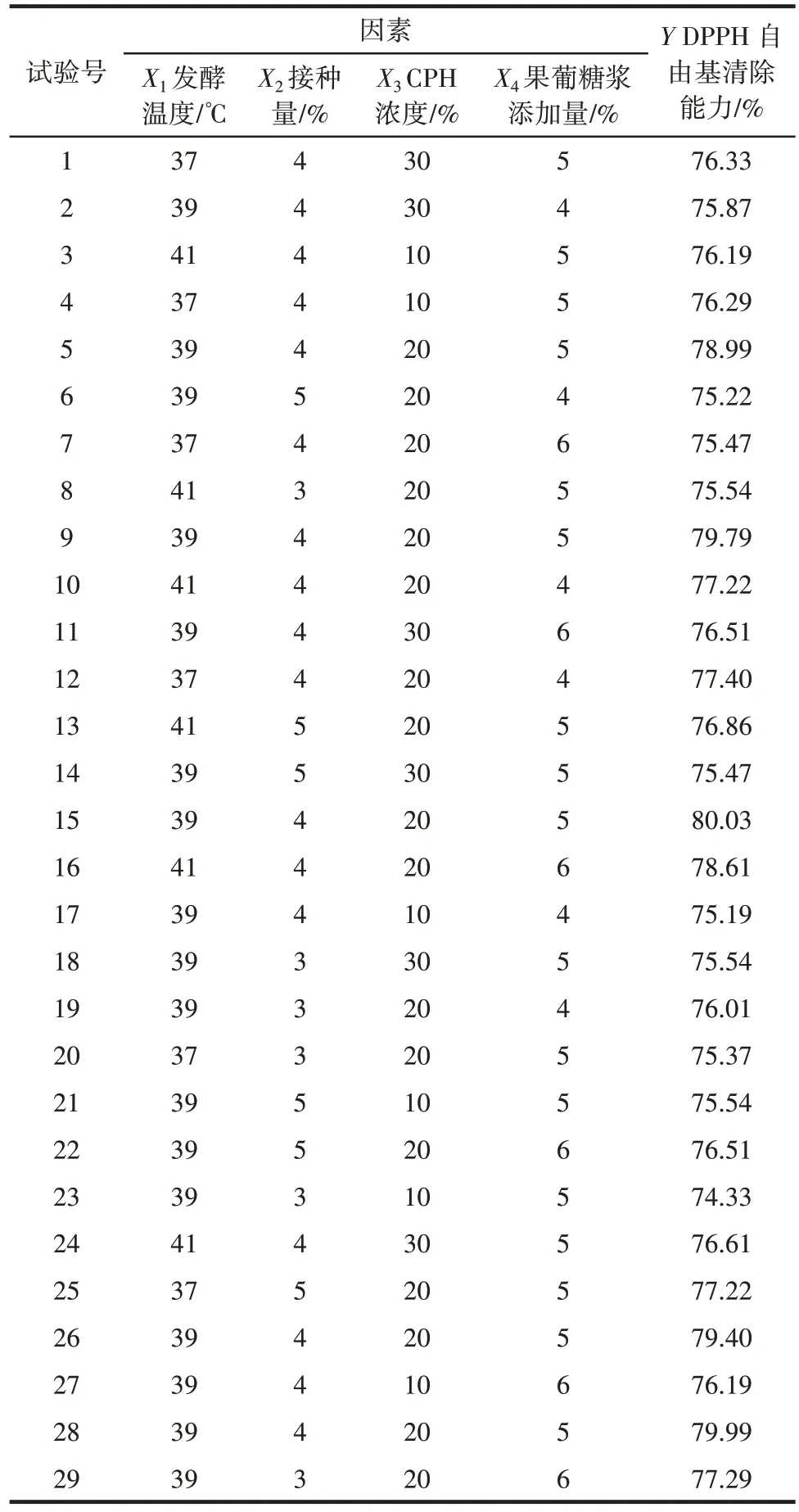
表3 乳酸菌发酵玉米蛋白水解物的响应面试验结果Table 3 Response surface test results of CPH fermented by lactic acid bacteria
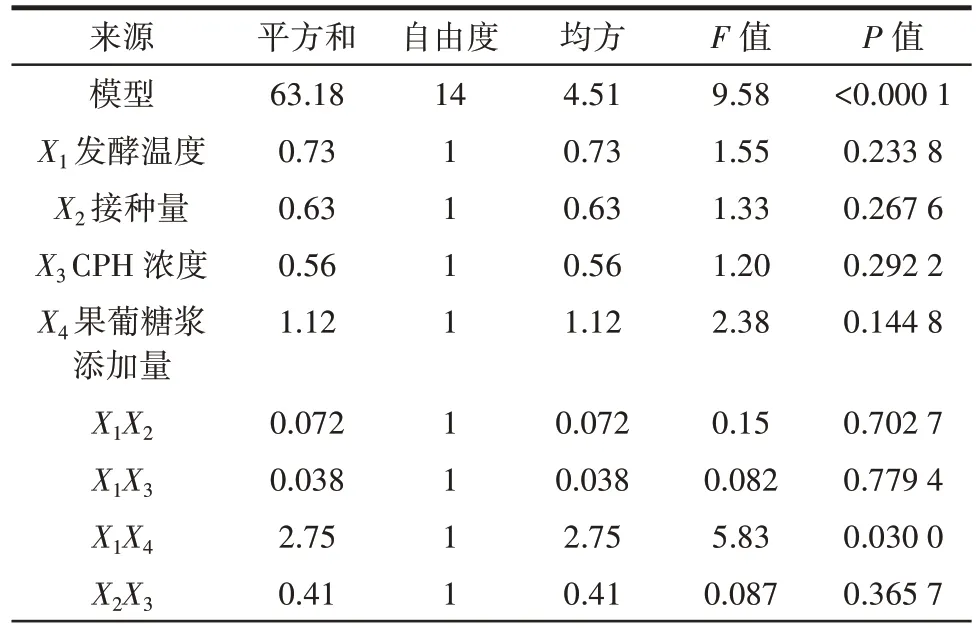
表4 回归响应面模型方差分析Table 4 Variance analysis for regression response surface model
应用Design-Expert version 8.0.6 软件对表3 数据进行多元回归拟合,得到的二次多项回归方程为Y=79.64+0.25X1+0.23X2+0.22X3+0.31X4-0.13X1X2+0.098X1X3+0.83X1X4-0.32X2X3-2.5×105X2X4-0.089X3X4-1.13X12-2.16X22-2.26X32-1.34X42。
由表4 可以看出,该方程的相关系数R2为0.905 5,说明模型拟合程度良好,可用于分析和预测。模型的F值为9.58,P<0.01,极显著;失拟项P=0.151 0>0.05,不显著;调整复相关系数R2Adj=0.810 9,说明该模型的回归方程能够反映实际情况,可以用回归方程对试验结果进行分析和预测。一次项X1(发酵温度)、X2(接种量)、X3(CPH 浓度)和X4(果葡糖浆添加量)影响不显著;二次项X12、X22、X32、X42均处于极显著水平,说明其对响应值的影响较大;交互项X1X4处于显著水平,说明发酵温度和果葡糖浆添加量之间存在交互作用,且对DPPH 自由基清除能力的影响较大。
经Design-Expert version 8.0.6 软件工艺优化,最优发酵工艺参数为发酵温度39.34 ℃、接种量4.04%、CPH浓度20.45%、果葡糖浆添加量5.16%,模型预测此条件下的DPPH 自由基清除能力可达79.69%。结合实际情况,将优化后的方案适当调整为发酵温度39.5 ℃、接种量4%、CPH 浓度20.50%、果葡糖浆添加量5%,在此条件下进行验证试验,3 次验证试验得到的DPPH自由基清除能力为80.89%,总酸含量为55.65 g/L,乳酸菌活菌数为2.66×109CFU/mL,感官评分为89.5,与预测值较为接近,说明模型预测准确度较高,利用响应面分析优化乳酸菌发酵工艺是可行的。
2.3 乳酸菌协同发酵玉米蛋白水解物对氨基酸种类及其含量的影响
氨基酸种类及其含量与成品的风味、营养和感官品质相关。乳酸菌协同发酵玉米蛋白水解物发酵前后的氨基酸含量结果如表5 所示。

表5 乳酸菌发酵玉米蛋白水解物的氨基酸含量Table 5 Amino acid content of CPH fermented by lactic acid bacteria
由表5 可以看出,乳酸菌协同发酵玉米蛋白水解物发酵前后均检测到16 种氨基酸,其中发酵前的总氨基酸含量为76.48 g/100 g,发酵后的总氨基酸含量为58.00 g/100 g,经乳酸菌发酵后总氨基酸含量下降了24.16%。大部分乳酸菌具有多种氨基酸营养缺陷性,在发酵过程中,乳酸菌分泌的胞外蛋白酶会水解原料中的蛋白质和多肽,产生氨基酸,满足乳酸菌的生长代谢,保障发酵的顺利进行[28]。苏能能等[29]利用植物乳杆菌发酵桑葚浆,其游离氨基酸总量下降了78.30%。但双歧杆菌发酵的果汁中,与发酵前相比,各游离氨基酸含量均有提升[30],可见游离氨基酸的代谢规律与菌种有着密切的关系。总氨基酸含量的减少还与挥发性成分有关。氨基酸可进一步通过转氨、脱羧、裂解等转化为醛类、醇类等风味物质[31]。根据乳酸菌的代谢作用,氨基酸可以形成发酵产品的风味前体物质,从而赋予发酵液特殊的发酵香味。李汴生等[32]研究发现,5 种果蔬汁经发酵后游离氨基酸总量减少,挥发性风味物质种类及醇酯类物质含量增加,说明在发酵过程中发生了氨基酸降解,这也是产生风味物质的重要途径。
2.4 体外抗氧化能力结果分析
氧化作用是自然界普遍发生的化学反应,在生物体中起着重要作用。生命活动的氧化代谢过程伴随着自由基的产生,如羟自由基、超氧阴离子自由基等。虽然人体有抗氧化防御系统,但这些系统并不能完全有效地抵御或修复氧化损伤,如果不及时清除自由基,则会对机体造成伤害,引发疾病[33]。因此,具有高抗氧化活性的食品受到人们的高度重视,体外抗氧化能力的测定已成为评价功能食品的重要指标之一。乳酸菌发酵玉米蛋白水解物的体外抗氧化活性见表6。
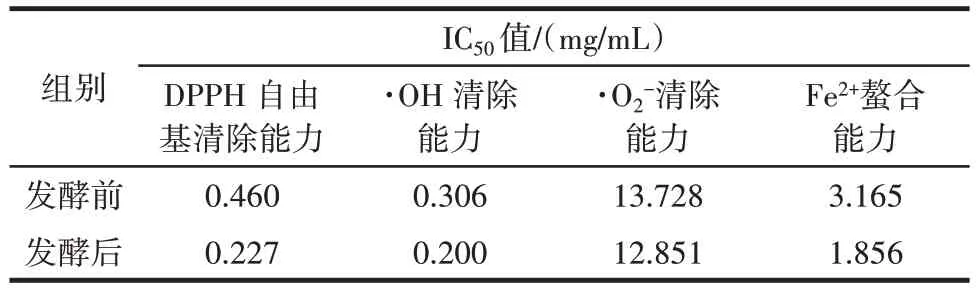
表6 乳酸菌发酵玉米蛋白水解物的体外抗氧化活性Table 6 Antioxidant activity of CPH fermented by lactic acid bacteria in vitro
如表6 所示,乳酸菌发酵玉米蛋白水解物发酵前后均能够有效清除DPPH 自由基、·OH、·O2-和提高Fe2+螯合能力。发酵前玉米蛋白水解物的DPPH 自由基清除能力、·OH 清除能力、·O2-清除能力、Fe2+螯合能力的IC50值分别为0.460、0.306、13.728、3.165 mg/mL;发酵后的DPPH 自由基清除能力、·OH 清除能力、·O2-清除能力、Fe2+螯合能力的IC50值分别为0.227、0.200、12.851、1.856 mg/mL。 与发酵前相比,分别提高了50.65%、34.64%、6.41%、41.36%,说明玉米蛋白水解物经过乳酸菌发酵相较于发酵前具有更好的抗氧化活性。
崔宁等[34]研究表明,玉米蛋白水解物是良好的供氢体,也是Fe2+螯合剂,能通过抑制芬顿(Fenton)反应而减少羟基的生成,提高对自由基的清除能力,从而消除自由基对机体造成的氧化损伤。乳酸菌在细胞呼吸过程和生存环境中会产生过多的活性氧,而乳酸菌抵抗氧胁迫的能力较弱。过量的活性氧和自由基会攻击蛋白质、脂肪和核酸,从而加速微生物的衰老和死亡[35]。玉米蛋白水解物具有较强的抗氧化能力和自由基清除能力,可以帮助乳酸菌在发酵过程中抵抗氧胁迫,为其提供良好的生长环境,结果表明,玉米蛋白水解物有利于乳酸菌的生长代谢。
乳酸菌通过螯合Fe2+来阻止脂质过氧化生成·OH,从而降低脂质化合物氧化的速度。Li 等[36]对瑞士乳杆菌的胞外多糖探究,发现其表现出较强的Fe2+螯合能力,IC50值可达1.45 mg/mL。乳酸菌发酵玉米蛋白水解物具有良好的金属螯合能力,可以减少·OH 的产生,抑制过氧化物的产生。同时,乳酸菌发酵玉米蛋白水解物经过发酵后暴露出能提供电子的氨基酸和小肽,这些小分子化合物更容易与自由基结合,随着具有抗氧化活性的小分子肽浓度的增加,与自由基结合的机会变大,因此乳酸菌发酵玉米蛋白水解物对自由基的清除能力逐渐提高。乳酸菌在发酵过程中会产生超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽(glutathione,GSH)来清除·OH 和H2O2,而SOD 能直接降低活性氧自由基的毒性,并阻止活性氧自由基向·OH转变[37]。刘洋等[38]对发酵乳杆菌、乳酸乳球菌、嗜酸乳杆菌和瑞士乳杆菌4 株乳酸菌的体外抗氧化能力测定发现,乳酸菌清除·OH 的活性物质主要存在于菌体细胞表面以及代谢产物中而非胞内。除此之外,乳酸菌可以分泌阿魏酸酯酶(ferulic acid esterase,FAE),它能够促进植物细胞壁中阿魏酸(ferulic acid,FA)的生成,FA 是一种强抗氧化剂[39]。总之,乳酸菌发酵玉米蛋白水解物抗氧化能力提升的原因是多种抗氧化物质的综合作用。
3 结论
本研究利用鼠李糖乳杆菌和发酵乳杆菌协同发酵玉米蛋白水解物,通过单因素和响应面试验优化其发酵工艺,得到最佳发酵工艺参数为YY-15∶YY-16=3∶1(体积比),CPH 浓度20.50%,接种量4%,果葡糖浆添加量5%,发酵温度39.5 ℃,发酵时间24 h,在此条件下,乳酸菌发酵玉米蛋白水解物的DPPH 自由基清除能力为80.89%,总酸含量为55.65 g/L,乳酸菌活菌数为2.66×109CFU/mL,感官评分为89.5。在发酵过程中,玉米蛋白水解物能为乳酸菌提供低氧胁迫环境,有利于乳酸菌的生长。并且鼠李糖乳杆菌和发酵乳杆菌混合发酵可以相互促进,菌体增殖效果优于单一菌株发酵。乳酸菌发酵可明显提升玉米蛋白水解物的抗氧化能力,并可以促进氨基酸的转化,降低苦味氨基酸的含量,增强了产品的功能性和品质。

