植物乳植杆菌CCFM8661 对小鼠肠道菌群及肠道屏障的影响
唐宏伟,刘铭洋,史晓丹,李柏良
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150000)
益生菌作为一种活的微生物具有诸多益生特性,当宿主摄入足够数量的益生菌时,益生菌能够产生诸多正向的益处[1]。乳酸菌(lactobacillus,LAB)是可发酵碳水化合物中产生大量乳酸的一种细菌的统称,在自然界中极为普遍。乳酸菌是一种安全的革兰氏阳性微生物,广泛应用于各类发酵食品中[2]。除此以外,乳酸菌也是人体肠道菌群的重要组成部分,具有多种生理功能,包括免疫细胞平衡、代谢产物调节和肠道菌群;乳杆菌属作为乳酸菌的一大类,大多数菌株都具有益生作用[3-4],其中最具有代表性的乳杆菌为植物乳植杆菌(Lactobacillusplantarum)。
植物乳植杆菌作为优势乳酸菌之一,具有提高机体抗氧化活性、抑制有害菌群生长等多种优良特性,植物乳植杆菌在自然界中分布广泛,常存在于动物肠道内调节微生态平衡,具有增强非特异性免疫功能、预防肠道疾病的作用,同时还可以提供营养因子、促进营养物在肠道内的消化吸收、促进动物的生长发育和提高饲料转化率。植物乳植杆菌CCFM8661 具有缓解肠细胞铅中毒、有助于排出农药残留等功效[5-6],在前期的动物实验和临床实验中已经被证实具有良好的益生作用,例如调节肠道微生物群、抗氧化特性、缓解重金属毒性、清除幽门螺旋杆菌等[4,7]。
本实验以新型益生菌菌株植物乳植杆菌CCFM8661为研究对象,研究其对机体的肠道调节作用以及可能的机制,实验过程全程记录并监测小鼠的体质量变化,通过组织病理学分析实验、肠道通透性实验及肠道菌群增殖实验对植物乳植杆菌CCFM8661 菌株的肠道健康调节效果进行探究,以期为后续的深入研究与应用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
选取48 只BALB/c 小鼠(体质量均为22 g 左右)饲养于动物房中,温度设置为22 ℃,湿度10%~60%,12 h 明暗交替照明,由小鼠标准饲料喂养,适应性喂养1 周,自由饮水。喂养1 周后,将小鼠随机分成4 组,每组12 只,进入正式实验。
植物乳植杆菌CCFM8661 菌粉:微康益生菌(苏州)股份有限公司;DEPC 水(diethyl pyrocarbonate 水)、苏木素伊红染液:生工生物工程(上海)股份有限公司;伊红美蓝琼脂、双歧杆菌(bifidobacterium,BBL)琼脂、乳酸杆菌选择性(lactobacillus selective,LBS)琼脂、产气荚膜梭菌(tryptose sulfite cycloserine,TSC)琼脂:青岛海博生物技术有限公司;D-乳酸检测试剂盒:美国MP 公司;反转录试剂盒、实时荧光定量多聚核苷酸链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒:南京诺唯赞生物科技股份有限公司;脂多糖(lipopolysaccharide,LPS)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒:南京碧云天生物技术有限公司;乙酸标准品、丙酸标准品、丁酸标准品(均≥99%):美国Sigma-Aldrich公司;乙酸乙酯(≥99.5%):美国merck 公司;巴豆酸偏磷酸:美国Aladdin 公司。
1.1.2 仪器与设备
MLS-3751L-PC 高压蒸汽灭菌器、MDF-382E-80 ℃冰箱:日本Panasonic 公司;Cubis®II 实验室天平:德国Sartorius 公司;SORVALL ST8/8R 低温离心机:美国TOMOS 公司;Orbitrap™Exactive™气相色谱质谱联用仪:赛默飞世尔科技公司;SMATBCD Synergy MX 全自动酶标仪:美国Bio Tek 公司;Tnano-800 核酸蛋白分析仪:上海测博生物科技发展中心。
1.2 实验方法
1.2.1 动物分组及给药
小鼠被随机分为4 组:阴性对照(normal control,NC)组、植物乳植杆菌CCFM8661 低剂量组(LP,1.6×106CFU/只)、植物乳植杆菌CCFM8661 中剂量组(MP,1.6×107CFU/只)、植物乳植杆菌CCFM8661 高剂量组(HP,1.6×108CFU/只)。其中阴性对照组小鼠灌胃等体积的生理盐水,受试样品给予时间为14 d。对于植物乳植杆菌CCFM8661 实验处理组,灌胃药品需要提前配制,分别取一定量的菌粉按照一定浓度溶解在生理盐水中。分组及给药见表1。
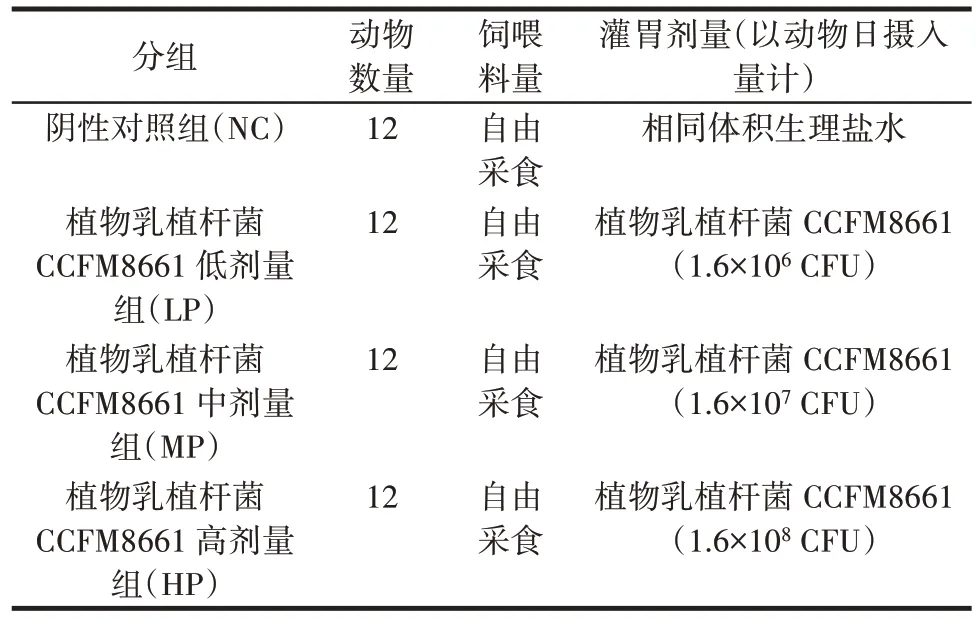
表1 动物分组及给药Table 1 Animal grouping and administration
1.2.2 靶标菌培养
收集各组小鼠给药前新鲜粪便于灭菌的塑料离心管中,称取并记录粪便质量,加生理盐水稀释,粪便与生理盐水配比为0.05 g/mL。稀释后将1.5 mL 离心管管封口,涡旋混匀7 min。将粪便混悬液按照10 倍梯度稀释10~104倍,接种于培养基中37 ℃培养,培养基种类及其培养条件见表2。
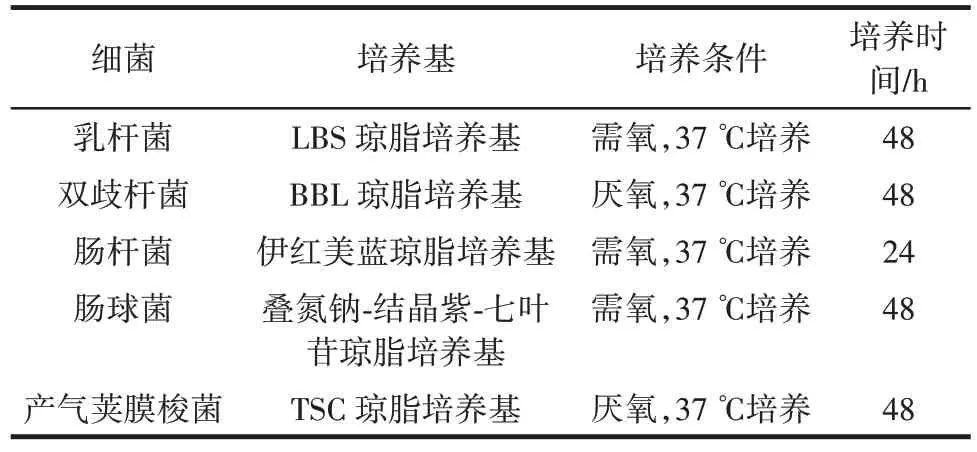
表2 细菌培养基种类及其培养条件Table 2 Types of bacterial medium and their culture conditions
1.2.3 样品收集
实验结束后使用电子天平记录各组小鼠体质量,将小鼠进行脱颈处理并于眼球处取血,收集血清。收集小鼠小肠组织存放于4% 多聚甲醛溶液中固定,等待染色;收集小鼠结肠组织并液氮速冻,用于基因表达量检测;收集小鼠盲肠内容物用于短链脂肪酸含量的检测;收集小鼠血清用于评估肠道通透性。
1.3 指标的测定
1.3.1 小鼠体质量测定
测量并记录动物初始体质量以及实验结束时的空腹体质量。
1.3.2 肠道靶标菌菌落计数
按照1.2.2 培养后,以菌落形态、革兰氏染色镜检、生化反应等生理生化指标鉴定计数菌落,计算出每克湿便中的菌落数,取对数后进行统计处理。最后一次给予受试样品后24 h,与实验前同样方式取直肠粪便,以同样的方法检测肠道菌群。观察双歧杆菌、乳杆菌、肠球菌、肠杆菌、产气荚膜梭菌含量的变化。
1.3.3 组织病理学观察
将结肠组织固定在10% 福尔马林盐水中24 h,然后包埋在石蜡中。切片(厚5 μm)后用苏木素伊红(hematoxylin-eosin,HE)染色观察肠道病理结构。
1.3.4 肠道屏障mRNA 表达的测定
取小鼠结肠组织,从肠道样品中提取RNA,利用核酸蛋白分析仪测定肠道屏障mRNA 的表达。样品中加入氯仿后培养5 min,4 ℃下8 000 r/min 离心20 min取沉淀。以无酶水为对照测定总RNA 浓度,样品的吸光值A260/A280控制在1.9~2.1 之间。以2 μg cDNA 为模板,按照qRT-PCR 检测试剂盒配制反应液,用实时荧光定量PCR 系统(ABI 7500)进行两步法PCR 扩增。根据目的基因的Ct 值和内参基因β-actin的Ct 值,按照2-ΔΔCt法计算样本中目的基因mRNA 的相对表达水平,通过检测肠道黏蛋白(MUC1 和MUC2)和紧密连接蛋白(ZO - 1、Occludin 和Claudin - 1)相关基因的mRNA 表达水平来评定肠道屏障。实时荧光定量PCR引物见表3。

表3 qRT-PCR 的引物Table 3 Primers of qRT-PCR
1.3.5 肠道通透性的测定
采集的血液在4 ℃、3 500 r/min 下离心10 min,取上清液用于小鼠D-乳酸和LPS 含量的检测,具体操作参照LPS 和D-乳酸检测试剂盒的说明书进行操作。
1.3.6 短链脂肪酸含量的测定
称量乙酸、丙酸、丁酸标准品,用乙酸乙酯配制成0.1、0.5、1.5、10.0、20.0、50.0 μg/mL 浓度梯度的标准溶液。
准确称取(0.80±0.01)g 盲肠内容物,加入乙酸乙酯配制成10% 悬浊液,取500 μL 悬浊液于1.5 mL 离心管中,并加入100 μL 巴豆酸偏磷酸溶液,-30 ℃冻结24 h,解冻后8 500 r/min 离心3 min(4 ℃)去除蛋白质、脂肪等杂质,加入等体积的乙酸乙酯进行提取并振荡混匀2 min,经11 000r/min 离心10 min 后,吸取上层有机相并加入终浓度为500 μmol/L 的4-甲基戊酸作为内标,混匀后移入进样瓶,用于气相色谱质谱联用(gas chromatography - mass spectrometry,GC - MS)仪检测。气相色谱条件:利用HP-FFAP 毛细管柱进行分离,检测器温度设定为250 ℃,进样量为1 μL。升温程序:起始温度60 ℃保持3 min,以10 ℃/min 升至200 ℃,再以30 ℃/min 升至225 ℃,保持3 min;载气为氮气,载气流速为1.0 mL/min。
1.4 数据处理
数据结果以平均值±标准差表示,用SPSS 软件进行方差分析、单因素方差分析,P<0.05 即判定为差异显著。采用GraphPad Prism 8.0 软件进行统计学分析,统计多组间比较数据并作图。
2 结果与分析
2.1 植物乳植杆菌CCFM8661 对小鼠体质量的影响
植物乳植杆菌CCFM8661 对小鼠体质量的影响见表4。

表4 植物乳植杆菌CCFM8661 对小鼠体质量的影响Table 4 Effects of Lactobacillus plantarum CCFM8661 on body weight of mice
由表4 可知,在正常菌群状态下,与阴性对照组相比,小鼠体质量随灌胃植物乳植杆菌CCFM8661 剂量的提升呈现显著增加的趋势(P<0.05),说明在健康状态下,随着时间的延长及益生菌的摄入,宿主的脾胃功能得到改善,进而出现进食量提高、体质量增加的情况[2]。
2.2 植物乳植杆菌CCFM8661 对小鼠肠道菌群的影响
通过为期14 d 的植物乳植杆菌CCFM8661 干预,小鼠肠道中双歧杆菌、乳杆菌、肠杆菌、肠球菌、产气荚膜梭菌的变化情况如图1 所示。
由图1 可知,粪便中双歧杆菌和乳杆菌的含量在3 种不同剂量的植物乳植杆菌CCFM8661 干预后均显著增加(P<0.05),而肠杆菌、肠球菌和产气荚膜梭菌的含量在干预前后无显著变化。结合《保健食品功能检验与评价方法(2022 版)》中“有助于调节肠道菌群检验方法”中阳性结果判定标准,证明植物乳植杆菌CCFM8661 具有调节小鼠肠道菌群的作用。刘伟贤等[3]的研究结果显示,干酪乳杆菌K56 具有调节肠道菌群的功能,能够显著提高小鼠肠道内益生菌含量,并降低条件致病菌含量,与本研究结果一致。综上,补充适当益生菌,可以通过促进肠道内有益菌(双歧杆菌和乳杆菌)的增加,抑制产气荚膜梭菌的增长,以达到调节肠道菌群的目的[1]。
2.3 组织病理学分析
对小鼠结肠组织进行HE 染色,并进行组织病理学切片观察,各组组织学改变见图2。

图2 小肠黏膜组织苏木素伊红(HE)染色结果Fig.2 Hematoxylin eosin(HE)staining results of small intestinal mucosal tissue
由图2 可知,NC 组结肠组织形态结构完整,结肠黏膜上皮完整,无炎症浸润。各喂养植物乳植杆菌CCFM8661(低、中、高)组小鼠肠组织HE 染色结果无明显改变,绒毛排列整齐紧密,粗细均匀,无明显差异。表明植物乳植杆菌CCFM8661 维持了正常肠道组织结构,并未对小鼠的结肠黏膜组织造成破坏。
2.4 肠道屏障结果分析
植物乳植杆菌CCFM8661 处理对小鼠结肠中ZO-1、Occludin、Claudin-1、MUC1、MUC2 mRNA 表达量的影响如表5 所示。
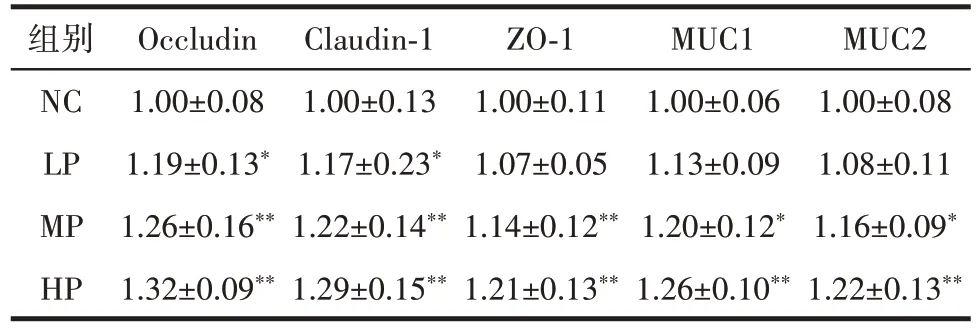
表5 植物乳植杆菌CCFM8661 处理对小鼠结肠中ZO-1、Occludin、Claudin-1、MUC1、MUC2 mRNA 表达量的影响Table 5 Effect of treatment with Lactobacillus plantarum CCFM8661 on mRNA expression of ZO-1,Occludin,Occludin-1,MUC1,and MUC2 in mouse colon
由表5 可知,与阴性对照组相比,植物乳植杆菌CCFM8661 灌胃组小鼠结肠Occludin、ZO-1、MUC1、MUC2 与Claudin-1 mRNA 的表达量均明显增加。随着植物乳植杆菌CCFM8661 灌胃剂量的增加,mRNA的表达量也随之增加。表明植物乳植杆菌CCFM8661能够通过上调肠上皮细胞间紧密连接蛋白和肠道黏蛋白相关mRNA 的表达量,达到保护肠道的作用[8]。
2.5 肠道通透性结果分析
在分子水平上,LPS 和D-乳酸是检测肠屏障损伤的敏感指标[9],本研究采用ELISA 试剂盒检测小鼠血清中LPS 和D-乳酸的含量,研究植物乳植杆菌CCFM8661 对小鼠肠道屏障通透性的影响,结果如图3所示。

图3 肠道通透性指标LPS 和D-乳酸的测定Fig.3 Determination of intestinal permeability indexes of LPS and D-lactic acid
由图3 可知,与阴性对照组相比,植物乳植杆菌CCFM8661 各处理组LPS 和D-乳酸的含量均极显著降低(P<0.01),这表明植物乳植杆菌CCFM8661 会导致肠道屏障通透性的降低[10]。但低、中、高剂量组的LPS 和D-乳酸含量均无明显差异。以上结果表明,植物乳植杆菌CCFM8661 具有良好的降低肠道通透性的效果。
2.6 植物乳植杆菌CCFM8661 对小鼠结肠内短链脂肪酸含量的影响
由于肠道菌群在调节代谢、机体免疫反应及维持肠道屏障等方面的作用,服用益生菌调节肠道菌群目前被认为是炎症性肠病(inflammatory bowel disease,IBD)治疗及延缓恶化方面的新方法。短链脂肪酸(short-chain fatty acids,SCFAs)除具有调节机体电解质平衡[11]、刺激胃肠激素分泌、调节肠道动力等功能外,还可以参与宿主免疫反应过程。SCFAs 是肠道中最丰富的菌群代谢物,具有1~6 个碳原子的脂肪族尾部的羧酸,包括甲酸、乙酸、丙酸、丁酸、戊酸和己酸,其中乙酸、丙酸和丁酸最丰富[12]。因此,本研究测定乙酸、丙酸和丁酸含量,探究植物乳植杆菌CCFM8661 对小鼠结肠内短链脂肪酸含量的影响,结果如图4 所示。
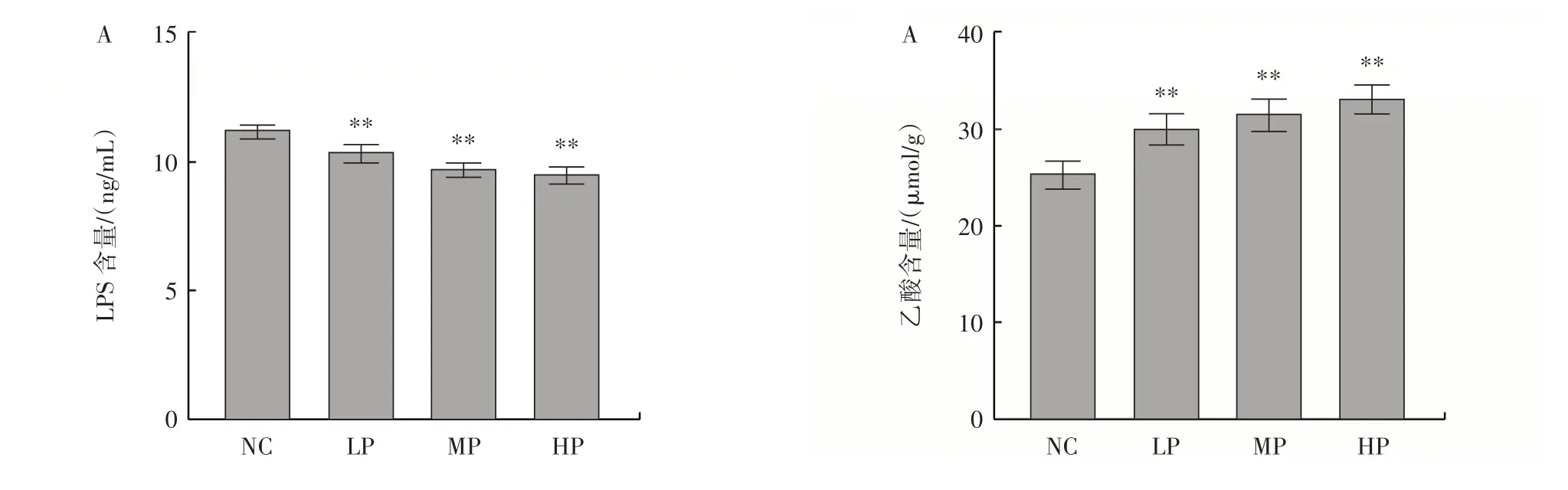
图4 植物乳植杆菌CCFM8661 对小鼠结肠内短链脂肪酸含量的影响Fig.4 Effect of Lactobacillus plantarum CCFM8661 on content of short-chain fatty acids in mouse colon
由图4 可知,与阴性对照组相比,植物乳植杆菌CCFM8661 的干预可以明显增加乙酸、丙酸和丁酸的含量。结果表明,植物乳植杆菌CCFM8661 能够调控肠道菌群代谢物,这与其对肠道菌群的调控密不可分。
3 讨论与结论
本研究欲证实植物乳植杆菌CCFM8661 是否具有调节肠道菌群、改善肠道环境的功效,使用BALB/c 小鼠来评价植物乳植杆菌CCFM8661 对肠道菌群和肠屏障的影响。大量研究表明,植物乳植杆菌能够通过调节肠道菌群来缓解便秘[13-14],人体肠道菌群中双歧杆菌、乳杆菌是有益菌的代表,通过降低肠道内环境的pH 值、抑制有害菌增殖而发挥作用[15]。产气荚膜梭菌是致病菌,能分解肌肉和结缔组织中的糖,产生大量气体,导致组织严重气肿,进而影响血液供应,引起气性坏疽[16]。肠杆菌在相当长的一段时间内被认为是非致病菌,直到20 世纪中叶,研究人员才发现一些特殊的肠杆菌对人和动物有致病性,会引起严重腹泻和败血症[17]。因此欲调节肠道菌群并避免其失衡,本实验选用这5 种代表菌作为评价肠道菌群变化的指标。
结果显示,植物乳植杆菌CCFM8661 的摄入能显著改变宿主的肠道菌群,主要是能显著提高宿主肠道内双歧杆菌和乳杆菌的含量(P<0.01),而对于肠杆菌、肠球菌含量的影响较小,对于产气荚膜梭菌则会降低其含量。阴性对照组干预前后,益生菌(双歧杆菌、乳杆菌)及产气荚膜梭菌含量均增加,但是变化幅度远不及低、中、高剂量组,这可能与动物周龄的增加、肠道容量的提高有关[18]。结合《保健食品功能检验与评价方法(2022 版)》中的阳性结果判定标准,判定样品调节肠道菌群功能动物实验的结果呈阳性,认为植物乳植杆菌CCFM8661 具有调节肠道菌群功能。
肠道屏障已成为治疗和预防疾病的重要关注靶标[19]。大量基于动物模型的研究结果表明,植物乳植杆菌可以显著增强肠道屏障[20-21]。本研究发现植物乳植杆菌CCFM8661 可以明显提高小鼠结肠内Claudin-1、Occludin、ZO-1、MUC1 和MUC2 的mRNA 表达水平,结果表明植物乳植杆菌CCFM8661 可以通过改变紧密连接蛋白和肠道黏蛋白的基因表达量间接改善肠道黏膜屏障的强度。 这与之前的研究,植物乳植杆菌KLDS1.0386 可以上调小鼠肠道上皮中Claudin-1、ZO-1、MUC1 和MUC2 的表达,降低结肠通透性的结果一致[22],证明了植物乳植杆菌CCFM8661 的添加能够改变小鼠肠道通透性,提高肠道屏障的强度,与阴性对照组相比,低、中、高剂量组肠道中LPS 和D-乳酸含量分别下降了7.70%、13.44%、14.94% 和22.89%、27.36%、30.24%(P<0.01);而在本实验中以高剂量干预小鼠为例,肠道菌群虽发生变化,组织切片观察实验却未见明显效果,因此需进一步验证。
短链脂肪酸(SCFAs)参与人体代谢,在肝脏、骨骼肌、脂肪组织和胰岛等不同器官中具有重要功能,对人体健康起着重要的作用[23],浓度过低或过高都会对健康产生不利影响。SCFAs 含量受多种因素影响,其中最重要的原因是内源发酵[24]。细菌生长过程中将难以消化的碳水化合物(膳食纤维)通过一系列代谢反应分解,以满足自身生长的能量需要,产生的SCFAs 是主要的最终产物[25],因此维持肠道菌群平衡是调节SCFAs 含量的重要因素之一。本研究结果证明,植物乳植杆菌CCFM8661 可以增加肠道内短链脂肪酸的含量,其中低、中、高剂量组肠道中的乙酸、丙酸和丁酸含量分别升高了18.25%、24.87%、30.61%,3.73%、6.75%、8.34% 和2.11%、4.01%、7.86%。这与张晨玥等[26]的结果一致。
综上,植物乳杆菌CCFM8661 促进了肠道中双歧杆菌和乳酸杆菌生长,抑制了产气荚膜梭菌的增殖。喂食植物乳杆菌CCFM8661 能显著改变小鼠肠道的通透性,降低肠道中LPS 和D-乳酸的含量,增强肠道屏障,增加肠道中短链脂肪酸(乙酸、丙酸和丁酸)的含量。总之后期将针对植物乳植杆菌CCFM8661 的功效及安全性进行系统研究,为其在食品中更广泛的应用提供参考。

