苍耳子鼻炎滴丸联合常规治疗儿童慢性鼻窦炎的临床研究
于博,杨屈扬,芦斐,尹光通
慢性鼻窦炎(chornic sinusitis,CRS)是耳鼻咽喉科的常见疾病,多由急性鼻窦炎发展而来[1]。CRS严重者可引起一系列并发症,如加重呼吸道感染症状,甚至会损伤颅脑、眼睛及肺等重要器官,严重影响患者的正常生活[2]。CRS在鼻科相关疾病中的占比较高,Shi等[3]随机从我国7个重点城市进行了横断面调查,结果显示CRS患病率约为8%,且呈逐年上升趋势。CRS的发病机制较为复杂,一般认为与鼻窦部位感染等因素导致的变态反应、免疫失调有关[4]。儿童处于生长发育关键期,机体免疫尚未成熟,更易受到外界病原菌侵袭,是CRS的多发人群[5]。王丽等[6]以头孢类抗菌药物(头孢泊肟酯干混悬剂)治疗儿童急性化脓性鼻窦炎,可有效改善患儿鼻腔情况评分、生活质量评分;邓文娴等[7]通过中医辨证施治联合糖皮质激素(糠酸莫米松鼻喷雾剂)治疗CRS,结果提示可有效改善患者局部症状,且临床疗效较好。上述头孢泊肟酯干混悬剂、糠酸莫米松鼻喷雾剂是治疗CRS的一线首选治疗药物。抗菌药物和糖皮质激素在一定程度上可缓解患儿的临床症状,但存在难以根治疾病、病情易反复的特点,不宜作为长期药物使用。从中医学角度,鼻窦炎又称“鼻渊”“脑漏”,是由于胆腑郁热、肺脾气虚、卫表不固、气血滞瘀于鼻腔所致,可采用益气固表、通窍止痛的方法治疗[8]。中药具有多组分、多靶点的起效机制,可起到协同治疗的效果[9]。苍耳子鼻炎滴丸源自《济生方》中苍耳子散,由苍耳子、辛夷、黄芩和人工冰片等组成,主治鼻渊、鼻流浊涕不止[10],可散风、疏通孔道,改善患者的临床症状。目前,尚无将苍耳子鼻炎滴丸与头孢泊肟酯干混悬剂、糠酸莫米松鼻喷雾剂联合用于治疗儿童CRS的临床研究。基于此,本研究通过观察88例CRS患儿接受头孢泊肟酯干混悬剂和糠酸莫米松鼻喷雾剂临床常规治疗,及联用苍耳子鼻炎滴丸后患儿临床症状的改善程度、生化免疫指标的变化以及临床疗效分析,以期为临床治疗儿童CRS提供参考。现报道如下。
1 资料与方法
1.1 一般资料
选取2021年4月~2022年6月期间于该院耳鼻咽喉科门诊就诊的88例CRS患儿作为研究对象,采用随机数字表法分为对照组(n=43)与观察组(n=45)。对照组:男性24例,女性19例;年龄1~13岁,平均年龄(4.23±2.76)岁。观察组:男性30例,女性15例;年龄1~12岁,平均年龄(5.23±2.82)岁。两组患儿一般资料比较无统计学差异(P>0.05),具有可比性。本研究经医院伦理委员会批准,所有患儿监护人知情并签署知情同意书。
纳入标准:①符合《中国慢性鼻窦炎诊断和治疗指南》(2018)[11]中CRS临床诊断标准者。②年龄1~13岁者。③对本研究所用药物均无过敏反应者。④近1个月未接受任何激素与免疫治疗者。⑤无严重传染病或恶性肿瘤者。
排除标准:①合并其他耳鼻咽喉科或呼吸系统疾病以及鼻部器质性病变者。②治疗期间参与其他临床研究或存在合并用药情况者。③患有严重精神疾病、意识障碍及依从性差者。④对本研究过程中使用药物过敏者。
脱落与剔除标准:未完成临床试验者以及违反用药方案者。本研究初始纳入病例为45例/组,因对照组在治疗过程中未完成持续追踪随访,导致临床数据缺失,因此参与最终结果分析的例数分别为对照组43例,观察组45例。
1.2 治疗方法
对照组接受常规治疗:服用头孢泊肟酯干混悬剂[四川合信药业有限责任公司,国药准字H20163272,规格50mg(按C15H17N5O6S2计)],1~3岁患儿50mg/次,bid;4~9岁患儿75mg/次,bid;10~13岁患儿90mg/次,bid,疗程为2周;同时使用糠酸莫米松鼻喷雾剂[浙江仙琚制药股份有限公司,国药准字H20113481,规格每瓶60揿,每揿含糠酸莫米松50μg,药液浓度为0.05%(g/g)],1~2岁患儿每侧鼻孔半揿/次,qd;3~11岁患儿每侧鼻孔1揿/次,qd;12~13岁患儿每侧鼻孔1揿半/次,qd,疗程为12周。观察组在对照组基础上加用苍耳子鼻炎滴丸(四川字库山制药有限公司,国药准字Z20090560,规格:每丸重43mg),1~4岁患儿0.4g/次,tid;5~7岁患儿0.6g/次,tid;8~13岁患儿1g/次,tid,连续治疗12周。治疗期间,通过复诊或电话随访更新评估患儿的疾病状态,并根据患儿实际情况调整用药。
1.3 观察指标
(1)基线资料:比较两组患儿发病病程、第1次发病距今时间、鼻炎史、过敏史、被动吸烟史等基线资料情况。
(2)临床观察指标主观评价:分别于入院后第1天及治疗后第1天采用视觉模拟评分法(visual analogue scale,VAS)[12]、鼻炎症状总评分(total nasal symptom score,TNSS)[13]、鼻炎伴随症状总评分(total non-nasal symptom score,TNNSS)[13]对患儿的临床症状进行评分。采用VAS对患儿临床症状(包括头痛、流涕、嗅觉减退、鼻塞等)进行评估,总分10分,在0~10cm的标尺上画线,标出症状相对应的分值。评分越高,表示患儿的生活质量越差;若VAS总分>5分,表示患儿的生活质量受到影响[14]。TNSS[13]包括喷嚏、流涕、鼻塞、鼻痒4项,每项0~3分。①喷嚏项:一次连续打喷嚏10个以上为3分,6~10个为2分,3~5个为1分。②流涕项:每日擤鼻次数10次以上为3分,6~9次为2分,5次及以下为1分。③鼻塞项:几乎全天用口呼吸为3分,间歇用口呼吸为2分,感觉有意识吸气为1分。④鼻痒项:难以忍受的蚁行感为3分,可以忍受的蚁行感为2分,间断蚁行感为1分;无上述症状均为0分。评分越高,表示患儿的症状越严重。TNNSS[13]包括鼻涕从咽部流过、鼻或眼部瘙痒、头晕头痛、流泪、鼻或口腔上颌疼痛5项,每项0~4分,根据临床医生对患儿的主观评价进行评分,评分越高,表示患儿的症状越严重。临床观察指标的主观评价由本研究团队6位专业医生进行独立评价,其评分取6位医生评分的平均值。
(3)呼吸功能评价:分别于入院后第1天及治疗后第1天使用SpirolabⅢ肺功能测定仪[米尔思维(北京)医疗科技有限公司]检测两组患儿第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1/FVC、呼气流量峰值(peak expiratory flow,PEF)及最大呼气中期流量(maximal mid-expiratory flow,MMEF)。
(4)生化指标评价:分别于入院后第1天及治疗后第1天采集患儿空腹肘静脉血4ml,平均分为2管。一管使用BC-7500 CRP全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)检测患儿白细胞(white blood cell,WBC)、淋巴细胞(lymphocytes,LYM)、嗜酸性粒细胞(eosinophils,EOS)水平,试剂盒购自迈瑞南京生物技术有限公司。另一管使用Avanti J-26S XP高速冷冻离心机[贝克曼库尔特(美国)有限公司,r=10cm],3000r/min(4℃)离心10min后,取血清。使用日立7600-020全自动生化分析仪(日本日立公司)检测两组患儿血清免疫球蛋白E(immunoglobulin E,IgE)水平,试剂盒购自中元汇吉生物技术股份有限公司。
(5)临床疗效情况:采用TNSS疗效指标评估患儿临床疗效。TNSS疗效指标(%)=(治疗前TNSS-治疗后TNSS)/治疗前TNSS×100%。①治愈:TNSS疗效指标≥90%。②显效:TNSS疗效指标≥60%。③有效:25%≤TNSS疗效指标<60%。④无效:TNSS疗效指标<25%。临床治疗总有效率(%)=(治愈+显效+有效)病例数/每组总病例数×100%。
(6)不良反应发生情况:观察并记录两组患儿治疗期间不良反应的发生情况,如恶心呕吐、食欲减低、便秘、头晕头疼、鼻腔干燥、皮疹等,并记录治疗前后两组患儿心电图、血、尿、便常规及肝肾功能等。
1.4 统计学方法
采用SPSS 20.0软件进行数据统计学分析。计量资料以±s表示,采用p-p图法进行正态性检验,符合正态分布、方差齐的多组样本采用单因素方差分析,组间样本两两比较采用t检验;计数资料以n(%)表示,采用χ2检验。P<0.05为具有统计学差异。
2 结果
2.1 两组患儿基线资料比较
本研究共纳入88例患儿,两组患儿发病病程、第1次发病距今时间、鼻炎史、过敏史、被动吸烟史等基线资料比较均无统计学差异(P>0.05),具有可比性(表1)。
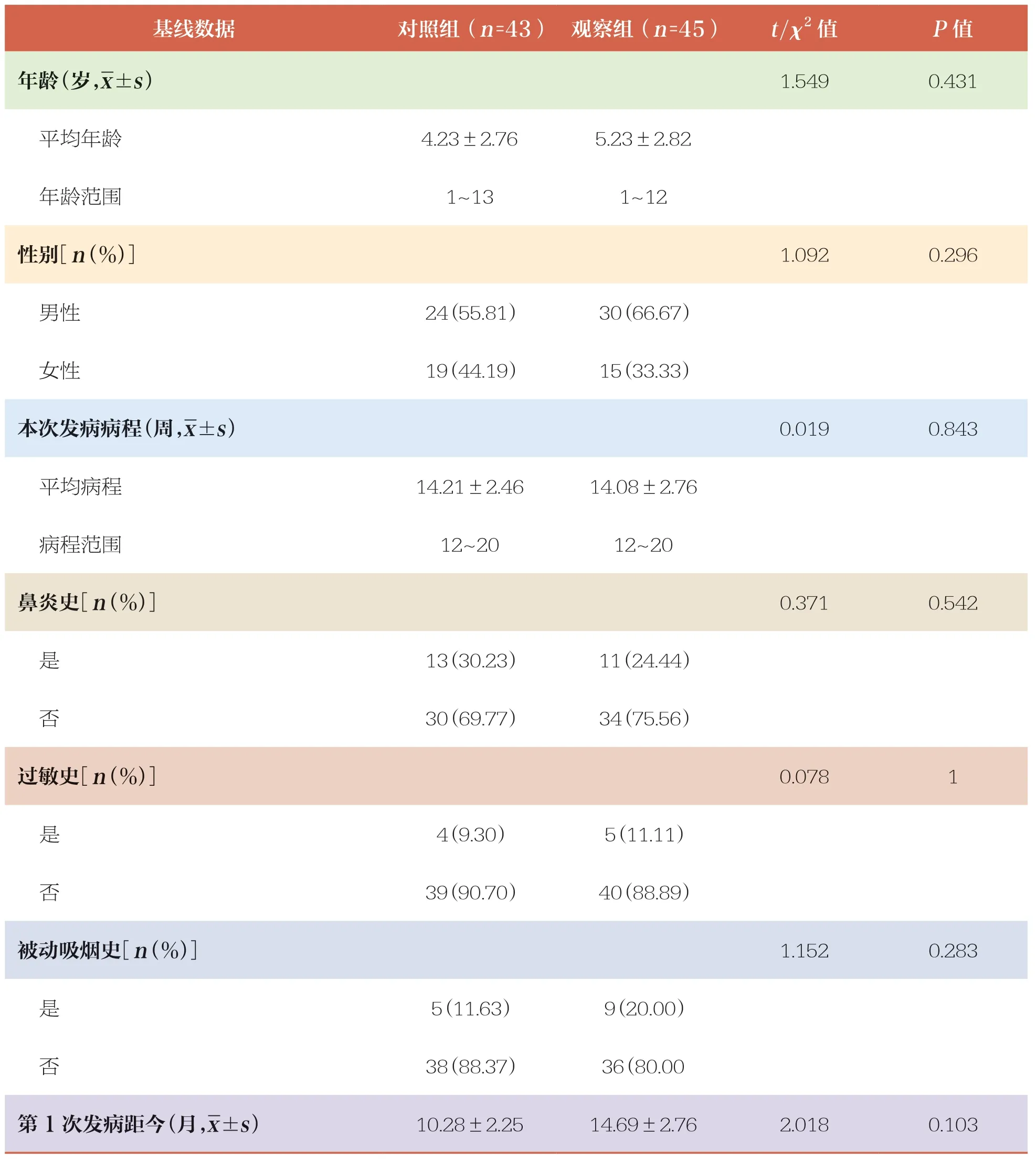
表1 两组患儿基线资料比较
2.2 治疗前后两组患儿临床症状主观评价比较
治疗前,两组患儿VAS、TNSS、TNNSS比较均无统计学差异(P>0.05);治疗后,两组患儿VAS、TNSS、TNNSS均降低(P<0.05),且观察组低于对照组(P<0.05)(表2、表3和表4)。
表2 治疗前后两组患儿VAS比较 ±s,分
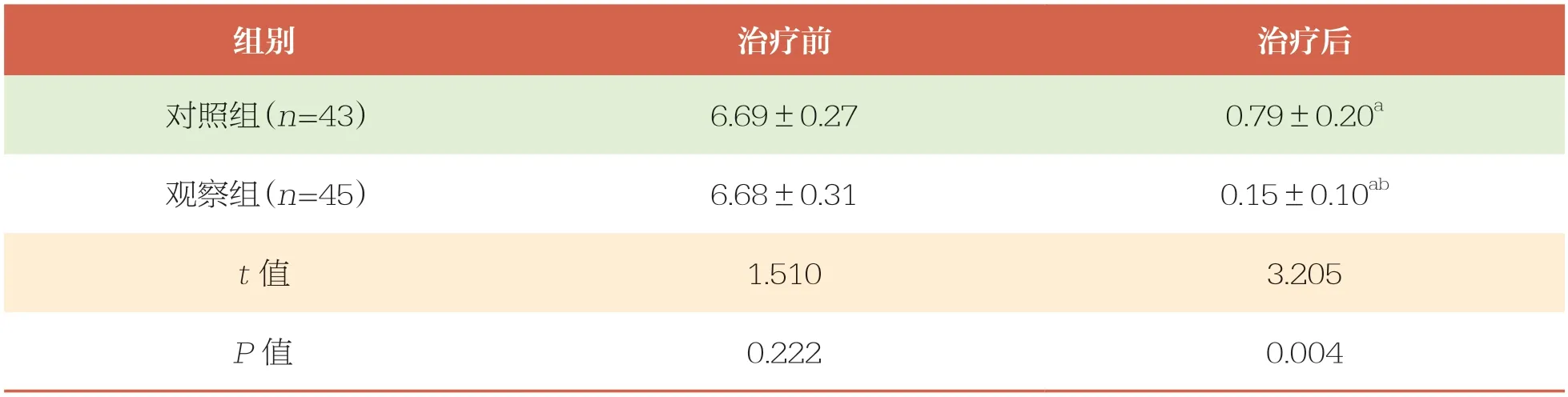
表2 治疗前后两组患儿VAS比较 ±s,分
VAS:视觉模拟评分法;与同组治疗前比较,a:P<0.05;与对照组比较,b:P<0.05。下同
组别治疗前治疗后对照组(n=43)6.69±0.270.79±0.20a观察组(n=45)6.68±0.310.15±0.10ab t值1.5103.205 P值0.2220.004
表3 治疗前后两组患儿TNSS比较 ±s,分
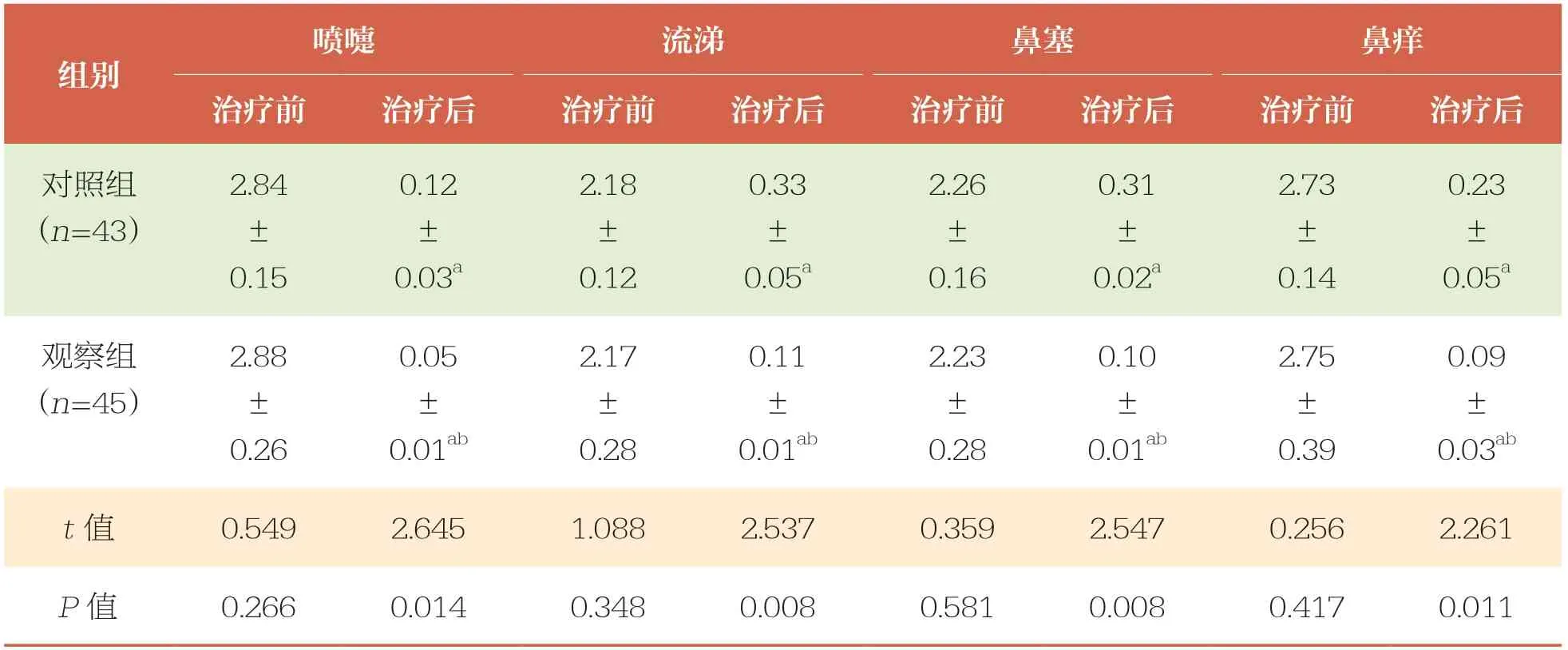
表3 治疗前后两组患儿TNSS比较 ±s,分
TNSS:鼻炎症状总评分
喷嚏流涕鼻塞鼻痒治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=43)组别0.23±0.05a观察组(n=45)2.84±0.15 0.12±0.03a 2.18±0.12 0.33±0.05a 2.26±0.16 0.31±0.02a 2.73±0.14 0.09±0.03ab t值0.5492.6451.0882.5370.3592.5470.2562.261 P值0.2660.0140.3480.0080.5810.0080.4170.011 2.88±0.26 0.05±0.01ab 2.17±0.28 0.11±0.01ab 2.23±0.28 0.10±0.01ab 2.75±0.39
表4 治疗前后两组患儿TNNSS比较 ±s,分
鼻涕从咽部流过鼻或眼部瘙痒头晕头痛流泪鼻或口腔上颌疼痛治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=43)组别2.92±0.19 0.18±0.04a 2.78±0.27 0.12±0.03a 3.00±0.25 0.30±0.05a 2.93±0.21 0.26±0.04a 2.84±0.31 0.23±0.02a
续表
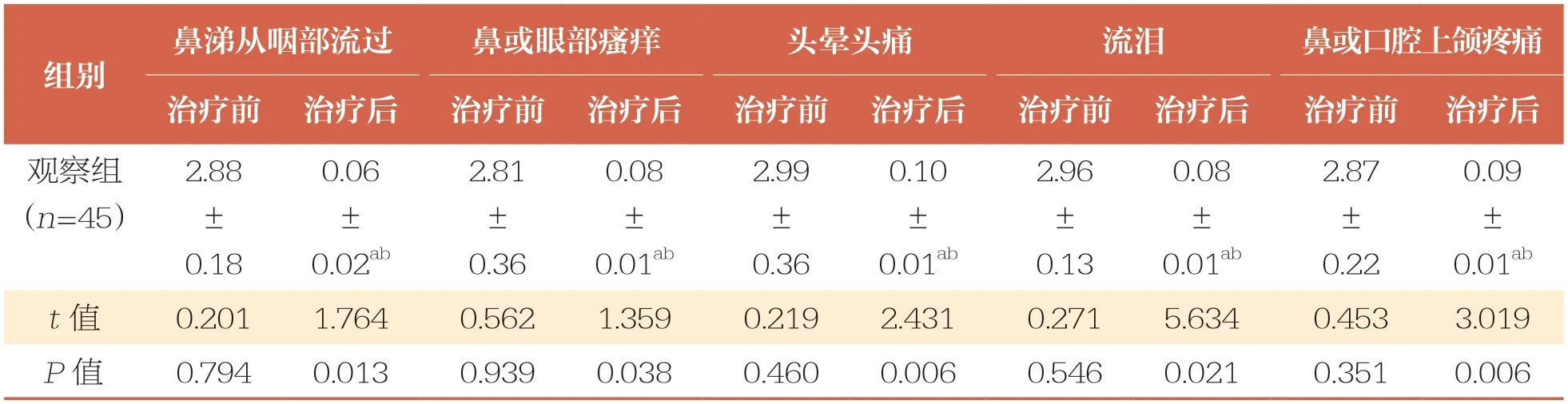
表4 治疗前后两组患儿TNNSS比较 ±s,分
TNNSS:鼻炎伴随症状总评分
鼻涕从咽部流过鼻或眼部瘙痒头晕头痛流泪鼻或口腔上颌疼痛治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=45)组别0.09±0.01ab t值0.2011.7640.5621.3590.2192.4310.2715.6340.4533.019 P值0.7940.0130.9390.0380.4600.0060.5460.0210.3510.006 2.88±0.18 0.06±0.02ab 2.81±0.36 0.08±0.01ab 2.99±0.36 0.10±0.01ab 2.96±0.13 0.08±0.01ab 2.87±0.22
2.3 治疗前后两组患儿呼吸功能评价比较
治疗前,两组患儿FEV1、FVC、FEV1/FVC、PEF、MMEF水平比较均无统计学差异(P>0.05);治疗后,观察组患儿FEV1、FVC、MMEF水平均高于对照组(P<0.05)(表5)。
表5 治疗前后两组患儿呼吸功能指标比较 ±s
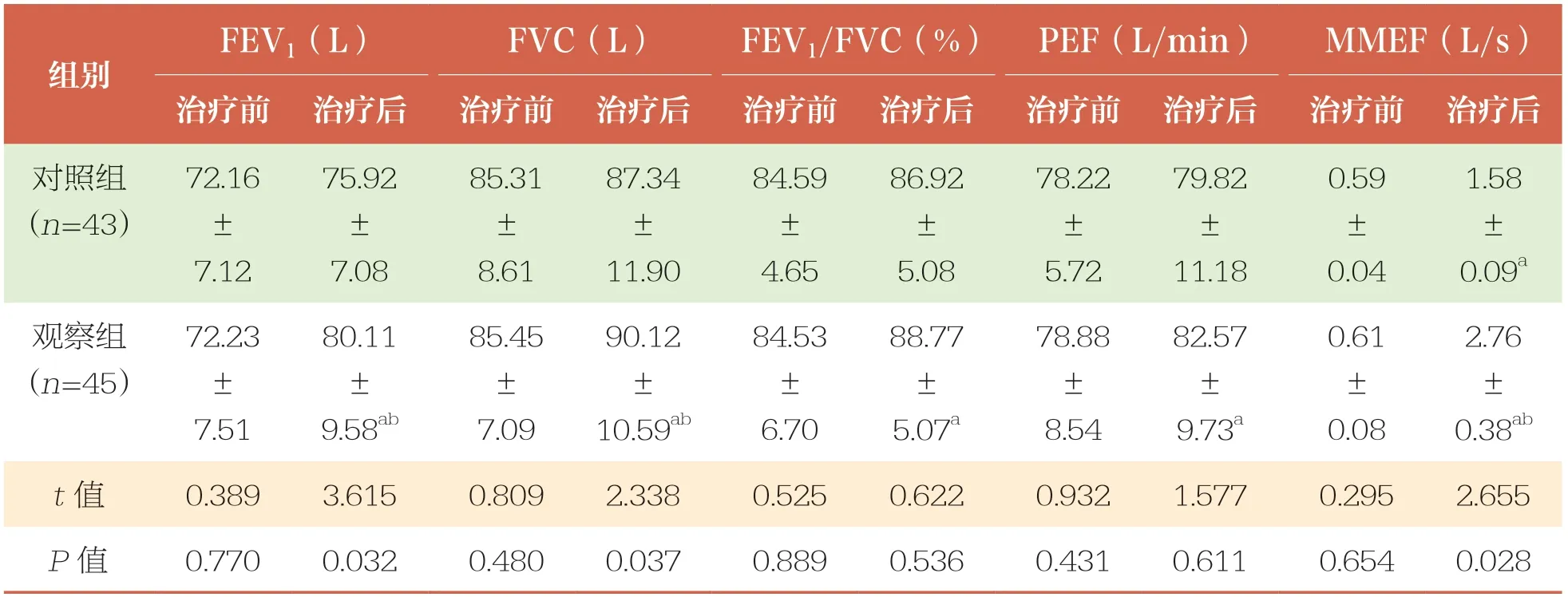
表5 治疗前后两组患儿呼吸功能指标比较 ±s
FEV1:第1秒用力呼气容积;FVC:用力肺活量;PEF:呼气流量峰值;MMEF:最大呼气中期流量
FEV1(L)FVC(L)FEV1/FVC(%)PEF(L/min)MMEF(L/s)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=43)组别1.58±0.09a观察组(n=45)72.16±7.12 75.92±7.08 85.31±8.61 87.34±11.90 84.59±4.65 86.92±5.08 78.22±5.72 79.82±11.18 0.59±0.04 2.76±0.38ab t值0.3893.6150.8092.3380.5250.6220.9321.5770.2952.655 P值0.7700.0320.4800.0370.8890.5360.4310.6110.6540.028 72.23±7.51 80.11±9.58ab 85.45±7.09 90.12±10.59ab 84.53±6.70 88.77±5.07a 78.88±8.54 82.57±9.73a 0.61±0.08
2.4 治疗前后两组患儿生化指标评价比较
治疗前,两组患儿WBC、LYM、EOS、IgE水平比较均无统计学差异(P>0.05);治疗后,两组患儿WBC、LYM、EOS、IgE水平均降低(P<0.05),且观察组低于对照组(P<0.05)(表6)。
表6 治疗前后两组患儿生化指标比较 ±s
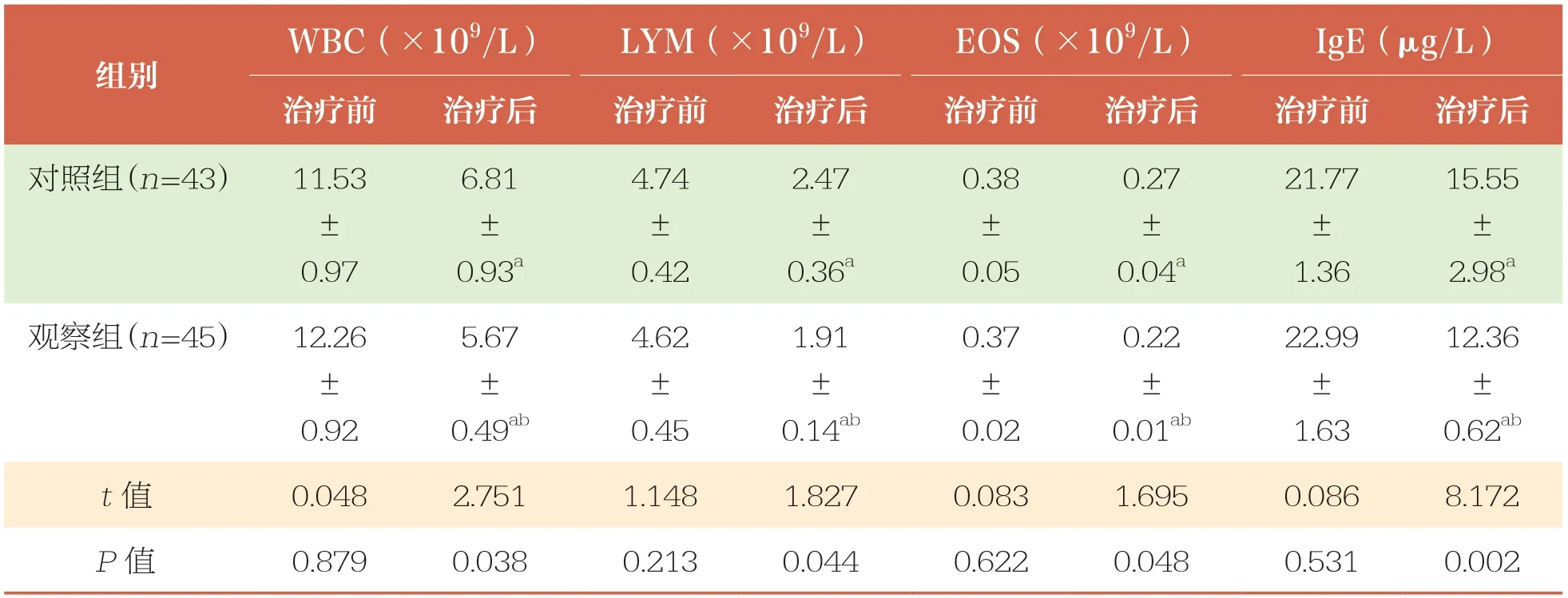
表6 治疗前后两组患儿生化指标比较 ±s
WBC:白细胞;LYM:淋巴细胞;EOS:嗜酸性粒细胞;IgE:免疫球蛋白E
WBC(×109/L)LYM(×109/L)EOS(×109/L)IgE(μg/L)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组(n=43)11.53±0.97组别6.81±0.93a 4.74±0.42 2.47±0.36a 0.38±0.05 0.27±0.04a 21.77±1.36 15.55±2.98a观察组(n=45)12.26±0.92 12.36±0.62ab t值0.0482.7511.1481.8270.0831.6950.0868.172 P值0.8790.0380.2130.0440.6220.0480.5310.002 5.67±0.49ab 4.62±0.45 1.91±0.14ab 0.37±0.02 0.22±0.01ab 22.99±1.63
2.5 两组患儿临床疗效比较
治疗后,观察组患儿临床治疗总有效率(95.56%)高于对照组(81.40%,P<0.05)(表7)。
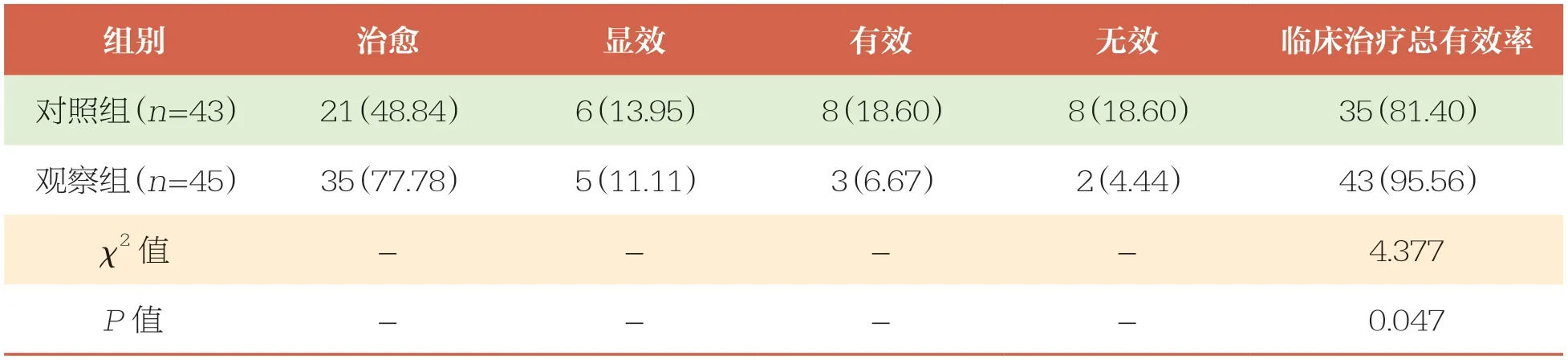
表7 两组患儿临床疗效比较 n(%)
2.6 不良反应发生情况
治疗随访期间,观察组仅1例患儿出现腹泻,对照组仅1例患儿出现消化不良,其他患儿未出现恶心呕吐、食欲减低、便秘、头晕头疼、鼻腔干燥、皮疹等不良反应,两组患儿不良反应发生率比较无统计学差异(P>0.05)。治疗前后两组患儿的心电图、血、尿、便常规及肝肾功能等均在正常范围。
3 讨论
多数CRS是由于急性鼻窦炎未彻底治愈迁延而成,大多数CRS患者无明显的全身症状,常表现为间歇性或交替性鼻塞、流脓、嗅觉不灵等。CRS患儿鼻腔黏膜充血肿胀,导致鼻窦窦口堵塞,引起鼻窦黏膜慢性炎症[15]。目前,CRS的病因尚不明确。有研究认为[16],自身机体免疫系统紊乱有可能会使中性粒细胞在鼻窦处过度聚集,攻击鼻黏膜,促使CRS进展。《素问玄机原病式》 中提到“鼻为肺窍,痒为火化”[17];若表现为鼻塞、黏稠涕多,且伴有头昏胀痛、嗅觉减退等症状时,辨证当属风热脾虚证。脏腑虚损乃发病之本,当脾、肺、肾诸脏亏虚,正气不足,卫外不固,易外感邪气而致肺气痹阻、鼻窍不利[18]。由此可见小儿鼻窦炎因风寒外袭、邪热循经犯及鼻窍所致,加之患儿体弱,生长发育未成熟,稚阴未长,肺脾气虚,卫外无力[19],当以滋养肺脾、益气固表、祛邪通窍、芳香化湿为治则[20]。
苍耳子鼻炎滴丸源自《济生方》中记载的苍耳子散,其组方经后世化裁加减,衍化为苍耳子、石膏、人工冰片、薄荷、白芷、黄芩、辛夷7味,具有疏风、清肺热、通鼻窍、止头痛的功效[21-22]。方中苍耳子发散风邪、散风除湿、宣通鼻窍、透达表里为君药;石膏、冰片、薄荷清热止痛、清利头目、泻火解毒为臣药;白芷辛散除湿、祛风散寒、宣肺排脓,黄芩疏风清热、燥湿解毒,共为佐药;辛夷发散风寒、芳香通窍,其性上达辛温发散,为使药;诸药合用,可清热利湿、祛邪通窍[23]。现代药理研究表明[24-25],方中多种组分具有消炎镇痛、消肿化脓、抑制病菌及增强机体免疫力等作用。如苍耳子中含有的酚酸及其衍生物类化合物,是抗炎镇痛的有效活性成分;石膏主含CaSO4及Fe、Zn、Mn、Cu等微量元素,可调节机体免疫功能。常颂平等[26]发现冰片可以破坏真菌的细胞结构,导致真菌溶解死亡;龙彤等[27]研究发现白芷能通过调节Th17/Treg平衡缓解过敏性鼻炎小鼠鼻黏膜组织损伤。因此,上述组方所得的苍耳子鼻炎滴丸不仅可抑制炎症反应,还具有免疫调节的作用。
目前认为CRS患儿发病的主要原因包括呼吸道反复感染、鼻腔结构异常、自身变态反应,故抗炎、消除水肿是治疗本病的关键。临床上以药物保守治疗为主,西医多采用激素吸入法以及局部抗炎疗法进行治疗,主要选择具有抗感染作用的抗菌药物和抗炎、抗水肿作用的糖皮质激素,如头孢泊肟酯干混悬剂和糠酸莫米松鼻喷雾剂等,在一定程度上可缓解患儿的临床症状,但长期使用会破坏鼻黏膜,导致头痛、鼻出血等不良反应的发生。
VAS、TNSS、TNNSS可评估CRS临床症状的严重程度,其分值与病情严重程度呈正比,分值越高,表示病情越严重[13]。本研究中,治疗后两组患儿VAS、TNSS、TNNSS均降低(P<0.05),且观察组低于对照组(P<0.05),提示苍耳子鼻炎滴丸联合常规治疗可有效改善患儿的临床症状。呼吸功能指标的临床监测,可直接反映出患者当前的呼吸状态,提供对病情以及治疗效果的判断依据。本研究中,治疗后观察组患儿FEV1、FVC、MMEF水平均高于对照组(P<0.05);WBC、LYM、EOS、IgE水平均降低(P<0.05),且观察组低于对照组(P<0.05),提示苍耳子鼻炎滴丸联合常规治疗可有效降低患儿机体炎症水平,改善呼吸功能。相关研究认为[28],炎症可直接或间接造成氧化应激,两者相互促进,进而导致急性鼻窦炎发展为CRS。因此,减轻机体炎症水平有利于缓解患儿的临床症状。本研究结果显示,观察组患儿临床治疗有效率(95.56%)高于对照组(81.40%,P<0.05)。此外,治疗随访期间,观察组仅1例患儿出现腹泻,对照组仅1例患儿出现消化不良,其他患儿未出现恶心呕吐、食欲减低、便秘、头晕头疼、鼻腔干燥、皮疹等不良反应;治疗前后两组患儿的心电图、血、尿、便常规及肝肾功能等均在正常范围,结果提示苍耳子鼻炎滴丸联合常规治疗可以提高CRS患儿的临床疗效,且安全性较高。然而,本研究仍存在一定局限性,如由于本研究主要就CRS患儿的症状变化进行探讨,对患儿的机体免疫功能及相应指标虽有涉及,但未做重点分析。未来将进一步扩大样本量,在不破坏试验整体性和有效性的前提下,细化临床分型,增加免疫学评价标准,深入研究药物对CRS患儿鼻黏膜局部免疫功能的影响。
综上所述,苍耳子鼻炎滴丸联合常规治疗可有效调节CRS患儿的呼吸功能及免疫水平,无严重不良反应,且安全性高,临床疗效较好。

