三株无量山森林土壤芽孢杆菌鉴定及其生物活性挖掘
王楠 廖永琴 施竹凤 申云鑫 杨童雨 冯路遥 矣小鹏唐加菜 陈齐斌 杨佩文
(1.云南农业大学植物保护学院,昆明 650000;2.云南省农业科学院农业环境资源研究所,昆明 650205)
农业绿色发展是可持续发展和生态文明建设的必由之路,在《“十四五”全国农业绿色发展规划》《全国农业可持续发展规划(2015-2030 年)》等政策的指导下,绿色农业的发展得到了大力助推。多样化农业生产资源的形成得益于土壤中有效微生物资源的充分利用[1],但在植物病害防治上仍面临优良菌株资源匮乏、菌株功能单一、难以在田间自然条件下定植、抗药能力差等条件限制[2],挖掘高效及功能多样的菌株资源对充实生物防治资源,转变传统生产模式,构建植物病害绿色防治技术具有重要的现实意义[3-7]。
拮抗微生物对作物根茎类病害具有良好的防控作用,且对构建健康土壤微生态,提高土壤有益微生物多样性和丰富度具有显著促进作用[8]。目前应用于植物病害生物防控的微生物包括细菌、真菌、放线菌,其中细菌主要是芽孢杆菌(Baccillus sp.)和假单胞菌(Pesudomonas sp.)等[9]。前人研究表明,独特的自然生境内蕴含丰富的具有生物防控潜力的菌株资源,Morais 等[10]从塞拉多-卡廷加交错带森林分离的内生木霉(Trichoderma)菌株对多种病原菌菌丝生长表现出抑制活性。宋嘉宝等[11]从霉变雪茄(Cigarro)烟叶表面分离、纯化的枯草芽孢杆菌(B.subtilis)和耐盐芽孢杆菌(B.halotolerans),对篮状菌属(Talaromyces)、帚霉属(Scopulariopsis)和曲霉属(Aspergillus)的病原微生物具有良好的拮抗活性。Wen 等[12]从库姆塔格沙漠中分离出具有较强的紫外辐照抗性和抗菌能力的链霉菌(Streptomycetaceae)。分离自小麦(Triticum aestivum L.)根际土壤的解淀粉芽孢杆菌,对禾谷镰刀菌(F.graminearum)平均抑菌率达70%以上[13]。除了对植物病原菌高效地抑菌活性外,芽孢杆菌还可通过分泌次生代谢产物或挥发性物质,在植株的生长发育和抗性诱导上发挥作用[14]。Zhang 等[15]从盐碱地分离出的解淀粉芽孢杆菌具有耐盐碱、解磷和修复铅污染的能力,这些功能与微生物在生存环境中的定殖及植物的生长发育息息相关。
菌株功能的多样性为植物病害的高效防治提供了保证,而在生防菌株挖掘过程中往往容易忽略对抑菌活性以外的功能活性进行研究。本研究从菌株的特殊生境入手,考虑到目前生物资源丰富的无量山国家自然保护区[16],在潜在优势微生物资源活性和功能方面的挖掘和研究明显不足。因此从中分离筛选拮抗活性强,且抑菌谱广的可培养微生物,并针对有益于植物生长、抗病的功能,验证其多样化的生物活性,旨在提高植物病害绿色防控的高效性和可持续性,并为拮抗菌株的开发利用提供理论基础,充实农业绿色发展所需的有效微生物资源。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试土壤样品:采样地点位于云南省大理白族自治州无量山国家级自然保护区,共5 个采样小区,10 个样点,每个样点使用五点取样法采集样品,共采集得到50 份样品,分装于50 mL的无菌离心管中,带回实验室做土壤细菌分离。
供试病原菌:番茄枯萎病菌(F.oxysporum f.sp.lycopersici)、香蕉枯萎病菌(F.oxysporum f.sp.cubense)、烟草炭疽病菌(C.micotianae)、烟草赤星病菌(Alternaria alternate)、玉米大斑病菌(Exserohilum turcicum)、油菜菌核病菌(Sclerotinia sclerotiorum)、草果叶斑病菌(Phoma matteuciicola),由云南省农业科学院农业环境资源研究所分离、鉴定与保存。
1.1.2 供试培养基 本研究所用培养基如表1 所示。

表1 供试培养基成分Table 1 Composition of test media
1.2 方法
1.2.1 功能菌株的分离筛选 土壤细菌的分离:取2 g 混合均匀的土壤样品于200 mL 的无菌水内,28℃条件下加入适量玻璃珠摇瓶培养4-6 h,吸取200 μL 土壤溶液均匀涂布于NA 平板,28℃恒温培养24 h 后挑取形态不同的细菌单菌落作为待测菌株。
初筛:以番茄枯萎病菌为指示菌,通过平板对峙法在PDA 培养基两侧分别接种待测菌、直径5 mm 的病原菌,置于25-30℃的恒温培养箱暗培养5-7 d,选择具有抑菌效果的菌株作为候选拮抗菌株。
复筛:以番茄枯萎病菌为指示菌,28℃条件下摇瓶培养24 h 得到各待测候选拮抗菌株发酵液,PDA 培养基中央接种直径5 mm 的菌饼,在距离菌饼上下左右各2.5 cm 处各放置一个牛津杯,菌株发酵液12 000 r/min 离心5 min 后过无菌滤膜后,每个牛津杯接入200 μL 候选拮抗菌株无菌发酵液,以接无菌水为对照,置于25-30℃的恒温培养箱暗培养5-7 d,利用琼脂扩散法检测菌株发酵液的抑菌效果,选出拮抗活性强的菌株作为后续试验的研究对象。
1.2.2 功能菌株抑菌广谱性测定 PDA 培养基中央接种直径为5 mm 的供试病原菌菌饼,上下左右各2.5 cm 点接待测菌,以接无菌水为对照,置于25-30℃的恒温培养箱暗培养5-7 d,计算抑菌率。
菌株抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-0.5 cm)×100%
1.2.3 功能菌株对番茄枯萎病菌菌丝生长的影响 拮抗菌株与指示菌于25℃恒温培养箱内平板对峙培养5-7 d,每处理3 个重复,挑选拮抗交界处菌丝制样,将样品浸没于含有体积分数为2.5%的戊二醛固定液(pH 6.8)中,室温固定4 h,4℃固定过夜,磷酸盐缓冲液(0.1 mol/L,pH 6.8)漂洗3 次,每次间隔10 min;固定后用不同浓度梯度乙醇(30%、50%、70%、80%、90%)脱水10 min,最后脱水用100%的乙醇脱水3 次,每次30 min;将样品置于高真空中进行干燥,在离子溅射仪内喷金,最后在扫描电子显微镜下进行观察并拍照[19]。
1.2.4 功能菌株对番茄枯萎病菌孢子萌发的影响 病原菌培养15 d 后刮取分生孢子,加入无菌水过滤获得病原菌孢子悬液,28℃下摇床培养72 h 获得功能菌发酵液,1∶1 等体积加入病原菌孢子悬浮液和功能菌的无菌发酵液至灭菌离心管制成混合液,以只加病原菌孢子悬液为对照,重复3 次,在25℃条件下孵育,于48 h 观察孢子萌发情况,芽管长度低于孢子短直径的1/2 视为萌发受到抑制[20]。
1.2.5 功能菌株脂肽类抗性基因PCR 检测 取斜面保藏纯化菌株,平板划线法接种于NA 培养基上,挑取单菌落接种于NB 培养基,30℃ 180 r/min 振荡培养24 h,取1.5 mL 菌液10 000 r/min 离心处理5 min,去除上清液,用200 μL ddH2O 重悬,95℃沸水处理10 min,冰浴处理5 min,10 000 r/min 离心处理5 min,提取上清液为菌株DNA 模板。本研究所使用的10 对特异性引物(表2)均由北京擎科生物科技有限公司合成,利用上述特异性引物分别对菌株进行PCR 扩增。扩增体系为20 μL,具体参照申云鑫等[9]的方法:10×buffer 2.0 μL、dNTPs 1.6 μL、DNA 模板1.0 μL、Taq DNA 聚合酶 0.2 μL、上下游引物各1.0 μL、ddH2O 补满体系。扩增条件:98℃ 2 min;98℃ 10 s,52℃ 15 s(ituC)或54℃ 15 s(bymC)或 58℃ 15 s(srfA),72℃ 10 s,35 个循环;72℃ 5 min,扩增结束后于4℃条件下保存备用。使用1.0%琼脂糖凝胶电泳检测扩增产物,在凝胶成像系统中观察检测结果。

表2 脂肽类抗性基因检测引物Table 2 Detection primers for lipopeptide resistance genes
1.2.6 功能菌株促生及番茄枯萎病防治效果测定 刮取PDA 平板上28℃恒温培养5-8 d 的病原菌,分散到6 g/L CMC(羧甲基纤维素钠)溶液中制成孢子悬液,孢子浓度调至2.0×106CFU/mL。功能菌株28℃恒温振荡培养2-8 d,稀释成2.0×108CFU/mL 的菌悬液。选取生长状态良好且一致的盆栽苗,CK1 为空白组(单接无菌水)、营养对照组CK2(单接NB 培养基)、对照组CK3(单接病原菌)、试验组(接种病原菌和功能菌),每个处理20 盆、每盆1 株,重复3 次,幼苗移栽定殖3 d 后,采用灌根的方式接种病原菌,每盆接种量为100 mL,待病原菌定殖3 d 接入等量功能菌悬液。30 d 后统计发病情况,病情分级标准参考王静等[21]的方法:0 级为无症状;1 级为1 片或2 片叶子明显变黄;2 级为3 片或4 片真叶变黄且叶片萎蔫下垂;3 级为5 片或6 片真叶变黄或真叶萎蔫下垂;4 级为全株严重萎蔫以致枯死。测定番茄苗的株高、根长、茎叶鲜重、根鲜重、叶绿素含量等指标,而后于180℃烘干至恒重,测定茎叶干质量、根干重等指标。
防效(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100%
病情指数=Σ(各级病株数×该病级值)/(总株数×最高级值)×100
1.2.7 功能菌其他生物活性测定 产铁载体功能测定时,先取0.060 5 g 铬天青S 溶于50 mL 去离子水,加入0.002 7 g 氯化铁搅拌混匀获得A 液;再称取0.072 9 g 十六烷基三甲基溴化铵溶于40 mL 去离子水获得B 液,将A 液缓慢倒入B 液搅拌均匀得CAS显色液,将待测菌株点接于CAS 双层显色培养基的中心上层,若菌落周围变红或产生透明圈则表明有活性。解磷、解钾、固氮、溶锌、体外产酶功能测定时,将待测菌株点接于平板中心的上下左右各2.5 cm 处,置于28℃条件下恒温箱暗培养24 h,观察各功能平板是否有透明圈产生以检测其相应活性,观察淀粉酶活性时需滴加卢戈氏碘液(碘5.0 g、碘化钾10.0 g、蒸馏水加至100 mL)显色。抗生素药敏检测:取300 μL 菌株发酵液均匀涂布于NA 平板上,待平板干燥后将药敏纸片(杭州微生物试剂有限公司)放置于平板中央,28℃恒温培养箱暗培养24 h观察实验结果,产生透明圈则证明菌株对相应抗生素敏感,不产生则证明菌株对相应抗生素不敏感。
1.2.8 功能菌株鉴定 平板划线法接种拮抗活性菌株,28℃的恒温培养箱暗培养24-48 h 观察并拍摄记录扫描电子显微镜下的菌株形态,参照《伯杰氏系统分类手册》[22]和《常见细菌系统鉴定手册》[23]进行形态特征和生理生化鉴定分析。
分子生物学鉴定:接种功能菌株至NB 液体培养基,30℃、180 r/min 条件下摇床培养,无菌条件下取样测定菌液OD600值,当OD600值近似于1(约1×109CFU/mL)时停止培养,用TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0 试剂盒提取菌株的基因组DNA。采用细菌16S rRNA 通用引物27F/1492R(5'-AGAGTTTGATCCTGGCTCAG-3',5'-TACGGYTACCTTGTTACGACTT-3')、gyrA 基 因引 物F/R(5'-CAGTCAGGAAATGCGTACGTCCTT-3',5'-CAAGGTAATGCTCCAGGCATTGCT-3)、rpoB 基因引物2292F/3354R(5'-AGGTCAACTAGTTCAGTATGGAC-3',5'-AAGAACCGTAACCGGCAACTT-3')进行PCR 扩增,扩增产物纯化回收,送至北京擎科生物科技有限公司进行测序,测序结果经BLAST 检索后与GenBank 数据库中相关种属的基因序列进行比较分析,选同源性较高的菌株的序列作为参比对象,用Clustal X 进行多序列比对,并采用邻接法(neighbor-joining)用Mega7.0 构建供试菌株与参比菌株之间的系统发育树。
1.2.9 数据处理 使用Excel 和SPSS Statistics 22.0进行数据统计分析,采用GraphPad Prism 8.0 制图。
2 结果
2.1 功能菌株分离筛选
经过初筛,10 株菌株对番茄枯萎病菌具有较强的拮抗活性,抑菌率均在70%以上(表3),其中菌株SH-53、N4471 和N9456 的抑菌率最高,分别为92.35%、87.29%和88.47%,经过复筛,菌株SH-53、N4471 和N9456 的无菌过滤发酵液对番茄枯萎病菌抑菌效果显著高于其他菌株,故以该3 株菌株作为后续研究对象。
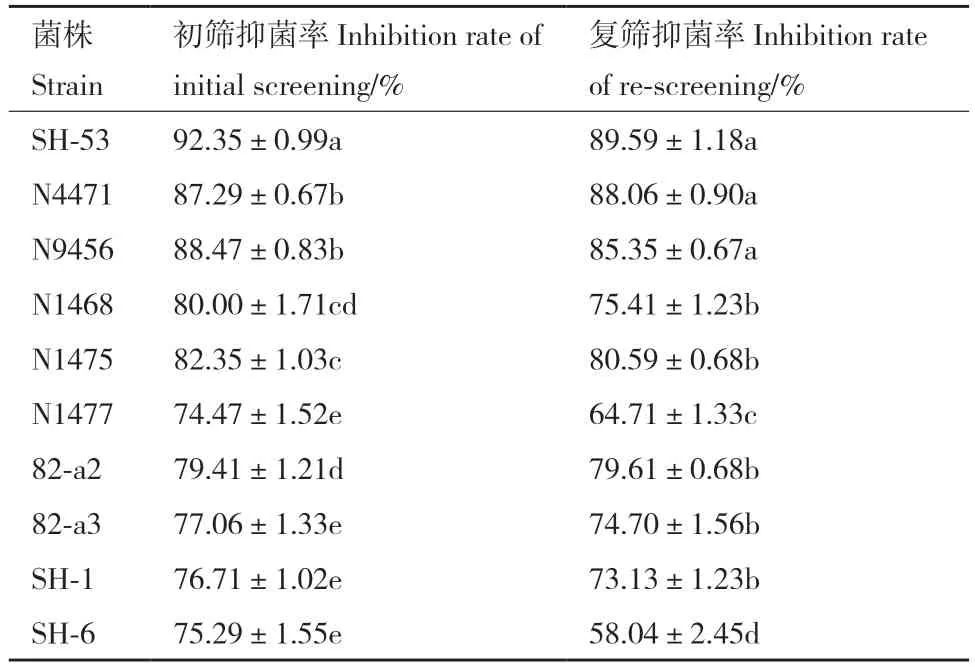
表3 功能菌株筛选结果Table 3 Results of screening functional strains
2.2 功能菌株抑菌广谱性测定
3 个功能菌株对多种病原菌均表现良好拮抗活性(图1),菌株SH-53 对香蕉枯萎病菌、烟草炭疽病菌、烟草赤星病菌、玉米大斑病菌、油菜菌核病菌、草果叶斑病菌拮抗活性分别达到75.3%、82.4%、84.1%、88.8%、81.2%、87.6%,菌株N4471 对香蕉枯萎病菌、烟草炭疽病菌、烟草赤星病菌、玉米大斑病菌、油菜菌核病菌、草果叶斑病菌抑菌率分别达71.8%、80.6%、77.6%、85.9%、77.6%、85.9%,菌株N9456 对香蕉枯萎病菌、烟草炭疽病菌、烟草赤星病菌、玉米大斑病菌、油菜菌核病菌、草果叶斑病菌的抑菌率分别达76.5%、81.8%、80.0%、87.1%、84.1%、90.6%。
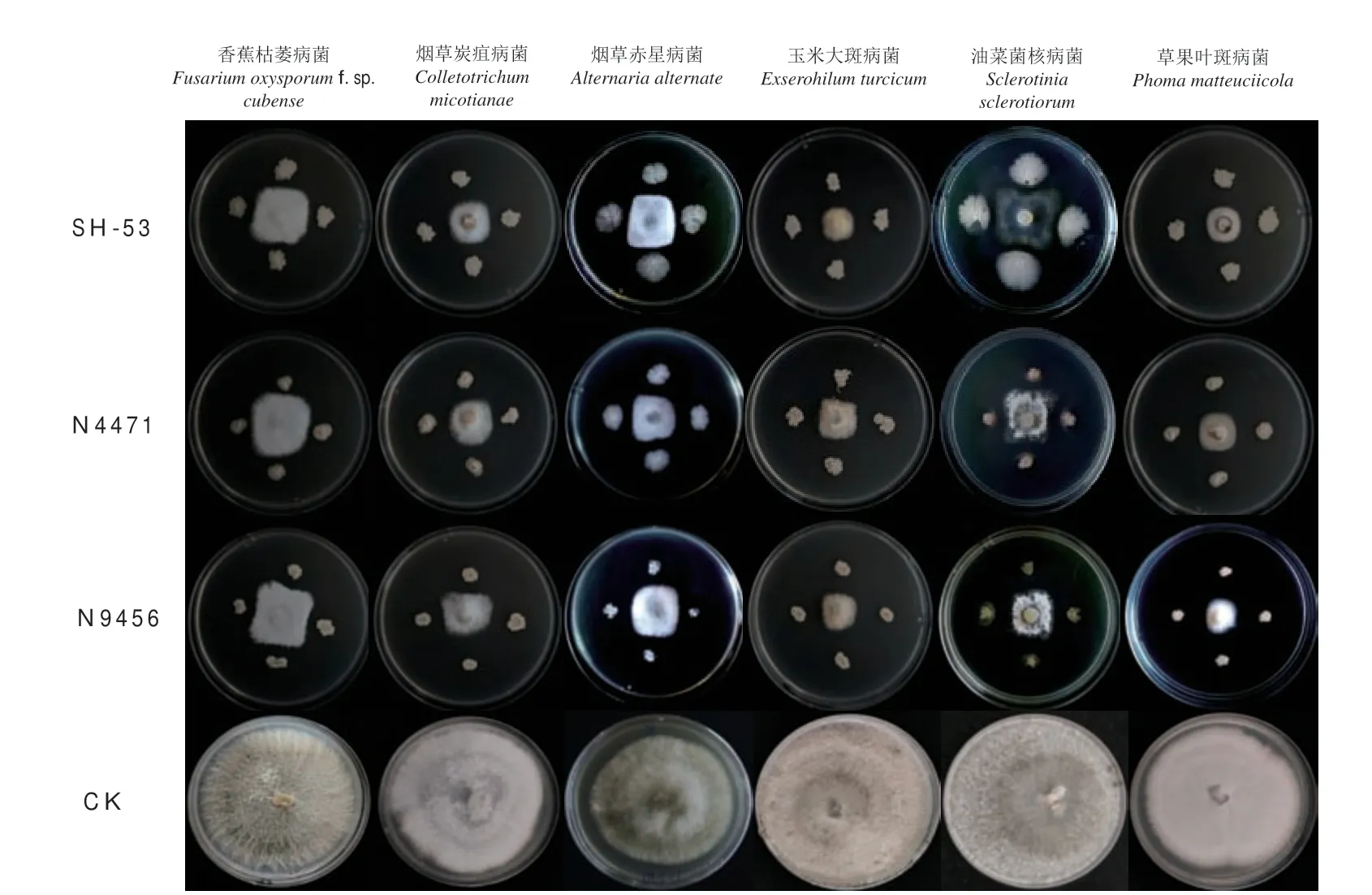
图1 功能菌株SH-53、N4471、N9456 抑菌谱Fig.1 Bacteriostatic spectrum of functional strain SH-53,N4471,and N9456
2.3 功能菌株对番茄枯萎病菌菌丝生长的影响
与正常的病原菌菌丝相比,在菌株SH-53 的影响下,番茄枯萎病菌菌丝发生畸形弯曲,部分节间肿大,还出现断裂、泡囊结构;菌株N4471 使番茄枯萎病菌的菌丝出现不规则形变,菌丝钝化且菌丝量变少、节间缩短,菌丝发生断裂;受菌株N9456影响,番茄枯萎病菌菌丝畸形、变短、数量减少、弯曲变细(图2)。

图2 功能菌株对番茄枯萎病菌菌丝的影响Fig.2 Effects of functional strains on the mycelia of Fusarium oxysporum causing tomato wilt disease
2.4 功能菌株对番茄枯萎病菌孢子萌发的影响
菌株SH-53、N4471、N9456 发酵液对番茄枯萎病菌的分生孢子萌发有明显抑制作用。48 h 番茄枯萎病菌孢子萌发效果如图3 所示,对照组大部分孢子长出了明显的芽管,而处理组大部分孢子还未产生芽管,或芽管长度低于孢子短直径的1/2。
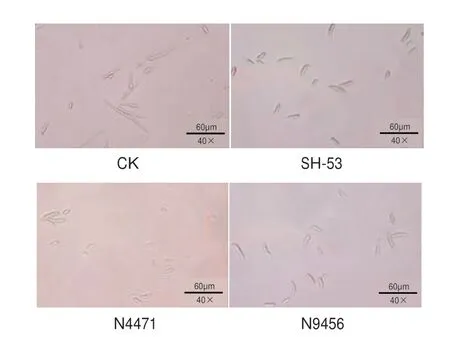
图3 番茄枯萎病菌孢子萌发(孵育48 h)显微镜观察效果Fig.3 Microscopic observation of spore germination of tomato wilt bacterium F.oxysporum(Incubated for 48 h)
2.5 功能菌株脂肽类抗性基因PCR检测
对10 组功能基因进行的PCR 检测,结果(图4)显示,3 个功能菌株均具有脂肽类抗性基因srfA(1 300 bp)、fenA(1 000 bp)、ituA(1 047 bp)、ituC(575 bp)、ituD(647 bp)、bymC(875 bp),其中菌株SH-53 和菌株N9456 还具有脂肽类抗性基因sfp(675 bp)、fenB(1 600 bp)、bymA(1 200 bp),菌株N9456 还具脂肽类抗性基因bymB(983 bp)。

图4 功能菌株脂肽类抗性基因PCR 电泳产物Fig.4 PCR electrophoresis products of lipopeptide synthesis genes in functional strains
2.6 功能菌株促生及番茄枯萎病防治效果
番茄幼苗经功能菌株接种处理30 d 后,3 个功能菌株对番茄幼苗促生效果良好(图5)。处理组SH-53、N4471、N9456 株高分别较空白对照组(CK1)显著增加47.5%、38.9%和45.3%,分别较营养对照组(CK2)增加34.6%、26.7%和32.5%;茎粗分别较对照组(CK1)增加64.9%、67.8%和61.5%,分别较营养对照组(CK2)增加20.2%、22.3%和17.7%;根长分别较对照组(CK1)增长76.8%、36.4%和52.9%,分别较营养对照组(CK2)增长52.3%、17.5%和31.7%;地上部分鲜重分别较对照组(CK1)增重54.2%、52.8% 和69.4%,分别较营养对照组(CK2)增重50.7%、49.2%和65.5%;地上部分干重分别较对照组(CK1)增重113.6%、165.4%和125.4%,分别较营养对照组(CK2)增重47.5%、83.2%和55.6%;地下部分鲜重分别较对照组(CK1)增重49.3%、101.9%和86.5%,分别较营养对照组(CK2)增重11.8%、51.2%和39.7%;地下部分干重分别较对照组(CK1)增重214.3%、278.6%和150.0%,分别较营养对照组(CK2)增重109.5%、152.4%和66.7%(表4)。

图5 番茄苗促生效果图Fig.5 Growth-promoting effect diagram on tomato seedling
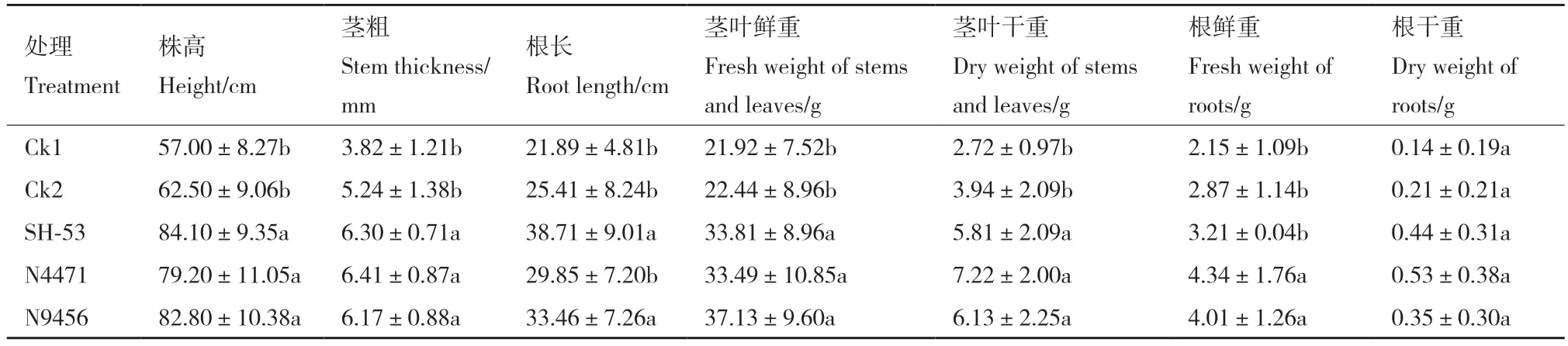
表4 功能菌株对番茄幼苗生长的影响Table 4 Effects of functional strains on the growths of tomato seedlings
处理30 d 后,接种病原菌孢子悬浮液处理的番茄苗表现出茎基部皱缩的症状,且叶片自下而上逐渐发黄枯萎,剖开茎基部维管束明显呈现褐色发黑状。只接种病原菌的对照组(CK3)发病较为严重,病情指数达75.6,在混接病原菌及功能菌株SH-53、N4471、N9456 发酵液处理下,番茄幼苗发生番茄枯萎病的病情指数显著降低为11.7、33.9、30.0,表明3 株功能菌对番茄枯萎病均有显著的抑制作用(P<0.05),功能菌株SH-53、N4471、N9456 对番茄枯萎病的防治效果分别为84.7%、55.0%、59.7%。表明3 个菌株均能有效抑制番茄枯萎病的发生,其中以菌株SH-53 的防治效果最好,其植株健康状态与营养对照组(CK2)的番茄幼苗无明显差异(图6)。

图6 功能菌株对番茄幼苗枯萎病的防控效果Fig.6 Effects of functional strains on the prevention and control of tomato fusarium wilt
2.7 功能菌株其他生物活性测定
研究结果表明(图7),3 株功能菌均具有溶锌功能,均能分泌蛋白酶、淀粉酶,菌株SH-53、N4471 还具有解磷、固氮的功能,并具有分泌纤维素酶及产铁载体的能力。菌株SH-53 对青霉素、氨苄西林不敏感,对红霉素、庆大霉素、链霉素、四环素、万古霉素敏感;菌株N4471 对庆大霉素敏感,而对红霉素、链霉素、四环素、青霉素、万古霉素、氨苄西林不敏感;菌株N9456 对青霉素、氨苄西林、红霉素、庆大霉素、链霉素、四环素、万古霉素均表现出不同程度的敏感。
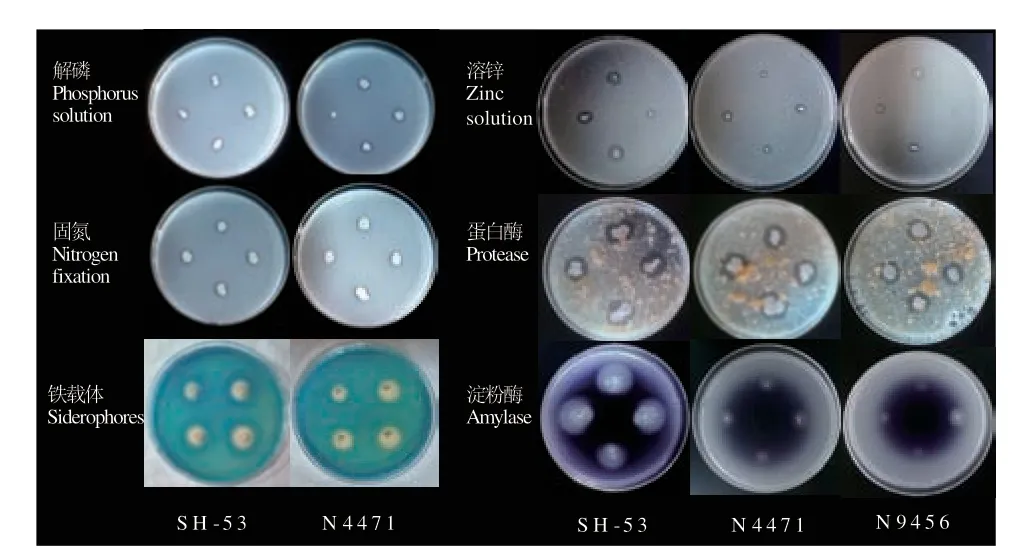
图7 菌株生物活性测定结果Fig.7 Results of strain biological activity assay
2.8 功能菌株鉴定结果
3 个功能菌在NA 培养基上的菌落形态及扫描电镜下的形态如图8 所示,3 个菌株在扫描电镜下均表现为杆状形态,菌株SH-53 菌落中心呈乳白色,边缘半透明,产色素,菌落形状不规则呈褶皱状,边缘整齐,较规整,菌落表面黏稠,略微凸起。菌株N4471 菌落中心呈乳白色,边缘半透明,不产色素,菌落形状不规则,略呈放射状,较规整。菌株N9456 菌落中心呈乳白色,黏液状且形状不规则,具有整个边缘且边缘半透明,略微凸起,不产色素。经形态学初步鉴定菌株SH-53、N4471、N9456 为芽孢杆菌属(Bacillus sp.)。
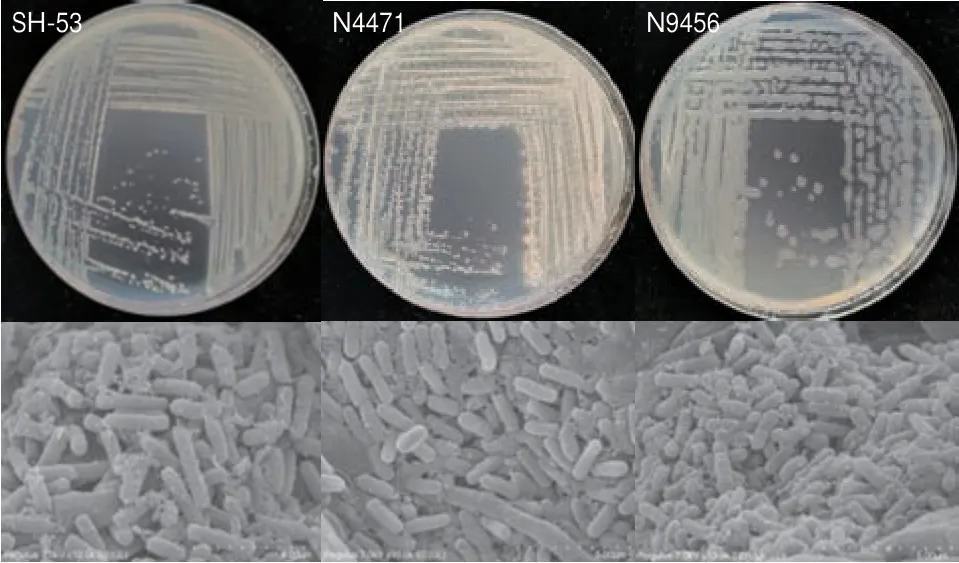
图8 功能菌株菌落形态及扫描电镜图Fig.8 Colony morphology and scanning electron microscopy of functional strains
生理生化鉴定结果(表5)显示,3 个菌株均为革兰氏阳性菌,需氧且均能产生芽孢,接触酶、V-P实验均为阳性,且均能发生硝酸还原反应及使明胶液化,此外菌株SH-53、N4471 还具有产吲哚的能力。
经NCBI Blastn 搜索并 与GenBank 数据库中相关种属基因序列比较分析后,菌株SH-53、N4471、N9456 属于芽孢杆菌属。菌株SH-53 与B.amyloliquefaciens ZJU1,菌株N4471 与B.cabrialesii TE3,菌株N9456 与B.siamensis LS5 分别处于同一独立分支,且其引导支持率分别达到100%、100%、99%(图9)。结合形态学鉴定和生理生化特征,鉴定菌株SH-53 为解淀粉芽孢杆菌,菌株N4471 为卡式芽孢杆菌,菌株N9456 为暹罗芽孢杆菌。
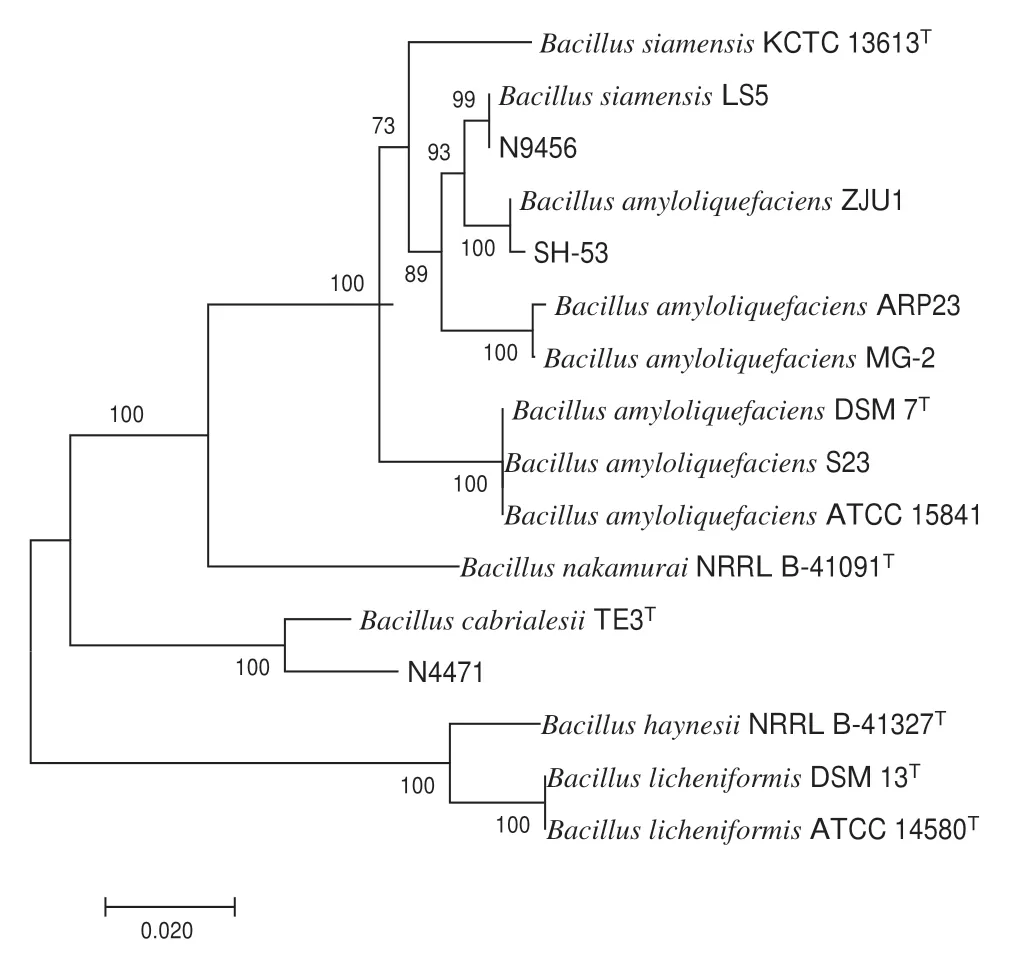
图9 菌株SH-53、N4471 和N9456 基于16S rRNA、gyrA、rpoB 序列的系统分析发育树Fig.9 Phylogenetic trees of the strain SH-53,N4471 and N9456 based on 16S rRNA,gyrA,and rpoB sequences
3 讨论
芽孢杆菌属(Bacillus sp.)作为植物病害生物防治的主要微生物种群,具有抑菌谱广、抗逆性高和不易产生抗药性等特点[24]。3 株芽孢杆菌SH-53、N4471、N9456 对自然环境适应性良好,除番茄枯萎病菌以外,对香蕉枯萎病菌、烟草炭疽病菌、玉米大斑病菌等多种病原菌均有良好抑菌活性。从微观角度探寻菌株高效抑菌的机制,本研究发现3 株拮抗菌对番茄枯萎病菌菌丝均有不同程度的破坏、致畸作用。前人研究表明,芽孢杆菌在生长代谢的过程中会产生多种抗菌物质,其中包括具有广谱抑菌活性的脂肽类抗生素,如polymyxins、surfactins、iturins、fengycins 等[25],许本宏[26]通过试验发现,脂肽类化合物iturin A 和bacillomycin F 能使菌丝发生变形、畸形发育而破坏其生长,而3 株拮抗菌均具有srfA、fenA、ituA、ituC、ituD、bymC 等脂肽类抗性基因,表明其高效广谱的抑菌活性可能来自于这些基因的高效表达,通过脂肽类抗生素的合成来抑制菌丝的生长发育。
菌株SH-53、N4471、N9456 分别被鉴定为解淀粉芽孢杆菌、卡式芽孢杆菌和暹罗芽孢杆菌,对番茄枯萎病防效良好,国内外均有学者验证了这些种群作为生防菌株的应用潜力。解淀粉芽孢杆菌作为一种重要的生防微生物,具有防治植物病害、促进植物生长、改善根际土壤微生物种群结构等作用[27],该种群对橡胶树炭疽病菌(C.acutatum)、水稻基腐病菌(Dickeya zeae)、西瓜枯萎病菌(F.oxysporum f.sp.niveum)等多种病原物都有良好的抑菌活性[28-30]。卡式芽孢杆菌也被证实在小麦种植过程中具备生防促生潜力[31],并对番茄灰霉病菌(Botrytis cinerea)具有较强抑菌活性[32]。暹罗芽孢杆菌[33]对附子白绢病菌(Sclerotium rolfsii)、花生冠腐病菌(Aspergillus niger)、灰葡萄孢等也有较好抑菌效果[34-36]。虽然生防微生物自身具备病原拮抗能力,但投放田间后常常会因农药施用或残留等影响,影响种群数量,进而影响生防效果[2]。菌株SH-53、N4471 对多种抗生素的抗性,将有助于提高其在实际应用过程中的稳定性。不仅如此,菌株包括分泌蛋白酶、溶锌、产铁载体在内的诸多生物活性,也被证实能通过改善农艺性状、提高土壤肥力、促进土壤中难溶性化合物的降解[37]等提高植物的抗病能力。肖瑀轩等[38]分离的暹罗芽孢杆菌CML548 能同时产生蛋白酶、淀粉酶和纤维素酶,并发现其具有优良的益生性状。褚睿等[39]发现具解钾、分泌蛋白酶、铁载体功能的贝莱斯芽孢杆菌(B.velezensis)N6 对黄瓜(Cucumis L.)幼苗生长有显著的促进作用。土壤中的铁元素通常以氧化物等溶解度极低的形式存在,微生物产生的铁载体,可以特异螯合Fe3+,促进植物对铁元素的吸收[40]。另外环境中锌离子浓度过高也会影响菌株生物膜的形成[41],进而影响其拮抗病原菌的能力。Sellappan 等[42]发现配施可溶性锌肥和可溶锌的芽孢杆菌,有助于提高玉米(Zea mays L.)籽粒的生长及产量特性和养分积累。故菌株的抗病能力及各种生物活性的加持有利于应用过程中作物的生物强化。
本研究所筛选菌株的优势在于其高效广谱的抗病能力及丰富的生物活性,如何有针对性地提高其抗病能力并发挥生物活性的功效,在生产实践中是不可忽略的环节。后续可通过菌株发酵条件的优化来提高其生长量和抑菌效果,并寻找生物相容性强的载体、助剂提高其稳定性,从而提升生物菌剂的开发速度,降低菌株开发成本,为植物病害绿色防控充实微生物菌株资源。
4 结论
本研究筛选的3 株生防芽孢杆菌(SH-53:解淀粉芽孢杆菌,N4471:卡式芽孢杆菌,N9456:暹罗芽孢杆菌)具有高效广谱的抑菌活性,可分泌蛋白酶和淀粉酶,且具有溶锌的功能,并具有srfA、fenA、ituA、ituC、ituD、bymC 等脂肽类抗性基因,可显著降低番茄枯萎病病情指数,并对番茄植株生长有促进作用。

