黄龙病发病芦柑根际土壤细菌群落组成与多样性特征
雷美玲 饶文华 胡进锋 岳琪 吴祖建 范国成
(1.福建农林大学植物保护学院,福州 350002;2.福建省农业科学院植物保护研究所,福州 350013)
柑橘黄龙病(citrus Huanglongbing,HLB)是一种由韧皮部杆菌(Candidatus Liberibacter asiaticus,CLas)引起的细菌性病害,该细菌寄生在柑橘韧皮部。CLas 属于α-变形菌纲、根瘤菌目、根瘤菌科、韧皮部杆菌属。它主要感染芸香科柑橘属(Citrus L.)、枳属(Poncirus Raf.)和金柑属(Fortunella Swing)[1]。该病害具有传播速度快、危害性大、潜伏期长等特点,难以通过化合物进行有效的防治[2]。柑橘黄龙病主要是由宿主植物、环境、病原菌和柑橘木虱4 个主要因素相互作用而引起的。由于CLas无法进行离体培养,研究难度大,导致对其的防治极其困难[3-4]。目前,一些研究通过使用纳米药剂来提高柑橘韧皮部对药物的吸收效率,提高防治效果[5]。此外,还有研究使用石灰土壤pH 改良剂[6]、中微量营养元素[7]、抗氧化剂和赤霉素等方法来增强柑橘的抗病性。尽管这些措施具有一定的防治效果,尚无法从根本上解决问题。
有研究表明,柑橘黄龙病病原菌可以通过嫁接或木虱传播到柑橘韧皮部,然后通过维管束运输到柑橘根部并繁殖,导致根部受损。此外,根际的病原菌也会随着韧皮部汁液流动扩散到柑橘的其他部位,并表现出典型的黄龙病症状,健康水平也会下降[8-10]。植物与保护性根际微生物群之间存在相互作用。研究表明,当植物感染病原体后,会向根系发出信号,招募具有抗病和促进生长作用的有益微生物,以调整根际微生物群的组成,最大程度提高后代在同一土壤中的生存机会[11]。根际微生物群对植物的健康起着积极作用,帮助植物从土壤中获得所需的养分,并提供额外的宿主功能。它们通过各种生物化学机制实现互利共生,包括改变土壤肥力、提高植物抵御非生物和生物胁迫的能力,与植物病原体竞争等[12-14]。根际微生物群落由丰富的核心成员(在至少95%的叶片或根样本中检测到)、一些地点特定性的代表性成员以及低丰度可变的微生物群组成。其组成和多样性不仅与地理位置显著相关,还与植物品种有关[15]。根际细菌群落与植物之间的相互作用是双向的。研究表明,长刺蒺藜草(Cenchrus longispinus(Hack.)Fern.)入侵可以增加根际土壤中链霉菌属、红色杆菌属和类诺卡氏菌属微生物的丰度,从而影响根际土壤中的氮代谢过程[16]。CLas感染柑橘后会导致柑橘根际微生物群的重组,许多物种的丰度会下降,或者没有被检测到,或者被其他物种所取代。这种重组的菌群可以更好地耐受或适应压力条件[17-18]。
当前的研究表明,患病和健康的柑橘植株在根际土壤细菌群落上存在差异,但对其与根际微生物群的相互作用尚未有深入研究。本研究通过对福建南平地区患有黄龙病和健康的芦柑树根际土壤细菌群落多样性特征和组成的分析,探讨显著差异细菌的功能,并研究根际微生物群落结构特征与柑橘黄龙病发病情况之间的关系。旨在为柑橘根际土壤微生物组调控方式提供理论基础,为寻找绿色防治技术模式提供依据,促进柑橘产业的可持续发展。
1 材料与方法
1.1 材料
叶片和根系样品采集:本研究采集了福建省南平市顺昌县罗坑芦柑园的红壤土壤样本,采样日期为2022 年3 月8 日。该芦柑园位于东经117.8°,北纬27.0°,海拔170 m。根据芦柑树病症情况和田间经验,初步评估采集“健康”与“黄龙病”的芦柑树叶片与根际土壤样品。为了确保采样的均匀性和代表性,从每棵芦柑植株东西南北4 个方向,分别采集5-10 片成熟叶片并混合。采集时,尽可能保证每棵树上所采集的叶片在树体上基本处于相同的位置。根际土壤采用五点采样法来收集细根,且根系上附着土壤。共采集11 棵树的叶片和根际土壤样品,存放冰盒中带回实验室,叶片置于4℃冰箱,须根置于-80℃冰箱,以备后续试验。
根际土壤分离:将采集的芦柑须根放入无菌管中,加入50 mL PBS 缓冲液,用无菌镊子用力搅拌,以便从根表面分离根际土。移除根后,PBS 离心30 s,离心沉淀即为根际土,后续用于开展16S rRNA 扩增子测序实验。
试剂及仪器:植物DNA 试剂盒(杭州新景生物试剂开发有限公司)、真空冷冻干燥机(LGJ-25D,北京四环起航科技有限公司)、球磨仪(MM 400,Retsch)、漩涡振荡仪(MIX-25,杭州米欧仪器有限公司)、离心机(1-14,SIGMA)、电热恒温水浴锅(DK-S26,常州高德仪器制造有限公司)、电子天平(2011F145-11,赛多利斯科学仪器(北京)有限公司)、超微量分光光度计(NanoDrop ONEc,Thermo Scientific NanoDrop Microvolume Instruments)、手掌型离心机(LX-100,江苏海门市其林贝尔仪器制造有限公司)、q-PCR 仪(realplex4,Eppendorf)。
1.2 方法
1.2.1 土壤理化性质检测 土壤pH 测定以水为浸提剂,采用电位法测定。全氮(TN)利用凯氏定氮法、连续流动分析仪法和元素分析仪法测定,碱解氮(AN)采用碱解扩散法测定,速效钾(AK)采用中性乙酸铵溶液浸提、火焰光度计法测定,有机质(OM)采用重铬酸钾容量法-外加热法测定,有效磷(AP)采用氟化铵-盐酸溶液浸提酸性土壤、以钼锑抗比色法测定[19]。
1.2.2 柑橘黄龙病病原菌检测 采用无菌刀片取叶片中脉,并将其切碎成2-3 mm 的小段,置于无菌1.5 mL 离心管中,放入无菌钢珠,用真空冷冻干燥机处理24 h,球磨仪研磨至粉末,运用植物组织提取DNA 的试剂盒提取叶脉的总DNA,并使用超微量分光光度计检测DNA 浓度与质量。利用qPCR 法检测柑橘黄龙病菌,qPCR 反应引物购自艾科瑞生物公司:上游引物5'-TCGAGCGCGTATGCAATACG-3',下游引物5'-GCGTTATCCCGTAGAAAAAGGTAG-3',荧光探 针5'-(FAM)AGACGGGTGAGTAACGCG(BHQ-1)-3'。反应体系为20 μL[引物F(5 μmol/L)、引物R(5 μmol/L)、Taq Man(2.5 μmol/L)和样品各1 μL,2× Pro Taq HS Probe Premix 为10 μL,ddH2O 为6 μL],反应程序为95.0℃预热2 min;95.0℃ 10 s,58.0℃退火30 s,循环40 次。
根据qPCR 鉴定所采集的样品的真实患病情况,选择4 棵健康树体作为健康组样品,以及4 棵黄龙病树体作为发病组样品(qPCR 检测结果见表 1,田间芦柑植株和叶片情况见图1)。每个树体均进行3次重复,以进行微生物多样性检测实验。

图1 田间芦柑植株和叶片Fig.1 Plant and leaf of C.reticulata in field
1.2.3 文库构建和测序 基于16S rRNA 扩增子测序技术,抽提黄龙病发病芦柑与健康芦柑的根际土壤DNA,利用1%琼脂糖凝胶电泳检测。在16S rRNA的338F/806R 区域,合成带有barcode 的特异引物。每个样本3 次重复,将同一样本的PCR 产物混合后,使用AxyPrepDNA 凝胶回收试剂盒(AXYGEN 公司)切胶回收PCR 产物,Tris-HCl 洗脱,2%琼脂糖电泳检测,对PCR 产物定量与均一化,构建PE2×300文库,进行Illumina 测序(委托上海美吉生物医药科技有限公司完成)。
1.2.4 生物信息学分析 原始测序序列使用Trimmomatic 软件质控,使用FLASH 软件进行拼接。使用Uparse(version 7.0.1090)对序列进行OTU 聚类,根据97%相似度对序列进行OUT 聚类,并在聚类过程中去除单序列和嵌合体。利用RDP classifier对每条序列进行物种分类注释,比对Silva 数据库(138),设置比对阈值为0.7。OTU 水平上,对发病组和健康组样品进行Alpha 多样性分析,全面了解两组样本的物种多样性及差异。门、科和属水平上,通过Venn 图比较发病组和健康组中的共有和特有细菌群落。门水平上,通过群落Pie 图直观展示样本中微生物的存在情况和各微生物的相对丰度分布。随后,属水平上筛选出发病组和健康组(其中发病组为黄龙病发病芦柑植株根际土壤样品组,健康组为健康芦柑植株根际土壤样品组)中显著差异的细菌物种。最后,通过分析环境因子与物种层级之间的关系,探讨它们之间的相互影响,为深入理解微生物群落在发病过程中的作用提供重要线索。

表1 柑橘黄龙病病原菌qPCR 检测结果Table 1 qPCR detection of citrus HLB pathogen
1.2.5 数据统计分析 所有统计分析利用开源软件R 3.3.1 完成。微生物群落的Alpha 多样性通过mothur(version v.1.30.2)进行指数分析,采用97%的OTU 相似水平作为评估标准,全面了解样本内的多样性水平。为进一步探索样本之间的差异,采用Venn 图分析,选取门、科和属水平的样本表,并借助R 语言(version 3.3.1)进行统计和图示处理。此外,基于tax_summary_a 文件夹中的数据表,利用R 语言绘制不同分组群落的饼图,直观展示了各类群的相对丰度分布情况。NMDS 分析beta 多样性距离矩阵。利用R 语言中的vegan 软件包(v2.4.3)进行NMDS 分析和作图,揭示样本间的群落结构差异。差异物种分析采用Student-t 检验,对P 值不进行校正,置信度设定为0.95。此外,运用DP 方法计算影响大小,通过Welch t 检验方法计算置信区间,使用R 语言的stats 包和python 的scipy 包(v1.0.0)进行分析。最后,采用Spearman 等级相关系数计算环境因子与物种之间的关联,将相关矩阵可视化为Heatmap 图,利用R 语言中的pheatmap package 进行展示。
2 结果
2.1 健康与黄龙病发病芦柑植株根际土壤理化性质
健康与黄龙病发病芦柑植株根际土壤理化性质结果显示,芦柑园土壤呈酸性土壤,而黄龙病发病芦柑根际土壤的速效钾(164 mg/kg)、有效磷(81.50 mg/kg)、全氮(0.225%)以及有机质(38.7 g/kg)的含量低于健康芦柑根际土壤(速效钾:167 mg/kg,有效磷:82.20 mg/kg,全氮:0.233%,有机质:40.9 g/kg),但pH 值(3.85)高于健康芦柑根际土壤(pH 3.78),表明黄龙病发病芦柑根际土壤的营养成分含量低于健康芦柑根际土壤。
2.2 健康与黄龙病发病芦柑植株根际土壤细菌群落的多样性
经Alpha 多样性分析(图2)发现,黄龙病发病芦柑和健康芦柑根际的coverage 值均超过98%,这表明测序数据的完整性较高,可用于进一步的分析。黄龙病发病组的平均Chao 指数为1 404.12,而健康组的平均Chao 指数为1 265.33,表明黄龙病发病芦柑根际土壤中的细菌丰富度高于健康样本。此外,黄龙病发病芦柑植株根际土壤的Shannon 指数为5.35;而健康植株根际土壤的Shannon 指数为5.28。表明黄龙病发病芦柑植株根际土壤中的细菌多样性与健康芦柑植株的差异并不显著,但整体上略高于健康芦柑。
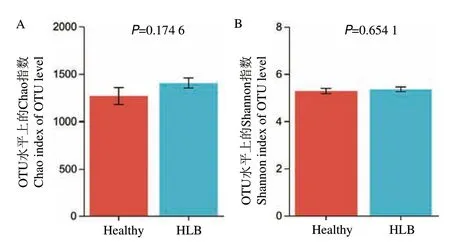
图2 健康组与发病组在OTU 水平的Alpha 多样性指数分析Fig.2 Alpha diversity index of healthy group and HLB group at the OTU level
2.3 健康与黄龙病发病芦柑植株根际土壤细菌群落的结构
非度量多维尺度分析(NMDS)结果(图3)显示,stress 值为0.133,小于0.2,表明二维点图具有一定的解释意义。此外,P 值为0.002,小于0.05,并且R2值为0.119 2,说明两个样本点的分布存在一定的距离,且它们的物种组成之间存在显著差异。
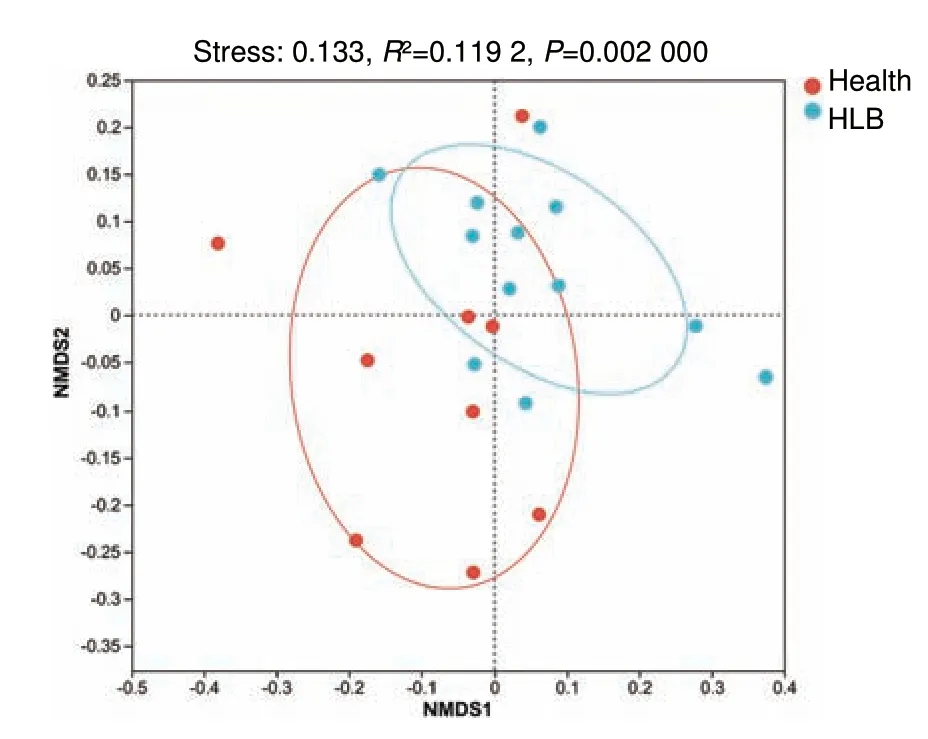
图3 健康组与发病组在OTU 水平的非度量多维尺度分析Fig.3 NMDS analysis of healthy group and HLB group at the OTU level
2.4 健康与黄龙病发病芦柑植株根际土壤细菌群落的组成
对健康和黄龙病发病芦柑植株根际土壤中的细菌进行OTU 聚类分析,共鉴定出2 601 个OTU,分属27 个门、78 个纲、196 个目、327 个科、579 个属和1 086 个种。通过图4 可统计发病组和健康组样品中细菌群落中特有和共有的物种,直观展现了在门、科和属的分类水平上,健康组和发病组样本中细菌群落的组成情况。结果表明,健康组和发病组样本中细菌群落的组成存在较大的差异。在门的水平上,健康组和黄龙病发病芦柑根际共有23 个门,发病组有27 个门,其中4 个门是特有的,包括脱硫杆菌门(Desulfobacterota,占比0.003 6%)、盐厌氧菌门(Halanaerobiaeota,占比0.002 7%)、纤维杆菌门(Fibrobacterota,占比0.002 1%)和弯曲杆菌门(Campilobacterota,占比0.001 8%),而健康组没有独有的门。在科的水平上,健康组和发病组共有283 个科,健康组有299 个科,其中16 个科是特有的,而发病组有311 个科,其中28 个科是特有的。在属的水平上,健康组和发病组共有491 个属,健康组有517 个属,其中26 个属是特有的,而发病组有553 个属,其中62 个属是特有的。
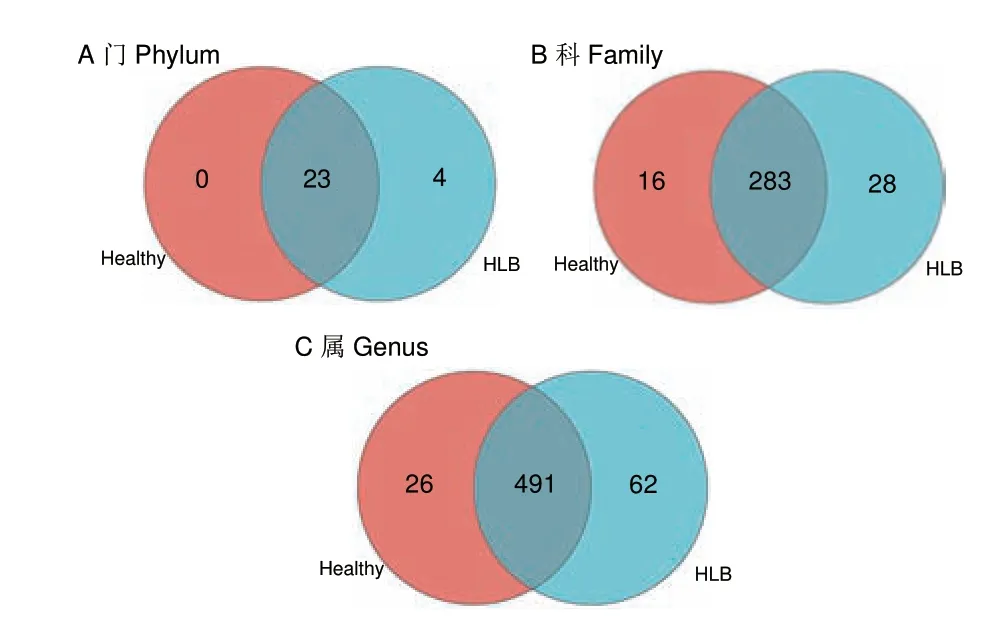
图4 发病组与健康组样品在门、科和属水平上共有和独有的物种情况图Fig.4 Common and unique species of HLB group and healthy group at the phylum,family and genus level
发病组和健康组的细菌群落组成基本相同,但相对含量有所不同(图5)。在门的水平上,健康组和发病组的细菌群落优势菌种主要包括酸杆菌门(Acidobacteriota)、厚壁菌 门(Firmicutes)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、变形菌 门(Proteobacteria)、WPS__2、浮霉菌 门(Planctomycetota)和拟杆菌门(Bacteroidota)。然而,在黄龙病发病芦柑根际土壤中,酸杆菌门、变形菌门和拟杆菌门的相对含量明显上升。其中,变形菌门的相对含量最高,达到29.24%。相比之下,健康植株的优势菌群属于放线菌门,其相对含量为30.19%,明显高于黄龙病发病芦柑植株(26.35%)。
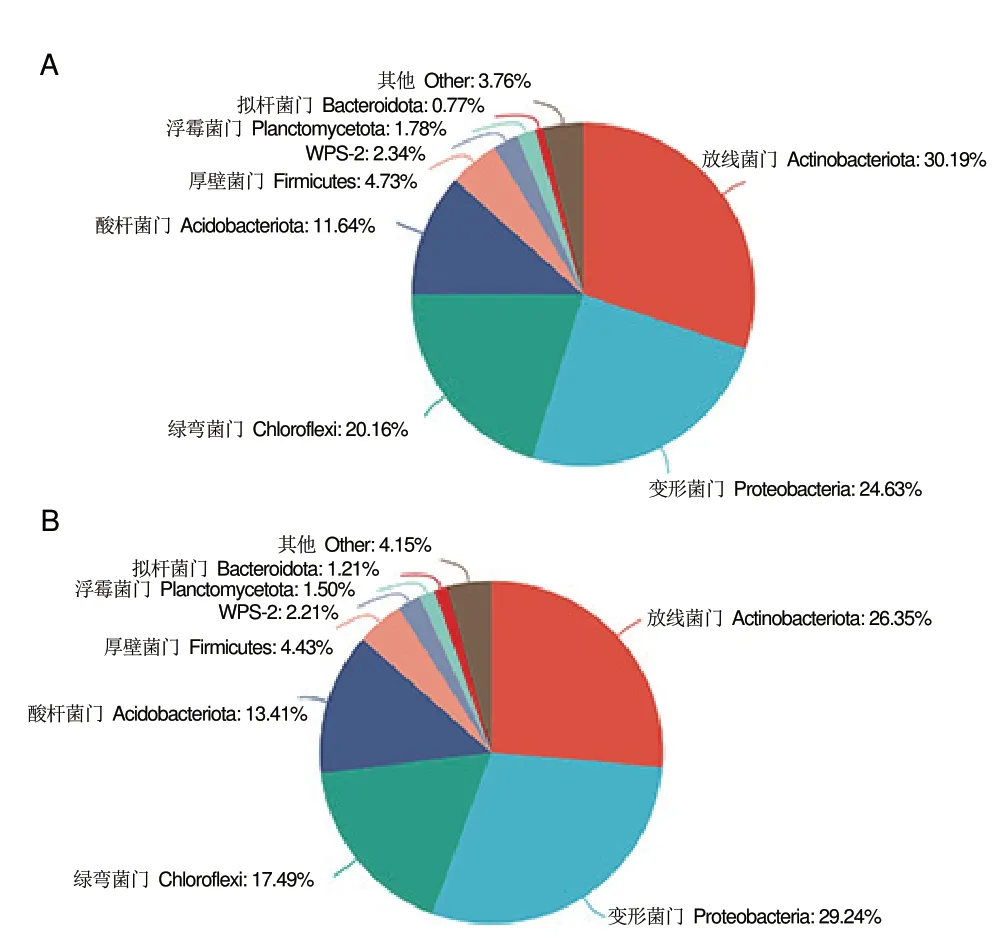
图5 健康组(A)与发病组(B)细菌群落丰度在门水平上的相对丰度比较Fig.5 Comparison of bacterial community abundance at the phylum level between healthy group(A)and HLB group(B)
在属水平上,发病组相对于健康组,芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、慢生根瘤菌属(Bradyrhizobium)、伯克霍尔德菌属(Burkholderia)、鞘氨醇单胞菌属(Sphingomonas)、中根瘤菌属(Mesorhizobium)的相对含量比健康组低(低0.002%-0.476%),铜菌属(Cupriavidus)、细胞弧菌属(Cellvibrio)、变异菌属(Variovorax)的相对含量比健康组高(高0.002%-0.047%)(表2)。
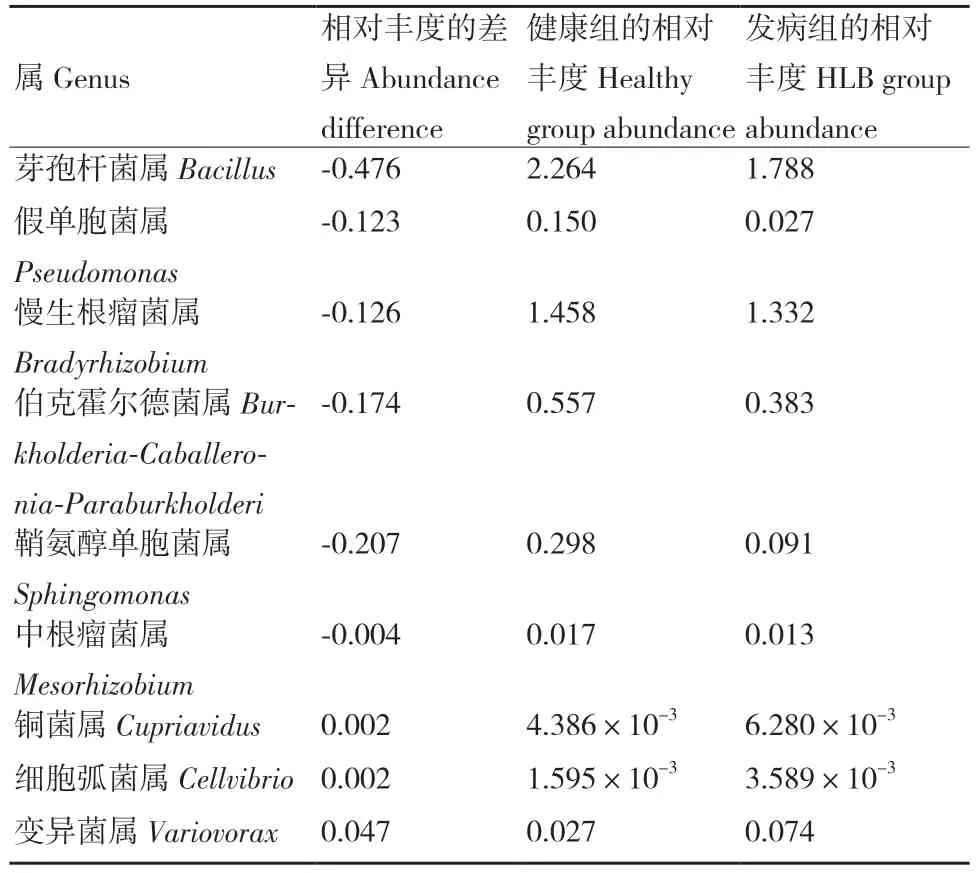
表2 健康组与发病组柑橘根际部分细菌群在属水平上的相对丰度比较Table 2 Comparative study on the relative abundance of rhizosphere part of the bacteria between healthy group and HLB group at the genus level
2.5 健康与黄龙病发病芦柑植株根际土壤细菌群落的显著性差异物种
在门水平上具有显著差异的前15 个门中,FCPU426 门在两个样本之间存在极显著差异(P <0.01),且发病组丰富度(0.046 1%)高于健康组(0.006 8%),其他门的差异不显著(图6-A)。在属水平上具有显著差异的前15 个属中,发病组的丰度极显著高于健康组的有蔷薇属(Roseiarcus)、norank_f_Xanthobacteraceae(黄杆菌 科)、norank_f_Acetobacteraceae(醋酸杆菌科),显著高于健康组的有嗜酸性杆菌属(Acidiphilium)、norank_f_SC-I-84、unclassified_f_Streptomycetaceae(链霉菌科)(P<0.05),而发病组丰度极显著低于健康组的有康奈斯氏杆菌属(Conexibacter)、褚氏杆菌属(Chujaibacter)、Jatrophihabitans、嗜酸菌属(Acidipila)、Sporosarcina、Nitrolancea,显著低于健康组的有FCPS473、norank_f_norank_o_IMCC26256、norank_f_JG30-KF-CM45(图6-B)。
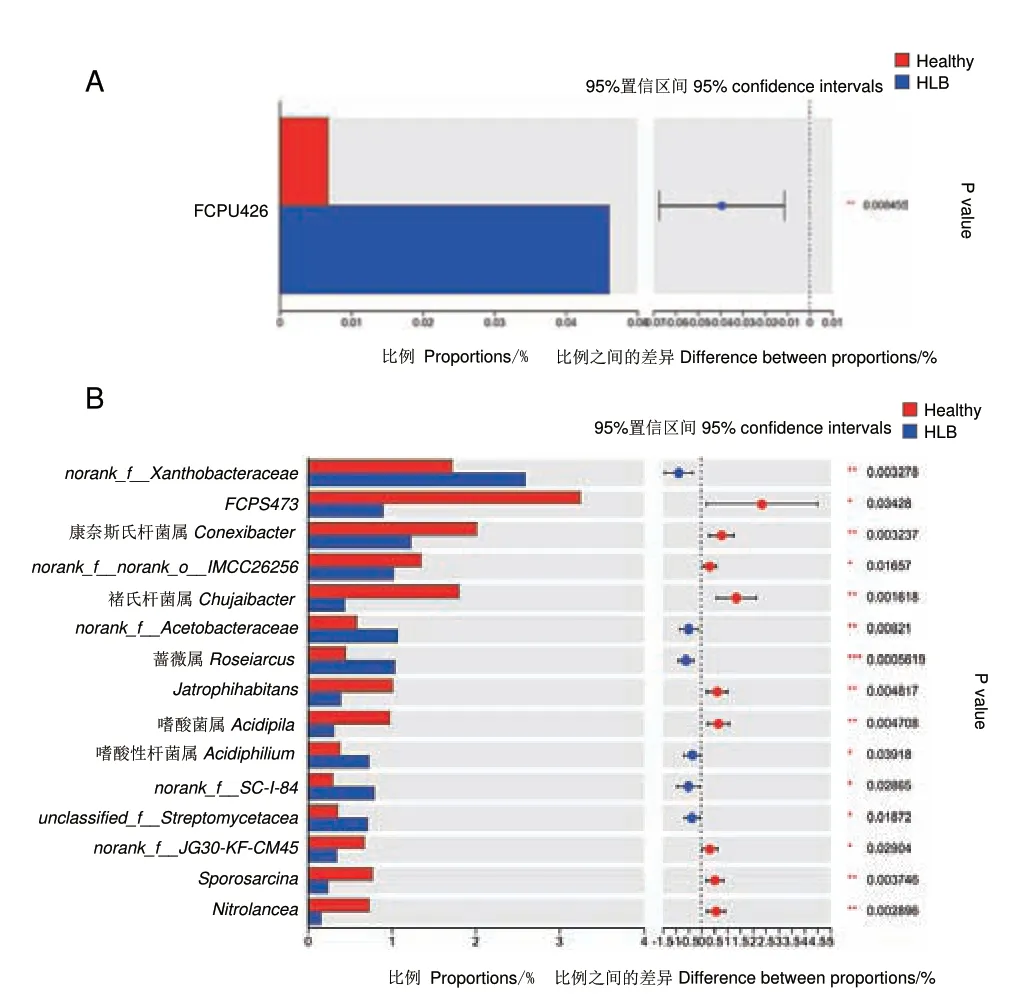
图6 健康组与发病组细菌群落在门(A)、属(B)水平相对丰度显著差异分析Fig.6 Significant difference in relative abundance of bacteria at the phylum(A)and genus(B)level between healthy and HLB groups
2.6 健康与黄龙病发病芦柑植株根际土壤细菌群落和环境因子之间的相关性
相关性热图结果(图7)显示,健康与黄龙病发病芦柑植株的根际土壤微生物群落受到环境因子的影响。属水平上,norank_f_Xanthobacteraceae、蔷薇属、norank_f_Acetobacteraceae、norank_f_SC-I-84、norank_f_norank_o_Subgroup_2、嗜酸性杆菌属和unclassified_f_Streptomycetaceae 的相对丰度与速效钾、有效磷以及有机质的含量呈显著负相关,而与pH 值呈显著正相关。与之相反,FCPS473、褚氏杆菌属、嗜酸菌属、Sporosarcina、康奈斯氏杆菌属、Jatrophihabitans、Nitrolancea、norank_f_norank_o_IMCC26256、norank_f_Gemmataceae 和norank_f_JG30-KF-CM45 与速效钾、有效磷以及有机质呈显著正相关,与pH 值呈显著负相关。
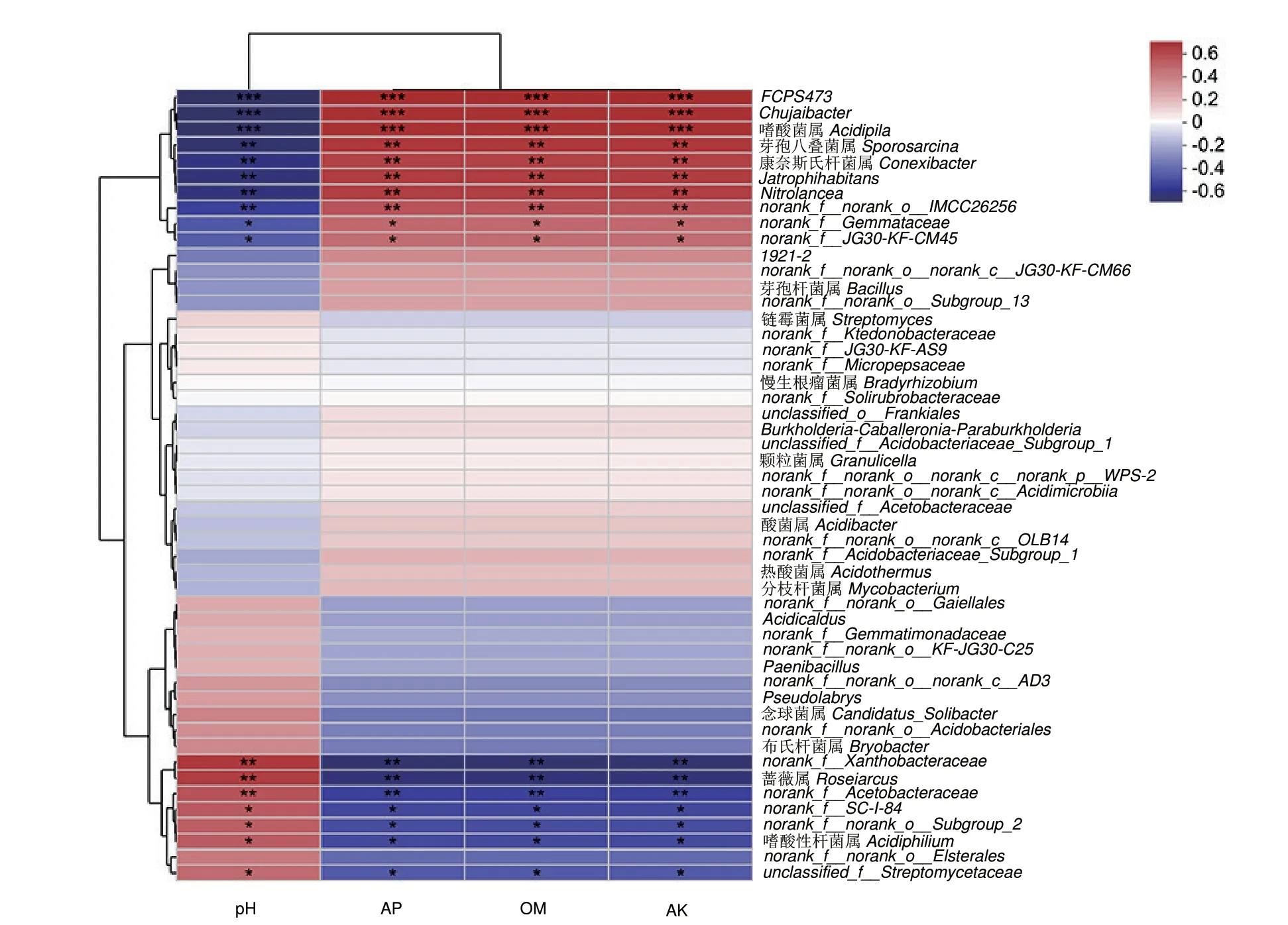
图7 属水平健康与黄龙病发病芦柑植株根际土壤细菌群落和环境因子之间的相关性Fig.7 Correlation between bacterial community and environmental factors in the rhizosphere soil of healthy and HLB-infected citrus plants at the genus level
3 讨论
植物根际微生物与其根系分泌物相互作用,形成了复杂的根际生态系统以维持植物健康生长环境。根际微生物群对植物适应生物和非生物胁迫具有重要调节作用[20]。根际细菌群落多样性和稳定性影响着土壤质量、植物健康和生态系统能量流动。病原体感染也会引发植物生理变化,对根际群落组成和功能产生不同影响[14,18]。本研究以扩增子测序技术和生物信息学方法,系统分析了福建南平地区患有黄龙病和健康芦柑树的根际土壤细菌群落多样性和结构组成,探讨显著差异细菌的潜在功能,明确了根际微生物群落结构特征与柑橘黄龙病发病情况间的关系,为通过土壤改良,调控柑橘根际土壤微生物组成的柑橘健身栽培提供理论基础。
黄龙病发病与健康的芦柑植株根际土壤微生物群落组成和多样性存在显著差异。黄龙病发病芦柑的根际土壤细菌群落多样性稍高于健康芦柑,这与秦泰春等[21-23]的研究结果相似,表明黄龙病病菌可能会破坏芦柑植株根际土壤细菌群落的生态平衡,导致某些细菌菌群的数量异常增加或减少。然而,在建立新的平衡之前,这种变化可能会持续存在。因此,需要进一步研究来了解黄龙病病菌与根际土壤细菌群落之间的相互作用机制,以及其对长期的影响。研究结果表明,发病组与健康组的优势物种组成基本相同,但优势物种的相对含量存在差异。健康组中最主要的优势种属于放线菌门,这些放线菌能够产生广泛的抗细菌、抗真菌和植物生长代谢物,有助于柑橘植株对抗黄龙病病原体和调节自身生长[24]。属水平上,发病组的芽孢杆菌属、假单胞菌属、慢生根瘤菌属、伯克霍尔德菌属、鞘氨醇单胞菌属和中根瘤菌属的丰度较健康植株低。已有研究结果显示,芽孢杆菌与根瘤菌的共同接种可以促进维生素和植物激素的产生,进而增加结瘤[25-26]。Bacillus sp.能够促进植物生长,并增加作物产量[27]。研究还指出伯克霍尔德菌属、农杆菌属、慢生根瘤菌属、铜菌属、根瘤菌属、假单胞菌属、中根瘤菌属、细胞弧菌属、变异菌属、鞘氨醇单胞菌属和副根瘤菌属是柑橘根际的核心细菌群。其中,伯克霍尔德菌属、假单胞菌属、慢生根瘤菌属和根瘤菌属在不同环境中被发现具有抑制植物病害的潜力,可作为潜在的益生菌[28-30]。
黄龙病会改变柑橘植株根际土壤理化特征,并影响有益细菌的相对丰度。黄龙病发病芦柑植株的根际土壤含有较低的速效钾、有效磷和有机质,而pH 值变高,该结果与陈杰等[31]、段春梅等[32]的研究结果一致,可能是由于芦柑植株在抵抗黄龙病菌侵害时需要消耗更多的能量,从而增加对土壤营养物质的消耗。属水平分析发现,发病组9 种细菌(康奈斯氏杆菌属、褚氏杆菌属、Jatrophihabitans、嗜酸菌属、Sporosarcina、Nitrolancea、FCPS473、norank_f_norank_o_IMCC26256、norank_f_JG30-KF-CM45)的丰富度低于健康组,并且存在显著差异。这些细菌与速效钾、有效磷以及有机质呈显著正相关。研究表明,康奈斯氏杆菌属的相对丰度增加与植物生长正相关[33],而其相对丰度的降低可能不利于植物成长。此外,褚氏杆菌属在硫丹胁迫下可能降解有机氯农药林丹[34]。Jatrophihabitans sp.GAS493 在土壤中对非重氮类多糖进行降解,具有潜在的功能[35],其相对丰度的降低会导致土壤中潜在的有机质分解减少。Nitrolancea 有的菌株是温和条件下需氧的化石自营细菌,能将亚硝酸盐转化为硝酸盐,并以二氧化碳作为碳源[36],其相对丰度的降低会导致土壤有机质含量降低。另一方面,发病组的6 种细菌(蔷薇属、norank_f_Xanthobacteraceae、norank_f_Acetobacteraceae、嗜酸性杆菌属、norank_f_SC-I-84、unclassified_f_Streptomycetaceae)的相对丰度与健康组相比具有显著差异,且高于健康组,与速效钾、有效磷以及有机质呈显著负相关。研究表明醋酸杆菌科的一些菌株,如药用内杆菌(Endobacter medicaginis),可以促进植物生长,具有固氮、植物激素合成、磷和锌的增溶以及生物防治等特性[37-39]。蔷薇属在根际氮矿化中起着重要作用,参与营养矿化、生物控制和胁迫耐受等生理生化过程[40]。嗜酸性杆菌属是一种严格的好氧、无机盐自养细菌,能够抵抗高浓度的锌和镍重金属离子[41],能利用铁作为电子受体氧化有机化合物[42-44],并具有CO2同化、甲烷代谢能力和氮源利用等水平转移基因[45],在根际环境中对植物生长和土壤健康起到重要的积极作用。另外,链霉菌科菌株JX02 和JX06 在土壤修复等方面发挥积极的作用[46]。上述研究结果表明,芦柑感染黄龙病后,芦柑树体能够招募具有促进植物根际生长、固氮和利用氮源能力的细菌来增强对黄龙病的防御和控制能力。
4 结论
本研究发现黄龙病菌侵染不仅对芦柑植株根际土壤细菌群物种组成和相对丰度变化产生显著影响,还导致芦柑植株根际土壤pH 值升高,速效钾和有效磷等土壤理化指标降低,从而降低康奈斯氏杆菌属和褚氏杆菌属等有益细菌的相对丰度。黄龙病发病芦柑植株能够吸引蔷薇属和嗜酸性杆菌属等有益细菌,以对抗病原微生物侵害。
致谢
感谢福建省农业科学院资源环境与土壤肥料研究所刘国红副研究员在试验设计与论文写作方面提供的帮助。

