盐胁迫下氮素对花生种子萌发和种子际细菌菌群结构的调控
徐扬 张瑞英 戴良香 张冠初 丁红 张智猛
(1.山东省花生研究所,青岛 266100;2.山东省招远市毕郭镇人民政府,烟台 265412)
花生是我国重要的经济和油料作物之一,在国民生产中占有重要地位。随着社会发展和居民膳食结构的改善,人们对于食用植物油的需求与日俱增。若通过扩大油料作物的种植面积,势必会加剧粮油争地的矛盾。我国盐碱地面积辽阔,约3.6×107hm2[1],因此,开发盐碱地是缓解粮油争地矛盾的可行措施之一。花生属豆科固氮作物,耐瘠抗旱,并具备较强盐碱耐受能力,是目前较适宜在盐碱地区种植的经济和油料作物之一[2-3]。盐胁迫属于复合胁迫,其引发的离子毒害和渗透胁迫可显著抑制种子活力和发芽率,最终降低作物产量[4]。因此,提高盐碱地花生发芽出苗率是保证盐碱地花生产业发展的重要前提。
氮是作物生长发育必需的大量元素之一,是植物体内蛋白质、氨基酸、叶绿素等的重要组成成分[5],也是盐碱地极度缺乏的重要营养元素之一。因此,提高盐碱地作物的氮素利用效率,对盐渍化土壤保肥、作物增产增收具有重要意义[6]。目前,盐碱地施氮主要涉及作物产量[7]以及养分积累和利用效率等方面的研究[8]。种子萌发前的营养状况也会直接影响其萌发率和幼苗素质[9-11],但盐碱地氮素利用与种子萌发出苗间的关系目前研究较少。有研究发现合理增施氮肥可以提高盐胁迫下偃麦草属牧草的发芽率[12];增施氮素也可提高甜高粱的发芽率,且NH4Cl 的促进效果优于KNO3[13];低浓度氮肥虽然可以提高盐角草种子的发芽率,但当氮浓度增加到357 mmol/L 时,发芽率随氮素浓度增加而降低[14]。
盐胁迫下适量氮肥施加有助于植物种子的萌发和幼苗的耐盐,但过量的氮肥供应却适得其反。因此,合理控制氮肥施加可有效提升作物在盐环境下的生存。此外,近几年越来越多的研究显示,种子际微生物菌群结构与种子的萌发密切相关,盐胁迫改变花生种子际土壤细菌菌群结构已有报道[3,15],但盐胁迫下氮肥施加与种子际菌群结构的关系仍然未知。
本研究以花生品种花育25(HY25)为研究对象,结合不同氮素水平,研究盐胁迫下不同施氮量对花生发芽率和荚果产量的影响,并结合高通量测序技术进一步对种子际土壤细菌种类和菌群结构进行系统分析,旨在确立盐胁迫下施氮对花生种子际土壤细菌群落结构平衡、种子发芽率和荚果产量的影响,为盐碱地花生出苗、高产栽培提供依据和技术指导。
1 材料与方法
1.1 材料
供试花生品种为HY25。供试土壤采自山东省莱西市望城镇(36.86°N,120.53°E)耕地0-20 cm表层土,土壤类型为褐土,基础养分:全氮1.21 g/kg、有机质12.8 g/kg、速效氮63.5 mg/kg、速效磷17.1 mg/kg、速效钾95.3 mg/kg、pH 6.5。
1.2 方法
1.2.1 试验设计 试验分别在山东省花生研究所日光温室和莱西实验站田间进行,均采用盆栽试验。
田间盆栽试验采用直径32 cm,高26 cm 的盆栽塑料盆,每盆装土25 kg,装土、施肥、混盐(NaCl)后将栽培盆置于沟深10 cm 的畦田中。设置两种盐浓度和3 个施氮水平,分别为非盐胁迫的原土土壤(莱西试验站田间0-20 cm 土层土壤)和3‰含盐土壤,均为施用氮肥(尿素)0(N)、90(M)和180(H)kg/hm2三个水平。3‰盐胁迫处理以NaCl 含量进行调节,NaCl∶土壤=3∶1 000(质量比);氮肥以尿素形式施入,施氮量分别为不施氮(N)、每盆施氮0.72 g(M,90 kg/hm2)、每盆施氮1.44 g(H,180 kg/hm2)3 个水平[16]。非盐碱原土和盐土3 个施氮量处理分别计为不施氮(CN,SN)、施氮90 kg/hm2(CM,SM)、施氮180 kg/hm2(CH,SH),装盆前将称好的NaCl 和氮肥以盆为单位与土壤混匀后,每盆灌水3 000 mL 以沉实土壤,自然蒸发至合适土壤墒情备播。选取经晾晒剥壳后饱满、无破损的花生种子5 kg,用0.5%的次氯酸钠消毒后,再用无菌水冲洗5-6 次后备用。每盆播种7 粒并将各粒间距均匀分布,播深3 cm,均保持种子横向播入,待花生出苗后进行间苗,每盆留长势一致的4 株花生。6 次重复,随机排列,管理同常规大田,成熟期以盆为单位收获、考种、计产。
1.2.2 花生种子发芽率统计和种子际土样的采集 另选用高10.5 cm、上内径12.5 cm、下内径8.5 cm 的圆台形塑料营养盆钵,每钵装土0.75 kg,盐胁迫与施氮处理同上。盐、氮肥与土壤混合均匀后,每钵浇50 mL 无菌水,置于人工气候室中(25℃,16 h 光照/8 h 黑暗,土壤湿度保持60%-70%)沉实、蒸发、备播。每盆播10 粒种子,均匀分布于每钵的播种土层,每粒种子的间距均保持≤20 mm,播深均为3 cm,保持种子横向,重复10 次,共播种240 盆。自播种之日起每天进行种子发芽率统计,播种后1 d开始测量不同处理种子下胚轴长度,连续统计10 d。每天随机选取3 盆进行种子发芽率调查,计算其发芽率(胚根顶破种皮3 mm 视为发芽)。所有试验进行3 次生物学重复。
种子际土壤样品采集于播种后3 d 开始,此时大部分种子的胚根已伸出,为胚根伸长期[3]。分别采集不同处理的种子际土壤样本。各处理以盆钵为单位将其移至灭菌的锡箔纸上,在超净工作台上采取各盆钵中种子周围1-10 mm 土壤,混合均匀后装入无菌袋中封存。采集的自然空白土壤作为对照(CK),外施氮肥原土种子际土壤样品分别命名为CNS(氮用量0 kg/hm2)、CMS(氮用量90 kg/hm2)和CHS(氮用量180 kg/hm2);外施氮肥盐土种子际土壤样品分别命名为SNS、SNS 和SHS。每6 盆相同处理所取的土壤样品混合为1 个生物学土壤重复样本,共进行3 次生物学重复。空白土壤样本分别命名为CK1、CK2、CK3;外施氮肥原土种子际土壤样品命名为CNS1、CNS2、CNS3,CMS1、CMS2、CMS3,CHS1、CHS2、CHS3;外施氮肥盐土种子际土壤 样品命名为SNS1、SNS2、SNS3,SMS1、SMS2、SMS3,SHS1、SHS2、SHS3。上述所有样品的菌群测序,在北京百迈克生物科技有限公司同批次进行。
发芽率(%)=(发芽种子数/供试花生种子总数)×100%[17-18]。
1.2.3 16S rRNA 测序利 用PowerSoil® DNA Isolation kit(MoBio Laboratories,Inc.,Carlsbad,CA,USA)试剂盒对采集的不同处理土壤样本提取DNA,并进行浓度(分光光度计)和纯度(琼脂糖凝胶电泳)检测[19]。以检测合格的土壤样品DNA 为模板,利用16S 测序引物338F(Forward primer:5'-ACTCCTACGGGAGGCAGCA-3')和806R(Reverse primer:5'-GGACTACHVGGGTWTCTAAT-3')进行土壤细菌V3-V4 区域扩增。利用MiseqPE300 平台进行双端测序,利用FLASH 20 进行序列拼接,用Quantitative Insights Into Microbial Ecology(QIIME)对原始数据进行质控过滤。最后利用Usearch 平台(version 7.0,http://drive5.com/uparse/)在相似 性97% 水 平上对序列进行聚类,将相似度高于97%的定义为一个聚类操作分类单元OTUs(operational taxonomic units),通过比对SILVA 细菌16S rRNA 数据库(Release 119,http://www.arb-silva.de)获得OTU 分类学注释,确定不同分类水平[18]。所有16S rRNA 测序的原始序列已上传NCBI(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA1013931),序列号为BioProject PRJNA1013931。
1.2.4 生物信息学分析 利用Mothur 软件(version v.1.30,http://www.mothur.org/)进行细菌群落α 多样性分析。使用主成分分析(principal component analysis,PCA)、样本层次聚类分析(hierarchical clustering tree)和ANOIMS 分析完 成β 多样性 分析[20]。通过RDA(redundancy analysis)预测分析土壤细菌菌群结构与土壤理化因子间的相关性[21]。利用百迈客云数据分析平台(http://www.biocloud.net/)对细菌16S rRNA 测序数据进行分析。
1.2.5 数据处理 采用SPSS 18.0 软件中Student’s t-test(P<0.05)和单因素方差分析(one-way ANOVA)进行统计学方差分析。利用Excel 2003 和GraphPad Prism 7 软件作图,图表中数据为平均值±标准差。
2 结果
2.1 盐胁迫下氮肥施用量对花生种子萌发的影响
由图1 可知,正常条件下,各氮肥处理间花生发芽率随时间变化基本一致,至6 d 时均达100%,但3 d 时CM 和CH 较CN 的发芽率分别提高47.54%和18.17%。与正常条件相比,盐胁迫处理显著降低了种子的发芽率。盐胁迫下不同氮肥用量间的发芽率存在差异,随施氮量的增加呈先提高后降低的趋势,SN 发芽速率慢、发芽率低,SM 萌发速率和发芽率均较高,至10 d 时,SN 发芽率最低(65.9%)、SH 次之(76.0%)、SM 发芽率最高(79.3%)。表明盐胁迫抑制花生种子萌发,施加氮肥可部分缓解这种抑制效果,但过高的氮肥用量对花生种子萌发有负作用。综上,最适氮肥施用量为90 kg/hm2。

图1 盐胁迫下不同氮肥施用对花生萌发的影响Fig.1 Effects of different nitrogen fertilizer applications on peanut germination under salt stress
2.2 盐胁迫下氮肥施用量对花生产量和产量构成因素的影响
由表1 可知,与正常条件相比,盐胁迫处理显著降低了花生荚果产量,SN、SM、SH 各水平的百果重和百仁重分别较对照CN、CM、CH 降低10.87%、10.34%、10.30% 和10.18%、9.10%、10.24%。盐胁迫下,与未施氮SN 相比,SM 水平的百果重、百仁重和出米率分别增加9.06%、8.85%和7.02%;SH 水平的百果重、百仁重和出米率分别增加9.56%、8.89%和7.44%。综上,盐胁迫显著降低花生产量,施氮可以提高花生产量,由各产量构成因素的综合提高所致。此外,因高氮与中氮对产量无显著差异(表1),从经济环保角度出发,最适氮肥施用量为90 kg/hm2。
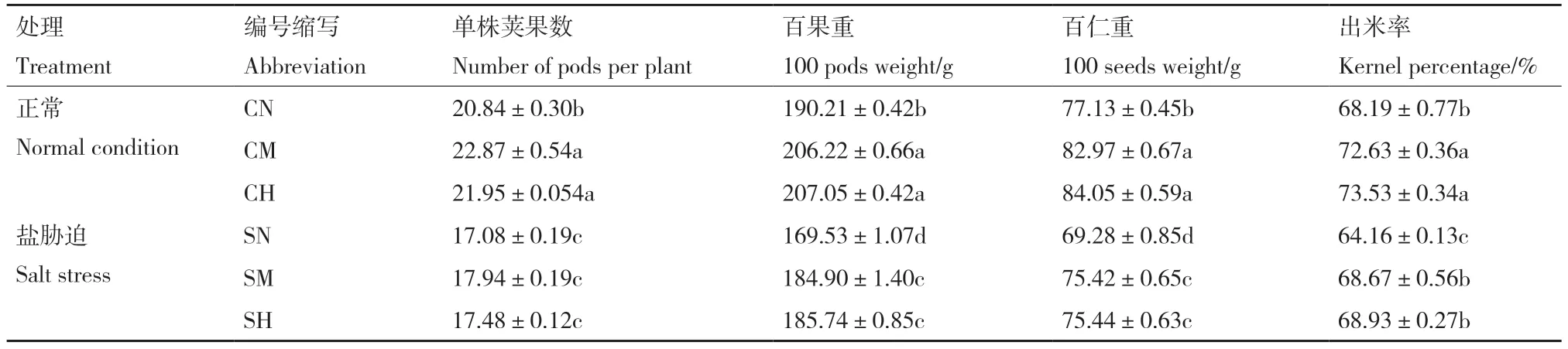
表1 不同处理条件下花生产量构成因素统计Table 1 Statistics of yield components of peanut under different treatments
2.3 α多样性分析
α 多样性分析可以检测土壤微生物群落的丰富度和多样性,其中,稀释性曲线(rarefaction curve)分析显示,各样本在测序量达到1 500 时,所有土壤样本曲线均趋于平缓,说明测序深度足够,基本覆盖所测样本内的所有物种(图2-A)。等级丰度曲线(rank abundance curve)能直观地显现各样本中OTUs 的均匀度和丰富度(图2-B),各物种的相对丰度在不同土壤样本中按从高到低依次排列,当OTU 数量大于1 250 时,相对应的物种相对丰度较低,但曲线较平缓,物种分布较均匀。物种累计曲线(species accumulation curves)初始表现为急剧上升,由于随着初始抽样量的加大,群落中大量的物种被发现,而至1 860 抽样量时,物种累积速率变得缓慢,曲线不再急剧上升而是趋于平缓,表明抽样量充分,可进行数据分析(图2-C)。

图2 α 多样性分析Fig.2 α diversity analysis
2.4 β多样性分析
β 多样性利用各样本序列间的进化关系及丰度信息来计算样本间距离,反映样本间是否具有显著的微生物群落差异,其中包括主坐标分析(principal component analysis,PCA),是研究数据相似性或差异性的可视化方法,如图3-A 所示,正常条件下不同氮肥处理种子际土壤组间CNS、CMS、CHS 与空白对照组CK 菌群相似度大,差异较小,基本分布于同一象限;盐胁迫下,不同氮肥处理种子际土壤组间SNS 和SMS 较相似,位于PC1 正半轴,SHS 位于PC1 负半轴,差异较大,分布于不同象限。盐与非盐处理种子际土壤组间比较显示,盐处理3 个组与非盐处理3 个组差异均较大,分布在不同象限,说明盐处理对花生种子际土壤细菌菌群结构影响较大。β 多样性中样本层次聚类分析(hierarchical clusteringtree)显示除SHS 外,同一样本的3 次重复间差异较小,聚集到同一分支,说明3 次平行重复性较好;但盐与非盐处理聚集于不同分支,距离较远,差异较大;而盐或非盐胁迫下不同氮素处理组间差异较小,距离较近(图3-B)。另外,ANOIMS 相似性分析显示,不同处理组间差异较大,同一处理组内3次重复之间差异较小(R2=0.348,P=0.001,图3-C)。由此可知,盐处理对花生种子际细菌群落结构影响较氮肥处理大,3 次平行重复性好,数据可信度较高。

图3 β 多样性分析Fig.3 β diversity analysis
2.5 物种组成及样本间差异比较
2.5.1 全样本门水平菌群结构分析 由图4-A 可见,各条件下的花生种子际土壤样本均以变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)及芽孢杆菌门(Gemmatimonadetes)等为共有优势菌门,其相对丰度之和占总菌量的93%以上,但在不同样本中存在明显差异。正常条件下,不同氮素处理组间菌群结构差异较小;盐胁迫下,SMS 和SHS 中变形菌门较无氮处理SNS 提高38.54%和76.69%,放线菌门较SNS 降低10.24%和58.16%。除SHS,盐处理显著降低变形菌门的丰度,SNS 和SMS 分别较对照CNS 和CMS 降低51.53%和33.40%;但显著提高酸杆菌门的丰度,SNS 和SMS 分别较对照不同氮肥处理组提高89.66%和92.31%。另外,SNS 中绿弯菌门的丰度显著高于CNS,约高25.67%,SMS 中芽孢杆菌门丰度显著低于CMS,约29.45%;高氮处理SHS 与对照CHS 间无显著差异。盐处理改变种子际土壤细菌菌群结构,但是高氮处理可以一定程度上缓解盐胁迫造成的菌群结构的变化。
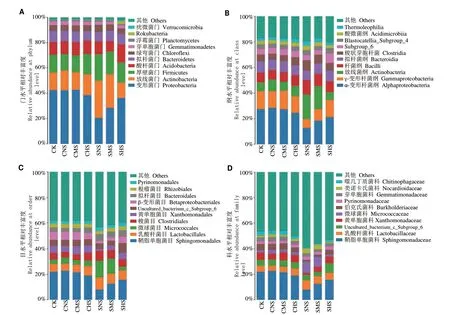
图4 物种组成及样本间差异比较Fig.4 Comparison of species composition and differences between diverse groups
2.5.2 全样本纲、目、科水平菌群结构分析 纲水平的分析结果(图4-B)显示,不同处理情况下的种子际土壤优势菌纲均主要为α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、放线菌纲(Actinobacteria)、杆菌纲(Bacilli)、拟杆菌纲(Bacteroidia)和梭状芽孢杆菌(Clostridia)。除SHS处理组,盐处理显著降低α-变形菌纲和γ-变形菌纲的相对丰度,但显著提高放线菌纲的相对丰度。目水平的分析结果(图4-C)显示,不同土壤优势菌目均主要为鞘脂单胞菌目(Sphingomonadales)、乳酸杆菌目(Lactobacillales)、微球菌目(Micrococcales)、梭菌目(Clostridiales)、黄色单胞菌目(Xanthomonadales)和uncultured_bacterium_c_Subgroup_6。科水平分析结果(图4-D)显示,不同种子际土壤鞘脂单胞菌科(Sphingomonadaceae)相对丰度最高,乳酸杆菌科(Lactobacillaceae)次之。
2.5.3 全样本属水平菌群结构分析 在属层次上的分析发现,所有菌属的相对丰度均小于18%,菌属数量较多,未命名菌属比例较高,表明花生种子际土壤细菌菌群多样性高,菌群构成较复杂(图5-A)。不同土壤优势菌属除鞘脂单胞菌属(Sphingomonas)和乳酸杆菌属(Lactobacillus),其他均为uncultured_bacterium。盐处理显著降低鞘脂单胞菌属的相对丰度(图5-A-B),SNS、SMS 和SHS 分别较对照不同氮素处理组降低70.62%、55.77%、17.21%;但乳酸杆菌属和uncultured_bacterium_f_Micrococcaceae 的相对丰度显著提高(图5-A-B),其在SNS 中较对照分别提高73.20%和34.00%,在SMS 较对照提高2.01倍和2.41 倍。盐胁迫下,不同氮素处理组间属水平差异较大,SMS 和SHS 中鞘脂单胞菌属较无氮处理SNS 分别提高41.46%和1.26 倍,乳酸杆菌属较SNS分别降低18.60%和24.01%。属水平上,盐处理与非盐处理样品间菌种丰度整体差异较大。

图5 属水平物种组成及样本间差异比较Fig.5 Comparison of bacterial composition and differences between diverse groups at the genus level
2.6 Lefse多级物种差异判别分析样本间差异
通过对不同处理花生种子际与非种子际土壤间进行不同分类水平上的Lefse 显著差异分析,结果(图6)表明,花生种子际与非种子际原土土壤间共有20 个显著差异细菌,种子际土壤中共有16 个表达丰度具有显著差异的细菌,CNS 包括Bacillales(芽孢杆菌目、芽孢杆菌科和芽孢杆菌属)、Gemmatimonadales(芽单胞菌目和芽单胞菌科)、Sphingomonadales(鞘脂单胞菌目、鞘脂单胞菌科、鞘脂单胞菌属)、Betaproteobacteriales、Burkholderiaceae(伯克氏菌科)和Massilia(马赛均属);CMS 包括Xanthomonadales(黄单胞菌目、黄单胞菌科、溶杆菌属)、Beijerinckiaceae(拜叶林克氏菌科)和Methylobacterium(甲基杆菌属);非种子际原土土壤CK 共有4 个显著差异细菌,包括Chitinophagales(噬几丁质菌目、噬几丁质菌科)、Sphingobacteriales(鞘脂杆菌目)、Ramlibacter(分支菌属)和uncultured_bacterium_f_Burkholderiaceae。3种不同施氮量种子际盐土之间共有33 个显著差异细菌,SNS 种子际土壤中共有22 个显著差异细菌,包括Lactobacillales(乳酸杆菌目、乳酸杆菌科、乳酸杆菌属)、Clostridiales(梭菌目、消化链球菌科)、Terrisporobacter(土孢杆菌属)、Solirubrobacterales(土壤红杆菌目、土壤红杆菌科)、Nocardioidaceae(类诺卡氏菌科、类诺卡氏菌属)、Micrococcales(微球菌目、微球菌科、uncultured_bacterium_f_Micrococcaceae)、Prevotellaceae(普雷沃氏菌科)、Intrasporangiaceae(间孢囊菌科和uncultured_bacterium_f_Intrasporangiaceae)和多个未知菌种;SMS 种子际土壤中共有6 个显著差异细菌,包括Caulobacterales(柄杆菌目、柄杆菌科)、Cytophagales(噬纤维菌目)、Hymenobacteraceae(薄层杆菌科)、Pontibacter(海洋杆菌属)和未知菌属uncultured_bacterium_f_Nocardioidaceae;SHS种子际土壤中共5个显著差异细菌,包括Bacteroidales(拟杆菌目)、Xanthobacteraceae(黄色杆菌科)和未知菌目uncultured_bacterium_c_Subgroup_6。Lefse 多级物种差异判别分析显示不同处理土壤具有特殊显著富集菌株。
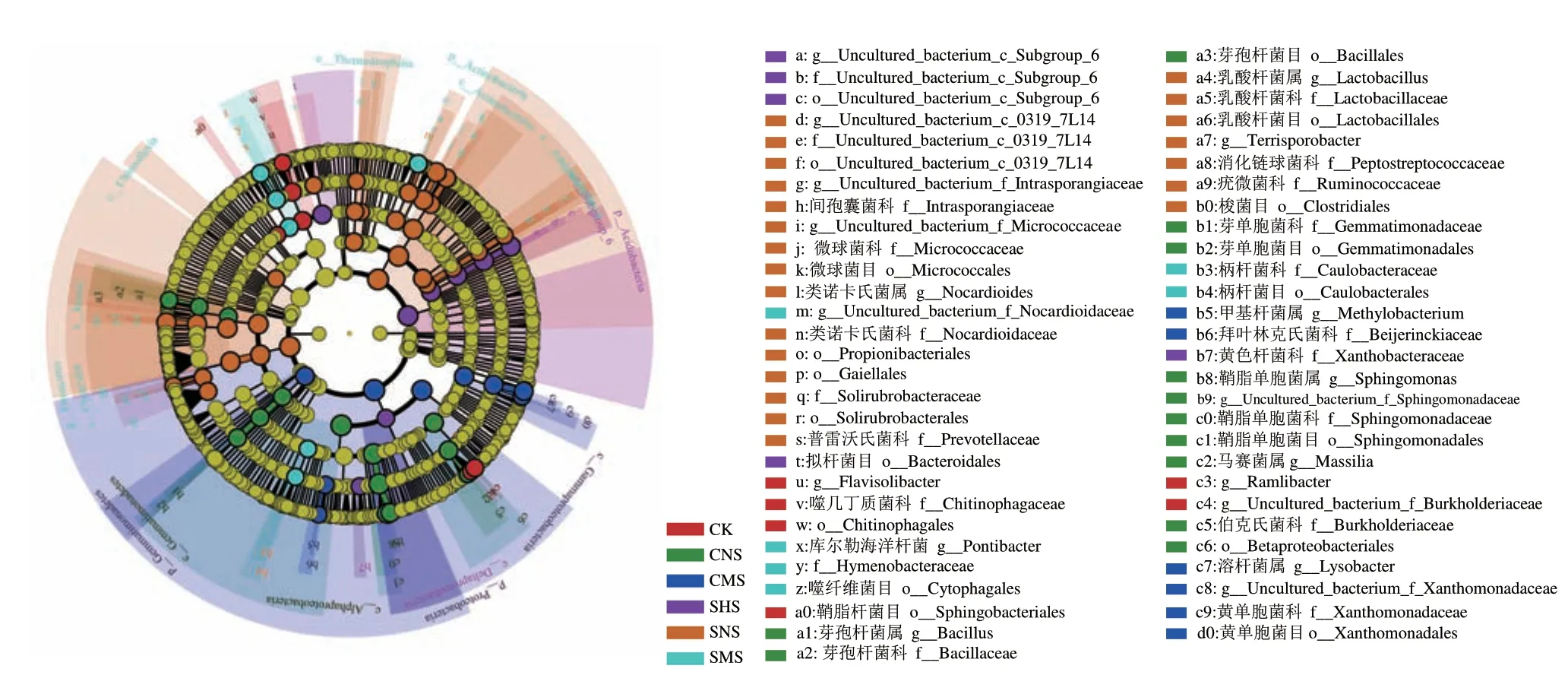
图6 Lefse 多级物种层级树图Fig.6 Lefse hierarchical tree of species
2.7 花生种子际细菌代谢功能KEGG分析
KEGG(Kyoto encyclopedia of genes and genomes)是指对OTU 丰度表进行标准化处理,以观测不同样品间微生物群落的功能基因在代谢途径上的差异和变化,从而研究种子际菌群为适应环境变化而发生的代谢改变情况。选取每个样本在各注释层级上最大丰度排名前25 的功能信息,生成代谢功能相对丰度柱状堆积图如图7 所示。主要的代谢功能有全局与概述图谱(global and overview maps)、糖代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、能量代 谢(energy metabolism)、辅助因子和维生素代谢(metabolism of cofactors and vitamins)、膜转运(membrane transport)、核酸代谢(nucleotide metabolism)、翻译(translation)、复 制和修复(replication and repair)和信号转导(signal transduction)等,占80%以上。一些重要的代谢活动如糖代谢、膜转运和核酸代谢在盐胁迫处理的样本中略有提高,一些重要的应激相关反应如信号转导和细胞生长与凋亡(cell growth and death)在盐胁迫处理的样本中降低(图7),但施加氮肥后这些应激反应丰度升高,可能与提高种子际菌群的胁迫应激有关,该过程可能是氮肥利用微生物帮助花生种子应对盐胁迫的重要机制之一。
2.8 环境因子关联性分析
Redundancy analysis(RDA)分析有助于明确种子际细菌群落与土壤氮和盐含量之间的关系(图8)。门水平细菌菌群与土壤盐(S)和氮(N)含量的关系分析显示,厚壁菌门、放线菌门、绿弯菌门、酸杆菌门、Rokubacteria 在S 箭头的正方向上,与土壤含盐量成正比;拟杆菌门、芽孢杆菌门、变形菌门、疣微菌门落在S 箭头的反方向上,与土壤含盐量成反比;浮游菌门与S 箭头几乎垂直,相关性较低。酸杆菌门、Rokubacteria、变形菌门在N 箭头的正方向上,说明土壤中氮含量越高,这些细菌门的丰富度越高;放线菌门、绿弯菌门、浮游菌门、拟杆菌门、芽孢杆菌门在N 箭头的负方向上,说明土壤中N 含量越高,这些细菌门的丰富度越低;厚壁菌门和疣微菌门与N 箭头几乎垂直,相关性较低(图8-A)。属水平细菌菌群与土壤盐和氮含量的关系分析显示,拟杆菌属(Bacteroides)、Escherichia-Shigella(埃希氏-志贺菌属)、RB41、Clostridium_sensu_stricto_1、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、Terrisporobacter 在S 箭头的正方向上,与土壤含盐量成正比;芽孢杆菌属(Bacillus)、鞘脂单胞菌属、溶杆菌属(Lysobacter)在S 箭头的负方向上,与土壤盐含量成反比。拟杆菌属、Escherichia-Shigella(埃希氏-志 贺菌 属)、RB41、Clostridium_sensu_stricto_1、芽孢杆菌属、鞘脂单胞菌属在N 箭头的正方向上,说明土壤中氮含量越高,这些细菌属的丰富度越高;乳杆菌属、Terrisporobacter、链球菌属在N 箭头的负方向上,说明土壤中氮含量越高,这些细菌属的丰富度越低;溶酸菌属与氮箭头几乎垂直,相关性较低(图8-B)。

图8 RDA 分析Fig.8 Redundancy analysis
3 讨论
盐胁迫通过渗透胁迫、离子失衡和氧化毒害来抑制种子萌发和植物生长,造成作物减产[22]。本研究表明,盐处理显著降低了花生发芽率和荚果产量,而施用氮肥可以缓解盐分对作物生长的抑制作用。随着施氮量的增加,花生发芽率先升高后降低,表明过高氮素对盐胁迫下种子萌发起反作用。花生产量随施氮量增加呈上升趋势,但高氮与中氮间无显著差异,表明氮肥的过量施用对花生产量而言也是无益的,只会导致氮肥利用率的下降,但对生态环境构成重大的潜在威胁[23]。本研究经过不同浓度的氮肥施用分析,表明3‰盐胁迫下花生的最适施氮量为90 kg/hm2。盐胁迫下,施用NH4NO3能有效缓解木麻黄幼苗受到的盐害程度,以0.75 g/L NH4NO3处理下幼苗生长生理指标表现最佳[24];盐处理后紫花苜蓿相对饲草价值随着施氮量的增加而增加,以225 和300 kg/hm2氮肥处理最佳[25];氯盐胁迫下西瓜生长和生理活性适宜施氮量为0.14-0.18 g/kg[26]。不同植物盐胁迫下最适施氮量有差异,但合理施氮,能在一定程度上缓解盐分对植物生长的抑制作用。
种子际是种子表面1-10 mm 内受种子萌发影响且存在相互作用的微区域[27]。种子际细菌可以调控种子的胁迫应答,对种子萌发具有重要影响[28-30]。本研究发现,不同处理下花生种子际优势菌门均为变形菌门、放线菌门、厚壁菌门、酸杆菌门、拟杆菌门、绿弯菌门及芽孢杆菌门,与之前报道的花生种子际主要优势菌门类型相同[3,27],但是相对丰度排序有差异,推测与不同地区的土壤性质有关。本研究分类到变形菌门在7 个供试土壤样品中均最多,与前人研究结果相同[27-28]。
种子际土壤中的有益菌株和有害菌株均会影响种子的萌发及幼苗的后续生长。RDA 分析发现,盐胁迫下的氮肥施加可以显著提高拟杆菌属、芽孢杆菌属、Escherichia-Shigella、鞘脂单胞菌属的相对丰度。通过氮肥施加,不仅补充了土壤的氮库,还刺激了鞘脂单胞菌属的增加[31],其适应性强,是一类丰富的新型微生物资源,可用于芳香化合物的生物降解[32],对于土壤中残留农药污染修复和地力提升具有重要作用[33-34]。土壤中拟杆菌属的相对丰度与皂苷类化感物质的含量显著负相关[35]。因此,拟杆菌属相对丰度的增加能更有效地降解皂苷类化感物质,缓解连作障碍,有助于降解土壤中化感自毒物质[36]。芽孢杆菌属具有固氮、磷酸盐增溶、吲哚-3-乙酸生成能力,能产生抗菌促生物质,促进植物对钙、镁、磷等元素的吸收,改良土壤环境,进而促进植物生长和抗逆抗病性[37-39]。溶杆菌属细菌对线虫和植物病害具有生防作用,是土壤中的重要有益细菌[40]。链球菌属是常见的化脓性球菌,是降低土壤质量的生物污染源之一[41]。盐胁迫处理导致有害的链球菌属增多,有益菌株芽孢杆菌属、鞘脂单胞菌属、溶杆菌属降低,这些菌群结构的变化降低了花生的萌发能力和生长潜力。盐胁迫下施氮则可提高多种有益菌的相对丰度,其中拟杆菌属和鞘脂单胞菌属能够参与清除土壤中残留的有毒物质,并产生抗菌促生物质,对土壤修复和地力提升有促进作用。芽孢杆菌属可以增强土壤中氮磷钾钙镁等营养元素的释放。
盐胁迫影响花生种子际菌群的功能丰度谱,糖代谢、膜转运和核酸代谢在盐处理样本中均有所提高。海藻糖和芽子碱被认为是重要的耐盐增强剂,其含量的提升可能有助于盐胁迫下的种子萌发[3]。盐胁迫下,信号转导和细胞生长与凋亡等胁迫应激活动在施氮后提高。经研究细菌信号转导丰度的提高,可能与花生耐盐提升有关[19,42]。另外有报道显示细胞生长与凋亡途径与土壤污染物降解和地力提升有关[43],可能对花生生长和胁迫应答有帮助。因此,盐胁迫下施氮可能通过调控细菌代谢活动增强花生的胁迫应答能力。研究不同氮肥施用量对盐胁迫种子际菌群结构的影响,通过有益菌株分离、纯化与培养,精细调控菌群配比,为通过种子包衣途径改善种子际微生态环境,提高种子萌发出苗健苗率和盐碱地花生生产力提供理论依据和技术支撑。
4 结论
盐胁迫下适量施氮可以提高花生发芽率和荚果产量,最佳施氮量为90 kg/hm2。合理施氮除提高土壤氮库外,还能在一定程度上提高土壤中有益菌属拟杆菌属、芽孢杆菌属、鞘脂单胞菌属的相对丰度,对土壤修复和地力提升有一定的帮助。

