石花菜醇提物成分分析
田永奇,罗海涛,丁 婷,王奇升,邓尚贵,汪少芸*
(1 福州大学生物科学与工程学院 福州350108 2 浙江海洋大学食品与药学学院 浙江舟山 316022)
石花菜(Gelidium amansii,G.amansii)属于石花菜科(Gelidiaceae)石花菜属(Gelidium)。石花菜藻体一般为紫红色或红黄色,在不同的海区因阳光辐照强度而使颜色存在一定差异。藻体直立、丛生,髙一般在10~20 cm 范围,也可达25 cm[1]。石花菜是中国、韩国、日本等亚洲国家常见的食用海藻,具有丰富的营养价值。《闽书》记载石花菜夏季可煮成冻,《南越笔记》 记载石花菜食之可去上焦浮热,清热解毒[2]。现闽南地区将石花菜熬制成膏,用刨刀刮成丝状,做成“四果汤”。石花菜为食药两用,还能作药引,有滋阴降火、润肺化痰、清热解毒、化瘀散结、缓下驱蛔等功效,可清热解毒、抗肿瘤和利肠道通便[3]。人们常用石花菜治疗矽肺、体癣、甲状腺肿大、肛门肿痛等疾病[4-5]。
石花菜含有大量碳水化合物、蛋白质、粗纤维及多种微量元素,长期以来,石花菜的研究主要聚焦于多糖的研究,关于石花菜醇提物的研究报道较少[6-7]。实际上,石花菜醇提物广泛的生物活性,值得研究人员深入研究。Seo 等[8]及Lee 等[9]研究发现石花菜醇提物能有效抑制活性氧的生成。Park等[10]和Kang 等[11]发现石花菜醇提物能有效降低小鼠的体质量,具有一定的降血脂作用。林雄平等[12]、孙杰等[13]研究发现石花菜醇提物有较强的抑制真菌和细菌作用。国内外对于石花菜醇提物的研究主要集中于生物活性方面,对其成分的研究几乎是空白。
为弥补这一缺陷,挖掘石花菜的食药两用的价值,本试验采用薄层色谱、液相-质谱联用方法分析石花菜醇提物的化学成分的丰富度;运用通过硅胶柱、高效液相等色谱方法对其进行分离纯化,运用气-质谱联用、核磁结合文献确证化合物结构;并对部分化合物抗氧化活性进行测定。本试验首次系统研究了石花菜醇提物的化学成分,为石花菜功能食品研发及其高值化利用奠定基础。
1 材料与方法
1.1 材料与试剂
300~400 目硅胶,安徽良臣硅源材料有限公司;HSGF254 薄层硅胶板,烟台江友硅胶开发有限公司;色谱纯级甲醇,美国J.T.BAKER 公司;色谱纯级乙腈、色谱纯级甲酸,美国J.T.BAKER 公司;SIGMA-ALDRICH 氘代氯仿,上海贸易有限公司;分析纯级香草醛,国药集团有限公司;其它分析纯级化学试剂,国药集团有限公司。试验用石花菜样品于2020 年9 月采集于福建福州、漳州海域。
1.2 仪器与设备
KQ5200DE 超声清洗仪,昆山超声仪器有限公司;RE-52AA 旋转蒸发仪,上海荣生化仪器厂;WFH-203B 三用紫外分析仪,上海精科有限公司;Primaide 半制备型高效液相色谱仪,天美科学仪器有限公司;UV-100 紫外-可见分光光度计,上海美普达仪器有限公司;Bruker AV II-600 MHz 核磁共振仪,布鲁克科技有限公司;Agilent 1260 HPLC-6500 系列Q-TOF 液质联用仪,安捷伦科技有限公司;气-质谱联用仪GC×GC HRT 4D plus,美国LECO 公司。
1.3 方法
1.3.1 石花菜醇提物的制备 称取干燥石花菜1 kg,用粉碎机将其打碎,制成石花菜粉末,60%乙醇溶液浸泡提取3 次,过滤,合并提取液,减压浓缩,得到石花菜醇提物20 g。用甲醇将其配制成10 mg/mL,用于后续的分析。
1.3.2 石花菜醇提物薄层色谱(TLC)分析 将石花菜醇提物分别用石油醚及乙酸乙酯萃取得到石油醚层和乙酸乙酯层;将石花菜醇提物小样过Flash 柱分离(石油醚-乙酸乙酯体系)得到不同极性段。将上述不同极性段分别溶于合适溶剂,用V石油醚∶V乙酸乙酯=1∶1 展开,硫酸香草醛显色剂加热显色。
1.3.3 石花菜醇提物液质联用(LC-MS)分析 采用Agilent 1260 HPLC-6500 系列Q-TOF 液-质谱联用仪对石花菜醇提物的化合物进行分析,波长为210 nm,离子源为+ESI,质量扫描范围为m/z 90~820 u,色谱柱为AA12S05-1546WT C18(150 mm×4.6 mm,5 μm);柱温为35 ℃,体积流量为1.0 mL/min;进样量为5 μL;流动相为水(A)和乙腈(B),梯度洗脱(0~30 min,5%~100% B;31~40 min,100% B)。
1.3.4 石花菜醇提物气质联用(GC-MS)成分鉴定顶空萃取瓶中加入5 mL 石花菜醇提物样品,再加入1 g NaCl 和10 μL 内标物2-辛醇(10 mg/L),盖上瓶盖,在转速600 r/min 和水温40 ℃水浴下温育20 min,使易挥发成分更好的从溶液中挥发出来。插入固相微萃取针,萃取纤维吸附易挥发成分30 min。将萃取完成后的萃取针插入GC-MS 中分析。柱温箱起始温度50 ℃,保留0.2 min,然后以20 ℃/min 升温至200 ℃,最后再以6 ℃/min 升温至300 ℃,保留10 min。
1.3.5 石花菜醇提物的分离与纯化 取石花菜醇提物浸膏进行正相硅胶柱色谱分离,以不同石油醚-乙酸乙酯体积比(100∶1→50∶1→20∶1→10∶1→5∶1→2∶1→1∶1)混合液为溶剂进行梯度洗脱,经薄层色谱检识合并得到13 个组分(标记为Fr.1~13)。组分经硅胶柱、半制备液相色谱等反复分离得到纯化合物。
1.3.6 抗氧化活性研究 DPPH 及ABTS 自由基清除活性的测定参照文献[14-15]进行。
2 结果与分析
本试验对石花菜醇提物化学成分进行了分析,运用GC-MS 鉴定出29 个化合物,类型包括脂肪酸、苯衍生物、生物碱、甾醇等;运用硅胶柱、半制备液相色谱等对石花菜醇提物反复分离,得到化合物1(产量为176 mg)、化合物2(产量为13 mg)、化合物3(产量为4.8 mg)、化合物4(产量为16 mg)、化合物5(产量为65 mg)、化合物6(产量为8.8 mg)、化合物7(产量为9.6 mg)、化合物8(产量为2.4 mg)、化合物9(产量为21 mg)。运用核磁、质谱等手段分离和鉴定了它们的结构,分别为胆甾醇(1)、1,2-二醇植烯(2)、帕格甾醇C(3)、6-羟基-胆甾-4-烯-3-酮(4)、胆甾-5-烯-7-酮(5)、胆甾-5-烯-3β,7α 二醇(6)、胆甾-5-烯-3β,7β 二醇(7)、胆甾-4-烯-6-酮(8)、3-羟乙基-2-甲基-马来酰亚胺(9),化合物3、8、9 为新天然产物(图1)。以下将详细阐明这些化合物的鉴定过程及数据。

图1 从石花菜醇提物中鉴定的化合物Fig. 1 Compounds identified from the ethanol extract of G.amansii
2.1 石花菜醇提物化学成分丰富度分析
运用TLC 和LC-MS 检测石花菜醇提物化学成分的丰富度。经萃取分级后,石花菜醇提物石油醚层和乙酸乙酸乙酯层均具有较多的代谢产物,且类型较为相近(图2a)。醇提物经Flash 柱分离,展现出更为丰富的代谢产物,硫酸香草醛显色呈紫色、蓝色、黄色,提示结构中可能含有有机酸、甾体、萜类等成分。石花菜醇提物按1.3.3 节的色谱及质谱条件进行分析,得到其HPLC 图及在正离子模式下的BPC 图(见图2b)。石花菜醇提物虽在小极性段(30 min 后)有丰富的代谢产物,但在质谱BPC 图上没有对应的峰出现,这提示了其不容易电离,很可能是甾体类成分。孙杰等[13]也以氯仿-浓硫酸试验推测石花菜醇提物中可能含有甾体皂甙类成分。
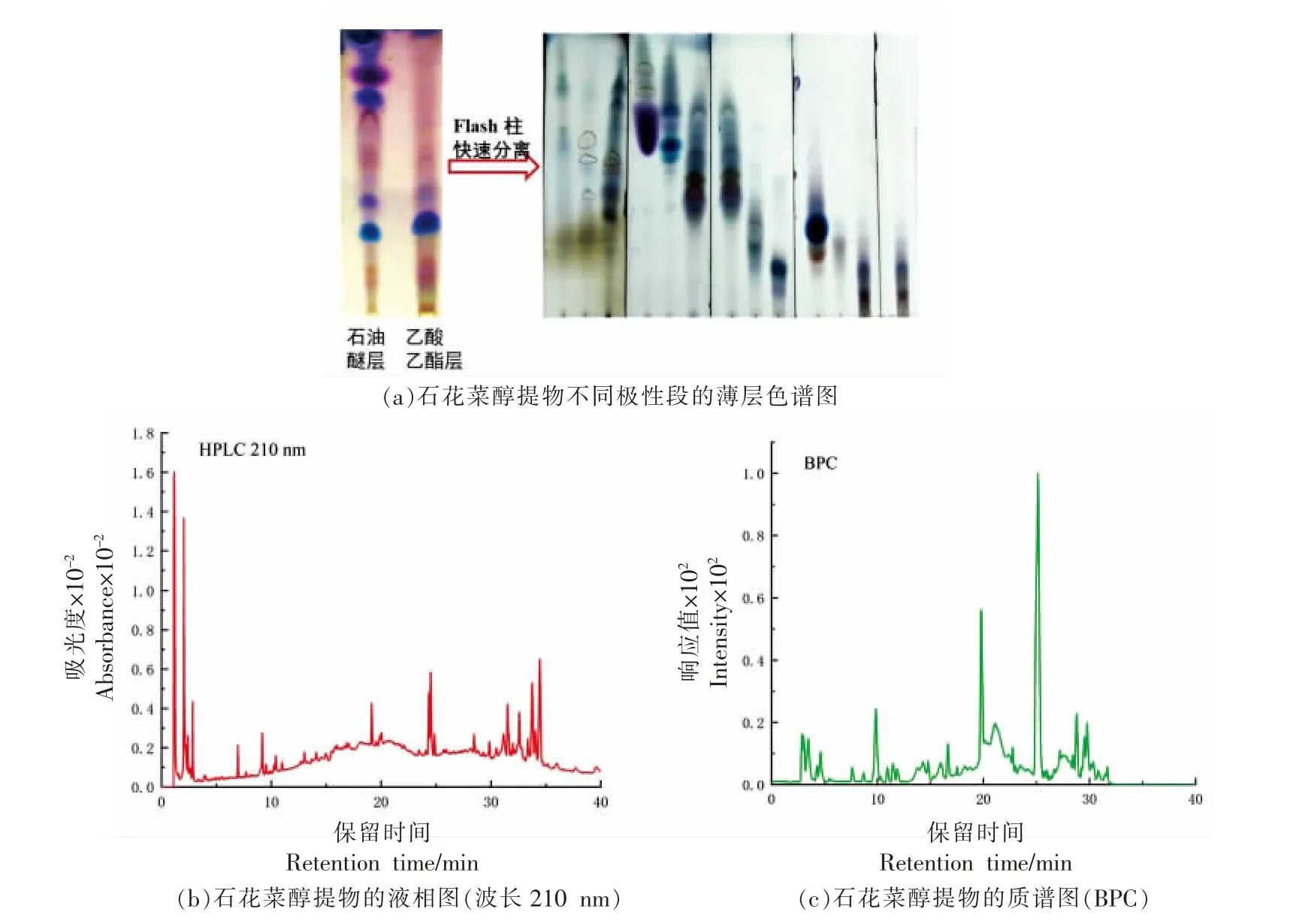
图2 石花菜醇提物的丰富度检测Fig. 2 Detection of the richness of the ethanol extract of G.amansii
2.2 石花菜醇提物GC-MS 分析
将石花菜醇提物通过气相色谱质谱联用分析得到图3。不同的峰对应着不同的化合物,以80%匹配度,筛选出29 个化合物,罗列得到表1。由表1 中可知,石花菜醇提物主要由脂肪酸、甾醇、生物碱、萜类等组成,其中含量较高的为棕榈酸(46.76%)、棕榈酸乙酯(13.82%)、胆甾醇(7.20%)、胆甾-4,6-二烯(4.99%)。石花菜中的甾醇主要以胆甾醇及其类似物为主,分别为胆甾醇、胆甾-4,6-二烯、胆甾-5-烯-7-酮、胆甾-4,6-二烯-3-酮、3β-(Benzoyloxy)-胆甾-5-烯-7β-醇。红藻中富含胆甾醇,国伟杰等[16]、夏欢等[17]、冯强等[18]从鸭毛藻、江蓠、坛紫菜3 种红藻中也发现了胆甾醇及其衍生物。

表1 GC-MS 鉴定的石花菜醇提物中的化合物Table 1 Compounds in the ethanol extract of G.amansii identified by GC-MS

图3 石花菜醇提物的GC-MS 图Fig. 3 GC-MS diagram of the ethanol extract of G.amansii
2.3 石花菜醇提物化学成分精细分离及结构鉴定
化合物1:白色粉末,极性较小,硫酸香草醛显色为红色;EIMS m/z 386.35 [M]+;核磁数据显示结构中有1 个双键信号,剩余为典型的甾醇信号,和标准品及文献 [16] 比对鉴定为胆甾醇(Cholesterol),具体核磁数据如下:1H-NMR(600 MHz,CDCl3)δH5.35(1H,m,H-6),3.54(1H,m,H-3),1.02(3H,s,H3-19),0.96(3H,d,J=6.5 Hz,H3-21),0.88(3H,d,J=6.6 Hz,H3-26),0.87(3H,d,J=6.6 Hz,H3-27),0.68(3H,s,H3-18);13C-NMR(150 MHz,CDCl3)δC139.7(C-5),122.6(CH-6),71.9(CH-3),56.7(CH-14),56.0(CH-17),50.0(CH-9),42.3(C-13),39.7(CH2-12),39.7(CH2-24),38.1(CH2-4),37.0(CH2-1),36.6(C-10),36.2(CH2-22),36.1(CH-20),31.9(CH2-7),31.9(CH-8),28.3(CH2-16),28.0(CH-25),27.8(CH2-2),24.3(CH2-15),24.3(CH2-23),23.0(CH3-27),22.7(CH3-26),21.0(CH2-11),19.3(CH3-19),18.8(CH3-21),11.8(CH3-18)。
化合物2:无色油状物;ESIMS m/z 313.30[M+H]+;1H NMR(500 MHz,CDCl3)δH5.15(1H,s,H-17),4.99(1H,s,H-17),4.22(1H,J=6.8,2.7 Hz,H-2),3.72(1H,d,J=10.0 Hz,H-1a),3.55(1H,dd,J=10.0,6.4 Hz,H-1b),2.36(1H,br s,OH),2.15~1.90(2H,m),1.04~1.55(20H,m),0.86~0.89(12H,m,H3-16,18,19,20),13C-NMR(125 MHz,CDCl3)δC148.7/148.6(C-3),110.5(CH2-17),75.1/75.0(CH-2),65.7(CH2-1),39.4(CH2-14),37.4(CH2-8),37.3(CH2-10),37.3(CH2-12),36.9(CH2-6),33.0(CH2-4),32.80(CH-11),32.7(CH-7),28.0(CH-15),25.5(CH2-5),24.8(CH2-13),24.5(CH2-9),22.7(CH3-20),22.6(CH3-16),19.8(CH3-19),19.70/19.71(CH3-18)。数据中C-2,C-3,C-18,C-10 碳谱都出现2 组不同的化学位移,推测为2 位羟基的异构造成的,以上数据与文献[19-20]对照,鉴定化合物2 为1,2-二醇植烯(Phytene-1,2-diol),且该化合物为差向异构体的混合物(2 位羟基)。
化合物3:无色油状物;HREIMS m/z 400.3341 [M]+;核磁谱上明显可以看出1 个醛基信号[δC189.7,δH9.97,CH-6],1 个双键信号(δC168.9,C-5;139.4,C-6),剩余是甾醇的典型信号(图4),具体数据如下:1H-NMR(500 MHz,CDCl3)δH9.97(1H,s,H-6),3.71(1H,m,H-3),3.47(1H,ddd,J=2.0,4.5,14.5 Hz,H-4a),2.55(1H,dt,J=4.0,11.0 Hz,H-8),2.05(1H,m,H-4b),0.95-1.96(22H,m),0.93(3H,s,H3-19),0.92(3H,d,J=6.5 Hz,H3-21),0.87(3H,d,J=6.5 Hz,H3-26),0.85(3H,d,J=6.5 Hz,H3-27),0.73(3H,s,H3-18);13C-NMR(125 MHz,CDCl3)δC189.7(CH-6),168.9(C-5),139.3(C-7),70.9(CH-3),60.2(CH-9),55.4(CH-17),54.5(CH-14),46.3(C-10),46.2(CH-8),45.2(C-13),39.8(CH2-12),39.5(CH2-24),36.2(CH2-1),36.1(CH2-22),35.6(CH-20),33.9(CH2-4),31.3(CH2-2),28.5(CH2-16),28.0(CH-25),26.6(CH2-15),23.9(CH2-23),22.8(CH3-26),22.5(CH3-27),20.7(CH2-11),18.9(CH3-21),15.6(CH3-19),12.5(CH3-18)。该化合物为帕格甾醇A(Parguesterol A)的类似物,2008 年由Wei 等[21]合成,未命名,本文将其命名为帕格甾醇C(Parguesterol C),为新天然产物。帕格甾醇类化合物显示出很好的抗分枝结核杆菌活性[22]。

图4 帕格甾醇C 的结构鉴定图Fig. 4 Structural characterization of parguesterol C
化合物4:白色粉末;EIMS m/z 400.33 [M]+;核磁谱上显示结构中存在1 个酮羰基(δC200.5,C-3),1 个双键信号(δC126.3,δH 5.81,CH-4;δC168.6,C-5),1 个连氧的次甲基信号(δC73.2,δH4.34,CH-6),剩余为典型的甾醇信号,具体数据如下:1H-NMR(500 MHz,CDCl3)δH5.82(1H,s,H-4),4.36(1H,t,J=4.4 Hz,H-6),2.52(1H,m,H-2a),2.40(1H,dt,J=16.5,3.0 Hz,H-2b),1.46-2.06(13H,m),1.34(3H,s,H3-19),1.00-1.33(11H,m),0.92(3H,d,J=6.6 Hz,H3-21),0.88(3H,d,J=6.6 Hz,H3-26),0.87(3H,d,J=6.6 Hz,H3-27),0.75(3H,s,H3-18);13C-NMR(125 MHz,CDCl3)δC200.5(C-3),168.6(C-5),126.3(CH-4),73.2(CH-6),56.1(CH-14),55.9(CH-17),53.6(CH-9),42.5(C-13),39.6(CH2-12),39.5(CH2-24),38.5(CH2-7),38.0(C-10),37.1(CH2-1),36.1(CH2-22),35.7(CH-20),34.2(CH2-2),29.7(CH-8),28.1(CH2-16),28.0(CH-25),24.1(CH2-23),23.8(CH2-15),22.8(CH3-26),22.6(CH3-27),21.0(CH2-11),19.5(CH3-19),18.7(CH3-21),12.2(CH3-18)。以上数据与文献[23-25]对照,故鉴定化合物4 为6-羟基-胆甾-4-烯-3-酮(6-Hydroxy-cholesterol-4-en-3-one)。
化合物5:白色粉末;EIMS m/z 400.33 [M]+;核磁谱上显示结构中存在1 个双键信号(δC136.0,δH5.69,CH-6;δC165.6,C-5),1 个连氧的次甲基信号(δC73.2,δH3.67,CH-3),剩余为典型的甾醇信号,具体数据如下:1H-NMR(500 MHz,CDCl3)δH5.69(1H,s,H-6),3.67(1H,m,J=1.1 Hz,H-3),2.51(1H,m),2.40(2H,m),2.03(1H,m),1.94(3H,m),1.46-1.66(6H,m),1.23-1.40(9H,m),1.20(3H,s,H3-19),1.00-1.17(7H,m),0.92(3H,d,J=6.6 Hz,H3-21),0.88(3H,d,J=6.6 Hz,H3-26),0.86(3H,d,J=6.6 Hz,H3-27),0.68(3H,s,H3-18);13C-NMR(125 MHz,CDCl3)δC202.6(C-7),165.6(C-5),126.0(CH-6),70.3(CH-3),54.8(CH-17),50.0(CH-14),49.9(CH-9),45.4(CH-8),43.1(C-13),41.8(CH2-12),39.5(CH2-24),38.7(CH2-4),38.3(C-10),36.4(CH2-1),36.2(CH2-22),35.7(CH-20),31.2(CH2-2),28.5(CH2-16),28.0(CH-25),26.3(CH2-15),23.8(CH2-23),22.8(CH3-26),22.5(CH3-27),21.2(CH2-11),18.9(CH3-21),17.3(CH3-19),12.0(CH3-18)。以上数据与文献[26]对照,故鉴定化合物5 为胆甾-5-烯-7-酮(Cholest-5-en-7-one)。
化合物6、7 是一对差向异构体,TLC 板显色呈蓝色,它们极性非常接近。波谱学特征也非常接近(图5)。化合物6:白色固体;EIMS m/z 402.35[M]+,核磁谱上显示结构中存在1 个双键信号(δC123.9,δH5.63,CH-6;δC146.3,C-5),1 个连氧的次甲基信号(δC65.4,δH3.87,CH-7),剩余为典型的甾醇信号,具体数据如下:1H-NMR(600 MHz,CDCl3)δH5.63(1H,dd,J=5.3,1.8 Hz,H-6),3.87(1H,m,H-7β),3.62(1H,m,H-3),2.36(1H,ddd,J=13.1,5.0,1.7 Hz,H-4a),2.30(1H,td,J=13.1,2.3 Hz,H-4b),2.02(1H,dt,J=12.9,3.9 Hz),1.85-1.94(3H,m),1.72(1H,m),1.37-1.58(10H,m),1.29-1.36(5H,m),1.10-1.25(11H,m),1.01(3H,s,H3-19),0.94(3H,d,J=6.7 Hz,H3-21),0.89(3H,d,J=6.6 Hz,H3-26),0.87(3H,d,J=6.6 Hz,H3-27),0.71(3H,s,H-18);13C-NMR(150 MHz,CDCl3)δC146.3(C-5),123.9(CH-6),71.3(CH-3),65.4(CH-7),55.9(CH-17),49.4(CH-14),42.3(CH-9),42.2(C-13),42.0(CH2-4),39.5(CH2-12),39.2(CH2-24),37.5(CH-8),37.4(C-10),37.0(CH2-1),36.2(CH2-22),35.8(CH-20),31.4(CH2-2),28.3(CH2-16),28.0(CH-25),24.3(CH2-15),23.7(CH2-23),22.8(CH3-26),22.6(CH3-27),20.7(CH2-11),18.8(CH3-19),18.3(CH3-21),11.6(CH3-18)。以上数据与文献[27-28]对照,故鉴定化合物6 为胆甾-5-烯-3β,7α 二醇(Cholest-5-ene-3β,7α diol)。
化合物7:白色固体;EIMS m/z 402.35 [M]+,核磁谱与化合物6 类似,最大的区别在于化合物7 中6 位氢往高场移动,由原来的δH5.63(dd),转变为δH5.32(t)(图5)。综合判断这是C-7 位手性变化所导致的,数据与文献[28]对照,故鉴定化合物7 为胆甾-5-烯-3β,7β 二醇(Cholest-5-ene-3β,7β diol),具体数据如下:1H-NMR(600 MHz,CDCl3)δH5.32(1H,t,J=2.1 Hz,H-6),3.87(1H,dt,J=8.0,2.3 Hz,H-7α),3.58(1H,m,H-3),2.35(1H,m),2.27(1H,m),2.04(1H,m),1.08(3H,s,H-19),0 94(3H,d,J=6.5 Hz,H3-21),0.89(3H,d,J=6.6 Hz,H3-26),0.87(3H,d,J=6.6 Hz,H3-27),0.71(3H,s,H-18);13C-NMR(150 MHz,CDCl3)δC143.5(C-5),125.4(CH-6),73.4(CH-7),71.4(CH-3),56.0(CH-14),55.5(CH-17),48.3(CH-9),42.9(C-13),41.7(CH2-4),40.9(CH-8),39.6(CH2-12),39.5(CH2-24),36.9(CH2-1),36.4(C-10),36.2(CH2-22),35.7(CH-20),31.6(CH2-2),28.6(CH2-16),28.0(CH-25),26.4(CH2-15),23.8(CH2-23),22.8(CH3-26),22.6(CH3-27),21.1(CH2-11),19.2(CH3-21),18.8(CH3-19),11.8(CH3-18)。
化合物8:白色固体;EIMS m/z 386.35 [M]+,核磁谱上显示结构中存在1 个碳基信号(δC203.2,C-6)和1 个双键信号(δC146.9,C-5;δC132.6,δH6.17,C-4),剩余为典型的甾醇信号,具体数据如下:1H-NMR(600 MHz,CDCl3)δH6.17(1H,t,J=2.2 Hz,H-4),4.26(1H,m,H-3),2.57(1H,dd,J=16.0,3.7 Hz,H-7a),2.08(2H,m),1.02(3H,s,H-19),0 93(3H,d,J=6.5 Hz,H3-21),0.89(3H,d,J=6.6 Hz,H3-26),0.87(3H,d,J=6.6 Hz,H3-27),0.71(3H,s,H-18);13C-NMR(150 MHz,CDCl3)δC203.2(C-6),146.9(C-5),132.6(CH-4),67.3(CH-3),56.7(CH-14),56.0(CH-17),51.3(CH-9),46.4(CH2-7),42.6(C-13),39.5(CH2-24),39.4(CH2-12),38.4(C-10),36.1(CH2-22),35.7(CH-20),34.8(CH2-1),34.2(CH-8),28.4(CH2-2),28.0(CH2-16),28.0(CH-25),24.0(CH2-15),23.8(CH2-23),22.8(CH3-26),22.6(CH3-27),20.8(CH2-11),19.8(CH3-21),18.7(CH3-19),12.0(CH3-18)。根据这些数据及相关文献[29],化合物8 被确证为胆甾-4-烯-6-酮(Cholest-4-ene-6-one),为新天然产物。
化合物9:黄色粉末;HRESIMS m/z 333.1059[2M+Na]+,推测分子式为:C7H9NO3;核磁谱(图7)给出2 个甲基信号、1 个次甲基信号、1 个烯碳信号、1 个羰基信号、1 个连氧的碳信号、2 个酮羰基信号,具体核磁数据如下:1H-NMR(500 MHz,CD3OD)δH4.80(1H,q,J=6.8 Hz,H-5),2.06(3H,s,H3-7),1.42(3H,d,J=6.8 Hz,H3-6);13C-NMR(125 MHz,CD3OD)δC174.7(C-1),139.3(C-2),143.7(C-3),173.8(C-4),63.4(CH-5),8.6(CH3-6),22.5(CH3-7)。以上数据与文献[30]对照,故鉴定化合物8 为3-羟乙基-2-甲基-马来酰亚胺 【2-(1-Hydroxyethyl)-3-methylmaleimide】。

图7 3-羟乙基-2-甲基-马来酰亚胺结构鉴定图Fig. 7 Structural characterization of 2-(1-Hydroxyethyl)-3-methylmaleimide
2.4 部分化合物的抗氧化活性
由图8a 可知,质量浓度为0~2.0 mg/mL 时,不同化合物清除DPPH 自由基能力随质量浓度增大而增大。由图8b 可知,化合物7 清除DPPH 自由基的IC50值最小,为0.18 mg/mL。化合物1、4、5、6,IC50值分别 为1.13,0.78,0.24 mg/mL 和0.20 mg/mL。VC 的IC50值为0.08 mg/mL,化合物7 清除DPPH 自由基能力接近VC。综上,化合物7 清除DPPH 自由基能力最好,化合物1 清除DPPH 自由基能力最弱。

图8 不同化合物清除DPPH 自由基能力及IC50 值Fig. 8 DPPH free radical scavenging ability and IC50 value of different compounds
由图9a 可以看出,质量浓度为0~30 μg/mL时,纯化合物随着质量浓度增加,清除ABTS 自由基能力增强。由图9b 可知,VC 的IC50值为1.3 μg/mL,化合物1、4、5、6、7 清除ABTS 自由基能力均低于VC,化合物中清除ABTS+自由基的IC50值大小顺序为:7<6<5<4<1,表明化合物7 清除ABTS 自由基能力最好,其IC50值为12.2 μg/mL。

图9 不同化合物清除ABTS 自由基能力及IC50 值Fig. 9 ABTS free radical scavenging ability and IC50 value of different compounds
3 结论
为了弥补石花菜醇提物化学成分的研究空白,本文综合运用TLC、HPLC、LC-MS、GC-MS、NMR 等多种色谱波谱手段,系统鉴定了其化学成分。TLC、LC-MS 分析表明石花菜醇提物中含有丰富的次级代谢产物,且很可能是甾醇类成分。运用GC-MS 从石花菜乙醇浸膏中鉴定到29 个化合物,其中5 个为甾醇类化合物。经正向硅胶柱和HPLC 分离,NMR 鉴定,得到9 个单体化合物,分别为胆甾醇(1)、1,2-二醇植烯(2)、帕格甾醇C(3)、6-羟基-胆甾-4-烯-3-酮(4)、胆甾-5-烯-7-酮(5)、胆甾-5-烯-3β,7α 二醇(6)、胆甾-5-烯-3β,7β 二醇(7)、胆甾-4-烯-6-酮(8)、3-羟乙基-2-甲基-马来酰亚胺(9);化合物7 清除DPPH 自由基和ABTS 自由基能力最好,其IC50值分别为180 μg/mL 和12.2 μg/mL。本文首次系统研究了石花菜的化学成分,化合物3、8、9 为新天然产物;部分甾醇类化合物展现出一定的抗氧化活性。本试验的研究结论明晰了石花菜醇提物活性的物质基础,为石花菜功能食品的研发及高值化利用提供了依据。

