HPV16 E6调控miR-23a表达促进宫颈癌细胞侵袭、迁移
王敏 母丹 孔德军 杨莉 叶璐 贺丹
成都医学院第二附属医院/核工业四一六医院肿瘤科 (成都 610000)
宫颈癌是常见的妇科恶性肿瘤疾病之一,病发率及病死率较高,病死率仅次于乳腺癌,发达国家由于防癌疫苗的接种及宫颈抹片的筛查到位,宫颈癌发病率下降,然而我国宫颈癌发病率依然较高,宫颈癌转移也会引起其他器官的病变[1-2]。资料显示宫颈癌发病的主要原因是高危型人乳头瘤病毒(human papillomavirus, HPV)感染,HPV16是高危型HPV 常见的基因型,占比约41.6%[3]。高危型HPV16 表达的致癌相关蛋白如HPV16 E6、E7蛋白在宫颈癌细胞增殖、迁移、侵袭等生物学行为过程中发挥重要调控作用,可能通过调控长链非编码RNA(SNHG12 等)及微小RNA(microrna-424-5p 等)表达发挥作用[4-5]。然而HPV16 E6 蛋白影响宫颈癌迁移、侵袭的分子机制仍不完善。研究[6-7]表明miR-23a 在卵巢癌、乳腺癌、肠癌等肿瘤中表达异常,其中过表达的miR-23a 具有抑制肺癌H1650 细胞侵袭的能力。研究[8]结果显示miR-23a在宫颈癌患者血清中表达有高有低,是宫颈癌预后的可能标志物,因此推测miR-23a 的表达异常可能与HPV16 E6 促进宫颈癌细胞侵袭及迁移有关。本研究通过对过表达HPV16 E6 蛋白的研究,探讨该蛋白对宫颈癌细胞侵袭及迁移等不良生物学行为的促进作用与miR-23a表达之间的关系,为探索HPV16 E6 的致病机制提供新思路。
1 材料与方法
1.1 细胞SiHa 人宫颈癌细胞系(HPV 阳性),购于上海雅吉生物科技有限公司。
1.2 组织100例宫颈癌HPV阴性患者、HPV阳性患者的组织标本及对应的癌旁正常组织均由本院提供。本实验经成都医学院第二附属医院/核工业四一六医院伦理委员会批准(编号:202203006),且获得所有患者的知情同意。
1.3 主要试剂及仪器pcDNA3.1-myc-HisA(-)哺乳动物质粒(货号:YS-1314F)购于上海雅吉生物;兔源HPV16 E6(货号:ab70)、Caspase-3(货号:ab13847)一抗、羊抗兔二抗(货号:ab150077)购于美国Abcam;兔源Bax、Bcl-2、MMP-2、MMP-9一抗(货号:FNab00809、FNab00840、FNab05238、FNab05247)购于武汉菲恩生物科技有限公司;脂质体核酸转染试剂盒购于上海莼试生物(货号:CS-X14488);MTT 试剂盒(货号:M1020)、RNA 提取试剂盒(货号:R1200)购于北京索莱宝;细胞凋亡双染试剂盒购于普诺赛(货号:P-CA-201);BCA试剂盒(货号:P0011)、蛋白提取试剂盒(货号:P0027)购于上海碧云天。
XElx800 酶标仪,美国Perkin Elmer 公司;MCO-15AC 细胞培养箱,日本SANYO;NC-100 细胞计数器,丹麦Chemimetec;TS100 倒置显微镜,日本Nikon;Accuri C6 流式细胞仪,美国BD;Simpliamp-PCR仪,美国ABI;GIS-500凝胶成像仪,Miulab公司。
1.4 方法
1.4.1 细胞培养SiHa 细胞于37 ℃复苏,然后在DMEM 培养液,于37 ℃、5% CO2培养箱中培养。培养基中含有10%胎牛血清、100 IU/mL 青霉素和100 mg/mL 链霉素。
1.4.2 HPV16 E6 质粒构建及细胞转染参考文献[9]进行pcDNA3 1-myc-HisA-HPV16 E6 质粒的构建,根据Homo HPV16 E6 基因序列,以pcDNA3 1-myc-HisA(-)哺乳动物质粒为载体构建HPV16 E6重组质粒;取生长至对数期的SiHa 细胞,接种于24 孔,每孔1.2 × 105细胞,常规培养至粘合度达到90%以上时根据脂质体核酸转染试剂盒中的要求进行细胞转染,并分为E6 过表达组(HPV16 E6 基因过表达)、空白组(常规培养,不转染)、阴性转染组,转染6 h 后更换新鲜培养液继续培养24 h。
根据脂质体转染试剂盒中说明书的要求进行操作,建立E6+miR-23a mimics 组(SiHa 细胞同时转染HPV16 E6、miR-23a mimics)。
1.4.3 RT-PCR 法测定宫颈癌组织、癌旁正常组织miR-23a 及各组细胞内HPV16 E6、miR-23a mRNA 表达从癌旁正常组织、宫颈癌组织及各组SiHa 细胞中提取总RNA,具体操作步骤见RNA提取试剂盒说明书。然后用逆转录试剂盒将RNA逆转录为cDNA,采用RT-PCR 法对HPV16 E6、miR-23a 进行扩增,分别以β-actin、U6 为内参,HPV16 E6 引物序列:正向引物:5'-TTGCTTTTCGGGATTTATGC-3',反向引物:5'-TCAGGACACAGTGGCTTTTG-3',内参β-actin 引物序列:正向引物:5'-CACGATGGAGGGGCCGGACTCATC-3',反向引物:5'-TAAAGACCTCTATGCCAACACAGT-3';miR-23a 引物序列:正向引物:5'-GCGAGATCTGGCTCCTGCATATGAG-3',反向引物:5'-GATGAATTCCAGGCACAGG CTTCGG-3';内参U6 引物序列:上游引物5'-CTCGCTTCGGCAGCACA-3',下游引物5'-AACGCTTCACGAATTTGCGT-3'。采用2-ΔΔCT法对miR-23a、HPV16 E6 表达水平进行定量分析。
1.4.4 MTT 法测量细胞增殖收集1.4.2 各组SiHa 细胞,以2 × 103细胞/孔的密度接种到96 孔板中。培养48 h 后,分别添加MTT 溶液(5 mg/mL)20 μL,在37 ℃下进一步孵育4 h。随后,将MTT 形成的晶体溶解在100 μL DMSO 中,使用全自动酶标仪在450 nm 处测定每孔的OD值,并根据OD值计算增殖抑制率。增殖抑制率=(OD值空白对照组-OD值实验组)/OD值空白对照组×100%。
1.4.5 流式细胞仪测定细胞凋亡参考文献[10]和AnnexinV-FITC/PI 细胞凋亡双染试剂盒说明书测定各组SiHa 细胞凋亡率。在1.5 mL EP 管中加入1 × 106个/mL 的SiHa 细胞,用3 mL 预冷PBS 洗涤2 次,离心去PBS,加入预冷的70%乙醇固定,4 ℃,2 h。离心弃固定液,3 mL PBS 重悬5 min,分别添加RNA 酶和Triton X-100,静置45 min 后,用2 μL PI 染液染色,4 ℃避光1 h。即刻上细胞流式仪检测细胞凋亡。
1.4.6 Transwell 小室实验检测细胞侵袭能力[11]将各组SiHa 细胞分离并重悬于不含胎牛血清的DMEM 中,并在Transwell 板上预涂50 μg Matrigel。随后,将2 × 105细胞/孔在Transwell 板的上腔(孔径为8 μm)中,而底部腔中填充500 μL 含有10%胎牛血清的DMEM。细胞在37 ℃下培养24 h,使用棉签擦拭未侵袭细胞,将侵袭到底部腔的细胞用4%多聚甲醛中在室温下固定20 min,用结晶紫在室温下浸染20 min。光学显微镜下观察并计数。
1.4.7 划痕实验检测细胞迁移[12]将SiHa 细胞置于6 孔板中,培养至95%融合。然后使用200 μL移液管尖端在细胞单层上形成划痕,用冰冷的PBS 洗涤2 次后,细胞在不含胎牛血清的DMEM 中于37 ℃孵育24 h,以尽量减少划痕实验中细胞增殖的影响。在倒置光学显微镜下,随机选择8 个显微镜视野(放大倍数,× 100),在0 和24 h 时间点测量划痕。使用Image J 对图像进行分析,并计算划痕愈合率。
1.4.8 WB 测定HPV16 E6、细胞凋亡相关因子(Caspase-3、Bax、Bcl-2)、迁移相关蛋白(MMP-9、MMP-2)表达SiHa 细胞按照1.4.2 的方法转染。转染后48 h,按照制造商的说明,使用RIPA 裂解液从转染的细胞中分离总蛋白,以检测蛋白表达。用10% SDS-PAGE 分离蛋白质,并将其转移到PDVF膜上。用5%脱脂奶粉在室温下封闭膜2 h。用TBST 洗涤膜,并与兔抗鼠HPV16 E6、Caspase-3、Bax、Bcl-2、MMP-2、MMP-9、GAPDH(均为1∶500)一抗一起在4 ℃下孵育过夜。然后用TBST洗涤膜,常温下用辣根过氧化物酶标记的二抗(1∶5 000)孵育2 h。使用蛋白成像凝胶仪定量分析上述蛋白表达。
1.5 统计学方法所有统计分析均使用SPSS 22.0进行。所有计量资料以3 个独立实验的平均数±标准差表示。组间比较行单因素方差分析和LSD-t检验,以P< 0.05为差异有统计学意义。
2 结果
2.1 miR-23a 在宫颈癌组织中的表达比较与癌旁正常组织相比,宫颈癌HPV 阴性组织、宫颈癌HPV 阳性组织中miR-23a 表达水平降低(0.67 ±0.14)、(0.18 ± 0.09)比(1.01 ± 0.31),F= 421.198,P< 0.05),其中宫颈癌HPV 阳性组织中miR-23a 的表达更低。
2.2 转染后各组宫颈癌SiHa 细胞中HPV16 E6表达水平及其对miR-23a 表达水平的影响与空白组、阴性转染组比较,E6 过表达组SiHa 细胞中HPV16 E6 mRNA 及蛋白表达水平升高,miR-23a mRNA 表达水平降低(P< 0.05);与E6 过表达组相比,E6+miR-23a mimics 组SiHa 细胞中HPV16 E6 mRNA 及蛋白表达差异无统计学意义(P> 0.05),miR-23a mRNA 表达水平升高(P< 0.05),见表1、图1。
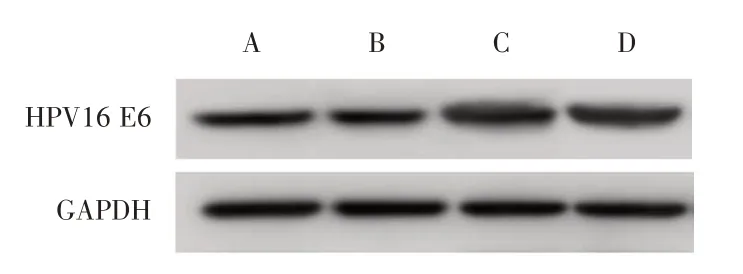
图1 各组宫颈癌SiHa 细胞中HPV16 E6 蛋白表达水平比较Fig.1 Comparison of HPV16 E6 protein expression levels in cervical cancer SiHa cells of all groups
表1 各组宫颈癌SiHa 细胞中HPV16 E6 mRNA、蛋白及miR-23a mRNA 表达水平比较Tab.1 Comparison of expression levels of HPV16 E6 mRNA, protein and miR-23a mRNA in cervical cancer SiHa cells of all groups ±s, n = 3
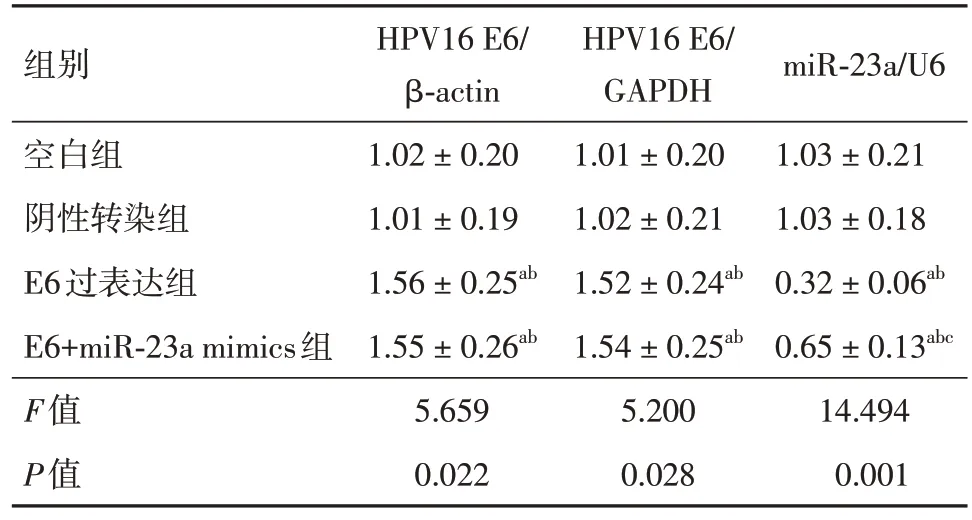
表1 各组宫颈癌SiHa 细胞中HPV16 E6 mRNA、蛋白及miR-23a mRNA 表达水平比较Tab.1 Comparison of expression levels of HPV16 E6 mRNA, protein and miR-23a mRNA in cervical cancer SiHa cells of all groups ±s, n = 3
注:与空白组相比,aP < 0.05;与阴性转染组相比,bP < 0.05;与E6过表达组相比,cP < 0.05
组别空白组阴性转染组E6过表达组E6+miR-23a mimics组F值P值HPV16 E6/β-actin 1.02 ± 0.20 1.01 ± 0.19 1.56 ± 0.25ab 1.55 ± 0.26ab 5.659 0.022 HPV16 E6/GAPDH 1.01 ± 0.20 1.02 ± 0.21 1.52 ± 0.24ab 1.54 ± 0.25ab 5.200 0.028 miR-23a/U6 1.03 ± 0.21 1.03 ± 0.18 0.32 ± 0.06ab 0.65 ± 0.13abc 14.494 0.001
2.3 各组宫颈癌SiHa细胞增殖情况比较空白组、阴性转染组、E6 过表达组和E6+miR-23a mimics 组的增殖抑制率分别是(18.16 ± 1.94)%、(17.98 ±1.66)%、(10.20 ± 0.23)%、(14.01 ± 0.47)%,组间比较差异有统计学意义(F= 10.327,P< 0.05)。与空白组、阴性转染组比较,E6 过表达组增殖抑制率降低(P< 0.05);与E6 过表达组相比,E6+miR-23a mimics 组增殖抑制率升高(P< 0.05)。
2.4 各组宫颈癌SiHa 细胞凋亡情况比较E6 过表达组与空白组、阴性转染组比较,Bax、Caspase-3蛋白表达及凋亡率下降,Bcl-2 蛋白表达增高(P<0.05);E6+miR-23a mimics 组与E6 过表达组相比,Bax、Caspase-3 蛋白表达及凋亡率增高,Bcl-2 蛋白表达下降(P< 0.05),见图2、3、表2。

图2 各组宫颈癌SiHa 细胞凋亡比较Fig.2 Comparison of apoptosis of cervical cancer SiHa cells in each group
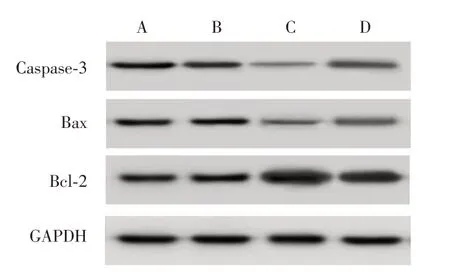
图3 各组宫颈癌SiHa 细胞凋亡蛋白表达比较Fig.3 Comparison of apoptosis protein expression in cervical cancer SiHa cells in all groups
表2 各组宫颈癌SiHa 细胞凋亡情况比较Tab.2 Comparison of apoptosis of cervical cancer SiHa cells in each group ±s, n = 3
注:与空白组相比,aP < 0.05;与阴性转染组相比,bP < 0.05;与E6过表达组相比,cP < 0.05
组别空白组阴性转染组E6过表达组E6+miR-23a mimics组F值P值细胞凋亡率(%)18.28 ± 1.23 19.01 ± 1.25 8.44 ± 0.75ab 15.33 ± 1.01abc 59.854 0.001凋亡相关因子蛋白表达Caspase-3/GAPDH 0.98 ± 0.15 1.01 ± 0.10 0.26 ± 0.07ab 0.71 ± 0.08abc 33.041 0.000 Bax/GAPDH 1.03 ± 0.14 0.99 ± 0.13 0.30 ± 0.05ab 0.65 ± 0.08abc 30.685 0.000 Bcl-2/GAPDH 0.94 ± 0.07 1.00 ± 0.08 1.64 ± 0.11ab 1.25 ± 0.09abc 38.636 0.000
2.5 各组宫颈癌SiHa 细胞迁移及侵袭情况比较与阴性转染组、空白组比较,E6 过表达组细胞穿膜数量、划痕愈合率、MMP-2、MMP-9 表达升高(P< 0.05);与E6 过表达组相比,E6+miR-23a mimics 组细胞穿膜数量、划痕愈合率、细胞侵袭相关蛋白表达降低(P< 0.05),见表3、图4-6。
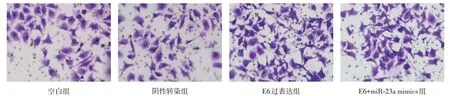
图4 各组宫颈癌SiHa 细胞侵袭情况Fig.4 SiHa cell invasion in each group

图5 各组宫颈癌SiHa 细胞迁移情况Fig.5 SiHa cell migration in each group

图6 各组宫颈癌SiHa 细胞侵袭相关蛋白表达Fig.6 Expression of invasion-related proteins in SiHa cells in each group
表3 各组宫颈癌SiHa 细胞侵袭及迁移情况比较Tab.3 Comparison of cervical cancer SiHa cell invasion and migration in each group ±s, n = 3
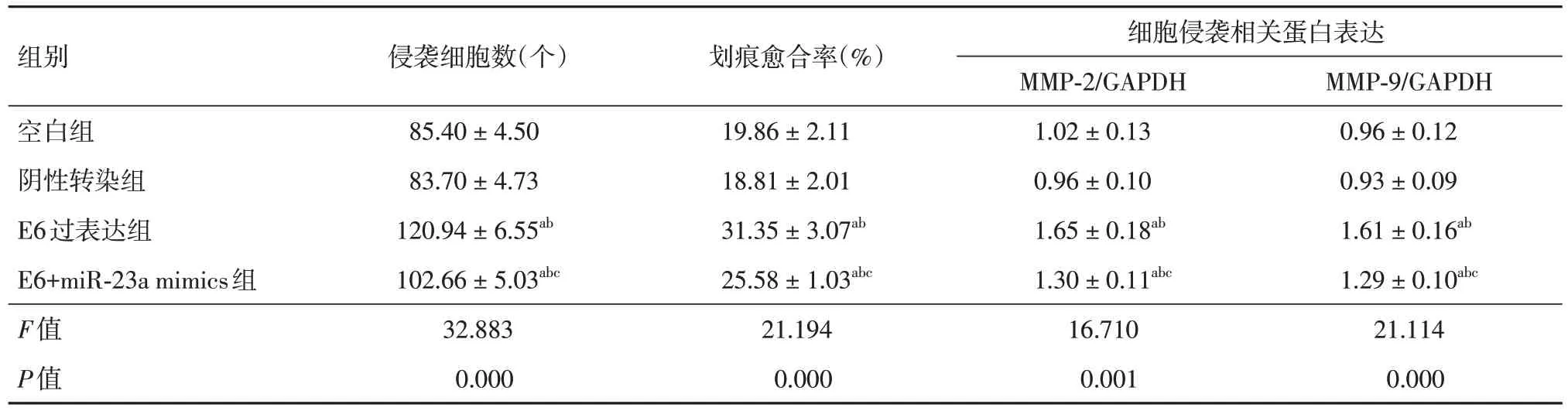
表3 各组宫颈癌SiHa 细胞侵袭及迁移情况比较Tab.3 Comparison of cervical cancer SiHa cell invasion and migration in each group ±s, n = 3
注:与空白组相比,aP < 0.05;与阴性转染组相比,bP < 0.05;与E6过表达组相比,cP < 0.05
组别空白组阴性转染组E6过表达组E6+miR-23a mimics组F值P值侵袭细胞数(个)85.40 ± 4.50 83.70 ± 4.73 120.94 ± 6.55ab 102.66 ± 5.03abc 32.883 0.000划痕愈合率(%)19.86 ± 2.11 18.81 ± 2.01 31.35 ± 3.07ab 25.58 ± 1.03abc 21.194 0.000细胞侵袭相关蛋白表达MMP-2/GAPDH 1.02 ± 0.13 0.96 ± 0.10 1.65 ± 0.18ab 1.30 ± 0.11abc 16.710 0.001 MMP-9/GAPDH 0.96 ± 0.12 0.93 ± 0.09 1.61 ± 0.16ab 1.29 ± 0.10abc 21.114 0.000
3 讨论
宫颈癌是全球第四大妇科恶性肿瘤疾病,严重威胁女性健康[13-15]。资料显示约70%的宫颈癌与高危型HPV16、18 感染有关,HPV16 表达的E6蛋白在HPV 肿瘤中起到关键作用,HPV16 E6 的促癌机制复杂,可诱导抑癌基因p53失活、下调宫颈癌HeLa 细胞的Rap1GAP 蛋白等的表达来参与肿瘤的形成,但其具体机制仍需深入研究[16]。有研究[17]表明miRNA 稳定存在于尿液、分泌物、血清等体液中,对宫颈癌、胃癌等肿瘤具有特异性,是一种较好的生物标志物,对肿瘤疾病的发生发展起到一定的调控作用。支亚丽等[18]研究发现宫颈癌组织中miR-23b 表达低于癌旁正常组织,高表达的miR-23b 具有抑制宫颈癌发生发展的作用。种楠等[19]研究发现槲皮素抑制宫颈癌细胞增殖、侵袭、迁移的作用机制可能与下调miR-23b 有关,miR-23 包括两种亚型:miR-23a 和miR-23b,二者相差一个核苷酸,因此推测miR-23a 可能与宫颈癌之间存在一定的联系。本研究结果显示,宫颈癌组织中miR-23a 表达水平降低,其中宫颈癌HPV 阳性组织中miR-23a 表达水平更低,表明miR-23a 在宫颈癌中的表达水平和miR-23b 类似,提示低表达miR-23a 与宫颈癌的发展密切相关,可能与HPV16 E6 的促癌作用存在一定的关联[20]。
资料显示HPV16 E6 具有调控宫颈上皮细胞癌变、增殖、恶性转化等作用,在宫颈癌病变中起到重要作用,HPV16 E6 可通过与E6 相关蛋白(E6-AP)结合形成复合物,再通过蛋白酶体降解使P53功能失活或抑制其活性来促进癌细胞的增殖,同时激活人端粒逆转录酶的转录,起到促进宫颈上皮细胞永生化的作用[21]。宫颈癌细胞中HPV16 E6 的表达可影响多种miRNA 的表达,HPV16 E6 基因沉默具有上调miR-23a-3p的作用[22]。ANAU等[23]研究显示高表达的HPV16 E6 可降低miR-23b 的表达,从而诱导人宫颈癌细胞的迁移。与此一致的是,本研究通过HPV16 E6 过表达发现SiHa 细胞中miR-23a mRNA 表达水平下降,表明HPV16 E6 过表达具有下调miR-23a 的作用,可能与SiHa 细胞增殖、迁移、侵袭等不良生物学行为相关。
对各组细胞增殖、凋亡、侵袭、迁移情况进行测定发现,E6 过表达可促进SiHa 细胞增殖、迁移和侵袭,并抑制细胞凋亡,而miR-23a mimics 逆转了E6 过表达对SiHa 细胞增殖、凋亡、侵袭迁移能力的影响,提示HPV16 E6 可能通过下调miR-23a促进宫颈癌细胞的增殖、侵袭、迁移并阻滞细胞凋亡。Bcl-2是抑制凋亡的调节因子,Bax和Caspase-3是促进细胞凋亡的主要调控因子,以上3 个指标的蛋白水平能够从侧面评估细胞凋亡的进展情况[24]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是肿瘤细胞完成侵袭迁移过程的重要调控分子,MMP-2、MMP-9 表达升高,肿瘤细胞的侵袭能力增强[25-26]。通过Western blot 测定各组细胞中凋亡、侵袭相关蛋白表达发现,E6 过表达降低了Caspase-3、Bax 蛋白表达,提高了Bcl-2、MMP-2、MMP-9 蛋白表达,同时过表达E6 和miR-23a 后上述蛋白表达呈现相反的趋势,进一步表明HPV16 E6 可能通过下调miR-23a 调节相关蛋白的表达促进宫颈癌细胞增殖和迁移、抑制凋亡。
综上所述,HPV16 E6 过表达宫颈癌细胞具有下调miR-23a 表达的作用,可能通过调控miR-23a表达发挥其促宫颈癌作用,为宫颈癌的治疗提供新的潜在靶点。但HPV16 E6 促宫颈癌细胞增殖、迁移的作用机制复杂,仍需深入研究。未来我们也将通过动物实验证实HPV16 E6 在宫颈癌中的作用及分子机制。
【Author contributions】WANG Min and MU Dan conducted the experiments and wrote the article. KONG Dejun presided over the experiments. YANG Li and YE Lu revised the article. HE Dan designed the study and reviewed the paper. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.

