猪肺炎支原体SYBR Green I 实时荧光定量PCR 检测方法的建立与应用
闫 微,杨 柳,龙云志,宋文博,李倩倩,余道兵,周明光,徐高原,黄 超,汤细彪
(武汉科前生物股份有限公司,湖北武汉 430070)
猪支原体肺炎又称猪喘气病或猪气喘病,是由猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)引起的一种接触性慢性呼吸系统传染病[1]。猪支原体肺炎病猪常见的临床症状包括发热、咳嗽、呼吸困难、食欲减退、饲料转化率低等。Mhp通常不引起猪死亡,但一旦感染猪群,就很难被彻底清除,将持续影响猪的生长发育[2]。此外,Mhp常与其他病毒或细菌发生混合感染引起猪呼吸系统疾病综合征(porcine respiration disease complex,PRDC),严重影响猪群出栏率[3]。目前,Mhp 在猪场呈普遍流行趋势,给生猪养殖带来了巨大经济损失[4]。据报道[5],全世界家猪群中的Mhp 平均感染率为30%~80%,发病率在40%以上[6]。宋志强等[7]对我国26 个省份2016—2019 年的35 995头肥猪进行屠宰检查,发现Mhp 平均阳性率为67%,并估算出我国养猪业在这4 年间因猪支原体肺炎产生的损失年均高达82.8 亿元。
目前,预防和控制猪支原体肺炎的主要措施是接种疫苗,在我国主要使用灭活疫苗[8]。然而,近些年来,随着Mhp 流行株的逐渐变异,临床上经常出现疫苗免疫效果不佳的情况。此外,灭活疫苗也存在一些缺点。比如:不同批次间的有效抗原含量相差较大,质控检验困难;不同流行株间的同源性差异较大,对同源性较低流行株的保护效果不理想[9]。
灭活疫苗中的抗原含量是决定Mhp 疫苗质量和免疫效力的关键因素之一。而对于Mhp 抗原含量测定,通常采用颜色改变单位(color changing units,CCU)法[10]。但传统的CCU 法测定过程漫长且繁琐,不适用于灭活疫苗生产及成品疫苗中的有效抗原含量测定。然而,在实际生产中,常常只有知道培养的Mhp CCU 才能确定其是否能用于疫苗制备及后续研究[11-12]。为了更快捷准确获得或快速检测试验生产及市售疫苗中Mhp 的CCU,本研究建立了一种快速高效获取支原体CCU 的方法——SYBR Green I 荧光定量PCR 方法,为实际生产及临床应用都提供了很大便利。
1 材料和方法
1.1 菌株与病毒
Mhp ES-2 株,保藏于中国典型培养物保藏中心,保藏编号为CCTCC M2018570。猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、副猪嗜血杆菌4 型(HPS4)及链球菌2 型(SS2),均由武汉科前生物股份有限公司临床猪病研究室分离、鉴定和保存。
1.2 主要试剂
2×EasyTaqPCR Super Mix(-dye), 购自北京全式金生物技术有限公司;电泳使用的所有Marker、载体PMD18-T、限制性内切酶及连接酶,均购自Takara 生物技术有限公司;凝胶电泳涉及的琼脂糖,购自Biowest 公司;新型核酸染料Gelred、50×TAE 缓冲液,均购自Biosharp 公司;DNA 回收试剂盒、质粒小提试剂盒,均购自天根生化科技(北京)有限公司;支原体全基因组提取试剂盒,购自Biomiga 公司;SYBR Green Master Mix,购自诺唯赞生物科技股份技术有限公司。
1.3 主要仪器
普通PCR 仪及荧光定量PCR 仪,均购自Bio-RAD 公司;电热恒温养箱,购自广东泰宏君仪器有限公司。
1.4 引物及序列
本研究使用的所有引物均通过Primer 5 软件设计,由武汉擎科创新生物科技有限公司合成,引物信息见表1。

表1 引物信息
1.5 最佳引物筛选
以ES-2 株全基因组为模板,用Mhp 标准引物构建内参质粒。对内参质粒进行10 倍倍比稀释(做9 个稀释度)将其作为荧光定量PCR 筛选最佳引物的模板,其中最大拷贝数浓度为4.9×109copies/μL,最小为4.9×101copies/μL,并以ddH2O 作为阴性对照。扩增体系及程序:2×AceQ qPCR SYBR Green master mix 10.0 μL,上下游引物各0.4 μL,DNA模板2.0 μL,50×Rox Reference Dye 0.4 μL,最后用无菌ddH2O 补至20.0 μL。反应条件:95 ℃2 min;95 ℃ 10 s,60 ℃ 35 s,40 个循环。溶解曲线分析从60 ℃到95 ℃。观察并比较4种引物(SX1、SX2、SX3 和SX4)的qPCR 最低检出模板浓度,并以此为标准筛选出最佳引物对。
1.6 引物特异性检测
对筛选出的最佳引物分别进行Mhp 和其他病毒(PPV、CV2 和PRV)及细菌(HPS4、SS2)的荧光定量PCR 检测,以确定引物特异性。
1.7 标准曲线绘制
将支原体按1:10 比例接种于含5 mL 液体培养基的西林瓶内,静置于37 ℃恒温培养箱内培养至平台初期;在超净工作台吸取100 μL 接种于含900 μL 培养基的西林瓶内,进行10 倍倍比稀释,共计稀释10~12 份,同时用支原体空白培养基作为阴性对照;在37 ℃温箱中静置培养14~21 d,肉眼观察西林瓶变色的最大稀释度即为支原体的CCU。将含量为1.0×108CCU/mL 的培养至平台期的支原体进行10 倍倍比稀释,选取6 个稀释度(10-4~10-9),每个梯度分别取200 μL 提取基因组,以此为模板并以支原体培养基为阴性对照,分别进行荧光定量PCR 扩增,以支原体CCU 的对数值为横坐标,对应的Ct 值为纵坐标绘制标准曲线。
1.8 建立方法稳定性检测
选取3 份已知不同CCU 含量的样本进行10倍倍比稀释,每个样本稀释10 份,最后一管出现颜色改变定为1 CCU/mL,推导出原支原体菌液的CCU。每份支原体样本取200 μL 提取基因组,以此基因组为模板进行荧光定量PCR 扩增,将所得Ct 值代入标准曲线方程,计算出对应的CCU。比较检测出的CCU 与计算出的CCU 之间的差异,验证建立方法的稳定性。
1.9 灭活与未灭活支原体Ct 值比较
对支原体使用0.01%的硫柳汞在2~8 ℃条件下灭活16 h,将灭活与未灭活的支原体分别提取基因组DNA 进行荧光定量PCR 扩增,得到Ct 值后进行比较。
1.10 疫苗生产中抗原含量检测和市售疫苗CCU测定
吸取两份疫苗生产中的支原体菌液各200 μL,一份提取基因组进行荧光定量PCR,将检测所得Ct 值代入标准曲线方程计算出对应的CCU,另一份使用倍比稀释法测定其中的CCU,然后比较两种方法所得结果。
分别吸取4 种市售Mhp 灭活疫苗250 μL(体积比,抗原:佐剂 = 4:1)提取基因组作为实验组,进行荧光定量PCR 检测,将检测所得Ct 值代入标准曲线方程计算支原体对应的CCU,验证疫苗中的CCU。
2 结果与分析
2.1 最佳引物筛选
以ES-2 株全基因组为模板,用引物MHP-F和MHP-R 构建内参质粒,对单菌落进行PCR 鉴定,结果见图1。将内参质粒10 倍倍比稀释9 个梯度(4.9×109~4.9×101copies/μL),并以ddH2O作为阴性对照,依据灵敏度和曲线拟合度,筛选出最佳引物,发现引物SX4 效果最佳,其灵敏度为4.9×101copies/μL,R2= 0.990 1(图2)。
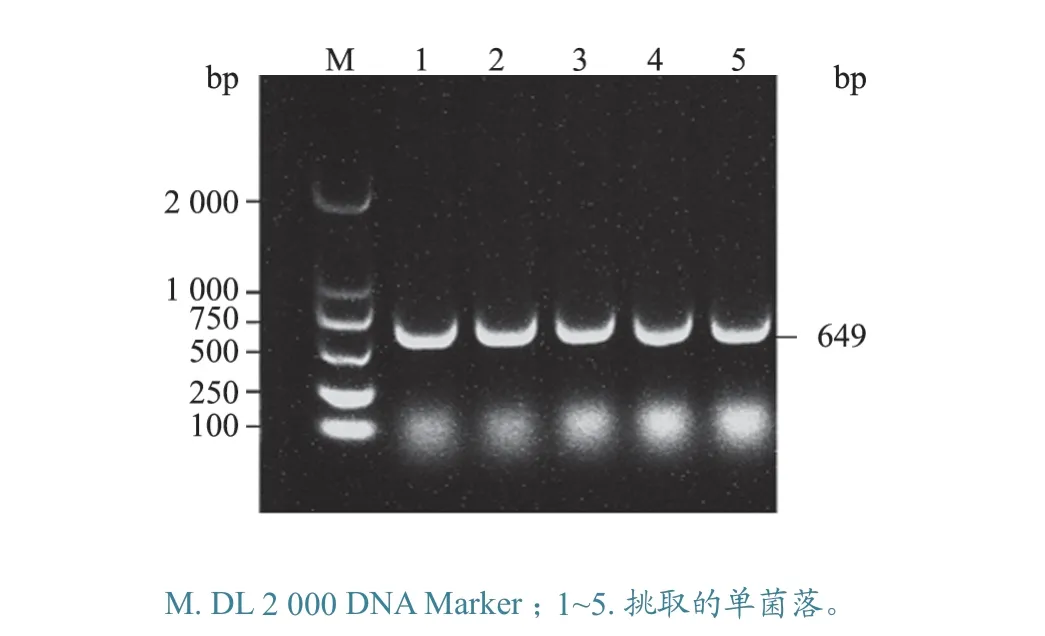
图1 内参质粒阳性克隆鉴定结果
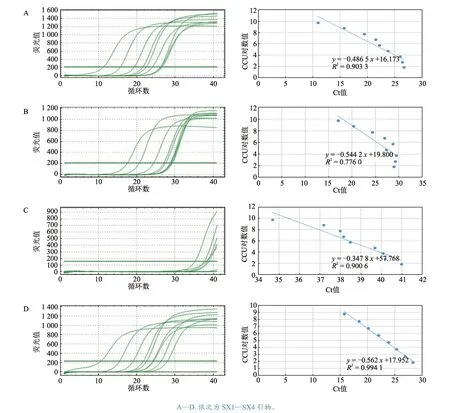
图2 4 对引物的荧光定量PCR 结果及拟合曲线
2.2 引物特异性检测
利用SX4 引物分别对Mhp、PPV、PCV2、PRV、HPS4 及SS2 进行引物特异性检测,结果除Mhp 外其他病原均无扩增(图3),说明该引物特异性良好。
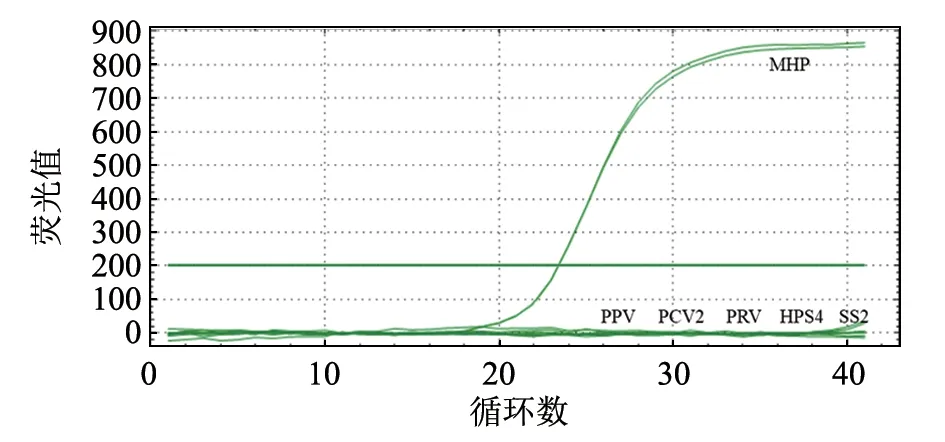
图3 引物特异性检测结果
2.3 支原体CCU 和荧光定量Ct 值之间的相关性
提取灭活前与灭活后支原体的基因组DNA进行荧光定量PCR 检测,结果灭活前的Ct 值为18.23,灭活后为18.31(图4)。由此可知,支原体在灭活前后的Ct 值基本不变,故此方法可用于市售灭活疫苗的支原体含量检测。
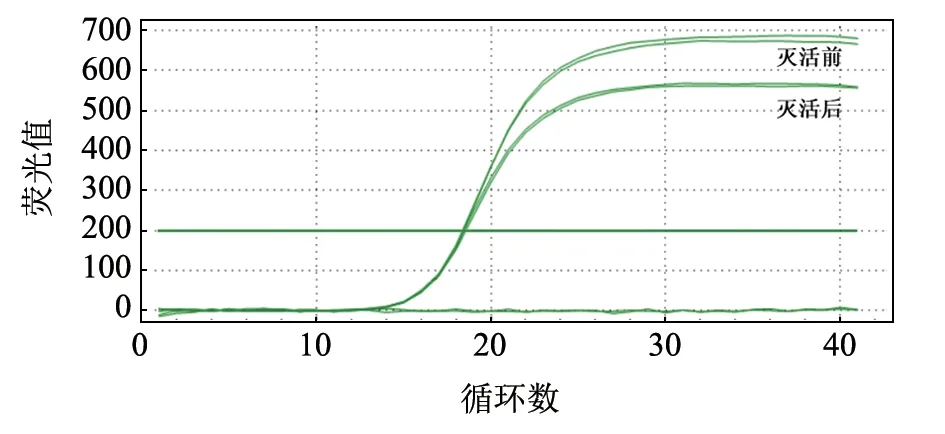
图4 灭活前后的支原体Ct 值
将抗原含量为108CCU/mL 的支原体10 倍倍比稀释9 个梯度,选取10-4~10-9稀释度,分别取200 μL 提取基因组,用引物SX4 进行荧光定量PCR 扩增,对每个稀释度基因组做3 个重复,且做阴性对照,所得结果以支原体CCU 的对数值为横坐标,对应的Ct 平均值为纵坐标绘制标准曲线,得出标准曲线回归方程为y= -3.658x+ 47.012,式中y为Ct 值,x为支原体CCU 的对数值,R2=0.997 2(图5),表明标准曲线Ct 值和支原体CCU 间呈现良好的线性关系。
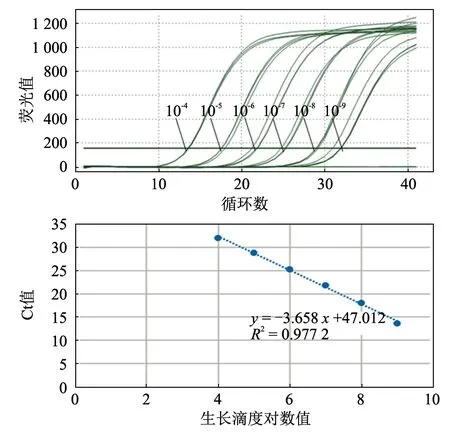
图5 不同CCU 支原体的荧光定量扩增及所得Ct 值与支原体CCU 标准曲线分析结果
2.4 引物稳定性试验
用上述建立的荧光定量PCR 方法检测3 份(样本A、B、C)已知CCU 的Mhp 原液(经倍比稀释法测定),判断建立方法的准确性。已知样本A、B、C 的支原体抗原含量分别为108、107、106CCU/mL(图6)。取样本A、B、C 各200 μL 提取基因组,以此基因组为模板进行荧光定量PCR 扩增,测定其Ct 平均值为分别为17.80、21.44、25.10(图7),将其代入标准曲线公式,计算所得对应支原体抗原含量分别为9.68×107、9.79×106、9.77×105CCU/mL(表2)。检测结果与实际含量的变异系数分别0.016 3、0.010 6、0.011 6,说明运用该方法的Ct 值能准确得出对应Mhp 的CCU。

图6 3 种已知样本的抗原含量
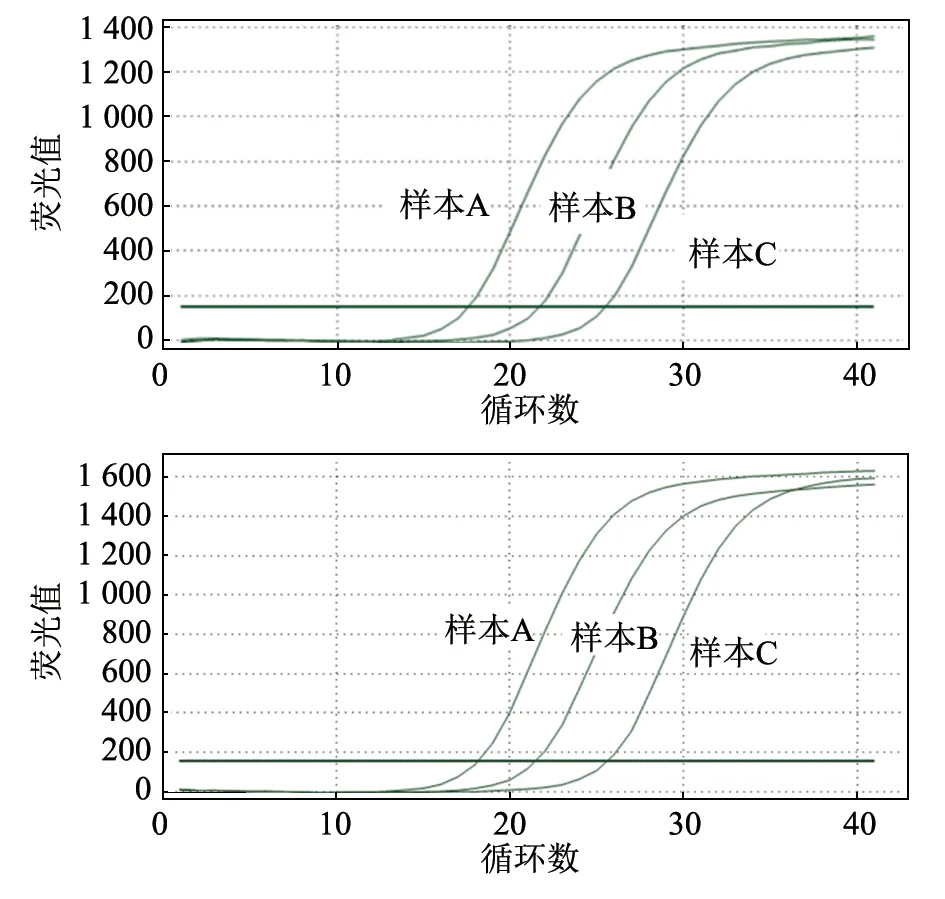
图7 不同CCU 支原体样本的两次荧光定量PCR 扩增结果
2.5 该方法测定工艺生产和市售Mhp 疫苗抗原含量
将疫苗工艺生产中的Mhp 菌液提取基因组DNA 进行荧光定量检测,结果Ct 值为14.22(图8),将其代入标准曲线公式,可得Mhp 抗原含量为9.12×108CCU/mL。采用倍比稀释法测定抗原含量为1.0×109CCU/mL(图9)。两种方法所得结果基本一致,进一步说明本研究建立的标准曲线成立,可更快捷地得出对应的CCU。
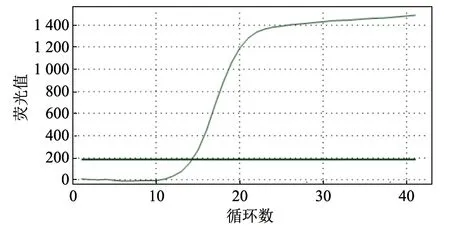
图8 疫苗生产中的CCU 荧光定量测定结果

图9 疫苗生产中的CCU 倍比稀释法测定结果
选择4 种市售Mhp 灭活疫苗,分别标注为1~4,其疫苗瓶上标注菌量分别为8.0×107、2.5×108、2.5×108、8.0×107CCU/mL。 通过本研究的荧光定量方法测定250 μL(体积比,抗原:佐剂 = 4:1)相应疫苗的菌量分别为6.43×107、9.04×107、7.87×107和5.56×107CCU/mL(图10、表3)。此方法检测所得菌量与市售疫苗标注菌量差异小于1 个数量级,而实际生产应用中的菌量测定通常采用CCU 法,肉眼观察误差可达1 个数量级,因此该方法可用于实际生产中的菌量检测。
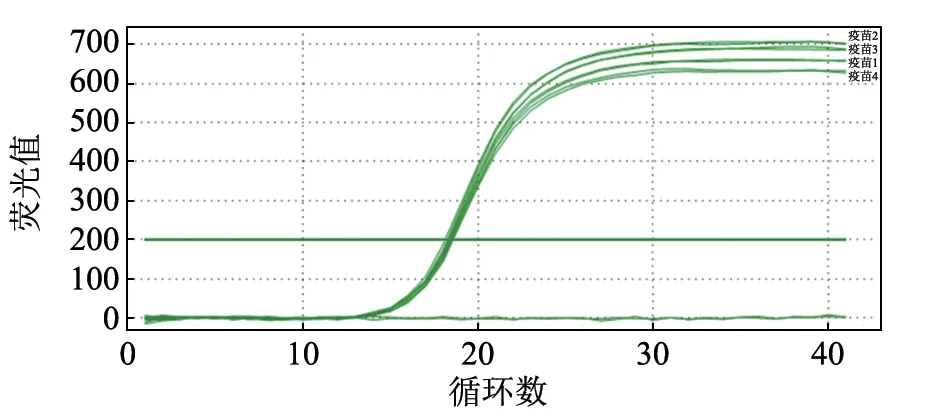
图10 用本研究方法检验疫苗样品中的抗原含量结果
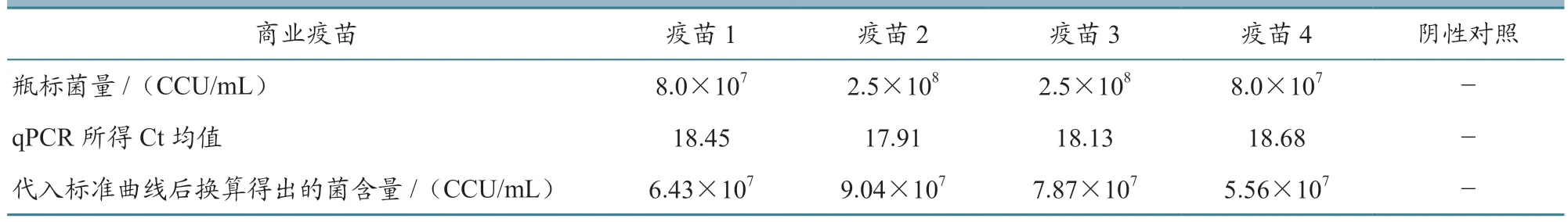
表3 4 种商业疫苗试验所得菌含量与瓶标菌量比较结果
3 讨论
疫苗的免疫效果受菌(毒)株、佐剂类型等因素影响,然而病原含量即抗原含量是影响疫苗效价的关键因素[13-14]。疫苗的CCU 是评判疫苗质量的重要标准,但是目前临床上对市售疫苗抗原量的评估存在难点,如注射疫苗后猪体内的Mhp 抗体含量与疫苗菌量没有相关性,并且临床所认可的血清学检测方法无法区分Mhp 抗体是来自自然感染还是疫苗免疫,不适用于个体动物的诊断,因此根据个体动物免疫后Mhp 抗体水平评定疫苗是否合格并不十分可靠[15-17]。而荧光定量PCR 检测技术因其高敏感性和特异性在Mhp 检测中发展迅速[18]。目前,荧光定量PCR 方法进行Mhp 检测的靶基因主要包括16S rRNA、P110、P97和P46[19]。丁敏[20]应用CCU 检测法、浊度法和荧光定量PCR 检测方法,对Mhp 的生长曲线进行研究,发现在Mhp 培养过程中,荧光定量PCR 检测法与浊度法检测结果一直高度相关,培养54 h 内,荧光定量PCR 检测法与CCU 法结果差异无统计学意义(P<0.05)。Marois 等[21]建立了以P46、P97和P102为靶基因的三重实时荧光定量PCR 方法,将其用于检测诱发SPF 猪支原体肺炎的Mhp 最小菌量。本研究建立了一种荧光定量检测Mhp 菌量的方法,可通过荧光定量检测Ct 值计算出抗原含量,与现有评估手段相比简化了试验流程[22],有助于提高生产中的检测效率。
本研究首先利用Mhp 国标引物MHP-F 和MHP-R(GB/T 35909—2018),以提取的支原体全基因组为模板进行PCR 扩增,将回收的PCR 产物与T 载体(PMD18-T)直接连接,转化至DH5α后涂于相应抗性平板,筛选阳性克隆后将测序正确的质粒作为内参质粒。根据支原体国标引物所扩片段序列设计4 对荧光定量特异性引物,通过灵敏度和扩增曲线拟合度筛查出引物SX4 敏感性最佳,为4.9×101copies/μL。通过特异性检测,发现引物SX4 对PPV、PCV2、PRV、HPS4 及SS2 都没有扩增,说明引物SX4 特异性良好。绘制该引物标准曲线,发现标准曲线Ct 值和支原体CCU 间呈现良好的线性关系。通过检测培养至不同状态的Mhp 含量发现,该方法与传统CCU 方法相比较,其CCU 数值是一致的,也验证了本研究建立方法的可行性与准确性。
基于Mhp 疫苗生产和临床使用实际,本研究利用该方法检测Mhp 疫苗生产过程及市售疫苗中的菌量,证实此方法可以作为疫苗生产过程中的菌量检测方法,并可节省人力、物力和时间成本。在市售疫苗菌量检测中,该方法测得数据与说明书标注数据差异均小于1 个数量级,但其中一份市售疫苗的检测菌量与标注菌量相差较大(较标注菌量低约2.2倍),除怀疑该疫苗的标注菌量与实际不符外,也说明在后续研究中需对该检测方法进一步优化。

