水系铵离子电池β-MnO2正极材料的制备及性能研究
刘 扬,陈 晗,向凯雄,2,3,周 伟
(1.湖南工业大学 材料与先进制造学院,湖南 株洲 412007;2.株洲冶炼集团股份有限公司 博士后工作站,湖南 株洲 412099;3.中南大学 冶金工程博士后流动站,湖南 长沙 410083)
0 引言
人类社会的快速发展导致对煤炭、石油等一次化石能源的需求不断增加,但化石燃料的开采和燃烧会对生态环境造成严重污染,因此,寻找高效、清洁且可持续的清洁能源成为当务之急[1-2]。目前,锂离子电池具有能量密度较高和循环使用寿命较长等优点备受青睐,然而锂资源匮乏、成本高昂、毒性较高、有机电解液易燃烧等缺点严重阻碍了其进一步发展[3]。1994年,LI W.等[4]使用浓度为5 mol/L 的LiNO3作为电解液,LiMn2O4和VO2(B)分别为正极和负极材料,构建了“摇椅式”水系锂离子电池。由于水系多价离子电池的安全性能较高、制造成本较低、离子导电率较高以及对环境无污染等优点,使得其发展迅速,应用前景广阔。
目前,水系多价离子电池的正极主要分为两大类:第一类采用金属离子作为电荷载流子,如锂离子(Li+)[4]、钠离子(Na+)[5]、钾离子(K+)[6]、锌离子(Zn2+)[7]等;第二类使用非金属离子作为电荷载流子,如质子(H+)[8]、铵根离子(NH4+)[9]等。
近年来,使用非金属铵根离子作为电荷载流子的研究取得较大的进展[10],由于铵根离子优势显著,如资源丰富、成本低、水合离子半价较近以及摩尔质量较轻等,加之水系铵离子溶液腐蚀性较小、氢析出电位较低等,因此引起了众多学者的关注,研究方向包括优化合成方法、深入了解其电化学性质以及拓展其应用领域等方面。
目前,关于水系铵根离子新储能领域的电极材料研究众多,比如普鲁士蓝类似物[9]、有机聚合物[11]、钒基氧化物[12]、三氧化钨[13]和层状锰氧化物[14]等。但是,在这些电极材料中,由于锰氧化物[15-16]资源丰富、无毒、成本低以及较高的工作电位和放电容量等优点,被公认为是最合适的电极材料。
基于以上分析,本文拟选取隧道结构的β-MnO2纳米棒作为水系铵离子电池的正极材料,并对其制备过程和性能进行测试,如通过XRD(X-ray diffraction)、SEM(scanning electron microscope)、TEM(transmicsion electron microscope)测试对正极材料的结构和形貌进行分析,采用活性炭作为负极材料,1 mol/L 的(NH4)2SO4水系电解液以及玻璃纤维隔膜组装成纽扣电池,并进行恒电流充放电、倍率性能以及循环性能测试等。
1 实验部分
1.1 实验材料与仪器
1)实验材料。过硫酸铵((NH4)2S2O8)、一水合硫酸锰(MnSO4·H2O)、硫酸铵((NH4)2SO4),均为分析纯,购买自国药集团;N-甲基吡咯烷酮,分析纯,天津市天力化学试剂有限公司生产;聚偏氟乙烯(PVDF),分析纯,广州化学试剂厂生产;乙炔黑,分析纯,河北墨钰化工有限公司生产;活性炭,电池级,江苏先丰纳米材料科技有限公司生产;不锈钢,电池级,东莞市天申金属材料有限公司生产。
2)实验仪器。X 射线衍射仪(XRD),Rigaku Ultima IV 型,日本理学株式会社;扫描电子显微镜(SEM),JEM6700F 型,德国蔡司集团;傅里叶变换红外光谱分析仪,NICOLET 6700 型,德国布鲁克光谱仪器公司;电化学工作站,CHI-660E 型,上海辰华仪器有限公司;电池测试系统,BTS-5 V-10 mA型,深圳新威尔电子有限公司。
1.2 β-MnO2 纳米棒材料的制备
关于β-MnO2正极材料,采用一步水热法制备纳米棒β-MnO2。具体步骤如下:将一定化学计量的过硫酸铵和硫酸锰依次添加到60 mL 蒸馏水中,用磁力搅拌至溶液透明,随后将上述溶液转移至100 mL内衬为聚四氟乙烯制成的不锈钢高压釜中,设定水热温度为180 ℃并维持该温度12 h。待冷却至室温后,通过真空过滤收集所得固体产物,并用蒸馏水和无水乙醇洗涤2~3 次,然后将其放在60 ℃ 鼓风干燥箱中干燥24 h,随后将其用玛瑙研钵研磨成粉末,所得样品材料即为β-MnO2。
1.3 电池极片的制备与组装
正极片的制备:将β-MnO2正极材料与导电剂(乙炔黑)和聚偏氟乙烯黏结剂(PVDF)按质量比为8:1:1 的比例混溶于N-甲基-2-吡咯烷酮(NMP)溶剂中并研磨成正极浆料,随后使用涂布机将该正极浆料均匀涂覆到不锈钢集流体上,放入真空干燥箱,设置温度为60 ℃,干燥24 h;将干燥后的正极极片使用冲片机裁剪成圆形极片,通过电子天平称量活性物质负载质量。负极片的制备方法与正极片制备相同:活性炭、导电剂(乙炔黑)和聚偏氟乙烯黏结剂(PVDF)的质量比为8:1:1。水系铵离子电池的组装:将正极片、负极片、玻璃纤维隔膜以及1 mol/L 的(NH4)2SO4电解液,在大气环境下组装成2025 型纽扣电池。
1.4 材料测试与表征
采用X 射线衍射仪确认所制备材料的相结构以及结晶度等相关信息。扫描范围为2θ= 5°~90°,测试条件为Cu-Kα放射线。为了观察所制备的β-MnO2正极材料的颗粒形貌以及尺寸信息,采用扫描电子显微镜和透射电子显微镜进行测试。对组装的纽扣电池,在电压范围0~1.6 V 内使用新威电化学测试仪对其进行恒电流充放电、倍率性能、循环性能等测试。采用电化学工作站进行循环伏安测试。
2 结果与讨论
2.1 材料结构表征
本文通过简易的水热法快速制备了隧道型β-MnO2正极材料,其反应方程式如下:
图1a 显示了β-MnO2正极材料的XRD 谱图,其所有衍射峰在 2θ为28.7°、37.3°、41.0°、42.8°、46.1°、56.6°、59.4°、64.8°、67.2°和72.3°处分别对应于(110)、(101)、(200)、(111)、(210)、(211)、(220)、(002)、(310)和(301)衍射晶面。其相匹配的衍射峰均与标准卡片JCPDS 24-0735 相吻合,证明所得产物β-MnO2属于四方晶系,空间群P42/mnm(136)。其峰型完整尖锐,结晶度高,且没有检测出其它杂峰。通过采用VESTA 软件更加清楚地展示了β-MnO2的晶体结构(图1b),为1 个Mn 原子与6 个O 原子共价相连形成[MnO6]八面体晶胞单元,这些[MnO6]八面体晶胞单元通过共角和共边相连的方式形成1×1 的隧道结构。
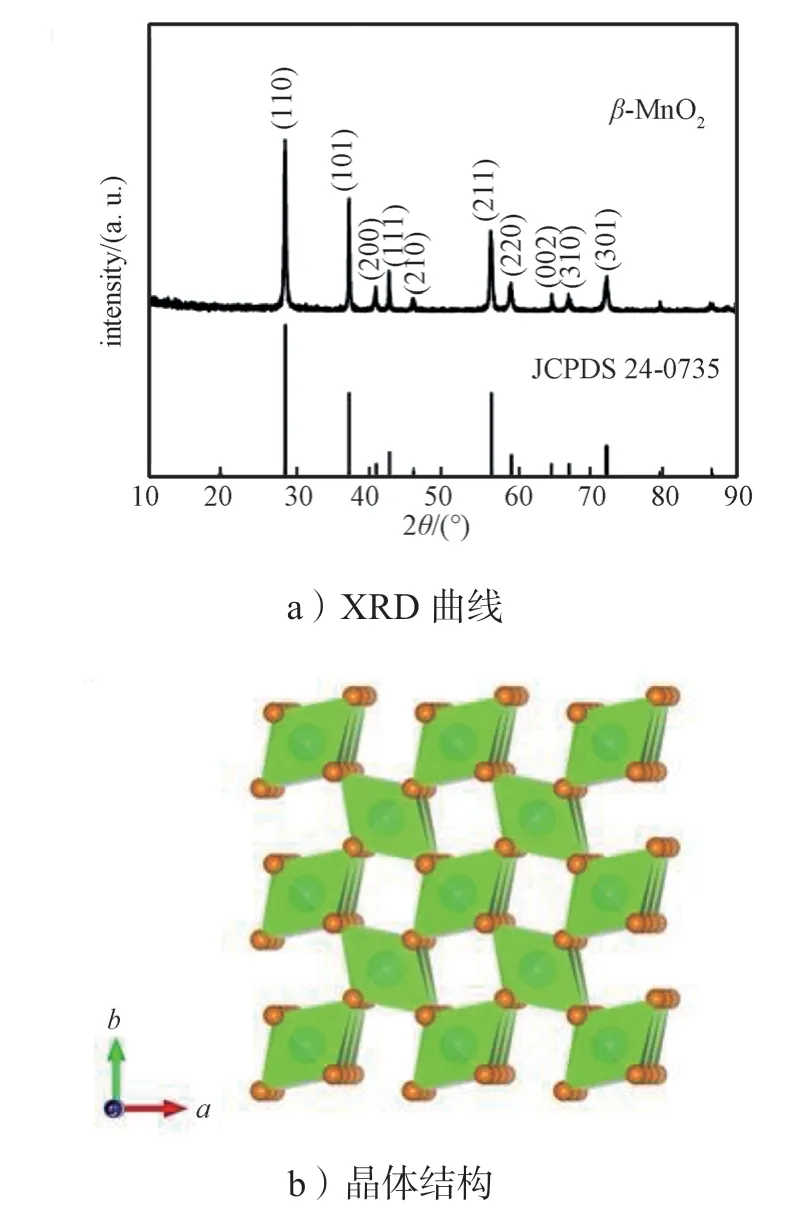
图1 β-MnO2 样品的XRD 图谱和晶体结构图Fig.1 XRD curves and crystal structure diagram of β-MnO2 samples
2.2 材料微观形貌表征
图2a 为β-MnO2正极材料的SEM 图,β-MnO2呈现纳米棒形貌,长度在200 nm~1 μm 之间,两端角尖锐,分布比较均匀。图2b 为β-MnO2的TEM 图,可以观察到其形貌和SEM 形貌吻合,图2c 为β-MnO2高分辨透射电镜(HRTEM)图,从图中可以清晰地看到β-MnO2晶格条纹,测量其晶格条纹可以得到间距d=0.24 nm,对应于β-MnO2的(101)晶面。

图2 β-MnO2 样品的微观形貌图Fig.2 Microstructure images of β-MnO2
2.3 电化学性能测试
为了研究β-MnO2纳米棒正极材料的储铵性能,对其进行了恒电流充放电、循环性能以及倍率性能测试,测试结果如图3所示。
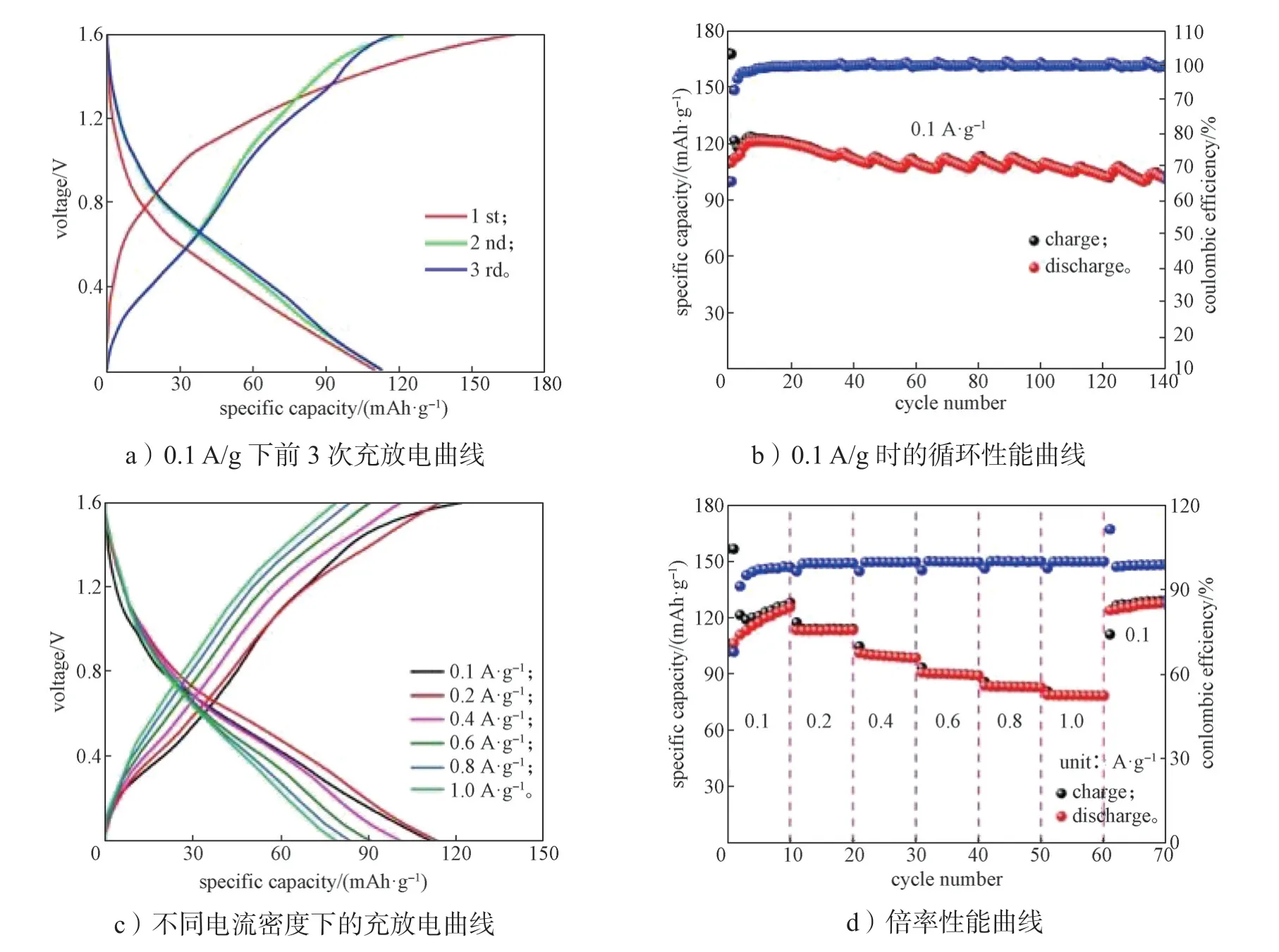
图3 β-MnO2 的电化学性能测试结果Fig.3 Electrochemical performance test results of β-MnO2
图3a 为β-MnO2纳米棒正极材料在0~1.6 V 电压区间、0.1 A/g 电流密度下的恒电流充放电曲线,从图3a 中可以知道,β-MnO2前3 次放电比容量分别为109.8,112.3,112.9 mAh/g,库伦效率分别为65.4%,92.5%,95.7%,在循环初期其放电比容量和库伦效率均有提高,这是由于新组装的纽扣电池在循环过程中电极材料与电解液充分接触,有利于铵根离子扩散。
图3b 为β-MnO2正极材料在0.1 A/g 电流密度下的循环性能图,从图3b 可知,其初始放电比容量为109.8 mAh/g,经过10 次循环后,放电比容量逐渐上升到121.2 mAh/g,库伦效率也逐渐提高,这部分对应电极活化过程。经过140 次循环后,放电比容量仍为101.9 mAh/g。其活化后的容量保持率为92.8 %,库伦效率接近100%,这表明β-MnO2电极材料具有良好的循环稳定性。
图3c 为不同电流密度下β-MnO2电极的恒电流充放电曲线,随着电流密度的增加,其放电比容量逐渐减小。此外,β-MnO2电极在0.1~1.0 A/g 电流密度下的恒电流充放电曲线显示出了几乎相同的形状,这意味着β-MnO2电极具有较低的极化现象以及优异的电化学动力学性能。
图3d 为β-MnO2在0.1,0.2,0.4,0.6,0.8,1.0 A/g 电流密度时,分别展现出121.4,113.3,99.7,90.2,83.3,78.7 mAh/g 的平均放电比容量。当电流密度恢复到0.1 A/g 时,其放电比容量回升到126.5 mAh/g,由此可知,β-MnO2电极材料的倍率性能优异。
2.4 循环伏安曲线测试
图4a 为β-MnO2正极材料在不同扫描速度下的循环伏安(C-V)曲线,在1.3 V 和0.4 V 附近可以发现一对明显的氧化还原峰,这主要归因于铵根离子的脱出与嵌入过程,MnO2中的Mn 化合价被氧化与被还原。随着扫描速度增大,极化现象使得氧化峰逐渐向右偏移,还原峰逐渐向左偏移。C-V曲线的峰值电流i和扫描速度v满足以下关系:
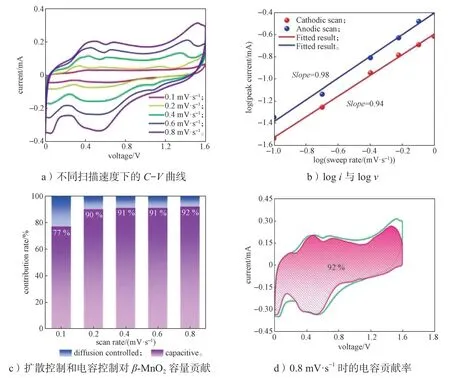
图4 β-MnO2 的循环伏安曲线及电容贡献率Fig.4 C-V curves and its capacity contribution of β-MnO2
通过变形该公式,可改写为
式中:a和b为常数,是logi对logv曲线的斜率,当b值接近0.5 时,该反应过程受扩散步骤控制,当b值接近1.0 时,该反应过程受赝电容行为控制。
如图4b所示,正极和负极峰的b值分别为0.94和0.98,表明该电荷储存过程主要受赝电容行为控制,这一特性使得铵根离子具有优异的扩散动力学,有利于其倍率性能。其表面赝电容控制容量与扩散控制容量可通过以下公式计算:
式中:k1v为表面赝电容控制;k2v1/2为扩散控制。
将式(4)变形可得:
图4c 显示了β-MnO2正极材料在不同扫描速度下的电容贡献率,随着β-MnO2正极材料扫描速度从0.1 mV/s 增加到0.8 mV/s,其电容贡献率从77%增加到92%。
图4d 为β-MnO2正极材料在0.8 mV/s 时的C-V电容贡献率曲线,可知其电容贡献率为92%。
2.5 储铵机理探索
为了解β-MnO2纳米棒的储铵机理,通过在不同充放电状态下对极片进行了非原位傅里叶变换红外(FTIR) 测试,选择了5 种电荷状态:初始、放电至0.6 V、放电至0 V、充电至1.0 V 以及充电至1.6 V,所得结果如图5所示。

图5 不同充电/放电状态下的FTIR 和高分辨率XPS 光谱Fig.5 Ex-situ FTIR curves and XPS spectra of β-MnO2 at different discharge/charge states
图5a 为β-MnO2在不同电荷状态下的FTIR 图,在放电过程中(Pristine~D 0 V),可以在红外波长为3 150 cm-1和3 350 cm-1附近观察到N—H 信号逐渐出现,在随后的充电过程中(D 0 V~C 1.6 V),该N—H 信号逐渐消失。一方面,在波长3 150 cm-1处的信号属于NH4+离子与主β-MnO2宿主材料之间相互形成氢键;另一方面,3 350 cm-1处的红外高频区归因于N—H 基团。同样的,在放电/充电过程中,在低频1 310 cm-1~1 500 cm-1的红外光谱仪区域可以看到N—H 信号的增强以及减弱并恢复到初始状态,这是由NH4+离子中N—H 键的振动造成的。在520 cm-1处的吸收峰可以归结为Mn—O 键的弯曲振动吸收峰。
图5b 为初始、D 0 V 和C 1.6 V 3 种状态下的N 1s 高分辨率XPS 光谱,由图5b 可知,在放电过程中N 1s 峰强增强,对应着铵根离子的嵌入,随后在充电过程后其峰强强度变弱,对应着铵根离子的脱出,说明铵根离子具有良好的可逆性。
以上结果说明氢键形成/断开的反应机制与β-MnO2正极材料中铵离子的可逆嵌入/脱出有关。在其它金属氧化物电极材料中也可以观察到类似的现象,如层状V2O5[12]、WO3[13]和MnOx[14]等。
3 结语
本文通过简单高效、制备方便的水热法,制备了隧道型β-MnO2纳米棒正极材料。在组装的纽扣电池中对β-MnO2纳米棒正极材料进行恒电流充放电、倍率和长循环等电化学性能测试,证明β-MnO2纳米棒适用于水系铵根离子电池正极材料。此外,通过一系列非原位FTIR、XPS 测试探索β-MnO2纳米棒的储铵机理,通过试验证明了铵根离子在隧道型β-MnO2纳米棒中可逆嵌入/脱出。隧道型β-MnO2纳米棒正极材料应用于水系铵离子电池表现出出色的放电比容量为109.8 mAh/g(电流密度0.1 A/g),经过140 次循环后,放电比容量仍有101.9 mAh/g,其保持率为92.8%,库伦效率接近100%,具有良好的循环稳定性。同时还具有良好的倍率性能,β-MnO2纳米棒正极材料即使在1.0 A/g 大电流密度下仍保持78.7 mAh/g 的放电比容量。本文将隧道型β-MnO2纳米棒正极材料应用在水系铵根离子电池,为水系铵离子的应用与发展提供了新的方向。

