天然产物中生物碱类成分调血脂作用机制研究进展
周 昶,黄 蓉,蔡 园,杨乐怡,董世芬, ,姜艳艳, *
1.北京中医药大学中药学院,北京 102488
2.国家中医药管理局“中药经典名方有效物质发现”重点研究室,北京 102488
高脂血症指由于机体脂质代谢紊乱或转运异常而引起血浆中一种或多种脂质结构失衡的代谢性疾病的统称[1]。主要临床表现为血浆总胆固醇、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、三酰甘油水平升高,或高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低[2-3]。基于以上脂蛋白的临床表现可以分为4 类:总胆固醇升高的高胆固醇血症,三酰甘油升高的高甘油三酯血症,总胆固醇、三酰甘油皆升高的混合型高脂血症,HDL-C 降低的高密度脂蛋白血症[4]。高脂血症影响着人类健康,我国血脂异常人数已超过4 亿人。对于脑血管疾病而言,高脂血症已成为仅次于高血压和高钠饮食的第3 大危险因素[5]。
近年来,大量研究表明中药复方、中药提取物及单体具有良好的调血脂活性[6-11]。中药单体因结构清晰、疗效确切、作用机制明确等优势而备受关注。天然产物中单体成分生物碱是一类含氮有机化合物,具有多种显著的生物活性,已成为研究热点[12-15]。根据化学结构的不同,生物碱类成分主要分为异喹啉类、有机胺类、哌啶类、吡咯烷类、萜类、吡啶类、吲哚类等[16]。文献报道,小檗碱、荷叶碱、胡椒碱、吴茱萸碱、辣椒素等多个生物碱类成分显示出良好的调血脂作用,并已广泛用于高脂血症的临床治疗。本文通过查阅近10 年国内外相关文献,对天然产物中生物碱类化合物调血脂作用机制进行系统综述,其机制主要包括促进肝脏胆固醇摄取、抑制肝脏胆固醇合成、促进胆固醇转化、抑制肠道胆固醇吸收、促进脂肪酸氧化、抑制脂肪生成、促进脂肪水解、调节胆汁酸代谢、调节肠道菌群、抗脂质过氧化、减轻胰岛素抵抗等,为进一步研究及开发天然产物中生物碱类调血脂新药提供帮助。
1 调节胆固醇代谢
胆固醇代谢平衡对维持细胞和机体的生命活动至关重要,其代谢异常与心脑血管疾病、神经退行性疾病及肿瘤等发生密切相关[17]。血浆胆固醇水平升高是高脂血症发生的主要原因,天然产物中生物碱类成分调节血浆总胆固醇水平主要表现在以下3个方面:(1)促进肝脏胆固醇摄取;(2)抑制肝脏胆固醇合成;(3)抑制肠道胆固醇吸收。
1.1 促进肝脏胆固醇摄取
1.1.1 上调LDL 受体转录表达 LDL 受体是一种广泛分布于肝细胞表面的多结构域跨膜糖蛋白[18],在维持体内胆固醇代谢平衡方面处于核心地位。肝细胞表面LDL 受体与携带外源性胆固醇的LDL 颗粒结合,细胞通过LDL 受体介导的内吞作用摄取LDL-LDL 受体复合物,然后LDL 从受体解离,内化的LDL 颗粒被转运到溶酶体中降解为游离胆固醇,促进肝脏胆固醇摄取,进而导致血浆中胆固醇含量降低。因此,上调LDL 受体转录表达对调控血浆胆固醇稳态至关重要。
异喹啉类生物碱小檗碱具有良好的调血脂生物活性[19]。Li 等[20]发现小檗碱可促进腺苷酸活化蛋白激酶(adenosine phosphate activated protein kinase,AMPK)磷酸化,进而上调LDL 受体表达。Lee 等[21]研究发现,小檗碱刺激c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)信号,间接上调肝细胞表面LDL 受体启动子转录活性,从而降低LDL 水平。Abidi 等[22]研究显示,细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)主要被小檗碱用于延长LDL 受体mRNA 半衰期,进而增加LDL受体的稳定性。也有报道称小檗碱体内代谢物小檗红碱及其结构修饰类似物调节LDL 受体和前蛋白转化酶枯草溶菌素 9(proprotein convertase subtilisin/kexin type 9,PCSK9)的表达主要由ERK信号通路介导,发挥降胆固醇作用[23]。PCSK9 作为一种肝源性分泌型丝氨酸蛋白酶,可与LDL 受体结合形成LDL 受体-PCSK9 复合物,后经溶酶体途径降解使肝脏表面LDL 受体数量减少,最终导致血清LDL-C 水平升高[24]。小檗碱还可通过泛素-蛋白酶体途径拮抗肝细胞核因子1α(hepatocyte nuclear factor 1α,HNF1α)的表达,在转录水平上抑制PCSK9的合成[25]。阔叶乌檀中的吲哚类生物碱3,14-二氢牛眼马钱托林碱通过抑制PCSK9 蛋白表达促进人肝癌HepG2 细胞摄取LDL[26]。脂肪从头合成相关蛋白固醇调节元件结合蛋白-2(sterol regulatory element-binding protein-2,SREBP-2)在调控LDL 受体表达方面效果显著[27]。邹莉芳[28]研究发现,自桑叶中分离得到的羟基生物碱1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)可诱导高脂饮食雌昆明种小鼠体内转录因子SREBP-2 表达水平,促进LDL受体表达,显著降低血清LDL-C。酰胺类生物碱辣椒素既能通过激活转录因子SREBP-2 增加LDL 受体的蛋白表达水平,亦能通过拮抗HNF1α 降低PCSK9 蛋白的表达[29]。荷叶碱[30]、吴茱萸碱[31]、荜茇宁[32]、巴马汀[33]可直接提高LDL 受体基因转录水平,进而影响肝脏胆固醇摄取。
1.1.2 上调HDL 介导的逆向转运 HDL 主要由载脂蛋白A1(apolipoprotein A1,ApoA1)、磷脂和游离胆固醇组成,属于血浆脂蛋白。HDL 作为载体将肝外细胞中过剩的胆固醇转运至肝脏,降解为胆汁酸盐排出体外,避免胆固醇在血液中积累,调节血脂代谢,这一过程称为胆固醇逆向转运(cholesterol reverse transport,RCT)[34]。在RCT 过程中,ATP结合盒转运子A1(ATP-binding cassette transporter A1,ABCA1)介导血管内皮下巨噬细胞中游离胆固醇及磷脂外流至ApoA1,初步形成圆盘状pre-β-HDL。而后经卵磷脂胆固醇酰基转移酶(lecithincholesterol acyltransferase,LCAT)及相关蛋白酯化为成熟HDL2 颗粒。肝细胞表面B 族I 型清道夫受体(scavenger receptor BI,SR-BI)选择性摄取一部分HDL2 中的胆固醇至肝脏中分解代谢。另一部分成熟的HDL2 在胆固醇酯转移蛋白(cholesteryl ester transfer protein,CETP)的作用下,使胆固醇酯转移至LDL 等,从而降低血浆HDL 水平。ABCG1 虽不参与盘状HDL 的生成,但可将肝外细胞中多余胆固醇转运至成熟HDL 中。因此,改善RCT 过程中相关蛋白表达有助于调节机体血脂异常。
邹瑾等[35]通过观察荷叶碱对巨噬细胞源性泡沫细胞ABCA1 表达的影响,发现荷叶碱通过激活过氧化物酶体增殖物激活受体 γ(peroxisome proliferator-activated receptor γ,PPARγ)/肝脏X 受体α(liver X receptor,LXRα)信号通路,显著上调ABCA1 的表达,有助于胆固醇流出。吲哚类生物碱吴茱萸碱具有抗肥胖、抗糖尿病、抗癌、调血脂等生物活性[36-37]。吴茱萸碱干预高脂饮食诱导的高脂血症小鼠模型后,刺激PPARγ 表达,进而增加小鼠肝脏中ABCG1mRNA 及蛋白表达,介导巨噬细胞胆固醇及胆固醇酯向ApoA1 和HDL 转移,改善RCT 显著预防高脂血症后[38]。DNJ 既能通过上调LCAT 的表达,促进游离胆固醇酯化及HDL 成熟;又可下调胆固醇酯转移蛋白CETP 的表达,抑制HDL 转化为LDL,使血清HDL-C 含量升高[28]。胡椒碱衍生物荜茇宁可显著上调LCATmRNA 和蛋白表达,催化游离胆固醇酯化[39]。冯亮[40]观察布渣叶生物碱对高脂血症大鼠动物模型的影响发现,其能提高ApoA1 的水平且激活LCAT 的表达,促进成熟HDL 合成,有助于调节血脂异常。
1.2 抑制肝脏胆固醇合成
胆固醇的内源性合成主要受胆固醇合成限速酶羟甲基戊二酸单酰辅酶A 还原酶(3-hydroxy-3-methylglutarylcoen-zyme A reductase,HMGCR)及转录因子SREBP-2 调控。HMGCR 催化3-羟基-3-甲基戊二酰辅酶A 转化为胆固醇前体物甲羟戊酸[41];而SREBP-2 可在转录水平上调控肝脏中胆固醇稳态相关基因即胆固醇合成基因的表达[42]。因此,抑制内源性胆固醇合成可有效改善血浆胆固醇升高引起的高脂血症。
Zheng 等[43]发现异喹啉类生物碱石蒜碱可改善高脂饮食高脂饮食诱导的高脂血症。石蒜碱通过螯合体1 介导的自噬非依赖性溶酶体降解途径加速SREBP 裂解激活蛋白降解,进一步抑制SREBPs 活性和蛋白表达,从而阻碍SREBPs 对肝脏内源性胆固醇合成的转录调控作用。Zhang 等[44]研究表明,辣椒素可呈剂量相关性降低肝脏HMGCRmRNA 水平,从而抑制肝脏胆固醇合成来预防卵巢激素缺乏引起的高胆固醇血症。荷叶碱能够显著下调小鼠肝脏组织细胞中影响胆固醇合成代谢相关蛋白HMGCR及SREBP-2的基因表达,进而达到降低血清总胆固醇的效果[45]。黄连中含多种生物碱,具有相似的异喹啉结构,其中常以盐酸盐形式存在的小檗碱含量最高,其次为黄连碱、巴马汀、药根碱、表小檗碱等[46]。研究表明,黄连生物碱单体及其5种单体复合物均可抑制HMGCR 的蛋白表达,减少胆固醇合成,调节血脂代谢。
1.3 抑制肠道胆固醇吸收
膳食胆固醇经小肠黏膜刷状缘上的胆固醇转运蛋白1(niemann-pick c1-like 1,NPC1L1)吸收进入小肠上皮细胞,然后被内质网中的酰基胆固醇酰基转移酶2(acyl-cholesterol acyl transferase 2,ACAT2)酯化为胆固醇酯,之后与三酰甘油、磷脂及游离胆固醇装配成乳糜微粒被运送至高尔基体,分泌到淋巴系统,最终进入血液循环[47]。此外,肠道ABCG5/8可将来自血液脂蛋白中的胆固醇排入至肠腔[48]。因此,调控肠道胆固醇吸收过程中相关蛋白表达有助于维持体内脂质平衡。药理研究表明,酰胺类生物碱胡椒碱可内化胆固醇转运蛋白NPC1L1 的表达,抑制人结直肠腺癌Caco-2 细胞对胆固醇的再摄取,调节血脂异常[49]。小檗碱也可通过下调NPC1L1 的表达发挥降胆固醇作用[50]。杜红岩[51]通过研究膳食辣椒素对肠道胆固醇吸收的影响机制,发现辣椒素通过激活瞬时受体电位香草醛亚家族1 通路,不仅能下调ACAT2 蛋白表达,抑制胆固醇酯化;而且还可上调转运蛋白ABCG5/8 的表达,促进肠道胆固醇外向转运,降低血清胆固醇水平。海洋生物碱manzamine A 是一种β-卡宾生物碱,主要通过抑制ACAT 活性改善ApoE缺陷小鼠的高脂血症[52]。
2 调节三酰甘油代谢
三酰甘油主要由甘油和游离脂肪酸酯化而成,是血脂的重要组成成分。三酰甘油水平升高是机体血脂异常的重要表现之一。调控由机体血清三酰甘油不平衡引发的高甘油三酯血症主要通过促进脂肪水解、抑制脂肪合成、促进脂肪酸β-氧化3 个方面。
2.1 促进脂肪水解
分泌型代谢调节糖蛋白血管生成素样蛋白4(angiopoietin-like 4,ANGPTL4)作为脂蛋白脂酶(lipoprotein lipase,LPL)的抑制剂,主要通过抑制LPL 的活性来阻止三酰甘油水解为游离脂肪酸[53]。阿朴啡型生物碱O-去甲基生物碱可降低ANGPTL4对LPL 的抑制作用,从而减轻三酰甘油的积累[30]。任祎等[54]通过研究燕麦麸皮中生物碱对D-半乳糖诱导的衰老小鼠血脂代谢的影响,发现其可显著上调LPLmRNA 的表达,促进脂肪水解,降低血清三酰甘油水平。脂肪三酰甘油脂肪酶(adipose triglyceride lipase,ATGL)和激素敏感性应激酶(hormone-sensitive lipase,HSL)是三酰甘油水解的关键酶[55]。小檗碱可通过激活AMPK 信号通路刺激成熟脂肪细胞水解,呈时间相关性上调ATGL 及HSL 的表达,调节三酰甘油代谢[56]。多羟基生物碱DNJ 可增加高脂饮食小鼠血清和肝脏中脂肪分解关键酶LPL 和HSL 的活性,加快三酰甘油分解,减少脂质积累[57]。
2.2 抑制脂肪生成
小檗碱及其代谢产物非洲防己碱可促进HepG2 细胞中AMPK 磷酸化,从而降低脂质生物合成相关基因脂肪酸合成酶(fatty acid synthase,FAS)、甘油三磷酸酰基转移酶(glycerol-3-phosphate acyltransferase,GPAT)、乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)的表达,降低血清中三酰甘油水平[58]。此外,Huang 等[59]研究表明,小檗碱可抑制与脂肪生成相关转录因子PPARγ 和CCTA增强因子结合蛋白α(CCAAT enhancer binding protein α,C/EBPα)及其上游调控因子C/EBPβ的mRNA 和蛋白水平[60],抑制三酰甘油生物合成。Yang 等[61]在研究盐酸药根碱抗高血脂作用机制中发现,其可降低高脂饮食致肥胖小鼠模型肝脏中SREBP-1c 及FAS 的蛋白水平,抑制脂肪生成,间接降低血清中三酰甘油水平。胡椒碱可显著拮抗小鼠胚胎成纤维3T3-L1 细胞中PPARγ、SREBP-1c、FAS 及C/EBPβ 的蛋白表达,改善脂质代谢[62-63]。莲子心生物碱包括莲心碱、甲基莲心碱、异莲心碱属于双苄基异喹啉型生物碱[64]。冯清强[65]研究莲子心生物碱对3T3-L1 细胞分化的影响,发现莲子心生物碱可有效下调脂肪形成相关转录因子PPARγ和C/EBPβ 蛋白的表达,降低细胞内三酰甘油含量,抑制脂肪形成。另有文献报道,荷叶碱能够显著抑制脂肪酸合成代谢蛋白ACC 及SREBP-1c的基因表达,达到降低三酰甘油水平的效果[45]。中药单体成分延胡索乙素(tetrahydropalmatine,THP)可显著抑制3T3-L1 细胞内三酰甘油的积累,其机制主要是THP 呈剂量相关性下调SREPP-1c 及其靶基因FAS、硬脂酰-辅酶A 去饱和酶1(stearoyl-CoA desaturase 1,SCD1)、GPAT 的表达,且抑制脂肪形成主要转录因子PPARγ 及C/EBPα 的表达[66]。从飞燕草中分离得到的brunodelphinine E、囊距翠雀碱、牛扁碱、囊距翠雀宁、sharwuphinine A 5 种二萜类生物碱,可呈剂量相关性下调脂质合成转录因子PPARγ 及SREBP-1c 的表达,抑制脂肪积累[67]。Do等[68]报道称自枯草芽孢杆菌中分离得到的DNJ 通过上调脂肪形成相关基因ACC及FAS的mRNA 表达,达到调血脂的功效。
2.3 促进脂肪酸氧化
脂肪酸β-氧化作为脂肪酸分解代谢的关键步骤,在调节血清三酰甘油方面至关重要。作为代谢性疾病的关键靶点,腺苷酸活化蛋白激酶AMPK 被激活后可促进肝脏脂肪酸氧化,调节脂代谢的关键转录因子PPARα 主要在肝脏中表达[69]。以上二者均可促进脂肪酸氧化限速酶肉碱棕榈酰转移酶-1(carnitine palmitoyl transferase-1,CPT-1)的表达,抑制脂肪酸氧化,减少血清三酰甘油合成。研究表明,药根碱干预高脂饮食诱导的高脂血症模型小鼠后,肝脏中PPARα 水平显著上调,促进CPT-1 的表达,加速脂肪酸β 氧化,从而减少血清三酰甘油水平[61]。也有报道称小檗碱及其代谢物可激活HepG2细胞中的AMP 活化蛋白激酶,促进CPT-1 的表达,表现出降低三酰甘油的作用[58]。THP 通过激活AMPK 信号通路[66],直接抑制ACC 活性,从而上调CPT-1 的表达,促使3T3-L1 细胞脂肪酸氧化,减少三酰甘油合成。邢毅[45]在研究荷叶提取物调血脂作用机制中发现,荷叶碱可直接降低CPT-1的基因表达,进而降低小鼠血清三酰甘油水平。Tsuduki等[70]研究表明DNJ 能增强血浆脂联素表达水平,激活AMPK的mRNA 表达,进而促进脂肪酸β-氧化抑制肝脏脂质蓄积。β-咔啉型生物碱picrasidine C 可诱导PPARα 及CPT-1 的蛋白表达,在治疗代谢性疾病如高脂血症中具有潜在的应用价值[71]。吴茱萸次碱通过激活AMPK/ACC2 信号通路,调控脂肪酸氧化,进而改善脂肪喂养大鼠的高脂血症[72]。具体机制见图1。
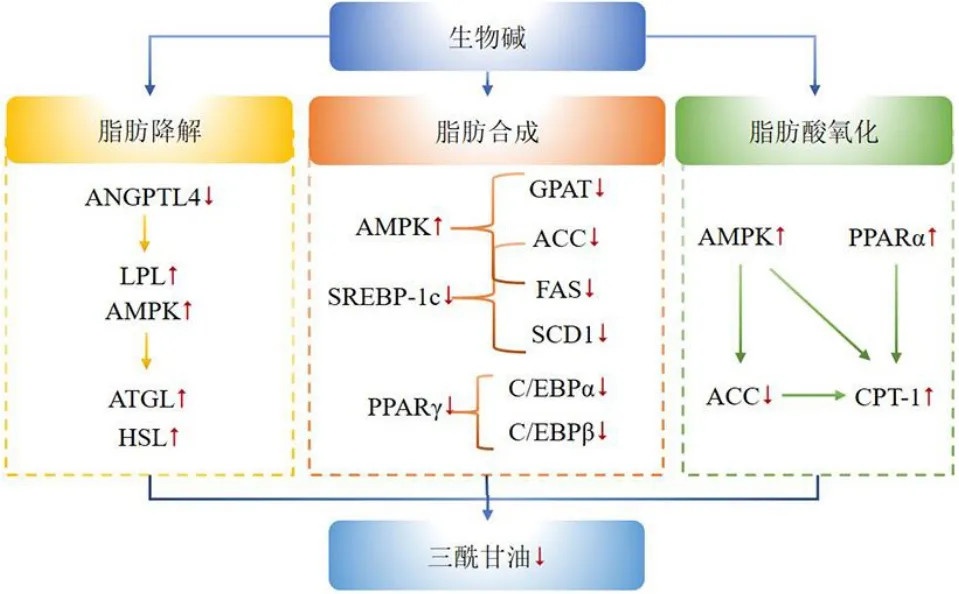
图1 生物碱类成分调节三酰甘油水平的相关机制Fig.1 Mechanism of regulation of triglyceride alcohol levels by alkaloid components
3 调节胆汁酸代谢
胆汁酸主要存在于肠肝系统中,并通过再循环调节机体脂质代谢。由肝脏胆固醇合成的胆汁酸储存于胆囊中,进食后,营养物质刺激胆囊收缩排出胆汁,胆汁酸随胆汁进入肠腔被重新吸收,最后经门静脉被肝脏细胞重新摄取。这一过程叫做胆汁酸肠肝循环[73]。机体内大约有95%的胆汁酸被肝脏重吸收,仅有5%随粪便排出体外,胆汁酸作为体内胆固醇代谢的最终产物,在调节机体脂质稳态方面发挥着重要作用。生物碱调控胆汁酸的作用机制具体表现为促进胆汁酸生物合成(即胆固醇生物转化)、激活胆汁酸相关信号通路、调节胆汁酸转运蛋白的表达3 个方面。
3.1 促进胆汁酸生物合成
由肝脏中胆固醇合成的初级胆汁酸主要涉及2条生物合成途径:(1)胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)介导的经典途径;(2)CYP27A1 介导的代替途径。Sun 等[74]研究发现THP可呈剂量相关性上调肝脏中CYP7A1 的表达,促进胆固醇分解代谢及胆汁酸合成,对高脂饮食诱导的高脂血症有一定的保护作用。Gu 等[75]研究口服小檗碱对高脂饮食诱导高脂血症仓鼠模型中胆汁酸代谢影响,结果显示,小檗碱500 ng/mL 可显著增加CYP7A1 及CYP27A1 的转录和翻译水平,促进肝脏胆固醇转化为胆汁酸,从而调节血脂异常。Ning等[76]研究巴马汀对高脂饮食所致大鼠高脂血症的改善作用,结果显示,巴马汀可激活 PPARα/CYP7A1 通路,进而调节胆汁酸代谢,对高脂血症有保护作用。邢毅[45]发现荷叶碱可显著上调LXRα和CYP7A1的基因表达,进而降低小鼠血清总胆固醇水平。药理学研究表明,黄连中生物碱单体成分可通过调节CYP7A1 的表达改善高脂饮食所致高脂血症大鼠的血脂,其作用机制可能与PPAR 的正向调节及法尼醇X 受体(farnesoid X receptor,FXR)的负向调节有关[77]。荜茇宁及其衍生物可显著上调CYP7A1 的表达,加快胆固醇清除[78]。
3.2 激活胆汁酸相关信号通路
激活胆汁酸介导的FXR/小异源二聚体伴侣(small heterodimer partner,SHP)信号通路可在一定程度上调节脂质稳态。高浓度胆汁酸经负反馈调控机制活化FXR,上调SHP 分子表达,进而抑制肝受体同源物-1(liver receptor homolog-1,LRH-1),最终拮抗CYP7A1基因表达。也有研究显示,胆汁酸活化FXR 后经SHP 下调脂肪合成相关因子的表达,降低三酰甘油含量。Huang 等[79]研究显示,从金钗石斛茎中分离得到的吡咯里西啶类生物碱石斛生物碱(Dendrobiumnobilealkaloids,DNLA)可增强高亲水性牛磺鹅去氧胆酸活性,降低与胆固醇吸收呈正相关的疏水性胆汁酸胆酸/鹅脱氧胆酸的值,有助于胆固醇外排,减少肝脏脂质积累。且DNLA 治疗组恢复FXRmRNA 水平,并诱导SHP基因的表达,可能是DNLA 调脂的靶点,具体调控机制仍有待进一步研究。中药单体成分DNJ 通过调控胆汁酸前反馈及负反馈过程中FXR、LXR及CYP7A1的基因表达,促进胆固醇转化为胆汁酸并排出体外,从而达到调血脂的效果[28]。
3.3 调节胆汁酸转运蛋白的表达
胆汁酸的回肠再摄取减少会增加肝脏中的胆汁酸合成,最终导致血浆胆固醇浓度降低。大多数胆汁酸被回肠末端的钠依赖性胆盐转运蛋白(apical sodium-dependent bile salt transporter,ASBT)有效重吸收,这是胆汁酸循环的重要生理途径和全身脂质代谢的调节。Ning 等[33]研究发现,黄连巴马汀可显著降低高脂饮食诱导的高脂血症模型小鼠回肠末端ASBTmRNA 及蛋白水平,肠道胆汁酸重吸收减少,促使肝脏胆固醇进一步向胆汁酸转化。具体机制见图2。
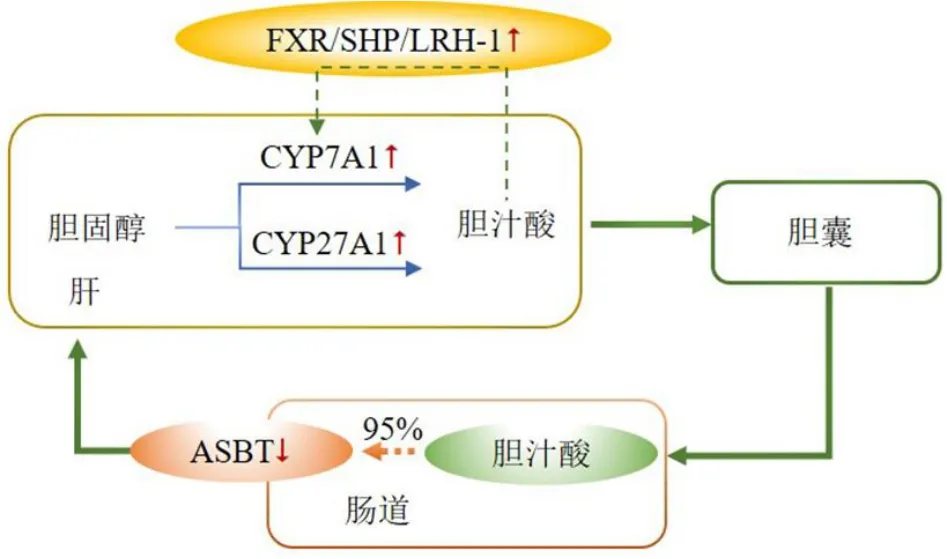
图2 基于胆汁酸代谢的生物碱类成分防治高脂血症相关机制Fig.2 Mechanisms related to prevention and treatment of hyperlipidemia by alkaloid components based on bile acid metabolism
4 调节肠道菌群
肠道微生物菌群作为代谢性疾病治疗位点,在调控血脂异常方面效果显著。天然产物中生物碱类成分通过调节肠道菌群的丰度或干预肠道微生物在体内的代谢产物拮抗高脂血症。研究表明,肠道微生物菌群将小檗碱还原为可吸收形式二氢小檗碱,其在肠道中被吸收后氧化成小檗碱入血液发挥调脂作用[80]。而硝基还原酶(nitroreductase,NR)是促进小檗碱肠道吸收的关键因素,高脂饮食处理后导致NR 产生菌的丰度和活性增加,从而更好地发挥调脂作用[81]。丁酸盐作为短链脂肪酸家族的重要成员,是肠道细菌发酵的主要产物,可以维持身体健康并为宿主代谢提供能量,血清丁酸水平与脂质生物标志物呈负相关[82-83]。小檗碱可通过上调丁酸盐产生菌的丰度及丁酸合成,促进肠道微生物菌群合成丁酸盐,随后入血发挥调脂作用[84]。也有报道称,巴马汀可减少有害菌变形杆菌、芽孢杆菌丰度,增加优势菌拟杆菌属的丰度[76],发挥调脂作用。Yu 等[85]发现荷叶碱可显著降低高脂饮食诱导的高脂血模型小鼠血清总胆固醇、三酰甘油水平。其作用机制主要与肠道微生物菌群结构及丰度有关,荷叶碱使有益菌Akkermansia及Bacteroides含量升高,且致病菌Lactobacillus含量下降,进而发挥调脂作用。王远微[86]研究辣椒素对高脂饮食诱导的野生型及基因敲除型小鼠血脂代谢影响,结果显示辣椒素2 mg/kg 通过影响小鼠肠道菌群结构、多样性及丰度,协同发挥调血脂作用。其既能减少幽门螺旋杆菌属、大肠杆菌属、萨特氏菌属和脱硫弧菌属等条件致病菌菌群的丰度,又能增加艾克曼菌属、拟杆菌属、粪便菌属、普雷沃氏菌、Odoribacter、Allobaculum和S24-7 科等具有调脂作用的有益菌菌群的数量,并且还可增加有益菌群介导的乙酸和丙酸的浓度。相关调控机制见图3。
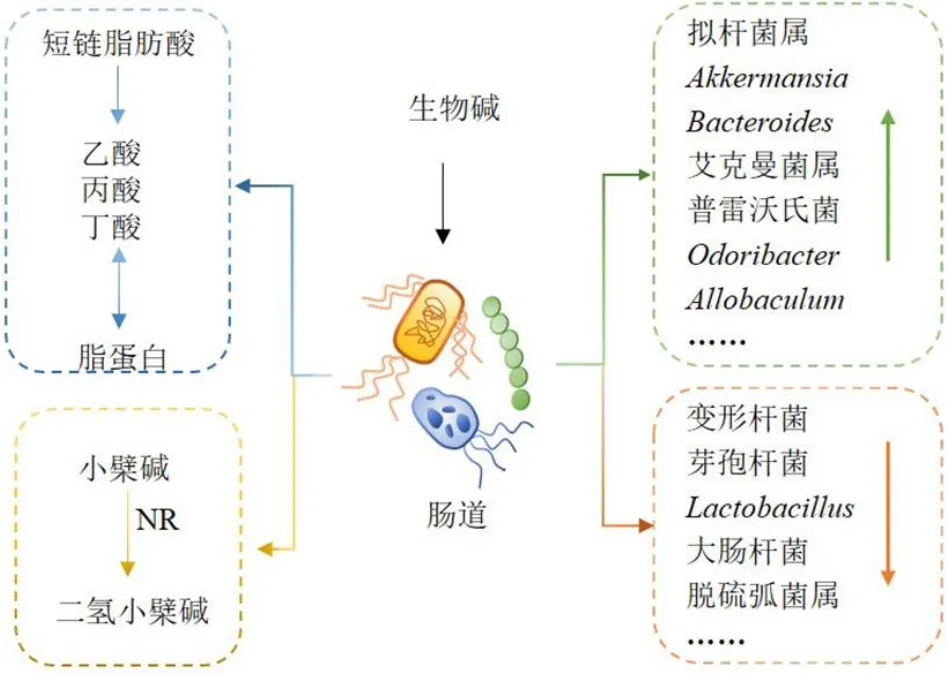
图3 基于肠道菌群的生物碱类成分防治高脂血症相关机制Fig.3 Mechanisms related to prevention and treatment of hyperlipidemia by alkaloid components based on intestinal flora
5 其他
此外,药理学研究表明,生物碱调脂作用还与脂质过氧化及胰岛素抵抗有关[87-88]。生物碱可保护血管内皮细胞、抗氧化及清除体内多余的氧自由基,显著改善高脂血症导致的机体内氧化与抗氧化失衡,进而调控血脂异常[89-90]。超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)及过氧化氢酶(catalase,CAT)作为生物体内抗氧化酶系中的重要成分[91-95],在机体氧化与抗氧化平衡中具有重要作用,是机体抗过氧化能力的指标。在生物体内,自由基作用于脂质发生过氧化反应生成终产物丙二醛,具有一定细胞毒性,可干扰脂肪酸氧化降解,最终导致脂肪在肝内蓄积[96]。Lin 等[97]研究表明自木贼草中分离得到的生物碱通过提高机体SOD 活性,降低丙二醛水平,显著改善高脂饮食喂养大鼠的HDL-C 水平,降低总胆固醇、三酰甘油、LDLC 水平。胡椒碱及其衍生物可显著增强高脂血症大鼠血清和肝脏中SOD、CAT、GSH-Px 活力,降低丙二醛含量,提高机体抗氧化能力,降低脂质过氧化程度,从而促进调脂效果[32,98]。燕麦生物碱(avenanthramide A~C)可提高SOD 及GSH-Px 活性,减少丙二醛含量,降低血清总胆固醇及LDL 水平[99-101]。小檗碱对高脂血症大鼠肝组织SOD、丙二醛和GSH-Px 有一定影响[102],可恢复机体氧化及抗氧化系统的动态平衡,进而纠正高脂血症大鼠肝脏指数。以季铵型芥子碱为代表的莱菔子水溶性生物碱可提升ApoE基因敲除小鼠血清SOD 活性并下调丙二醛含量,下调小鼠血清总胆固醇、三酰甘油、LDL-C 水平,同时升高HDL-C 水平[103-104]。原发性血脂异常家族性合并高脂血症主要与胰岛素抵抗有关。胰岛素抵抗可导致脂蛋白脂肪酶活性降低,刺激循环系统中富含三酰甘油的脂蛋白血浆清除减少[105-106]。因此,减轻胰岛素抵抗也是改善血脂异常的有效途径之一。葫芦巴种子中的活性化合物葫芦巴碱通过Insig 信号通路增强胰岛素敏感性,改善高脂血症[107]。吡嗪类生物碱川芎嗪通过抑制信号传导及转录激活因子3 信号通路降低铁调素的表达来预防高脂血症,为治疗高脂血症提供了一种具有前景的新策略[108-109]。
6 结语与展望
天然产物中生物碱类数量丰富且分布广泛,目前已报道的具有调血脂活性的生物碱主要包括异喹啉类、吲哚类、有机胺类、哌啶类、萜类等。本文通过整理天然产物中生物碱类成分干预高脂血症的作用机制,发现生物碱主要通过调控与脂质代谢密切相关的靶基因及蛋白表达水平和相应的信号通路,直接或间接发挥调脂作用(图4)。其调脂机制具体表现为以下几个方面:(1)生物碱通过激活LDL 受体转录表达及HDL 介导的逆向转运促进肝脏胆固醇摄取,减少血浆胆固醇积累。(2)生物碱通过上调HMGCR 介导的转录调控及SREBP-2 介导的转录后调控抑制肝脏胆固醇合成,进而调节脂质代谢。(3)生物碱通过调控肠道胆固醇吸收过程中相关蛋白NPC1L1、ACAT2 及ABCG5/8 的表达,维持体内脂质平衡。(4)生物碱也可通过下调FAS、GPAT、ACC、PPARγ、C/EBPα、C/EBPβ、SREBP-1c、SCD1 等的蛋白表达,提高脂解基因LPL、ATGL、HSL的活性,抑制脂肪酸β 氧化,调控由机体血清三酰甘油不平衡引发的高甘油三酯血症。(5)生物碱通过调控胆汁酸肠肝循环过程中相关蛋白及信号通路改善血脂异常。(6)生物碱还可调节肠道菌群的丰度或干预肠道微生物在体内的代谢产物拮抗高脂血症。(7)生物碱可改善高脂血症导致的机体内氧化与抗氧化失衡。
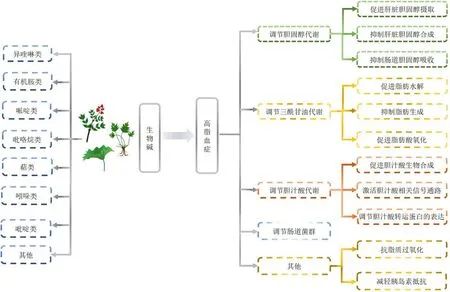
图4 天然产物中生物碱类调血脂机制Fig.4 Mechanism of hypolipidemic effect of alkaloid components in natural products
药物作用机制研究是中药及天然产物研究领域的关键科学问题,是阐明其科学内涵的重要途径,也是开展新药研发的前提和基础。天然产物中有效成分(群)通常表现为多途径、多靶点的复杂作用机制,生物碱类成分在发挥调血脂药效时也表现为通过多个基因靶点及通路发挥作用的特点。然而,目前大多数关于作用机制的研究仍然集中在单一或若干途径,对于作用机制的研究不够深入系统。因此,在今后的研究中,可结合蛋白质组学、基因组学、代谢组学、生物信息学、大数据挖掘等前沿生物医药科学技术,从多角度、多层面深入研究天然产物中生物碱类成分调血脂活性及作用机制。同时,中药调血脂作用机制研究还应注重与传统中医药理论相融合,从中药功能主治出发,构建符合中药特点的研究方法及体系。为生物碱类成分治疗高脂血症提供科学依据,为植物来源的调血脂药物的发现及开发奠定基础。
利益冲突所有作者均声明不存在利益冲突