新肾病1 号方调控miR-199b-5p 抑制肾小管上皮间充质转化改善肾纤维化的作用研究
曾聪聪,俞文秀,王成功,姜程曦,程锦国*
1.温州医科大学附属第一医院 中医科,浙江 温州 325000
2.温州医科大学,浙江 温州 325000
3.温州医科大学药学院,浙江 温州 325000
慢性肾脏疾病(chronic renal disease,CKD)作为全球健康面临的一大难题,其发病率呈上升趋势,已成为常见的死亡原因[1]。肾纤维化作为一种慢性病理过程,是CKD 进展的主要病理特征。在CKD的早期阶段,肾纤维化主要表现为肾小球硬化和肾小管间质纤维化,随着病情的进展,肾纤维化程度逐渐加重,最终导致肾功能衰竭[2]。因此,肾纤维化在CKD 的进展中起着关键作用,为疾病的预后和诊断提供了重要指标。然而肾纤维化进展的机制尚未完全阐明,临床治疗肾纤维化仍缺乏有效的方法。
越来越多的证据表明,肾小管上皮间质转化(epithelial-mesenchymal transition,EMT)是肾间质纤维化的关键事件,其特征是成纤维细胞增殖和细胞外基质(extracellular matrix,ECM)产生与降解之间的不平衡。在CKD 的发展过程中,肾小管细胞通过EMT 途径转化为间充质细胞,这一过程伴随着纤维化的发生。EMT 不仅参与了肾纤维化的形成,还通过旁分泌机制进一步加剧了纤维化的进程[3-4]。因此,抑制肾小管细胞的EMT 可能是一种潜在的治疗策略,有助于延缓或逆转肾纤维化,从而改善CKD 的预后。
MicroRNAs(miRNAs)是一类非编码RNA,它们在多种生物进程的转录后水平调节中发挥作用[5]。近年来,miRNAs 在肾小管EMT 中的作用也逐渐被重视。如miR-21、miR-29、miR-30 等可以通过调节与EMT 相关的基因(如Snail、Slug、Twist等)的表达水平,影响肾小管上皮细胞的形态、结构和功能[6-8]。miRNA 除可以正向或负向影响肾小管上皮间质转化,还可通过直接结合到靶基因的3’-UTR 区,抑制或促进靶基因的表达[9]。此外,miRNA还可以通过影响信号转导通路的活性[10],影响EMT的进展。
研究发现,糖尿病肾病患者血清miR-199b-5p水平升高,提示其参与了肾脏疾病的发生发展[11];雷伟等[12]发现miR-199b-5p 在脂多糖诱导的大鼠肾小管上皮细胞损伤中表达升高;miR-199b-5p 还通过激活周期蛋白依赖性激酶9(cyclin-dependent kinases 9,CDK9)/Smad3 轴促进心肌纤维化[13];此外,miR-199b-5p 在多种肿瘤EMT 进程中表达下调[14-15]。但关于miR-199b-5p 在肾小管EMT 及肾纤维化进程中的研究甚少,因此,进一步探究miR-199b-5p 在肾脏纤维化中的作用和调控机制,将为开发新的治疗方法提供更多思路。
新肾病1 号方(Improved-Nephropathy Formula 1,N1F)是第六批全国老中医药专家学术经验继承工作项目指导老师程锦国治疗慢性肾纤维化的经验方,临床疗效良好,前期实验研究了其抗肾纤维化的作用[16-17],但能否通过影响miRNAs 表达发挥对肾纤维化的治疗作用尚未见报道。故本项目以中医临床疗效确实的中药复方N1F 为研究对象,旨在观察N1F 调控miR-199b-5p、抑制肾小管EMT、发挥抗肾纤维化的作用,探讨治疗肾纤维化的新靶点。
1 材料
1.1 动物
36 只SPF 级雄性大鼠,体质量(200±20)g,购自浙江维通利华实验动物有限公司,许可证号SYXK(浙)2021-0020。所有大鼠均安置在SPF 环境中,温度20~25 ℃,相对湿度40%~70%,12 h光照和黑暗循环,适应性喂养1 周。动物实验经温州医科大学动物实验伦理委员会批准(批准号wydw2022-0633)。
1.2 药材
N1F 由温州医科大学附属第一医院中药房提供,由黄芪30 g、鳖甲12 g、猫人参30 g、三七12 g、附子6 g、土鳖虫15 g、党参30 g、柴胡12 g、桂枝12 g、制大黄6 g、黄柏10 g、片姜黄12 g、铁树叶30 g 组成,经温州医科大学附属第一医院中药房陈晓城副主任分别鉴定为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao 的干燥根、鳖科动物鳖TrionyxsinensisWiegmann 的背甲、猕猴桃科猕猴桃属植物对萼猕猴桃ActinidiavalvataDunn 的根、五加科植物三七Panaxnotoginseng(Burk.) F.H.Chen的干燥根和根茎、毛茛科植物乌头Aconitum carmichaeliiDebx 的子根的加工品、鳖蠊科昆虫地鳖EupolyphagasinensisWalker、桔梗科植物党参Codonopsispilosula(Franch.) Nannf.的干燥根、伞形科植物柴胡的干燥根BupleurumchinenseDC.、樟科植物肉桂CinnamomumcassiaPresl 的干燥嫩枝、蓼科植物掌叶大黄RheumpalmatumL.的干燥根和根茎、芸香科植物黄皮树PhellodendronchinenseSchneid.的干燥树皮、姜科植物姜黄CurcumalongaL.的干燥根茎和苏铁科植物苏铁CycasrevoluteThunb.的干燥叶。课题组采用UPLC-Q-TOF-MS 对N1F 水煎剂的成分进行了分析,鉴定出其水提取物含有97 种化学成分。N1F 中以柴胡、黄芪、黄柏为主,主要药效成分为柴胡皂苷、黄芪甲苷和盐酸小檗碱,质量浓度分别为0.024、0.117、0.032 mg/mL。
1.3 药品与试剂
氯沙坦钾片(国药准字号J20180006,批号0037482)由浙江华海药业股份有限公司生产,购自温州医科大学附属第一医院;逆转录试剂盒(批号RR036A)、TB Green Premix EX TaqTM II 试剂盒(批号RR820A)购自日本Takara 公司;苏木素-伊红(HE)染色试剂盒(批号G1340)、Masson 染色试剂盒(批号G1120)购自北京索莱宝科技有限公司;大鼠血清肌酐(serum creatinine,SCr)测定试剂盒(批号C011-2-1)、大鼠血清尿素氮(blood urea nitrogen,BUN)测定试剂盒(批号C013-2-1)购自南京建成生物工程研究所;PVDF 膜(批号IPVH00010、ISEQ00010)购自美国Millipore 公司;兔抗波形蛋白(Vimentin)抗体(批号5741)、兔抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号19245)购自美国CST 公司;兔抗GAPDH抗体(批号ab128915)、兔抗E-钙黏蛋白(Ecadherin)抗体(批号ab231303)、兔抗紧密连接蛋白(Zonula occludens-1,ZO-1)抗体(批号ab96587)、HRP 标记的山羊抗兔二抗(批号ab205718)、Alexa Fluor®488标记的山羊抗兔IgG 二抗(批号150077)、DAPI(批号ab104139)购自英国Abcam 公司。
1.4 仪器
CFX 荧光定量PCR 仪、165-8001 型电泳仪、转膜仪(美国Bio-Rad 公司);TGL-16g R 型低温离心机(上海安亭科学仪器厂);BSA224S 型电子分析天平(赛多利斯公司);Spectra Max 190 型全波长酶标仪(美国Molecular Devices 公司);JS-M6P 型凝胶成像系统(上海培清科技生物公司);Histo Core Arcadia 型石蜡包埋机、RM2235 型石蜡切片机(德国Leica 公司);TI-S 型倒置荧光显微镜(日本Nikon 公司)。
2 方法
2.1 肾纤维化模型建立、分组和给药
36 只SPF 级雄性大鼠适应性喂养1 周后,随机分为假手术组、模型组及N1F 低、中、高剂量(9.69、19.38、38.76 g/kg,分别相当于临床剂量的0.5、1、2 倍[18])组和氯沙坦(50 mg/kg)组,每组6 只。除假手术组外,其余30 只大鼠均行单侧输尿管结扎术,将动物固定在手术台上,消毒后,在腹部正中作1 个小的切口,分离出左侧输尿管并将其结扎,从而造成梗阻。假手术组大鼠仅开腹游离左侧输尿管不结扎。术后第1 天开始,每日给药1 次,连续14 d。各给药组每日早晨ig 相应药物,假手术组和模型组ig 等体积蒸馏水。
2.2 生化指标检测
末次给药2 h 后,以1%戊巴比妥钠(40 mg/kg)ip 大鼠。提前备好抗凝管,大鼠麻醉后腹主动脉取血,血液样本置于抗凝管中,摇匀,4 ℃、3 000 r/min离心10 min,分离血清,−80 ℃冰箱保存。按照试剂盒说明书检测SCr 和BUN 水平。
2.3 肾脏组织病理学变化
取出的肾组织经过固定、脱水、浸蜡、包埋等步骤后,被切成薄片。然后行HE 染色、Masson 染色,于显微镜下观察肾组织的病理学改变。
2.4 大鼠肾组织差异表达miRNA 的分析
2.4.1 肾组织RNA 的提取、制备文库和测序 分别从假手术组、模型组和N1F 高剂量组随机选取3只大鼠的肾脏组织,使用TRIzol 法提取组织样本的总RNA。实验流程按照Illumina 公司提供的标准步骤执行,包括制备文库和测序实验。miRNA 测序文库制备采用TruSeq Small RNA Sample Prep Kits 试剂盒[19]。文库制备工作完成后,对构建好的文库使用Illumina Hiseq2000/2500 进行测序,测序读长为单端50 bp。
2.4.2 基因鉴定与表达分析 此部分实验委托联川生物公司完成。每个具有miRNA 序列的样品读长与已有miRNA 数据库和新miRNA 的预测结果进行比较,对各样本中miRNA 进行表达量分析,并对表达量进行归一化,得到norm 值。以差异倍数(fold change,FC)>2 或FC<0.5(即|log2FC|>1)、P<0.05 为阈值。使用edgeR 软件进行差异表达分析,获得不同样本之间的差异表达miRNA。
2.5 差异表达miRNA 的qRT-PCR 验证
选择miR-199b-5p 这个差异表达miRNA 进行qRT-PCR 验证。取各组大鼠 miRNA,使用TransScriptⅡAll-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)反转录试剂盒反转录成cDNA。根据TransStart Top Green qPCR SuperMix 试剂盒说明书进行qRT-PCR 分析。引物序列见表1。
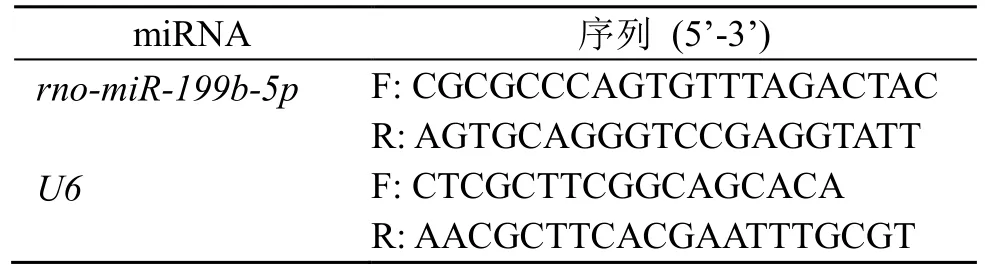
表1 miRNA 引物序列Table 1 miRNA primer sequences
2.6 miR-199b-5p 靶基因的功能分析
通过dbEMT、Genecard、String 等数据库对miR-199b-5p 的靶基因进行富集,包括基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。同时,初步筛选miR-199b-5p 通过EMT 影响肾纤维化的靶基因。
2.7 免疫荧光染色检测肾组织α-SMA 及ZO-1 表达情况
将肾组织样本石蜡包埋、切成薄片,脱蜡、水化,柠檬酸缓冲液中加热,滴加3%的H2O2孵育15 min,血清37 ℃封闭30 min,分别滴加α-SMA(1∶600)及ZO-1(1∶500)抗体,4 ℃孵育过夜;滴加荧光二抗(1∶800),避光37 ℃孵育1 h,DAPI复染10 min 后,滴加防荧光淬灭剂封片,利用荧光显微镜进行拍照。
2.8 Western blotting 检测肾组织 α-SMA、Vimentin、E-cadherin 和ZO-1 蛋白表达
肾组织加入RIPA 蛋白裂解液和蛋白酶抑制剂,取上清提取总蛋白。使用BCA 法测定蛋白含量,蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,用5%脱脂牛奶封闭1.5 h,分别加入α-SMA(1∶1 000)、Vimentin(1∶1 000)、E-cadherin(1∶1 000)、ZO-1(1∶2 000)及GAPDH(1∶20 000)抗体,孵育后洗膜;加入二抗孵育、洗膜,滴加发光液,采用凝胶成像系统拍照,分析条带灰度。
2.9 统计学分析
采用SPSS 23.0 软件进行数据处理和统计学分析,数据均以±s表示,采用单因素方差分析(One way ANOVA)法进行多组间差异分析。
3 结果
3.1 N1F 对肾纤维化大鼠肾功能的影响
如表2所示,与假手术组比较,模型组大鼠SCr、BUN 水平均明显升高(P<0.01);与模型组比较,各给药组SCr、BUN 水平均明显降低(P<0.05、0.01),且N1F 高剂量组作用最佳。
表2 N1F 对肾纤维化大鼠肾功能的影响 (±s, n = 6)Table 2 Effect of N1F on renal function in rats with renal fibrosis (±s , n = 6)
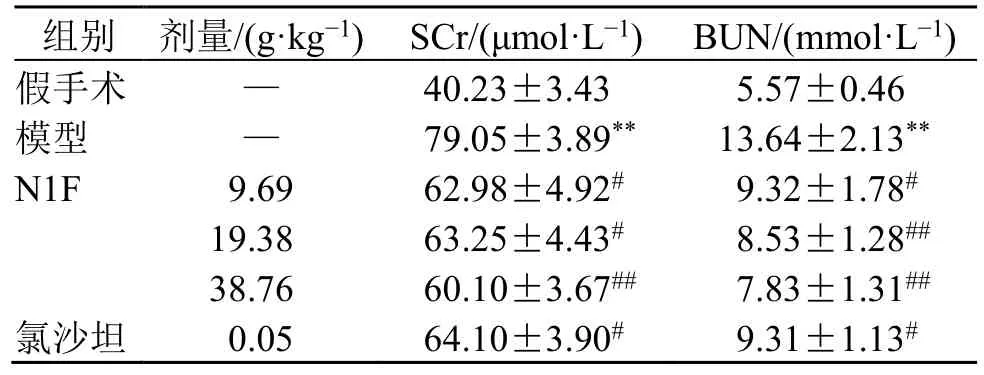
表2 N1F 对肾纤维化大鼠肾功能的影响 (±s, n = 6)Table 2 Effect of N1F on renal function in rats with renal fibrosis (±s , n = 6)
与假手术组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01.**P < 0.01 vs sham group; #P < 0.05 ##P < 0.01 vs model group.
组别 剂量/(g·kg−1) SCr/(μmol·L−1) BUN/(mmol·L−1)假手术 — 40.23±3.43 5.57±0.46模型 — 79.05±3.89** 13.64±2.13**N1F 9.69 62.98±4.92# 9.32±1.78#19.38 63.25±4.43# 8.53±1.28##38.76 60.10±3.67## 7.83±1.31##氯沙坦 0.05 64.10±3.90# 9.31±1.13#
3.2 N1F 对肾纤维化大鼠肾脏病理变化的影响
如图1 所示,假手术组大鼠肾脏结构正常,肾小球、肾小管及间质均无异常改变。与假手术组比较,模型组肾小管上皮细胞出现大量变性坏死,管腔扩张,间质增宽,大量炎性细胞浸润,肾小管萎缩,肾间质胶原纤维沉积明显增多;与模型组比较,各给药组大鼠肾脏组织的炎性细胞浸润有一定程度减轻,胶原纤维沉积减少,其中N1F 高剂量组胶原纤维沉积明显减少。
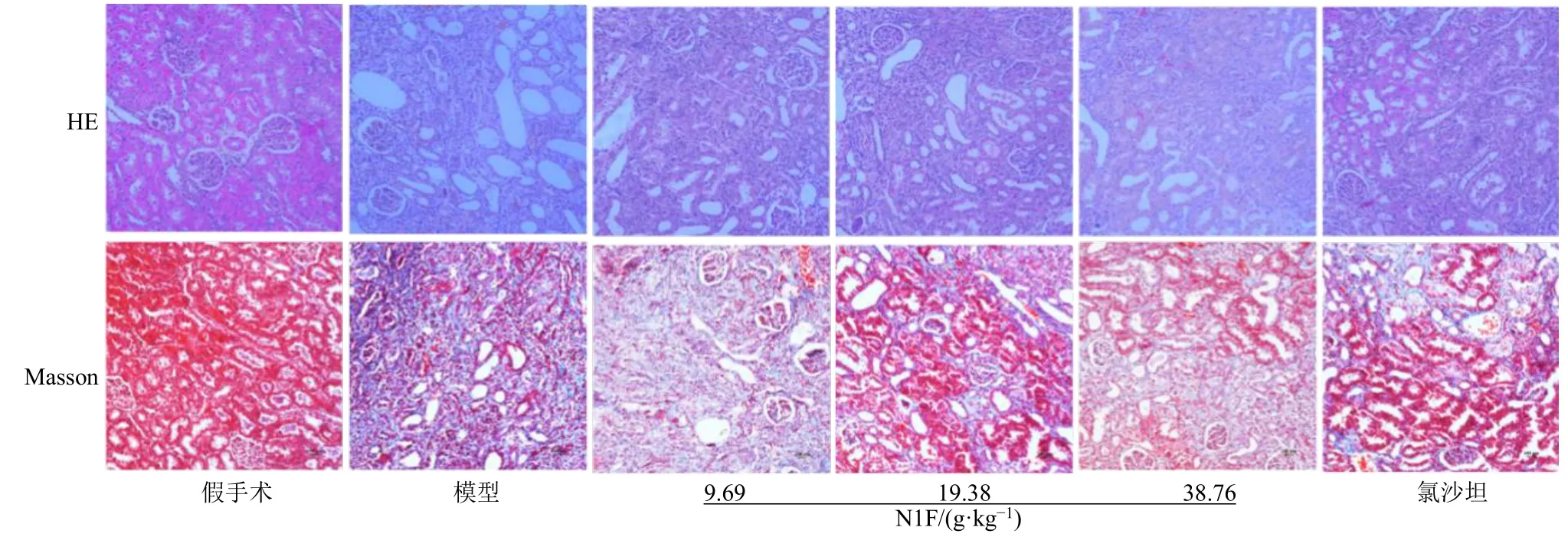
图1 N1F 对肾纤维化大鼠肾脏病理变化的影响 (×200)Fig.1 Effect of N1F on pathological changes of renal tissue in rats with renal fibrosis (× 200)
3.3 基因表达谱变化
如图2 和表3 所示,与假手术组比较,模型组共筛选出339 个差异表达miRNA,其中218 个miRNA 下调、121 个miRNA 上调;与模型组比较,N1F 高剂量组共筛选出41 个差异表达miRNA,其中39 个miRNA下调、2 个miRNA 上调。其中rno-miR-199b-5p、rnomiR-127-5p、rno-miR-103-2-5p和rno-PC-3p-39464在模型组表达上调,而在N1F 高剂量组表达下调。
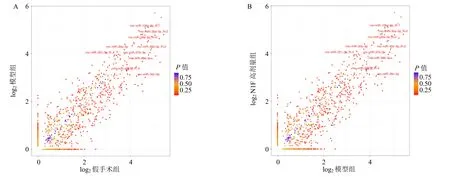
图2 模型组vs 假手术组 (A)、N1F 高剂量组vs 模型组 (B) 肾脏组织差异表达miRNA 的散点图Fig.2 Scatter plot of differentially expressed miRNA in renal tissue of model group vs sham group (A), N1G high-dose group vs model group (B)

表3 各组大鼠肾组织差异表达的miRNATable 3 Differentially expressed miRNA in renal tissue of rats in each group
3.4 miR-199b-5p 差异表达的qRT-PCR 验证
通过文献查阅[11-15],miR-199b-5p 可能与肾脏病及EMT 进程相关,且RNA 测序部分提示miR-199b-5p 为差异表达miRNA。因此,以miR-199b-5p 为研究对象,进行qRT-PCR 验证,如图3 所示,miR-199b-5pmRNA 相对表达量的验证结果与测序结果趋势一致,提示miRNA 测序结果真实可靠,可用于进一步的深层次数据分析。
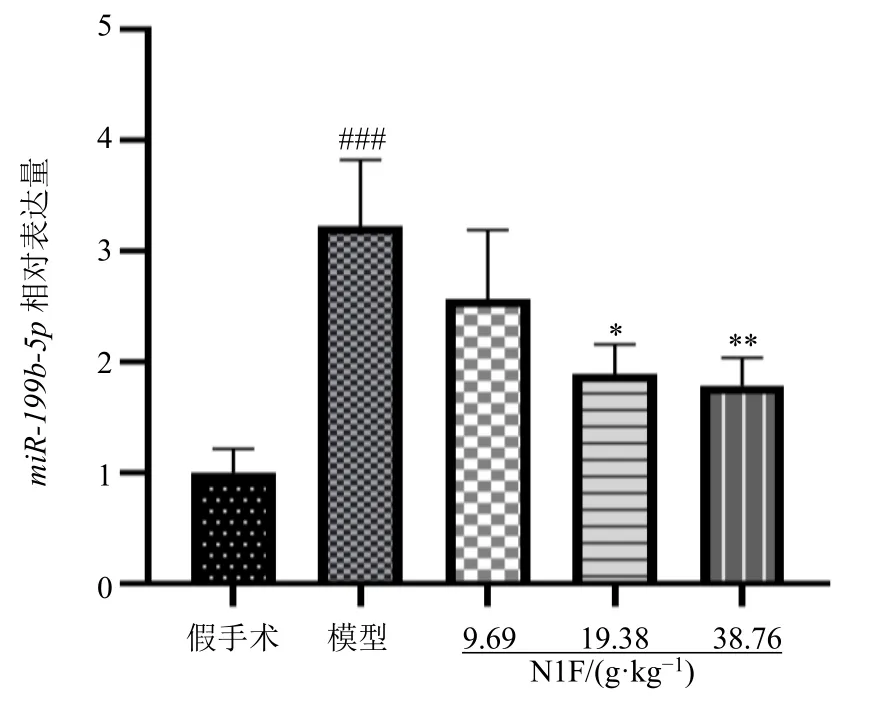
图3 miR-199b-5p 的qRT-PCR 验证 (±s, n = 6)Fig.3 qRT-PCR validation of miR-199b-5p (±s, n = 6)
3.5 miR-199b-5p 的靶基因的功能分析
miR-199b-5p 的GO 功能富集分析(图4-A)显示,靶基因主要富集在蛋白连接、细胞迁移、对生长因子的反应、细胞对生长因子刺激的反应、染色质结合、DNA 转录因子结合细胞增殖、凋亡、自噬等条目。KEGG 通路富集分析(图4-B)显示,主要富集于表皮生长因子受体2(receptor tyrosine protein kinase erbB2,ErbB)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)、病毒感染及肿瘤等。随后,对miR-199b-5p 影响肾纤维化的可能机制EMT 进行筛选,结合Targetscan 预测和韦恩分析,鉴定了miR-199b-5p 靶基因中与EMT、肾纤维化相关功能的90 个基因(图5);根据蛋白质-蛋白质相互作用(protein-protein interaction,PPI)中度值提取排名前20 名的核心靶点,并分析其对应的可能作用机制(表4)。
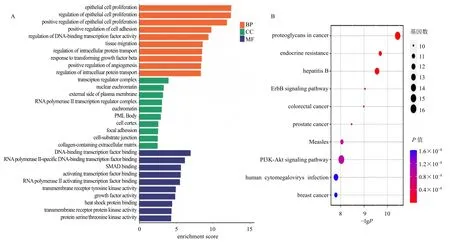
图4 miR-199b-5p 靶基因的GO 功能 (A) 和KEGG 通路 (B) 富集分析Fig.4 GO function (A) and KEGG pathway (B) enrichment analysis of miR-199b-5p target genes
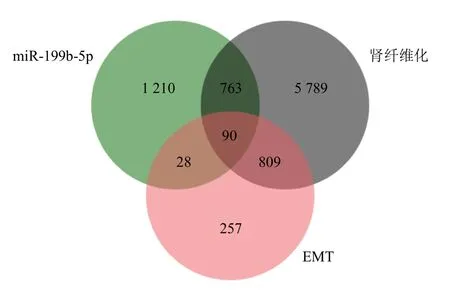
图5 与EMT、肾纤维化相关的功能基因筛选Fig.5 Screening of functional genes related to EMT and renal fibrosis
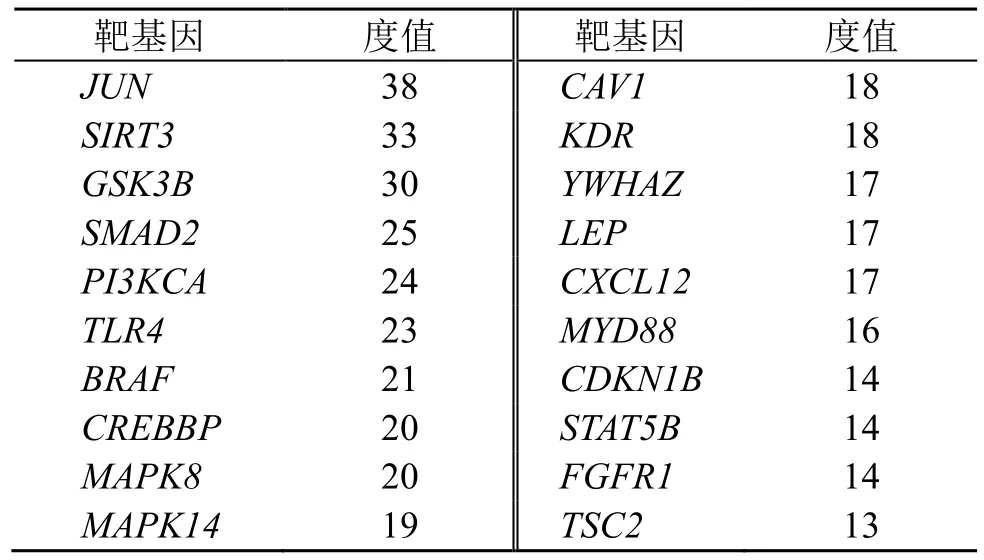
表4 miR-199b-5p 靶基因中与EMT、肾纤维化相关的功能基因Table 4 Functional genes related to EMT and renal fibrosis in miR-199b-5p-target genes
3.6 N1F 对肾纤维化大鼠肾组织EMT 相关蛋白表达的影响
如图6 所示,与假手术组比较,模型组大鼠肾组织中ZO-1、E-cadherin 蛋白表达水平显著降低(P<0.001),α-SMA 和Vimentin 蛋白表达水平显著升高(P<0.001);与模型组比较,各给药组α-SMA蛋白表达水平均显著降低(P<0.001),N1F 中、高剂量组和氯沙坦组Vimentin蛋白表达水平显著降低(P<0.05、0.01、0.001),N1F 低、中剂量组和氯沙坦组E-cadherin 蛋白表达水平显著升高(P<0.05)。免疫荧光染色结果(图7)与Western blotting 结果一致,与假手术组比较,模型组大鼠肾组织ZO-1 阳性表达减少,α-SMA 阳性表达增多;与模型组比较,N1F 各剂量组ZO-1 阳性表达增多,α-SMA 阳性表达减少。
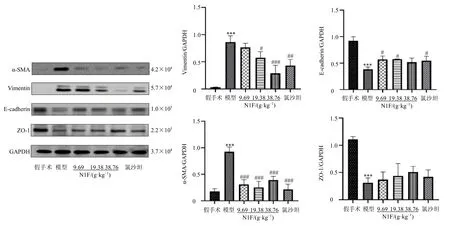
图6 N1F 对肾纤维化大鼠EMT 相关蛋白表达的影响 (±s , n = 3)Fig.6 Effect of N1F on EMT related proteins expressions in rats with renal fibrosis (±s , n = 3)
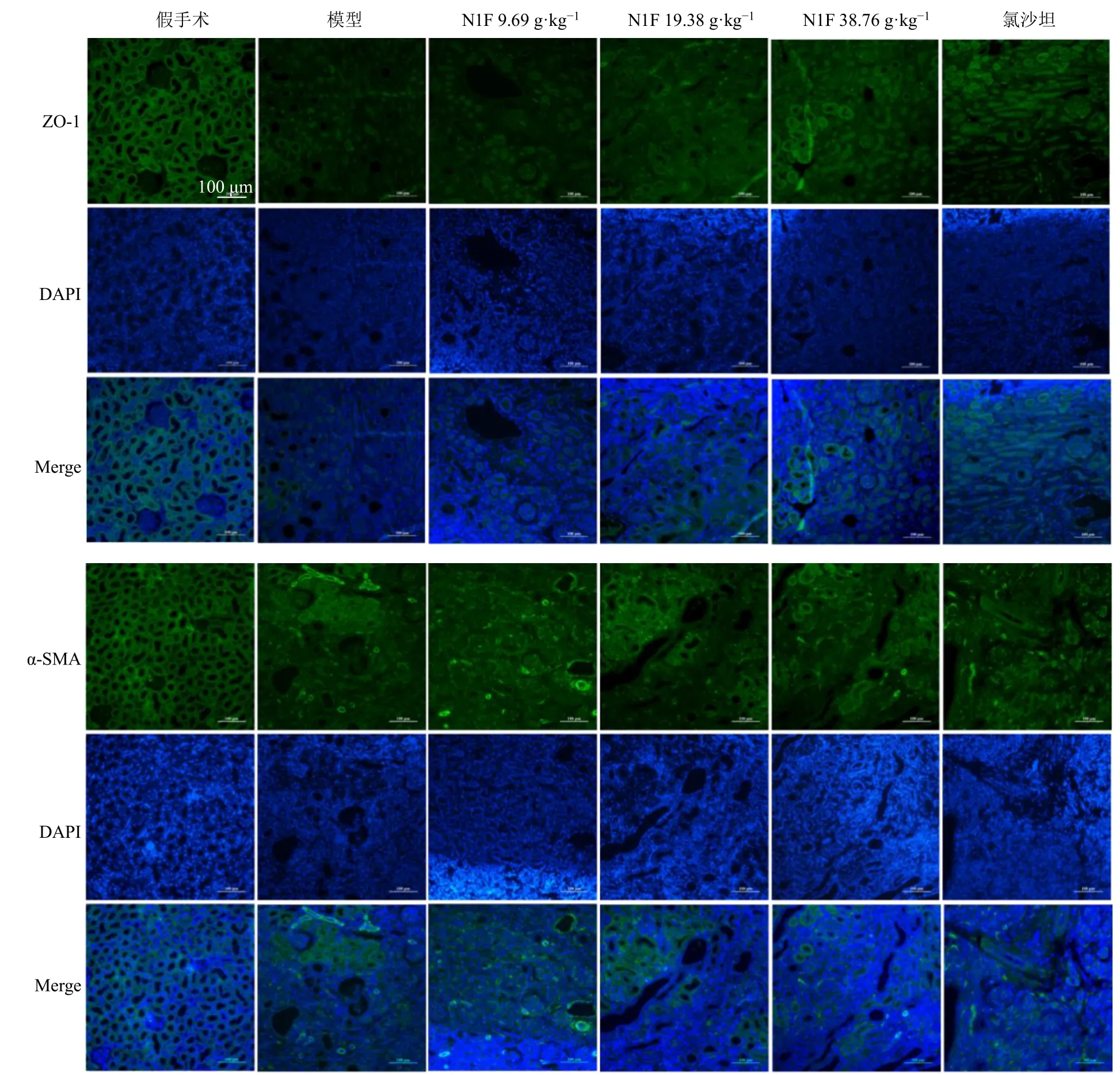
图7 N1F 对肾纤维化大鼠EMT 相关蛋白表达的影响 (免疫荧光, ×20)Fig.7 Effect of N1F on EMT related proteins expressions in rats with renal fibrosis (immunofluorescence, × 20)
4 讨论
肾纤维化是一个发展过程,是所有CKD 病情进展的共同途径。目前,对于肾纤维化机制及通路的探讨存在多样性,随着对肾小管上皮细胞在CKD进程中作用的认识加深,人们已经越来越注意到肾小管EMT 是肾纤维化非常重要的一个核心。miRNAs 作为参与基因调节的重要分子,已逐渐被证实在肾小管EMT 中的作用,但miRNAs 数量众多,筛选出合适的miRNA,对EMT 进行有效调控,仍需更多的研究工作。
左侧单侧输尿管梗阻法复制肾纤维化动物模型,具有简单易行、结果可靠的优点,是经典的制备肾纤维化模型的方法。本研究通过测序发现miR-199b-5p 在UUO 大鼠肾组织中显著增加,并验证了肾纤维化模型中miR-199b-5p 表达结果与测序一致,证明miR-199b-5p 参与了肾纤维化发生发展。本研究进一步发现N1F 干预后,miR-199b-5p 在模型组大鼠肾组织中表达显著下调,提示miR-199b-5p 可能为N1F 的作用靶点,筛选到了新的miRNA,在一定程度上进一步完善和丰富了肾纤维化的发生机制。
本研究生物信息学预测发现miR-199b-5p 可通过调控90 个靶基因介导肾小管EMT 参与肾纤维化过程。根据实验结果结合进一步文献查阅发现,miR-199b-5p 调控的靶基因JUN,其蛋白在肾小球和肾小管处均见表达,且主要在细胞核处高表达,但发生肾损伤是时其表达量显著降低[20],可能与JUN 参与细胞增殖、死亡、分化和炎症的调节相关;去乙酰化酶3(sirtuins3,SIRT3)作为线粒体蛋白乙酰化和代谢稳态的关键调节剂,在肾纤维化的发生过程中,SIRT3 的去乙酰化修饰作用参与线粒体能量代谢调控,从而起到抑制肾纤维化的作用[21],这表明SIRT3 可能是肾纤维化过程中的一个重要靶基因。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族(包括MAPK8、MAPK14等)在体内多种氧化应激和炎症反应过程中具有重要调控作用,肾脏组织可以广泛表达MAPK[22],从而加快肾纤维化进程;PI3K 信号通路是一个经典的抗凋亡、促存活的信号转导途径,已被证实是糖尿病肾病发病过程中的一条重要信号通路,与系膜基质增生、足细胞损伤等具有密切的联系,加速肾纤维化的进程[23]。当然还有更多的靶基因值得深入研究。本研究结果显示模型组大鼠肾脏组织EMT 上皮表型相关蛋白E-cadherin 和ZO-1 表达下调,间质表型相关蛋白α-SMA 和vimentin 表达上调;N1F治疗后,EMT 上皮表型相关蛋白呈现上调,间质表型相关蛋白下调,肾纤维化减轻。因此,认为miR-199b-5p 可能通过抑制EMT,减轻肾纤维化,与生物信息学预测相符。
综上,N1F 可减轻左侧单侧输尿管梗阻大鼠的肾脏纤维化,其作用机制可能与下调miR-199b-5p、抑制EMT 有关。本研究有助于阐明miR-199b-5p 在肾纤维中的作用,并为开发针对肾纤维化的新治疗策略提供了方向。但本研究未能采用转染敲低质粒的方法下调miR-199b-5p,尚需后续深入研究。
利益冲突所有作者均声明不存在利益冲突