基于网络药理学整合体内实验探究四物汤单味药组分治疗胆汁淤积性肝损伤的作用与机制
汪 乐,李佳楠,杨 洋,曲姣蓉*,李晓骄阳*
1.北京中医药大学生命科学学院,北京 100029
2.北京中医药大学中药学院,北京 100029
胆汁淤积性肝损伤(cholestatic liver injury,CLI)是一种临床常见的肝脏损伤,以原发性胆汁性胆管炎(primary biliary cholangitis,PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)较为常见,其主要特征是由于胆汁的形成、分泌或排泄过程出现障碍,导致胆汁不能正常流向肠道,而在肝脏或胆道系统内积聚并引起脏器损伤和肝纤维化。这种疾病可以由多种原因引起,包括胆道梗阻、肝内胆管损伤遗传因素、肝胆系统结构异常、药物毒性、感染、肝自身免疫疾病等[1]。熊去氧胆酸是大多数CLI 的基础治疗药物,但它仍无法阻止部分PBC 以及PSC 患者的疾病进展,最终可能导致肝功能失代偿,需要进行肝移植治疗。一些新型抗胆汁淤积剂如核受体激动剂、利胆剂和胆汁酸合成抑制剂,可能会在一定程度上改善CLI 及其相关并发症,但目前仍缺乏有效临床证据[2-3]。因此,未来研究可致力于改变胆汁淤积、炎症、细胞存活以及改善纤维化等多个途径共同改善CLI[4],寻找相关全新治疗策略势在必行。
中医药以其一方多药、一药多成分的特点或许能为CLI 更全面的治疗提供新的研究方向。四物汤最早见于晚唐时期蔺道人所著的《仙授理伤续断秘方》,被用于外伤引起的瘀血和疼痛。随着研究的不断深入,四物汤逐渐在中医临床中得到广泛应用,并被认为是一种补血、活血、调经的经典方药,其核心成分包括当归、川芎、白芍、熟地黄4 味药。作为补血调经的基础方剂,四物汤享有“妇科第一方”的美誉,有研究报道其通过提高抗氧化能力、调节血管生成来改善小鼠卵巢功能[5-6]。此外,还有研究报道四物汤通过抑制肿瘤细胞转化产生的抑癌作用[7-8]。近年来,大量实验研究发现,四物汤可通过调控机体免疫微环境、修复胆酸代谢稳态等途径有效改善因手术介入或化学药损伤导致的包括CLI在内的多种慢性肝病[9-11]。四物汤以其补益气血功效,或益于改善肝脏组织的养分供应,从而改善CLI。方中川芎入肝、胆经,具有活血化瘀、祛风止痛的功效;白芍则能养血敛阴、揉肝止痛;熟地味厚滋腻、滋补营血;当归补血和血,4 药合用,血虚得补,血滞得散[12]。尽管大量文献已报道四物汤及其中分离所得多种活性成分(如川芎嗪、阿魏酸、芍药苷等)均可有效缓解CLI,然而目前尚未有研究对于4 种单味药的药效进行对比评估,因此筛选单味药及主要活性成分有助于进一步探究四物汤改善慢性肝病的作用与机制。
网络药理学在中医药领域的应用是一种整合计算机科学、网络科学和药理学的交叉学科研究方法。它主要通过大数据、网络分析和计算模型等技术手段,系统地研究中医药的药理学特性、作用机制、多成分相互作用等方面。网络药理学可以帮助揭示中医药中各成分的作用靶点,以及这些靶点之间的相互关系,从而更全面地理解中医药的药理学特性[13]。前期有研究报道过四物汤复方的网络药理学,但本研究采用单味药的网络药理学,对比四物汤中各单味药的作用靶点。同时结合动物实验对四物汤中的单味药川芎、白芍、当归、熟地黄治疗CLI的药效及靶点进行验证,探讨了四物汤治疗CLI 的作用机制,对进一步解释四物汤治疗肝胆疾病的科学内涵、临床应用以及挖掘四物汤中有效活性成分具有重要意义。
1 材料
1.1 动物
SPF 级C57BL/6J 小鼠,8 周龄,雌雄各半,体质量22~24 g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010。动物饲养于北京中医药大学实验动物中心,在正常条件下饲养,周期为12 h 光照/12 h 黑暗,提供无限量饲料和纯水。动物实验经北京中医药大学实验动物伦理委员会批准(批准号BUCM-4-20200730023160)。
1.2 药材
川芎、熟地黄、白芍、当归饮片均购自北京同仁堂(集团)有限公司,经北京中医药大学中药学院中药药理教研室刘闰平教授分别鉴定为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎、玄参科植物地黄RehmanniaglutinosaLibosch.的干燥块根的炮制加工品、毛茛科植物芍药Paeonia lactifloraPall.的干燥根、伞形科植物当归Angelica sinensis(Oliv.) Diels 的干燥根。
1.3 药品与试剂
丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号20231013)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号20230802)、碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(批号20230802)、羟脯氨酸(hydroxyproline,HYP)试剂盒(批号20230921)、总胆汁酸(total bile acid,TBA)试剂盒(批号20231012)、总胆红素(total bilirubin,T-BIL)试剂盒(批号20230817)均购自南京建成生物工程研究所;异氟烷(批号20230502)购自江苏恒丰强生物技术有限公司;无水乙醇(批号20231018)、异丙醇(批号20220801315)均购自北京正程生物科技有限公司。
1.4 仪器
R500 型麻醉机(深圳市瑞沃德生命科技有限公司);酶标仪(赛尔福医疗科技北京有限公司);C1000 Touch 型PCR 仪(美国Bio-Rad 公司);Centrisart®D-16C 型离心机(德国赛多利斯公司);孵育箱(美国Thermo Fisher Scientific 公司);F6/10型匀浆仪(上海净信实业发展有限公司);Nano-800+型超微量核酸蛋白测定仪(上海嘉鹏科技有限公司)。
2 方法
2.1 四物汤单味药活性成分及靶点基因的获取
分别以川芎、白芍、熟地黄、当归为关键词在TCMSP 数据库(http://tcmspw.com/tcmsp.php)进行检索,获取各单味药的相关活性成分及靶点。将检索后得到的活性成分以口服生物利用度(oral bioavailability,OB)≥30%及类药性(drug-likeness,DL)≥0.18[14]为纳入标准对药物入血成分进行筛选,得到其潜在活性成分及对应靶点信息。将筛选后得到成分及靶点信息整合汇总并去掉重复靶点后,将靶点蛋白名依次输入UniProt 数据库中得到标准基因名称并汇总。
2.2 CLI 靶点的获取
以CLI 标准英文名称“cholestatic liver injury”为检索词在GeneCards(https://www.genecards.org/)数据库中进行检索,得到CLI 相关疾病靶点。并剔除在UniProt 数据库中无对应ID 号的靶点,保留有对应标准基因名及ID 号的靶点并进行汇总。
2.3 “药物-成分-作用靶点”网络构建及“药物-疾病”交集靶点获取
运用Cyctoscape 3.10.1 软件将“2.1”项下收集得到的活性成分及其相对应的靶点基因进行可视化处理,分别构建川芎、白芍、熟地黄、当归的“药物-活性成分-作用靶点”网络。将上述所获取的各单味中药的作用靶点分别和疾病靶点导入生物信息学与进化基因组学(http://bioinformatics.psb.ugent.be/webtools/Venn/)网站中,即可得到川芎、白芍、熟地黄、当归与CLI 之间的交集靶点,并据此绘制韦恩图。
2.4 生物信息学分析
根据韦恩图的结果,将起主要治疗作用的单味药物靶点基因数据导入DAVID 数据库(https://david.ncifcrf.gov/ ),将物种设置为“Mus musculus”,进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,根据P值从小到大,筛选出药物作用靶点的主要生物过程及信号通路,GO 分析取前10 位、KEGG 分析取前20 位结果。并对数据进行可视化处理,利用微生信网站(http://www.bioinformatics.com.cn/)在线绘制GO 分析条形图及KEGG 富集分析气泡图,用于后续分析及实验验证。
2.5 四物汤各单味药水提物的制备
分别称取川芎、白芍、熟地黄、当归饮片各20 g,打碎成粉末状后装入药包,加入200 mL 水,在圆底烧瓶中浸泡1 h,之后的操作根据各药物性质的不同时间长短有所不同,其中川芎加热回流1.5 h,滤过,药渣以同样的方法再煮1.5 h 并滤过[15];白芍加热回流2 h,滤过,药渣以同样的方法再煮1.5 h并滤过[16];熟地黄、当归加热回流30 min,滤过,药渣以同样的方法再煮20 min 并滤过[17-18]。将2 次滤过后药液混合后进行抽滤,所得液体通过旋蒸仪浓缩至50~100 mL,收集浓缩药液,取部分应用HPLC 测定并采取外标法测定熟地黄水提物中5-羟甲基糠醛质量浓度为5.07 mg/mL、白芍水提物中氧化芍药苷质量浓度为4.09 mg/mL、当归水提物中阿魏酸质量浓度为1.6 mg/mL、川芎水提物中洋川芎内酯A 质量浓度为2.2 mg/mL。其余药液室温冷却后放置−80 ℃冷冻过夜,次日转移至冷冻干燥机,直至冻干至粉末状,收集水提物粉末待用。
2.6 动物实验
2.6.1 分组、造模与给药 采用随机分组法将C57BL/6J 小鼠分成假手术组、模型组、川芎水提物组、白芍水提物组、熟地黄水提物组和当归水提物组,每组8 只(雌雄各4 只)。除假手术组外,其余各组均进行胆总管结扎(bile duct ligation,BDL)手术。小鼠仰卧位固定于手术操作台,持续异氟烷气体麻醉,将小鼠腹部毛发剔除,用医用碘伏和75%乙醇交替消毒,在会阴上1 cm 处剪开皮肤,开口至剑突下1 cm 左右,逐层分离皮下筋膜及肌肉层,暴露腹腔脏器,并使用撑开器将两侧组织持续撑开,用沾有PBS 溶液的无菌棉签将小鼠的肝脏和胃肠朝上下不同方向拨开,分离胆总管,用5-0 手术缝合线结扎胆总管,结束后由内向外逐层缝合各层组织。假手术组同样进行腹部组织切开及缝合,但不对胆总管进行结扎。参考文献报道[19]选择最佳的水提物治疗剂量(50 mg/kg),各给药组ig 相应药物,术前3 d 开始预给药,术后恢复2 d 后继续给药4 d。
2.6.2 血清样品的采集与处理 使用乌拉坦(1.4 g/kg)ip 麻醉成功后,从小鼠下腔静脉采集血样,常温放置30 min,待其凝固后,4 ℃、6 000 r/min离心10 min,取上清,置于1.5 mL EP 管中,即为血清样品。取部分血清稀释5 倍,用于血清生化指标检测,其余放置于−80 ℃冰箱储存。
2.6.3 肝脏组织病理变化观察 取血后,小鼠脱颈椎处死,解剖分离肝脏。取部分肝脏组织经福尔马林溶液固定,石蜡包埋后进行连续切片,进行苏木素-伊红(HE)染色,在超分辨显微组织成像系统下观察病理学变化。
2.6.4 肝损伤指标检测 参照试剂盒说明书检测小鼠血清中ALT、AST、ALP 活性和TBA、TBIL 含量,同时检测肝组织中HYP 水平。
2.6.5 肝组织基因表达检测 各组取部分肝脏组织,按照试剂盒说明书提取总RNA 并合成cDNA,进行qRT-PCR 分析。肌动蛋白2(actin alpha 2,Acta2)、I 型胶原α 1 链(collagen type I alpha 1 chain,Col1a1)、基质金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase 1,Timp1)、基质金属肽酶12(matrix metallopeptidase 12,Mmp12)、Mmp13、Mmp14、核受体亚家族3C 组成员2(nuclear receptor subfamily 3 group C member 2,Nr3c2)、类视黄醇X受体(retinoid X receptor alpha,Rxra)、前列腺素内过氧化物合成酶 2(prostaglandin-endoperoxide synthase 2,Ptgs2)、血管细胞黏附分子(vascular cell adhesion molecule 1,Vcam1)、肿瘤坏死因子(tumor necrosis factor,Tnf)、有丝分裂原激活蛋白激酶(mitogen-activated protein kinase 8,Mapk8)、AKT丝氨酸/苏氨酸激酶(AKT serine/threonine kinase 1,Akt1)、激酶插入结构域受体(kinase insert domain receptor,Kdr)、Mapk14、次黄嘌呤磷酸核糖基转移酶 1(hypoxanthine phosphoribosyltransferase 1,Hprt1)引物序列见表1,以Hprt1作为内参。

表1 引物序列Table 1 Primer sequences
2.7 统计学分析
使用GraphPad Prism 8 软件对实验数据进行处理及分析,结果以±s表示,组间采用单因素方差(One-way ANOVA)分析。
3 结果
3.1 四物汤各单味药活性成分及靶点的获取、CLI相关靶点的获取
通过TCMSP 数据库分别对川芎、白芍、当归、熟地黄活性成分的检索,以及根据设定好的纳入标准OB≥30%及DL≥0.18 进行筛查,共得到川芎的6 个活性成分和30 个药物作用靶点,白芍共获取7个活性成分以及90 个药物作用靶点,熟地黄仅获取2 个活性成分和31 个药物作用靶点,当归仅获取2 个活性成分但包含52 个药物靶点(活性成分见表2)。根据获得的数据使用Cyctoscape 3.10.1 软件分别绘制川芎、白芍、当归、熟地黄的“药物-活性成分-作用靶点”网络(图1)。通过对Genecards数据库的检索,共获得CLI 的843 个相关靶点,剔除在UniProt 数据库中无对应ID 号及标准基因名的靶点,最终得到753 个疾病靶点。结果显示川芎与白芍活性成分较多,白芍与当归的作用靶点较多,熟地黄的活性成分及作用靶点均较少。从网络药理学的角度分析,川芎、白芍、当归的药理作用相对广泛,而熟地黄的药理作用相对局限。
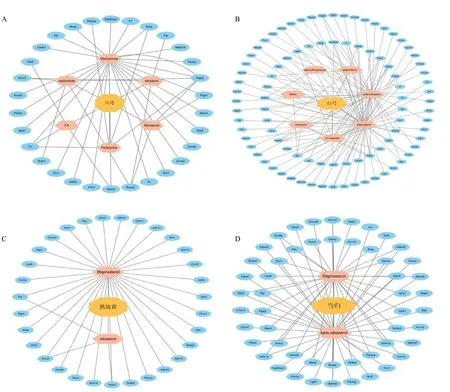
图1 川芎 (A)、白芍 (B)、熟地黄 (C)、当归 (D) 活性成分及作用靶点网络Fig.1 Network of active ingredients and targets of Chuanxiong Rhizoma (A), Paeoniae Radix Alba (B), Rehmanniae Radix Praeparata (C) and Angelicae Sinensis Radix (D)
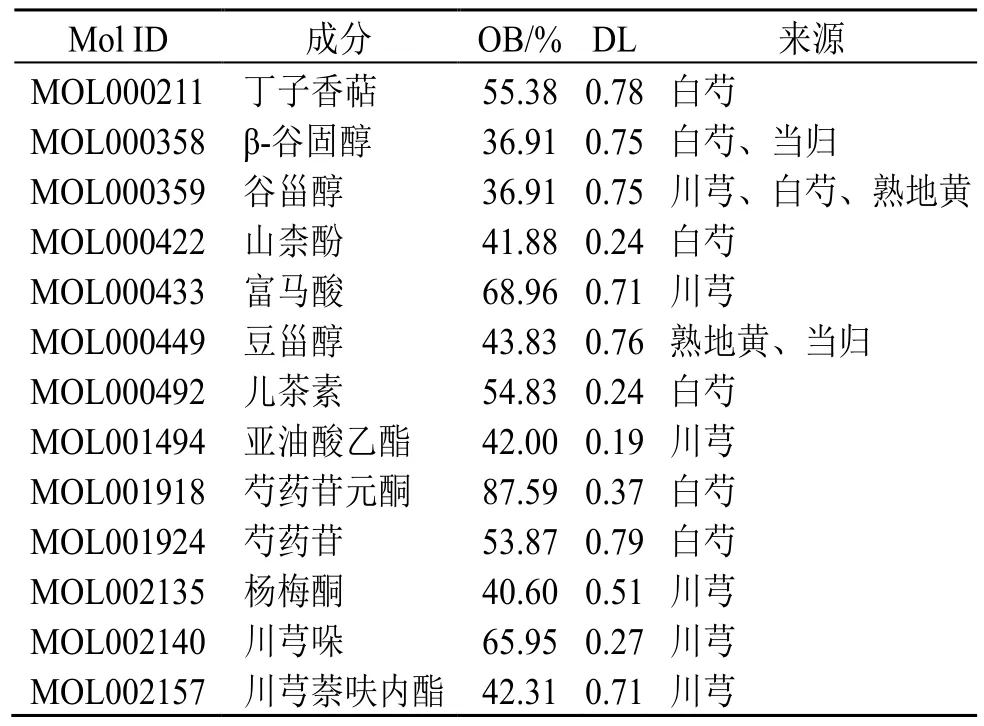
表2 纳入网络药理学4 种单味药中的活性成分Table 2 Active ingredients included in four individual herbs in network pharmacology
3.2 川芎、白芍、当归、熟地黄与CLI 交集靶点的获取
将各单味药获取的靶点基因与CLI 靶点基因分别导入生物信息学与进化基因组学网站,得到川芎与CLI 的14 个交集靶点、白芍与CLI 的37 个交集靶点、当归与CLI 的15 个交集靶点、熟地黄与CLI的5 个交集靶点。并据此结果分别绘制韦恩图(图2)。结果显示,川芎、白芍、当归、熟地黄分别有46.7%、41.1%、28.8%、16.1%的靶点基因可作用于CLI。因此,推测4 味药均能作用于CLI,但川芎、白芍对CLI 疗效的特异性明显高于当归、熟地黄。
3.3 基于体内CLI 模型验证4 种单味药药效及其中关键单味药的药效机制
上述网络药理学结果表明,白芍、川芎、当归、熟地黄与CLI 之间均存在靶点交集,故均存在改善CLI 的可能,CLI 伴随着胆汁淤积、肝损伤以及肝纤维化等异常改变,进一步通过BDL 手术模型模拟CLI 并评估单味药药效。
3.3.1 白芍、川芎、当归、熟地黄对CLI 的改善作用 如图3 所示,与假手术组比较,模型组小鼠血清ALT、AST 活性显著升高(P<0.01、0.001),经治疗后除熟地黄组外,白芍、川芎、当归组对该指标均存在不同程度的改善(P<0.05、0.001),但各单味药治疗组之间差异并不显著,表明四物汤各单味药均能改善CLI,其中白芍组的改善最为显著。同时,对血清中ALP 活性及TBA、TBIL 含量检测结果表明,白芍、川芎、当归、熟地黄均能改善BDL诱导的胆管损伤和胆汁淤积情况。熟地黄对ALP 和TBIL 改善不显著,当归对TBIL 改善不显著,但仍呈现改善病理状态的趋势。白芍、川芎总体疗效略优于当归、熟地黄。进一步检测了肝组织中HYP 的含量,结果显示BDL 术后小鼠肝脏出现了明显纤维化改变(P<0.001),经治疗后白芍组、川芎组、当归组、熟地黄组小鼠CLI 症状均明显减轻(P<0.001),组间差异并不显著。据以上结果推测,白芍、川芎可能具有更显著的抗CLI 疗效。
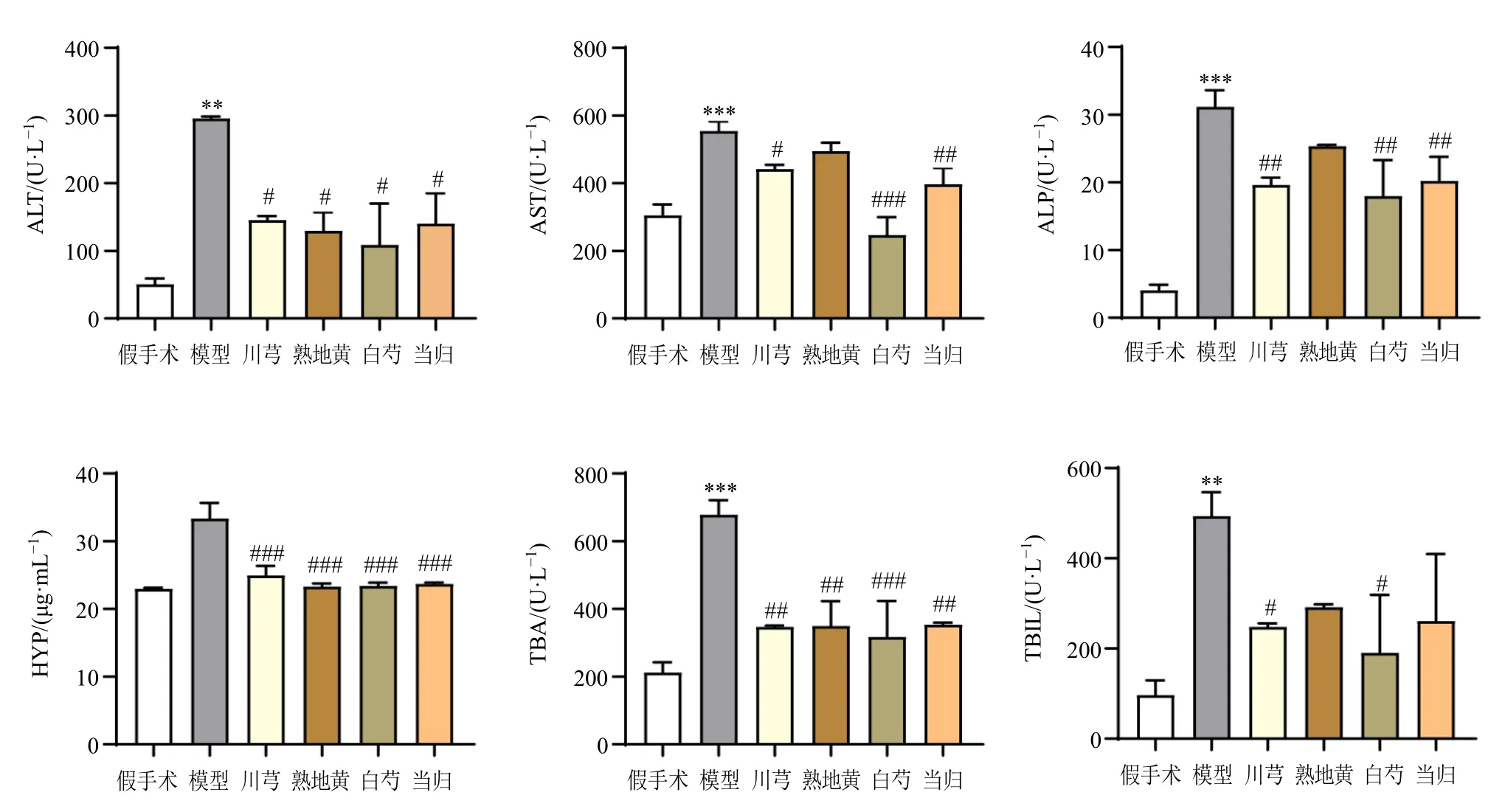
图3 各组小鼠血清ALT、AST、ALP 活性及TBA、TBIL 水平和肝脏HYP 含量 (±s , n = 8)Fig.3 ALT, AST, ALP activities, TBA, TBIL levels in serum and HYP content in liver tissue of mice in each group(±s , n = 8)
肝脏HE 染色结果见图4,与假手术组比较,模型组可见明显肝汇管区结构破坏,伴有大量炎性细胞浸润和胶原沉积,经白芍、川芎、当归、熟地黄水提物治疗后上述病理改变均出现了不同程度的好转,其中白芍组与川芎组的改善最为明显。
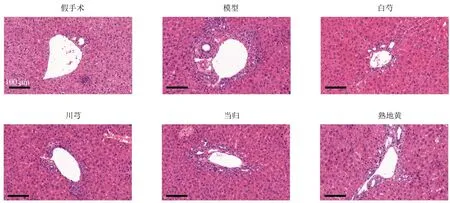
图4 各组小鼠肝脏病理变化 (HE,×20)Fig.4 Pathological changes in liver of mice in each group (HE, × 20)
为进一步检测各组小鼠CLI 程度的变化,检测了肝组织中CLI 相关基因表达。如图5 所示,与假手术组比较,模型组小鼠肝脏中Acta2、Col1a1、Timp1、Mmp12、Mmp13、Mmp14基因表达水平显著升高(P<0.05、0.01、0.001);经白芍、川芎、当归、熟地黄水提物治疗后均出现了不同程度的逆转,其中当归、熟地黄对部分基因表达改善不显著,白芍、川芎对以上基因表达均有显著改善(P<0.05、0.01、0.001),但各组间无统计学差异。结果表明,川芎组与白芍组对CLI 的改善作用最为明显。
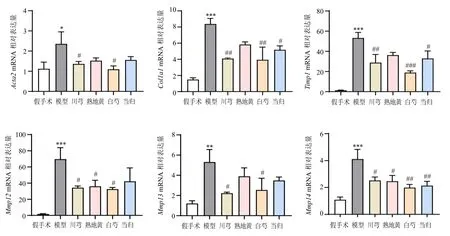
图5 各组小鼠肝脏中Acta2、Col1a1、Timp1、Mmp12、Mmp13、Mmp14 基因表达 (±s , n = 8)Fig.5 Acta2, Col1a1, Timp1, Mmp12, Mmp13 and Mmp14 gene expressions in liver of mice in each group (±s , n = 8)
3.3.2 白芍、川芎、当归、熟地黄与CLI 之间共同与独立交集靶点的获取 上述结果显示,白芍、川芎、当归、熟地黄均能改善CLI,推测各单味药与CLI 之间可能存在共同的交集靶点;白芍与川芎对各项指标的改善显著优于当归组与熟地黄组,推测白芍、川芎可能存在不同于熟地黄、当归的特异性靶向CLI 的靶点。将各单味药与CLI 的作用靶点共同输入生物信息学与进化基因组学网站,并绘制韦恩图。结果显示,白芍、川芎、当归、熟地黄与CLI共同交集靶点为3 个。白芍与CLI 独立的交集靶点有18 个,川芎与CLI 独立的交集靶点有4 个,当归、熟地黄与CLI 之间不存在独立于其他药物的交集靶点(图6)。
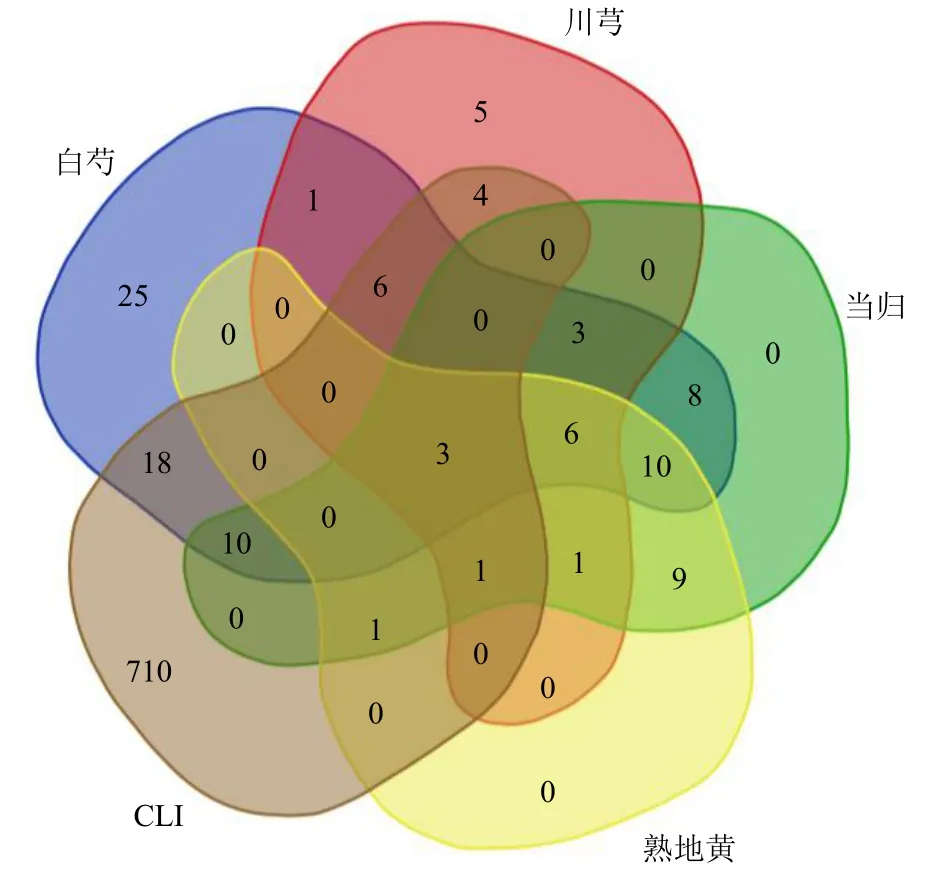
图6 各单味药与CLI 的共同与独立交集靶点Fig.6 Intersection of shared and unique targets between each individual herb and CLI
3.3.3 白芍、川芎、当归、熟地黄通过3 个共同靶点改善CLI 上述结果显示,白芍、川芎、当归、熟地黄与CLI 共同交集靶点为3 个,分别为Nr3c2、Rxra、Ptgs2,使用qRT-PCR 进一步验证了以上3 个靶点基因在各组小鼠肝脏中的表达。如图7 所示,与假手术组比较,模型组中Nr3c2、Rxra、Ptgs2表达显著升高(P<0.05、0.001);经白芍、川芎、当归、熟地黄治疗后以上基因表达均显著降低(P<0.05、0.01、0.001)。表明白芍、川芎、当归、熟地黄可通过降低Nr3c2、Rxra、Ptgs2的表达共同改善CLI。
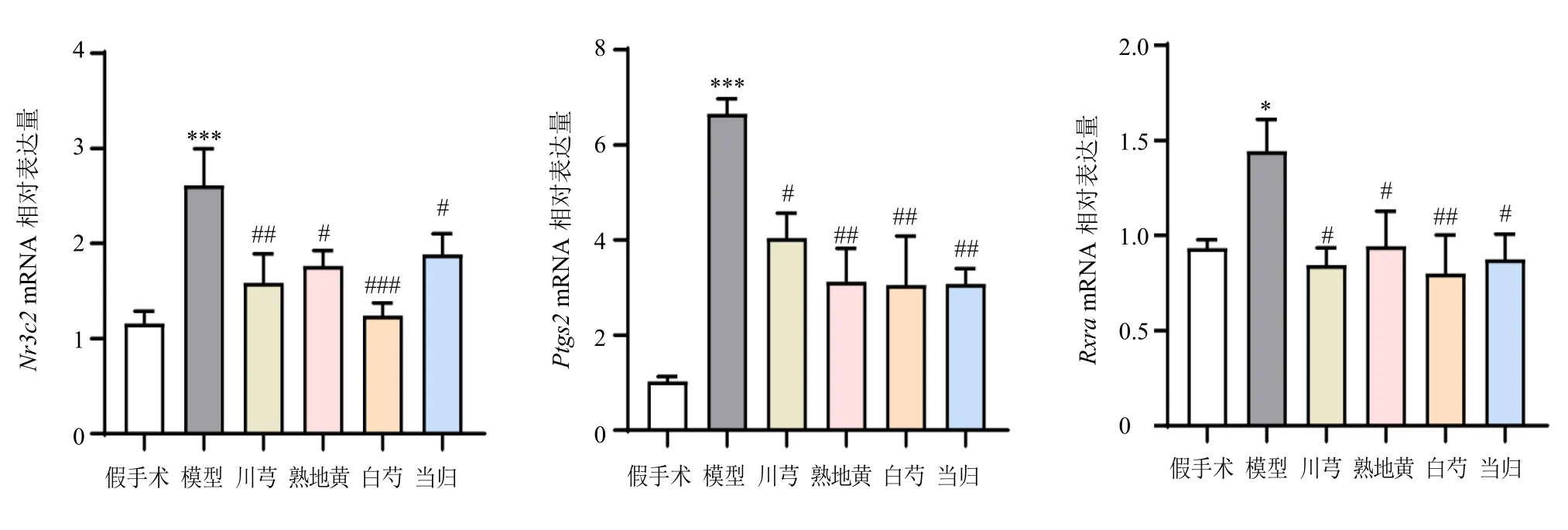
图7 各组小鼠肝脏中Nr3c2、Ptgs2、Rxra 基因表达 (±s, n = 8)Fig.7 Nr3c2, Ptgs2 and Rxra gene expressions in liver of mice in each group (±s, n = 8)
3.3.4 白芍通过TNF 通路改善CLI 韦恩图结果显示,白芍与CLI 之间有18 个独立交集靶点,这与推测相符合。为进一步证实白芍是否通过这些交集靶点特异性改善了CLI,将白芍对应的靶点基因进行GO 与KEGG 分析,GO 分析选取10 条主要结果显示,发现白芍作用靶点富集于细胞凋亡、一氧化氮生物合成、炎症反应、血管内皮生长因子产生、血管生成、一氧化氮合酶活性、肝再生、细胞迁移、细胞黏附等生物过程。KEGG 分析结果选取20 条主要信号通路,选择了既往有大量研究报道与肝损伤相关[20-22]的TNF 信号通路,并推测白芍可能通过TNF 通路改善CLI(图8)。
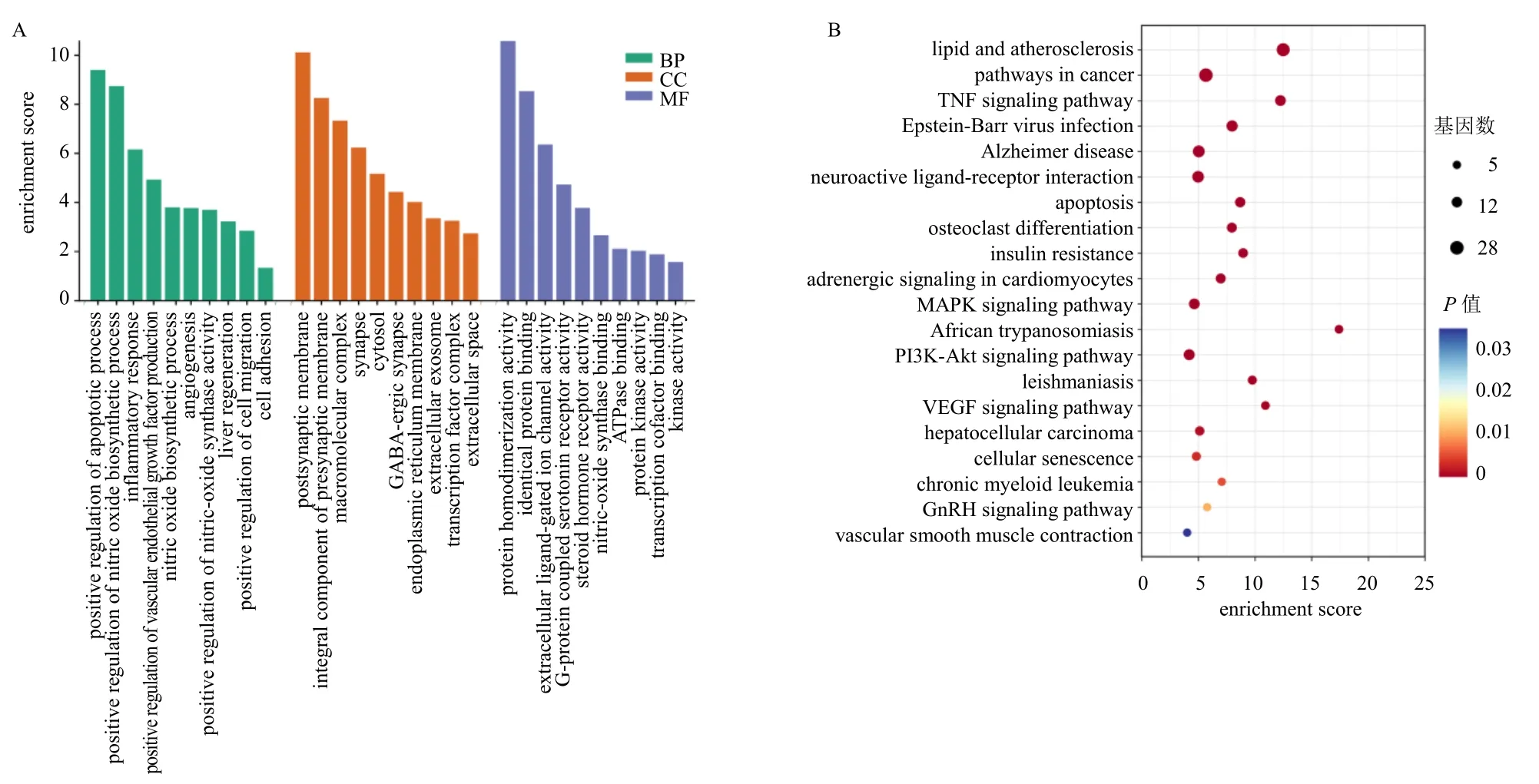
图8 白芍GO 分析柱状图 (A) 和KEGG 分析气泡图 (B)Fig.8 Bar graph of GO analysis (A) and bubble graph of KEGG analysis (B) for Paeoniae Radix Alba
通过qRT-PCR 评估了白芍与CLI 的18 个独立交集靶点并富集于TNF 通路中的Vcam1、Tnf、Mapk8、Akt1的表达水平,如图9 所示,与假手术组比较,模型组小鼠肝脏中以上基因表达均显著升高(P<0.01、0.001);与模型组比较,白芍治疗后能显著降低BDL 术后以上基因的高表达(P<0.05、0.01),表明白芍可能通过TNF 通路改善CLI。
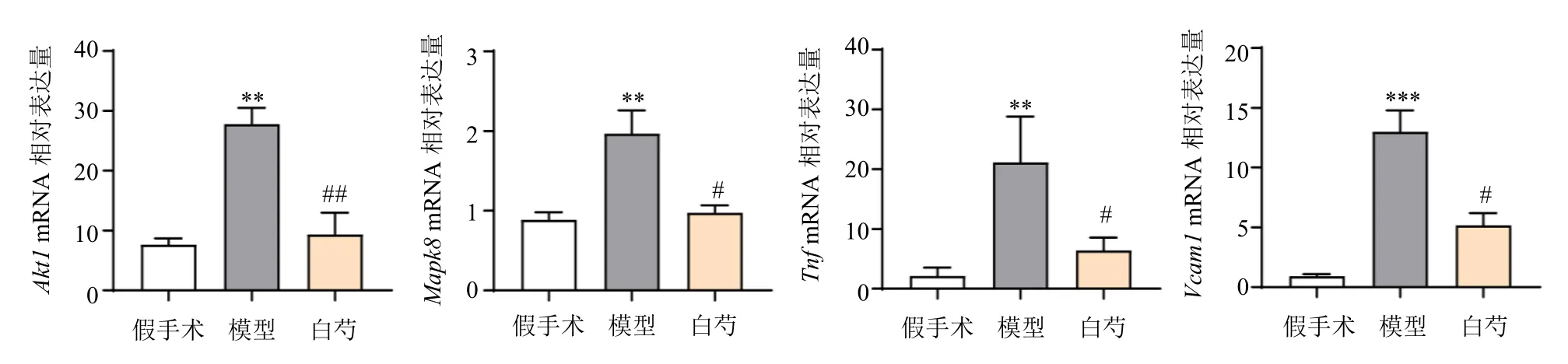
图9 各组小鼠肝脏中Akt1、Mapk8、Tnf、Vcam1 基因表达 (±s, n = 8)Fig.9 Akt1, Mapk8, Tnf and Vcam1 gene expressions in liver of mice in each group (±s, n = 8)
3.3.5 川芎通过VEGF 通路改善CLI 根据韦恩图结果,发现川芎与CLI 之间有4 个独立交集靶点。将川芎的作用靶点进行GO 与KEGG 分析,GO 分析选取10 条主要结果显示,川芎作用靶点富集于信号转导一氧化氮合成、蛋白质磷酸化、细胞增殖、缺氧反应、血管内皮生长因子受体信号、细胞间信号传导、血管生成等生物过程。KEGG 分析结果选取前20 条主要信号通路,考虑到既往大量研究结果显示VEGF 通路与肝损伤过程密切相关[23-25],推测川芎可能通过VEGF 通路改善CLI,选择VEGF通路进行后续研究(图10)。
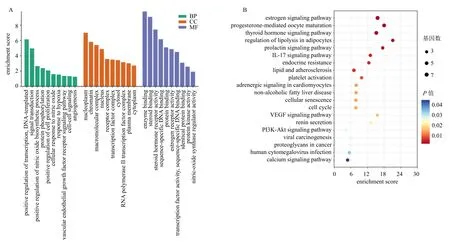
图10 川芎GO 分析柱状图 (A) 和KEGG 分析气泡图 (B)Fig.10 Bar graph of GO analysis (A) and bubble graph of KEGG analysis (B) for Chuanxiong Rhizoma
通过qRT-PCR 评估了川芎与CLI 的4 个交集靶点并富集于VEGF 通路中的Kdr、Mapk14的表达水平,如图11 所示,与假手术组比较,模型组小鼠肝脏中以上基因表达水平显著升高(P<0.01、0.001);与模型组比较,经川芎治疗后以上基因表达水平显著降低(P<0.05、0.01),表明川芎可能通过VEGF 通路改善CLI。
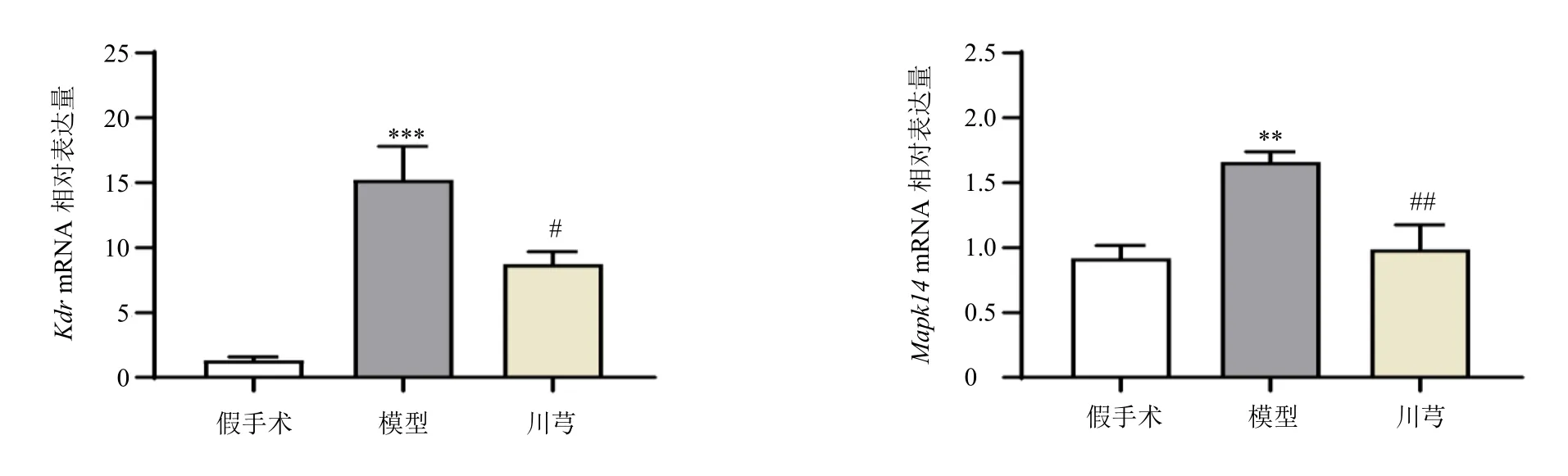
图11 各组小鼠肝脏中Kdr、Mapk14 基因表达 (±s , n = 8)Fig.11 Kdr and Mapk14 gene expressions in liver of mice in each group (±s , n = 8)
4 讨论
胆汁淤积可能由多种原因引起,除了肝胆相关疾病、胆道结构异常、药物、感染等因素外,近年来有研究报道了食物添加剂、膳食补充剂和肠外营养等所含的成分也可引发CLI[26]。CLI 可以导致黄疸、胆绞痛、消化不良、恶心、呕吐、皮肤瘙痒、腹胀等各种症状和并发症。CLI 涉及的病理机制复杂,病理过程较多,单一药物成分或靶点往往只能改善部分病理指标,且难以阻止疾病的进一步发展。而中医药具有一方多药、一药多成分,以及多通路、多靶点共同作用的特点,可从多方面协同改善胆汁淤积引起的肝损伤及肝纤维化。本研究通过数据库筛查,运用网络药理学方法构建了“四物汤单味药-治疗靶点-信号通路”网络,并结合体内实验评价药效,探讨四物汤治疗CLI 的主要作用靶点和潜在作用机制。
以往已有大量研究报道了四物汤治疗肝胆相关疾病的研究。一项临床试验报道了四物汤对肝脏具有的保护作用[9]。课题组前期研究发现四物汤不仅通过调节肠道微生物群和胆汁酸稳态,还通过调节免疫微环境以减少炎症反应、改善CLI[10-11]。但目前尚无报道四物汤中4 味单药改善肝损伤的疗效对比研究,因此本研究对川芎、白芍、当归、熟地黄改善CLI 进行了疗效比较。结果显示,川芎、白芍、当归、熟地黄4 个单味药均能改善CLI。将4 个单味药与CLI 靶点取交集后发现它们通过3 个共同靶点(Nr3c2、Rxra、Ptgs2)作用于CLI。因此推测白芍、川芎、当归、熟地黄可通过以上3 个靶点共同改善肝损伤,qRT-PCR 结果显示,白芍、川芎、当归、熟地黄可能均能下调肝脏中Nr3c2、Rxra、Ptgs2的表达。既往研究报道了这3 个靶点均与肝胆疾病密切相关,NR3C2、PTGS2 参与调控小鼠肝缺血再灌注损伤[27-28],RXRA 在HSC 激活以及促进CLI 中发挥关键作用[29]。表明川芎、白芍、当归、熟地黄可能通过调节Nr3c2、Rxra、Ptgs2共同改善了CLI。
考虑到白芍、川芎、当归、熟地黄与CLI 之间交集靶点的差异性,以及川芎、白芍对CLI 的改善明显优于当归、熟地黄,推测川芎、白芍与CLI 之间是否存在相对独立的特异性作用靶点。进一步分析结果显示,白芍存在18 个独立靶点作用于CLI,川芎存在4 个独立靶点作用与CLI,而当归、熟地黄不存在独立作用靶点。对白芍的作用靶点进行GO 分析,发现靶点富集于炎症、肝再生、血管生成等与肝损伤和纤维化密切相关的生物过程[30-32],同时KEGG 分析显示白芍靶点富集于TNF 信号通路。进一步评估了白芍与CLI 的独立交集靶点基因,发现Vcam1、Tnf、Mapk8、Akt1等基因均富集于TNF通路,且在模型组明显上调,而给予白芍治疗后明显下调,由此推测白芍可能通过TNF 通路相关基因改善了CLI。既往研究报道了VCAM1 促进LSEC毛细血管化和肝纤维化[33];抑制TNF-α 可改善小鼠BDL 后的肝星状细胞活化以及肝纤维化[34];MAPK8 的表达与药物性肝损伤相关[35];Akt 在肝损伤伴随的炎症、细胞增殖、迁移和纤维形成中有着重要的作用[36],这些基因均显示出与肝损伤与肝纤维化的紧密相关性。此外,TNF 可作为上游基因诱导VCAM1 表达[37-38],而VCAM1 可通过激活下游的Akt 和MAPK 信号传导来增强细胞的增殖和迁移[39]。综上,推测白芍可能通过TNF/VCAM1/Akt/MAPK 相关通路改善了CLI,其具体机制仍有待于进一步研究,以确定其上下游及相互作用关系。此外,GO 富集分析显示川芎的作用靶点富集于与CLI密切相关的血管内皮生长因子、血管生成等生物过程;KEGG 分析显示川芎靶点富集于VEGF 信号通路,这可能与其特异性改善CLI 有关。进一步评估了川芎与CLI 的独立交集靶点基因,发现Kdr、Mapk14富集于VEGF 通路,二者在模型组明显上调,而给予川芎治疗后明显下调,因此推测川芎通过VEGF 通路改善CLI。Kdr(VEGFR2)作为血管内皮生长因子受体,与血管生成以及肝纤维化显著相关[40-41],此外,抑制MAPK14 可缓解酒精引起的肝损伤[42],同时MAPK14 为VEGFA 的上游调节因子[43]。因此,推测川芎可能通过MAPK14/VEGF/VEGFR2 相关通路改善CLI。
综上,本研究基于网络药理学、生物信息学分析、体内动物模型和分子生物学手段,预测并验证了四物汤防治CLI 的关键单味药及其作用靶点。发现四物汤中各单味药均能改善胆汁淤积引起的肝损伤及纤维化,4 个单味药共同通过靶向Nr3c2、Rxra、Ptgs2发挥疗效。此外,川芎、白芍显示出更优药效,白芍通过调控TNF 通路基因改善CLI,而川芎改善CLI 则与调控VEGF 通路相关。本研究为传统方药四物汤及其组成的临床应用与机制研究提供了一定的科学依据,也为病理机制复杂的CLI 治疗方案提供了理论指导。
利益冲突所有作者均声明不存在利益冲突