基于液质联用技术结合化学计量法分析杜仲盐制前后差异性成分
唐 瑞 ,吴杭莎 ,李亚飞 ,赵明方 ,方可儿 ,张海瑞 ,葛卫红 *,杜伟锋 ,
1.浙江中医药大学药学院,浙江 杭州 311402
2.浙江中医药大学中药炮制技术研究中心,浙江 杭州 311401
3.浙江中医药大学中药饮片有限公司,浙江 杭州 311401
杜仲在中医药方面的使用已有2 000 多年的历史,首载于《神农本草经》[1],“杜仲,味辛,平。主腰脊痛。补中,益精气,坚筋骨,强志,除阴下痒湿,小便余沥。久服轻身,耐老。一名思仙”,将其列为上品,属于名贵滋补药材之一,具有独特的药用价值。现代药理研究表明,杜仲具有抗骨质疏松[2]、降压[3]、保护肾脏[4-5]、调血脂[6]、抗肿瘤[7]、保护神经[8]、安胎[9]等作用。其中杜仲含有较多的硬性橡胶类物质杜仲胶,研究表明这种胶质会对有效成分的溶出产生抑制作用[10],而经高温加热后,硬性橡胶可被破坏,可促进有效成分溶出,提高治疗效果,因而中医临床上常以炮制品为主。历版《中国药典》中收录的杜仲炮制品以盐制为主,研究表明盐杜仲中的浸出物含量比杜仲高,而铅含量比杜仲低,可达到减毒增效的作用[11],此外,盐杜仲的补肾健骨作用也优于杜仲[12]。由此可见,杜仲盐制的必要性与优越性。通过对杜仲资料的收集与梳理,目前共有17 个省市的炮制规范收载了杜仲及盐杜仲,除上海市的中药炮制规范对杜仲以松脂醇二葡萄糖苷作为含量测定指标,其他省市最新炮制规范均未对杜仲及盐杜仲规定含量测定项。《中国药典》2020 年版对于杜仲药材、饮片及盐杜仲均采用松脂醇二葡萄糖苷作为含量测定指标,未存在限度上的差异,无法全面体现出杜仲盐制前后的专属性与整体性变化;同时在实际生产中发现,当杜仲胶炮制断丝时,松脂醇二葡萄糖苷的含量一般低于标准的限度,质量无法合格,这说明仅检测该指标可能无法全面判定炮制饮片的质量、无法体现出炮制特色。因此,有必要进行杜仲盐制前后的差异研究并寻找潜在差异性成分。近年来,对盐制杜仲的相关研究主要有盐制杜仲的温度研究[13],杜仲盐制前后指纹图谱的构建及化学成分含量的变化[14-16],肾纤维化药动学研究[17]等。但对杜仲盐制的增效物质基础还未有系统研究,无法准确全面的对杜仲盐制的增效物质基础进行阐述。
液质联用技术对中药中复杂的成分具有很好的分离能力和结构鉴别的能力,现常应用于化学药物、复方中药、不同产地中药、炮制前后中药及单味中药的成分定性及定量等分析。近年来,中药炮制过程中成分的变化和药效物质基础的研究已成为中药领域的一大热点。已有学者运用液质联用技术对中药炮制的物质组学基础进行了探索,王祎等[18]利用液质联用技术结合多元统计分析筛选得到,葫芦巴中的黄酮碳苷类成分在盐制后溶出增加,皂苷类成分发生了结构转化,这2 类成分可能是葫芦巴盐制前后差异性成分,吴杭莎等[19]利用液质联用技术结合化学计量法筛选续断盐制前后质量差异成分,初步筛选了12 个主要差异性成分。文旺等[20]利用液质联用技术结合植物代谢组学,并通过化学统计分析筛选甘草清炒和蜜制后化学成分的变化,最终鉴定出10 个显著差异成分,主要为甘草苷和甘草酸的衍生物。
本研究采用液质联用技术对杜仲盐制前后的化学成分组成进行鉴定,经化学计量法分析可视化展示杜仲及盐杜仲中化学成分的组间差异并筛选出影响杜仲盐制前后质量变化的潜在差异性成分。
1 仪器与材料
1.1 仪器
UPLC-Triple-TOF/MS 系统:AcquityTMultra 型高效液相色谱仪,美国Waters 公司;Triple TOF 5600+型飞行时间质谱,配有电喷雾离子源,美国AB Sciex公司;U3000 型高效液相色谱仪,美国Thermo Fisher公司;ME-204E 型电子分析天平(0.01 g)、XS105型电子分析天平(0.01 mg),瑞士Mettler Toledo 公司;Centrifuge 5425 型离心机,德国Eppendorf 公司;DFT-200 型手提式高速中药粉碎机,温岭市林大机械有限公司;DFD-700 型电热恒温水浴锅,天津市泰斯特仪器有限公司;KQ-500DB 型数控超声波清洗器,昆山市超声仪器有限公司;TG16-WS 型台式高速离心机,上海卢湘仪离心机仪器有限公司。
1.2 试药
1.2.1 对照品 京尼平苷酸(批号111828-201805,质量分数为98.10%)、绿原酸(批号110753-201817,质量分数为96.80%)、紫丁香苷(批号111574-201605,质量分数为95.20%)、松脂醇二葡萄糖苷(批号111537-201706,质量分数为91.70%)、金丝桃苷(批号111521-201809,质量分数为94.90%)、京尼平苷(批号 110749-201919,质量分数为97.10%),均购自于中国食品药品检定研究院;京尼平(批号21041202,质量分数为99.40%)、中脂素二葡萄糖苷(批号20031903,质量分数为98.46%),均购自于成都格利普生物科技有限公司;咖啡酸(批号110002-202005,质量分数≥98.00%)、芦丁(批号100080-201811,质量分数≥98.00%),均购自于上海鸿永生物科技有限公司。
1.2.2 试剂 甲醇、乙腈、甲酸为色谱纯,美国Tedia公司;磷酸,分析纯,浙江汉诺化工科技有限公司;甲醇,分析纯,广东光华科技股份有限公司;纯净水购自杭州娃哈哈集团有限公司。
1.2.3 药材 杜仲饮片5 批,购自浙江中医药大学中药饮片有限公司,编号为S1~S5,由浙江中医药大学药学院葛卫红教授鉴定,为杜仲科杜仲属植物杜仲EucommiaulmoidesOliv.干燥树皮的加工品。盐杜仲饮片由杜仲饮片制备而得(炮制方法参考2005 版《浙江省中药饮片炮制规范》[21],具体炮制工艺按浙江中医药大学中药饮片有限公司盐杜仲生产工艺进行炮制:取杜仲,加盐水,闷透,置炒制容器中,220 ℃加热炒制7~9 min,至丝易断、表面焦黑色,取出放凉,即得。每100 千克杜仲,用食盐2 kg 拌匀),编号为Y1~Y5。
2 方法与结果
2.1 溶液的制备
2.1.1 供试品溶液 取杜仲样品粉末(过三号筛)约2 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,密塞,称定质量,超声处理(频率40 kHz、功率500 W)40 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,精密量取25 mL 续滤液于蒸发皿中,蒸干,用50%甲醇定容于5 mL 量瓶中,过0.45 μm 微孔滤膜,即得。
2.1.2 对照品溶液 取对照品松脂醇二葡萄糖苷、京尼平苷、京尼平苷酸、京尼平、紫丁香苷、金丝桃苷、绿原酸、咖啡酸、芦丁、中脂素二葡萄糖苷适量,精密称定,置于20 mL 量瓶中,加50%甲醇制成分别含177.0、205.8、213.9、197.0、113.1、188.9、190.7、193.1、311.6、173.3 μg/mL 的混合对照品溶液,即得。
2.2 色谱条件
色谱柱为Waters HSS-T3 柱(150 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~20 min,2%~30%B;20~35 min,30%~50% B;35~42 min,50%~95% B;体积流量为0.3 mL/min;柱温为50 ℃;检测波长254 nm;进样量3 µL。
2.3 质谱条件
UPLC-Triple-TOF 5600+飞行时间液质联用仪:负离子扫描模式;扫描范围m/z100~1 500;雾化气(GS1)344.738 kPa(50 psi);雾化气(GS2)344.738 kPa(50 psi);气帘气(CUR)241.317 kPa(35 psi);离子源温度(TEM)550 ℃;离子源电压(IS)−4 500 V;一级扫描:去簇电压(DP)100 V,聚焦电压(CE)10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,碎片碰撞电压(CID)为20、40、60 V,进样前,用CDS 泵做质量轴校正,使质量轴误差小于2×10−6。
2.4 化学成分分析
将杜仲样品供试品溶液按上述“2.2”和“2.3”项下的色谱和质谱条件进样分析,得到样品盐制前后UPLC-Triple-TOF/MS 负离子模式下的总离子流图,结果见图1。通过Analyst®TF 1.6 软件采集数据,Peak view 软件拟合化合物的分子式,比对Scifinder 和Reaxy 数据库以及国内外杜仲化学成分研究相关文献和对照品数据,结合裂解规律的分析,结果共推断出杜仲中52 个化合物,如表1 所示。
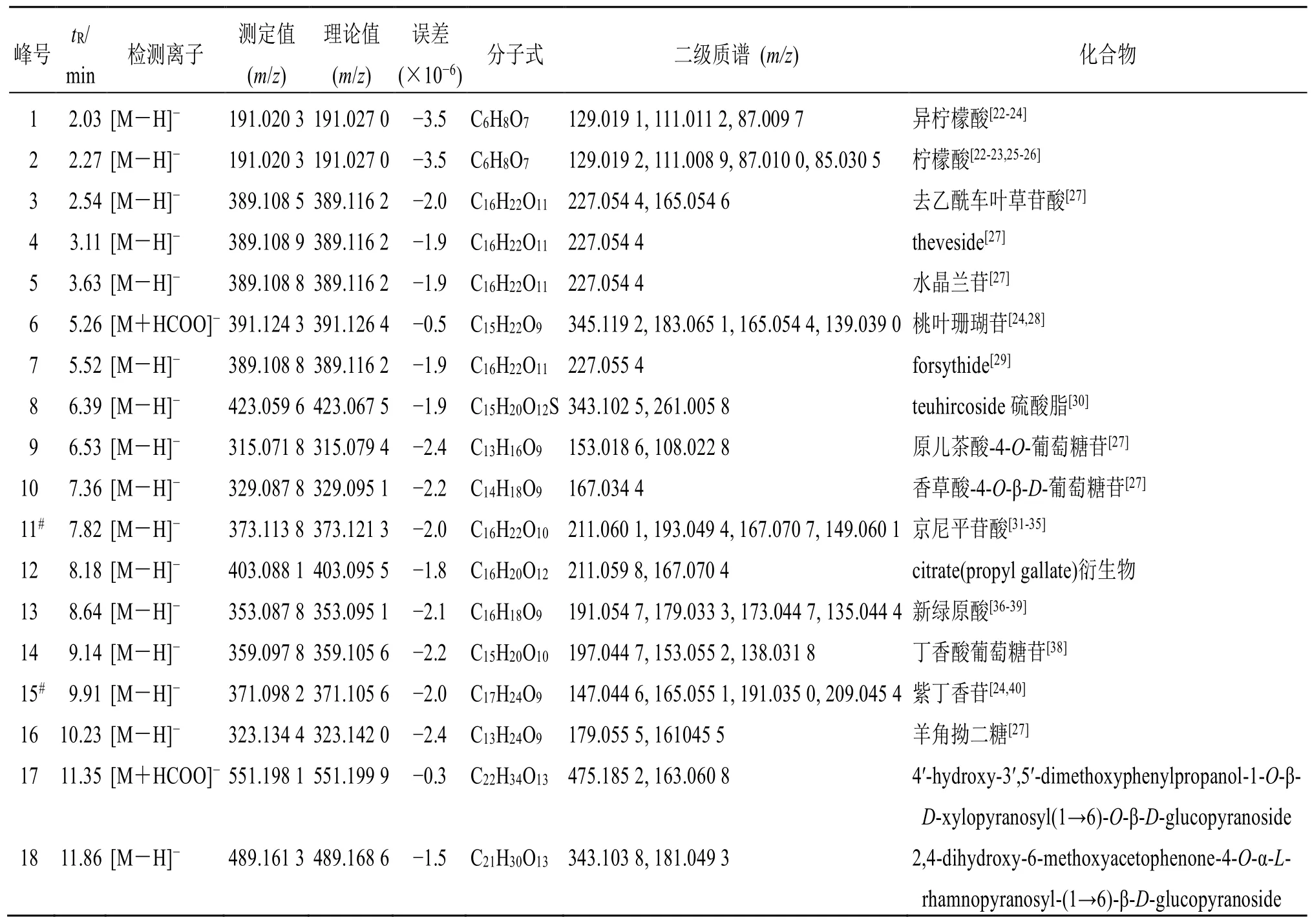
表1 杜仲中化学成分的鉴定结果Table 1 Identification results of chemical constituents in EC
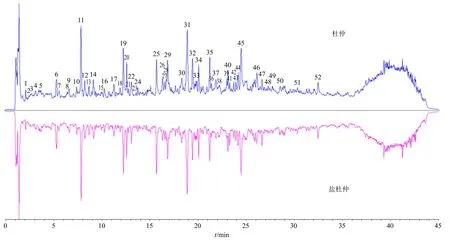
图1 杜仲与盐杜仲在UPLC-Triple-TOF/MS 负离子模式下的总离子流图Fig.1 Total ion current diagram of Eucommiae Cortex (EC) and salt-processed Eucommiae Cortex (spEC) in UPLC-Triple-TOF/MS negative ion mode
2.4.1 环烯醚萜类化合物 环烯醚萜类化合物在负离子模式下易形成[M-H]−和[M+HCOO]−这2 种准分子离子,其在裂解过程中易失去葡萄糖结构,得到苷元碎片离子[M-H-Glc]−,同时苷元碎片进一步易失去H2O 和CO2分子,从而得到[M-H-Glc-H2O]−、[M-H-Glc-CO2]−、[M-H-Glc-H2OCO2]−等碎片离子。
峰11 化合物准分子离子为m/z373.113 8 [MH]−,拟合分子式为 C16H22O10,根据二级质谱211.060 1、193.049 4、167.070 7、149.060 1,推测其裂解后形成[M-H-Glc]−、[M-H-Glc-H2O]−、[M-H-Glc-CO2]−、[M-H-Glc-H2O-CO2]−等碎片离子,推测化合物存在葡萄糖结构,母核为环烯醚萜,结合数据库检索及文献对比[31-35]推测该化合物为京尼平苷酸,其裂解途径如图2 所示。
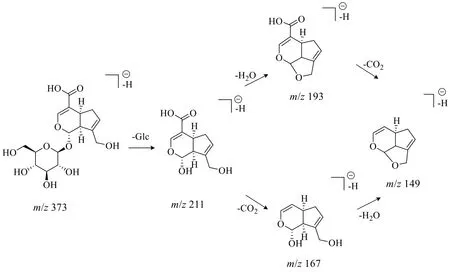
图2 京尼平苷酸的裂解途径Fig.2 Fragmentation pathway of geniposidic acid
峰25 化合物的准分子离子为m/z433.134 8[M+HCOO]−,拟合分子式为C17H24O10,根据二级质谱387.130 1、225.075 7、207.064 9,推测其裂解后形成[M-H-Glc]−、[M-H-Glc-H2O]−等碎片离子,结合数据库及文献对比[34-35,45]推测该化合物为京尼平苷,其裂解途径如图3 所示。
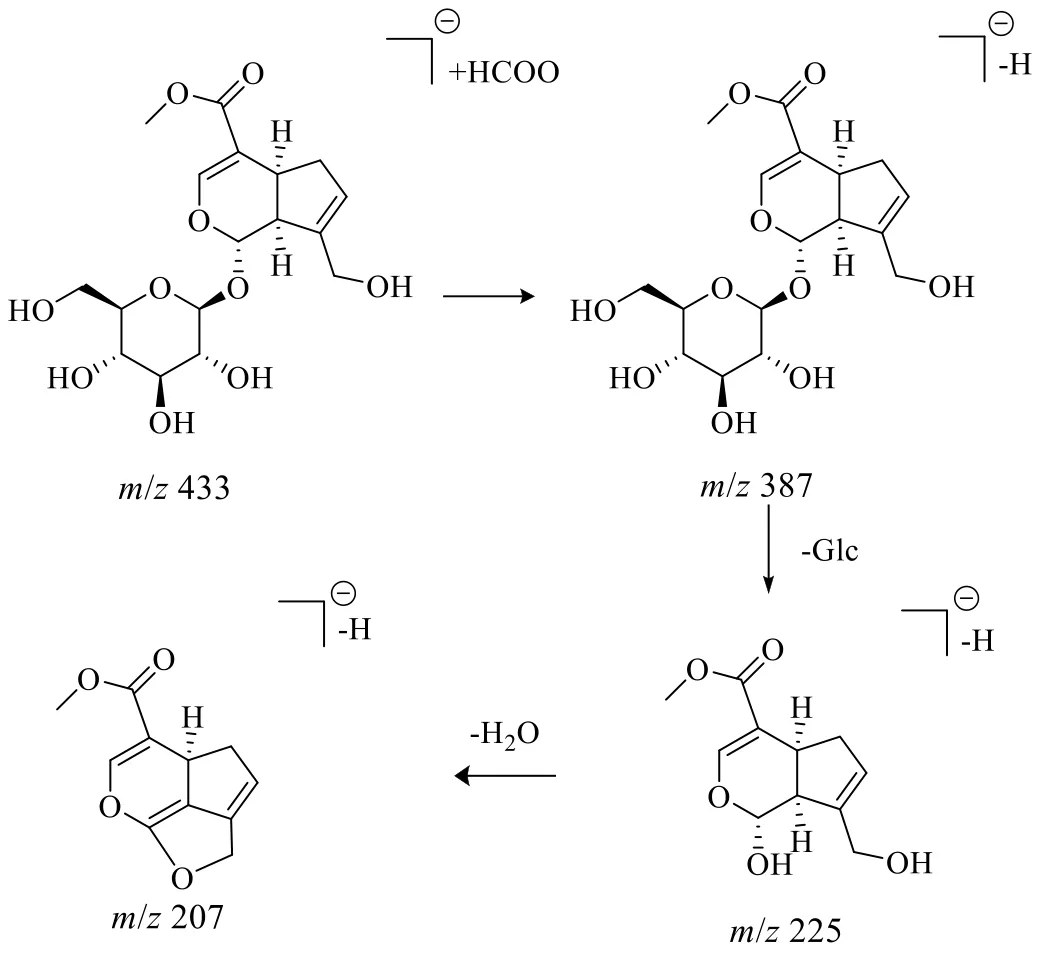
图3 京尼平苷裂解过程Fig.3 Fragmentation pathway of geniposide
2.4.2 有机酸类化合物 杜仲中的有机酸类化合物主要有脂肪族羧酸、糖衍生有机酸及酚酸类,其在负离子模式下均易形成[M-H]−准分子离子。脂肪族羧酸包括柠檬酸、异柠檬酸等。糖衍生有机酸在裂解过程中易失去葡萄糖结构,得到苷元碎片离子[M-H-Glc]−,同时苷元碎片进一步易失去CH3和CO2分子,从而得到[M-H-Glc-CH3]−、[M-HGlc-CO2]−、[M-H-Glc-CH3-CO2]−等碎片离子。峰14 化合物的准分子离子为m/z359.097 8 [M-H]−,根据高分辨质谱结果拟合的分子式为C15H20O10,二级质谱为197.044 7、153.055 2、138.031 8,推测该化合物存在葡萄糖结构,裂解形成[M-H-Glc]−、[M-H-Glc-CO2]−、[M-H-Glc-CO2-CH3]−碎片离子,结合数据库检索,推测该化合物母核为丁香酸,结合文献对比[38]推测该成分为丁香酸葡萄糖苷,其裂解途径如图4 所示。
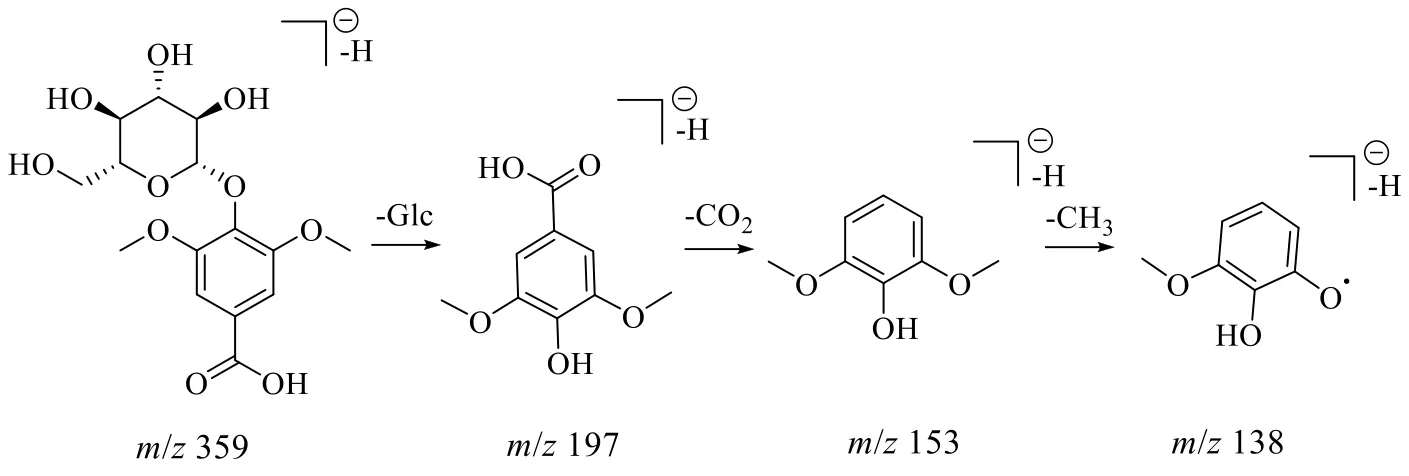
图4 丁香酸葡萄糖苷的裂解过程Fig.4 Fragmentation pathway of syringic acid glucoside
酚酸类成分为含有酚环的有机酸,其在裂解过程中易形成咖啡酸特征碎片离子m/z179 及奎宁酸特征碎片离子m/z191,随后进一步丢失CO2或H2O分子。峰19 化合物的准分子离子为m/z353.087 6[M-H]−,拟合分子式为C16H18O9,根据二级质谱191.054 7、179.033 3、173.044 7、135.044 4,推测化合物存在咖啡酸和奎宁酸结构,根据数据库检索,结合文献对比[36-38,41]推测该化合物为绿原酸,其裂解途径如图5 所示。
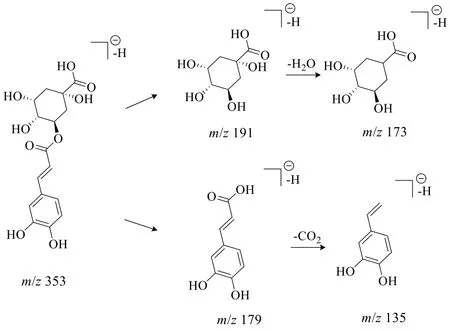
图5 绿原酸的裂解过程Fig.5 Fragmentation pathway of chlorogenic acid
2.4.3 木脂素类化合物 木脂素类化合物在负离子模式下易形成[M-H]−和[M+HCOO]−这2 种准分子离子,其在裂解过程中易失去葡萄糖结构,得到碎片离子[M-H-Glc]−或[M-H-2Glc]−,同时苷元碎片进一步易失去CH3、CO 等分子,从而得到[M-H-Glc-CH3]−、[M-H-2Glc-CH3]−、[MH-Glc-CO]−、[M-H-2Glc-CO]−等碎片离子。峰31 化合物的准分子离子为m/z727.247 0 [M+HCOO]−,根据高分辨质谱结果拟合的分子式为C32H42O16,根据二级质谱681.241 3、519.190 9、357.135 4,推测化合物存在2 个葡萄糖结构且母核为松脂醇,根据数据库检索及文献对比[24,35,46-48]推测该化合物为松脂醇二葡萄糖苷,其裂解途径如图6 所示。
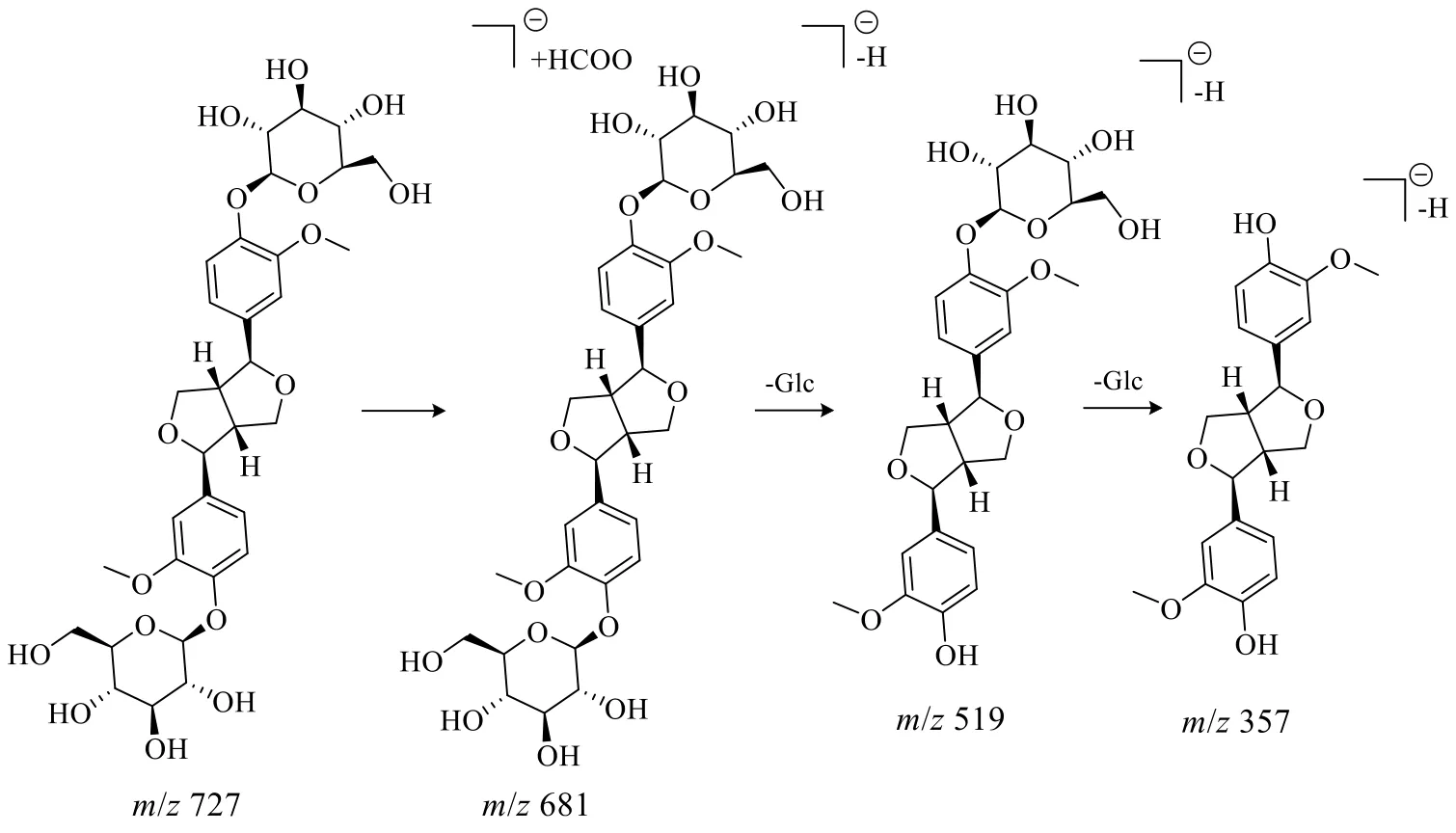
图6 松脂醇二葡萄糖苷的裂解途径Fig.6 Fragmentation pathway of pinoresinol diglucoside
2.4.4 黄酮类化合物 黄酮类化合物在负离子模式下易形成[M-H]−准分子离子,在裂解过程中经常发生糖苷键的断裂,丢失葡萄糖分子或鼠李糖分子,得到苷元碎片离子[M-H-Glc]−或[M-H-Rha]−等,苷元碎片后续进一步发生CH3、CO、H2O、CHO等分子的丢失。峰50 化合物的准分子离子为m/z463.094 9 [M-H]−,拟合分子式为C21H20O12,根据二级质谱301.053 1、255.163 9,结合数据库检索及文献对比[52],推测该化合物为金丝桃苷,其裂解途径如图7 所示。
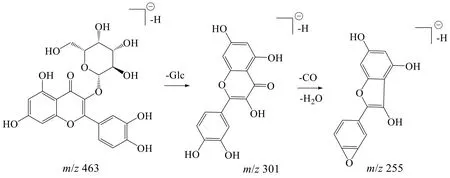
图7 金丝桃苷的裂解途径Fig.7 Fragmentation pathway of hyperoside
2.5 杜仲盐制前后差异性成分筛选
使用Peakview 软件对样品中所有鉴定的化合物的质谱峰数据进行提取,将数据导入SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)、正交偏最小二乘法-判别分析(orthogonal partial least squares method-discriminant analysis,OPLS-DA)进行多元统计分析,筛选出潜在差异性成分。
2.5.1 聚类分析 将5 批杜仲及盐杜仲的质谱峰数据导入MetaboAnalyst 5.0 中,得到杜仲与盐杜仲样品的聚类热图,结果见图8。样品中化合物含量越高,热图上所显示的颜色就越深。Pearson 聚类热图表明各样品可分为2 类,S1~S5 聚为一类,Y1~Y5 聚为一类。
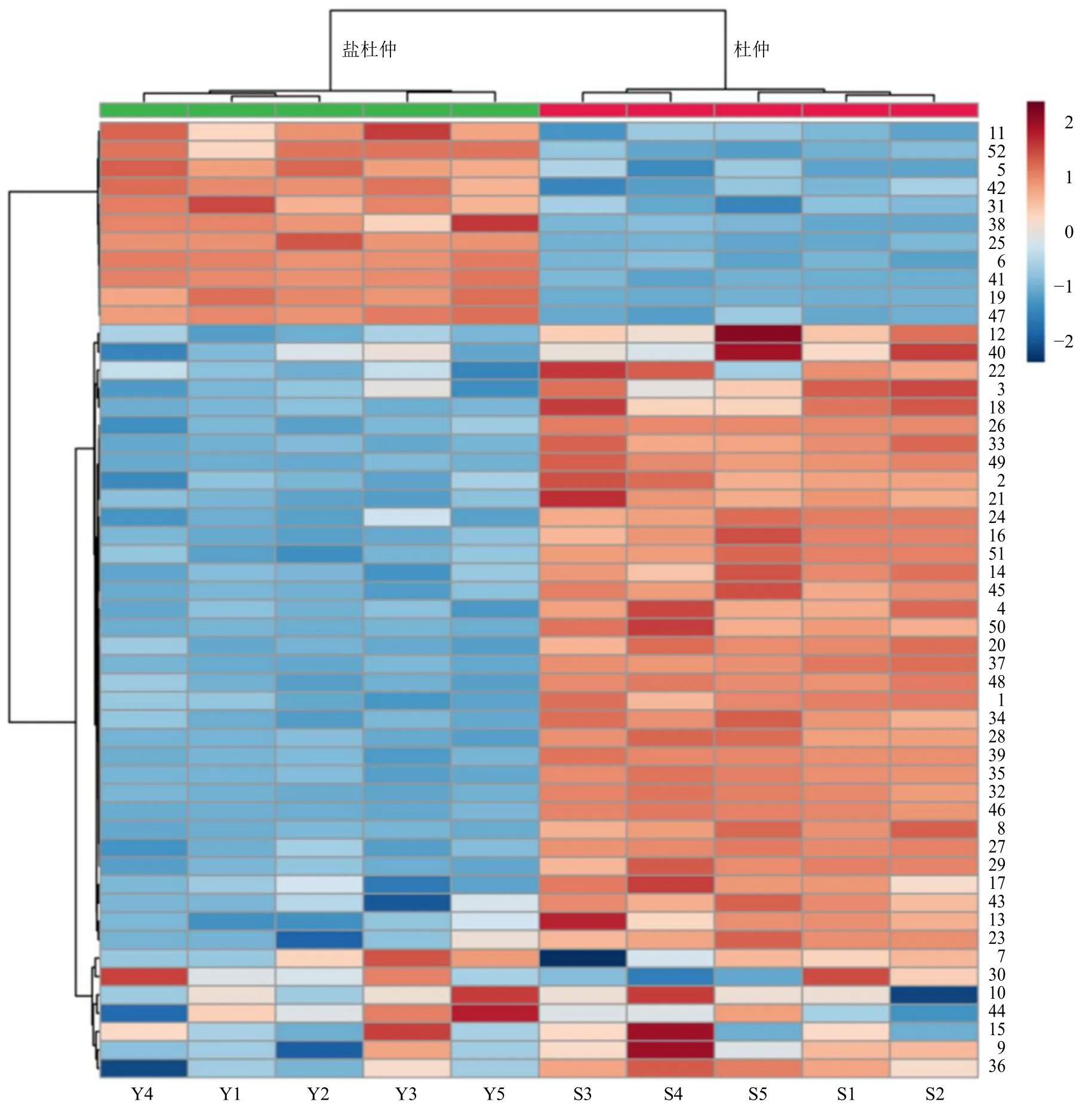
图8 杜仲与盐杜仲各化学成分聚类热图Fig.8 Cluster heat map of chemical components of EC and spEC
2.5.2 PCA 将各样品在负离子模式下已鉴别的52 个成分的质谱峰数据导入到SIMCA 14.1 中进行PCA,结果如图9 所示,在无监督的情况下,杜仲样品分布于第1、4 象限,盐杜仲样品分布于第2、3 象限,两者具有明显的区分,表明杜仲盐制前后其总体化学特征发生了改变,可能存在化学成分种类或含量的变化;各组中不同样本点之间离散较小,说明各批次样品组内均一性较高。
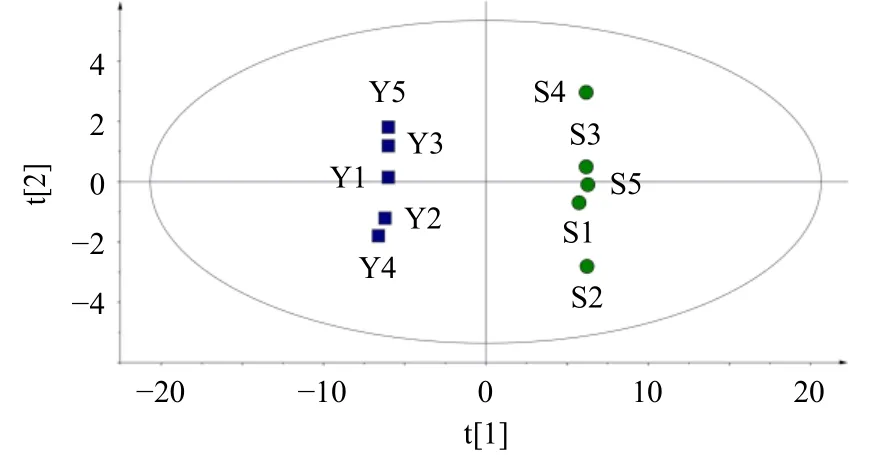
图9 杜仲与盐杜仲PCA 得分图Fig.9 PCA score plot of EC and spEC
2.5.3 OPLS-DA 将各样品在负离子模式下已鉴别的52 个成分的质谱峰数据导入到SIMCA 14.1 中进行OPLS-DA,以此来筛选影响杜仲与盐杜仲分类判别的潜在差异成分。样品得分散点图如图10 所示,杜仲与盐杜仲聚为2 类,模型的累积解释能力参数RX2、RY2及预测能力参数Q2分别0.957、1.000、1.000,说明模型可靠,拟合效果较好。由图11 所示的200次置换检验图中可知,R2和Q2的回归线分别与左侧纵轴相交于2 条回归线,斜率均较大,且左侧随机排列得到的R2和Q2随机值均小于右侧的原始值,说明所建立的原模型有效、稳定,且未出现过拟合,可用于进行进一步的数据分析。

图10 杜仲与盐杜仲OPLS-DA 得分图Fig.10 OPLS-DA score plot of EC and spEC
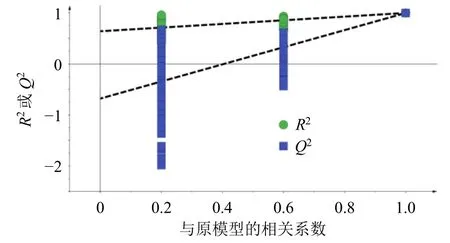
图11 杜仲与盐杜仲OPLS-DA 模型置换检验图Fig.11 Permutation validation figure of OPLS-DA model of EC and spEC
进一步生成模型的VIP 图(图12)和S-Plot 图(图13),导出得到VIP 值及p(corr)和P值,计算|p(corr)|和−lgP值,以VIP>1,|p(corr)|≥0.5 和−lgP>1.3 为条件对影响杜仲盐制前后质量差异的潜在差异性成分进行筛选,得到14 种潜在的差异性化学成分,分别为峰25(京尼平苷)、19(绿原酸)、46(杜仲醇)、6(桃叶珊瑚苷)、31(松脂醇二葡萄糖苷)、11(京尼平苷酸)、32(京尼平)、41(eucomoside B)、47(异绿原酸C)、8(teuhircoside硫酸脂)、20(橄榄素二葡萄糖苷)、35(丁香脂素二葡萄糖苷)、34(中脂素二葡萄糖苷)和37(去氢二松柏醇葡萄糖苷),结果见表2。
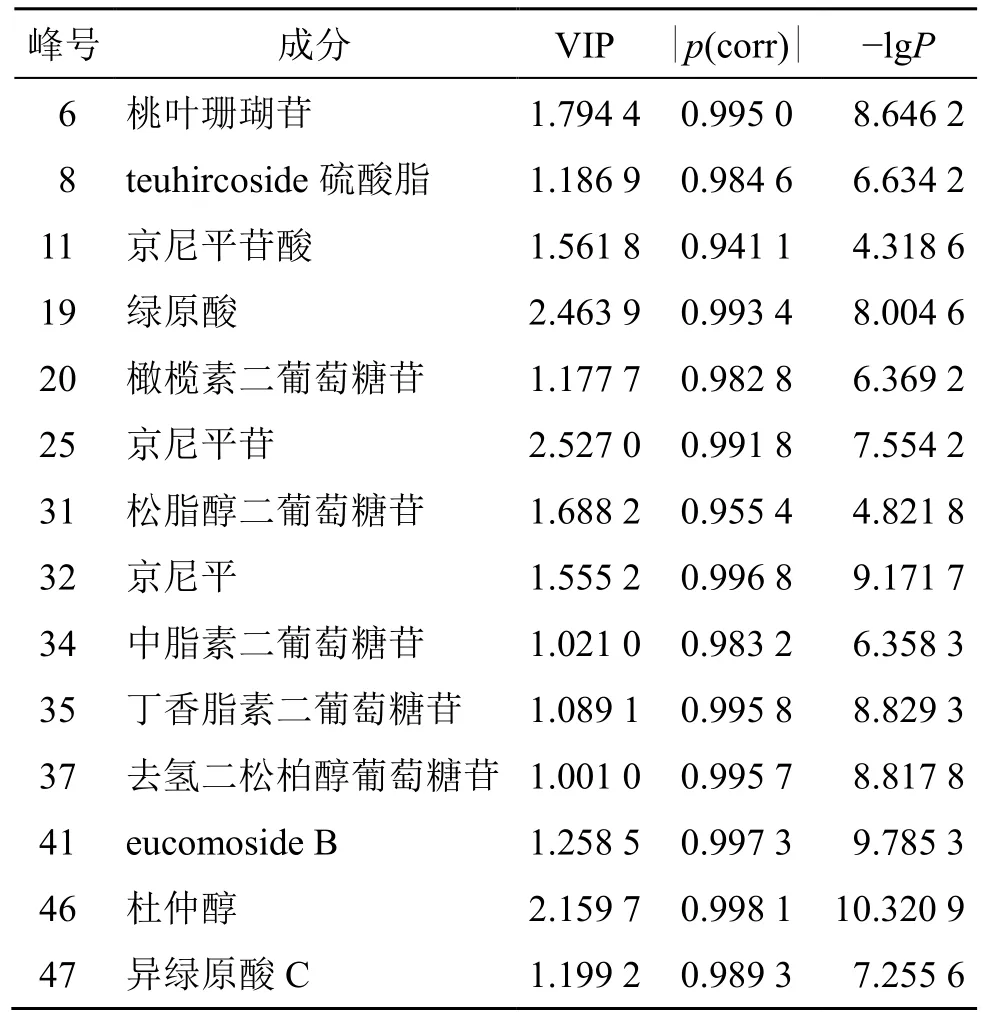
表2 杜仲与盐杜仲差异性成分筛选结果Table 2 Screening results of differential components between EC and spEC
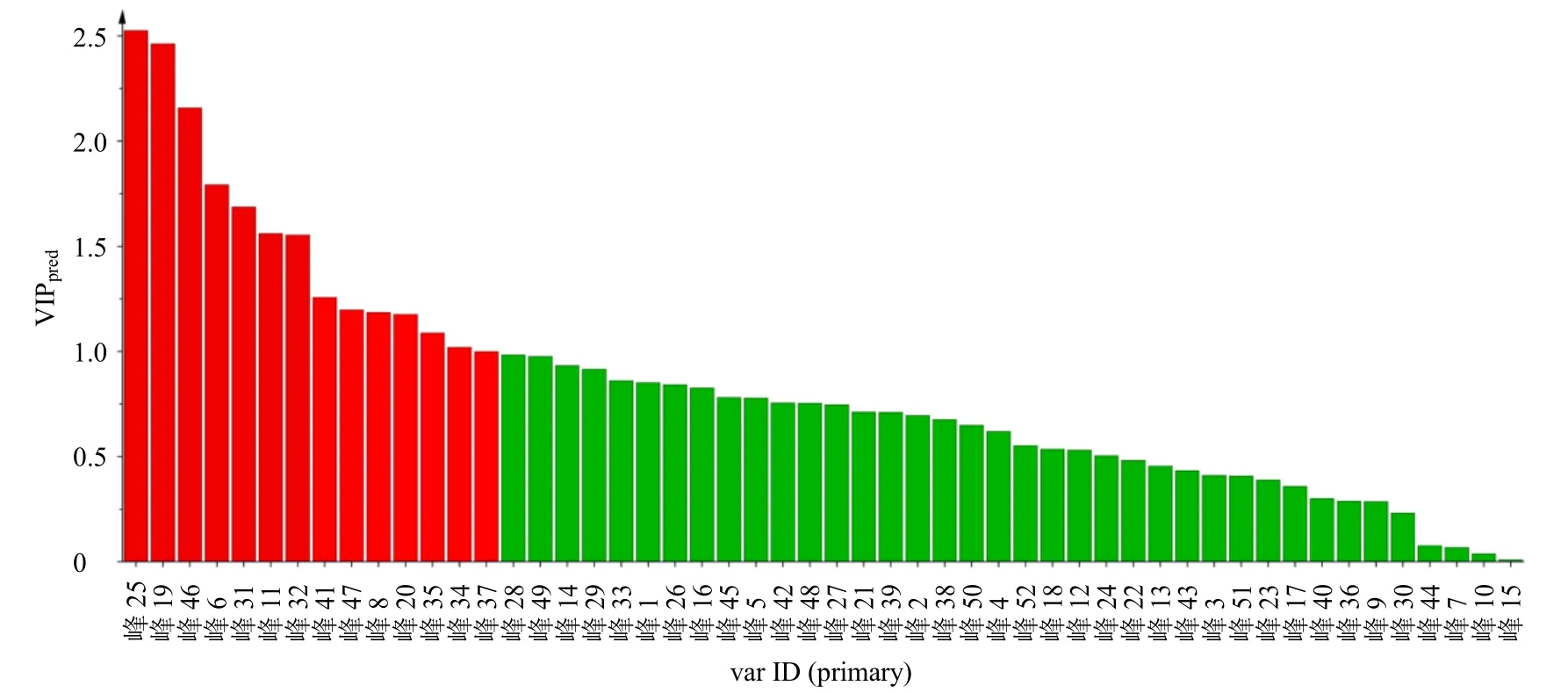
图12 杜仲与盐杜仲52 个共同成分VIP 图Fig.12 VIP diagram of 52 common components of EC and spEC
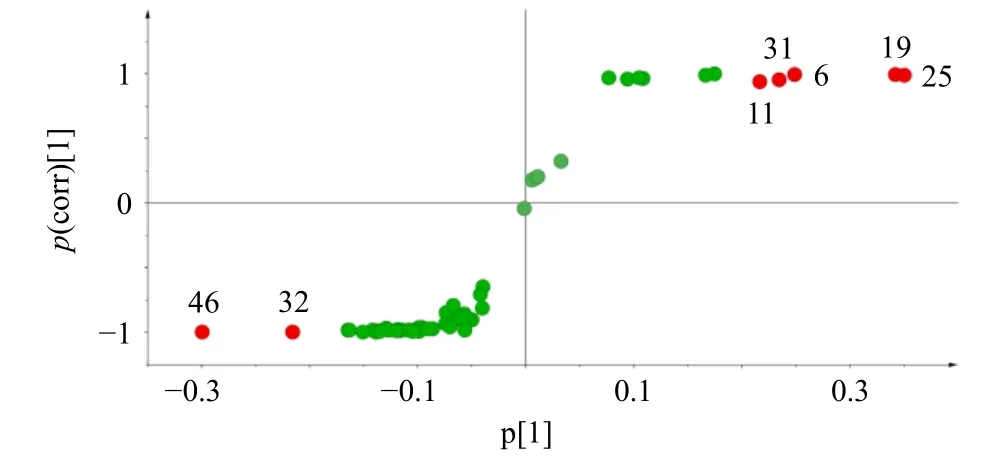
图13 杜仲与盐杜仲52 个共有成分S-Plot 图Fig.13 S-plot spectrogram of 52 common components of EC and spEC
各成分所对应的峰面积表示含量的变化,本研究计算了5 批杜仲与盐杜仲的同一成分质谱峰面积占该批次的峰面积总值的百分比,分别以杜仲与盐杜仲各成分峰面积百分比平均值做比较,结果如表3 所示,杜仲经盐制后桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、松脂醇二葡萄糖苷、异绿原酸C 和eucomoside B 呈上升趋势,而杜仲醇、京尼平、teuhircoside 硫酸脂、橄榄素二葡萄糖苷、丁香脂素二葡萄糖苷、中脂素二葡萄糖苷和去氢二松柏醇葡萄糖苷呈下降趋势。
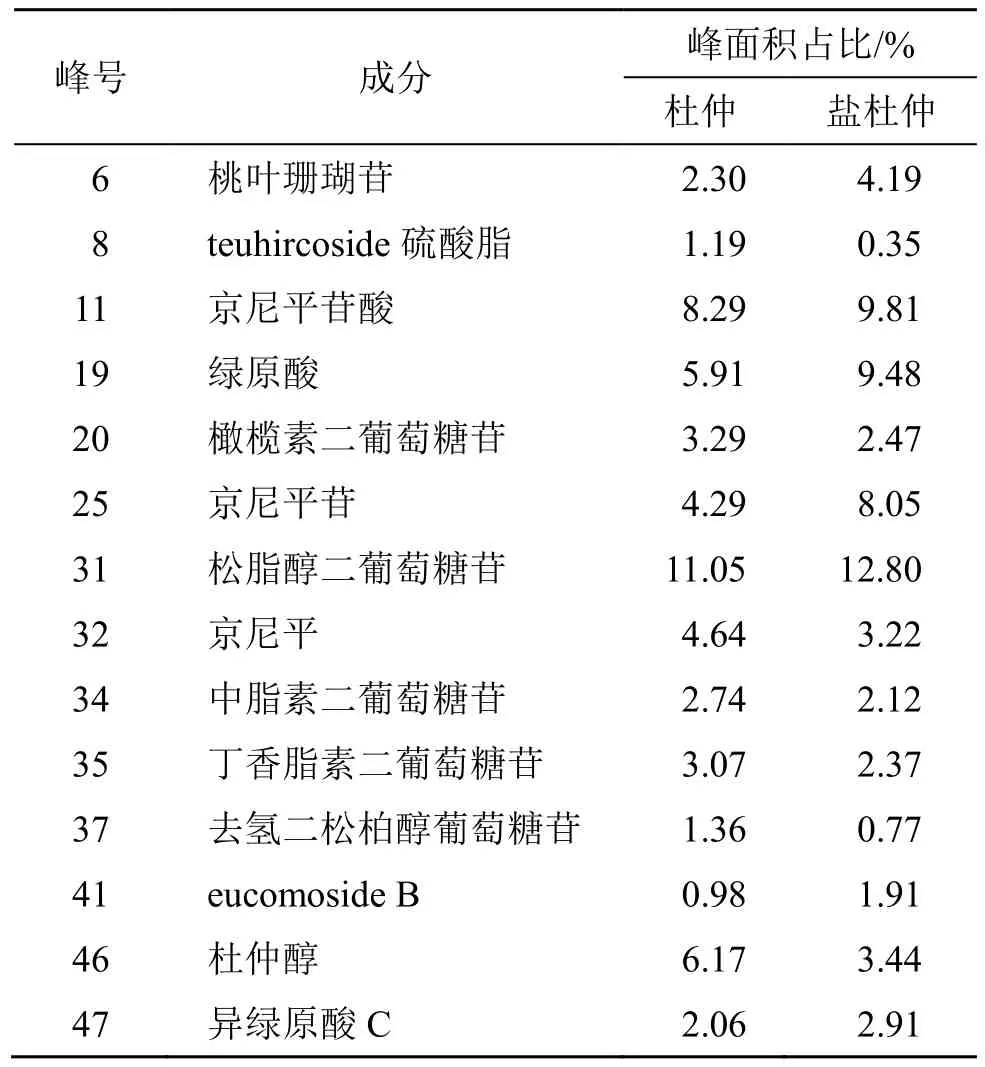
表3 杜仲与盐杜仲差异性成分的峰面积变化结果Table 3 Results of peak area changes of differential components of EC and spEC
3 讨论
本研究采用UPLC-Triple-TOF/MS 建立了杜仲化学成分的定性分析方法,通过Scifinder、Reaxys数据库、相关文献的搜索以及裂解规律的分析,共鉴定出52 种化合物,主要类别有环烯醚萜类、黄酮类、木脂素类和有机酸类等。
炮制前后仅发现有成分含量高低的变化,并未发现有新增或消失的成分。PCA 与OPLS-DA 结果显示,杜仲与盐杜仲在有监督和无监督的情况下均能得到较好地区分,利用液质联用数据共筛选出京尼平苷、绿原酸、杜仲醇、桃叶珊瑚苷、松脂醇二葡萄糖苷、京尼平苷酸、京尼平、eucomoside B、异绿原酸C、teuhircoside 硫酸脂、橄榄素二葡萄糖苷、丁香脂素二葡萄糖苷、中脂素二葡萄糖苷和去氢二松柏醇葡萄糖苷这14 个潜在差异成分。桃叶珊瑚苷属于环烯醚萜苷类化合物,现代药理研究表明其具有抗炎、抗骨质疏松、保护肝肾的作用[53]。京尼平、京尼平苷、京尼平苷酸均属于环烯醚萜类化合物,现代药理研究表明京尼平、京尼平苷均具有较好的治疗糖尿病肾病作用[54-55],京尼平苷酸是京尼平苷的衍生物,现代药理研究表明其具有抗炎、抗氧化应激、保护肝脏等作用[56-58]。
绿原酸属于多酚类化合物,多个药理研究表明其具有较强的抗菌作用[59-62]。松脂醇二葡萄糖苷属于木脂素类化合物,药理研究表明其具有改善骨质疏松的作用,同时可提升骨质量和骨坚硬程度[63-64]。杜仲醇属于环烯醚萜类化合物,现代药理研究表明其具有镇静催眠、安胎的作用[65-66]。异绿原酸C 属于苯丙素类化合物,现代药理作用表明其具有抗炎、保护肝脏等作用[67-68]。
经质谱峰面积分析,杜仲盐制后京尼平苷、绿原酸、桃叶珊瑚苷、松脂醇二葡萄糖苷、京尼平苷酸、异绿原酸C、eucomoside B 呈上升趋势,这几个差异性成分可作为主要的潜在物质基础研究方向,根据这几个差异性成分的现代药理作用,我们推测盐制后能够增强杜仲的抗炎、抗骨质疏松及保护肝肾等功效,这同时也印证了杜仲“盐制入肾”炮制理论,为后续开展相关药理对比研究提供了方向。
本研究采用液质联用技术结合化学计量学对盐杜仲增效的物质基础进行研究,对杜仲各类成分进行了较好的分析,结合化学计量学对杜仲盐制前后进行差异性成分筛选,共筛选出14 个潜在差异成分,为后续杜仲炮制前后药效学的物质基础的研究及质量标准的提升提供了科学依据。
利益冲突所有作者均声明不存在利益冲突