信迪利单抗联合化疗对晚期胃癌患者近期疗效及血清CEA sTim-3 sLAG-3和T淋巴细胞亚群的影响
刘 昭, 任玉川, 张亚鹏, 吕晓燕, 张立平
(1.山西省阳泉市第一人民医院肿瘤血液内科, 山西 阳泉 045000 2.山西省太原市中心医院肿瘤科, 山西 太原 030009)
胃癌发生大多与患者饮食习惯、细菌感染等有关,是由胃黏膜经过多重病理过程而成[1]。胃癌在我国发生率居高不下,且由于该病临床症状不显著,胃癌的筛选方法普及率不高,导致多数患者确诊时已进入晚期,错失手术治疗机会[2]。临床上对于晚期胃癌患者多使用化疗方案进行治疗,但治疗后患者生存率低,有效率不理想,因此还需寻找新的疗法改善晚期胃癌患者生存质量[3]。近期化疗方案联合靶向药物治疗胃癌取得较好的效果,成为研究热点。信迪利单抗属于程序性死亡分子(PD1)抗体,能显著降低癌症患者肿瘤负荷。基于此,本研究主要分析晚期胃癌患者在化疗基础上通过信迪利单抗,研究患者近期疗效变化,报道如下。
1 资料与方法
1.1一般资料:研究样本选取我院2020年5月至2022年5月就诊84例晚期胃癌患者,分组方式为分段随机化法(观察组和对照组),每组各42例。两组年龄、病程、肿瘤评分等一般资料差异无统计学意义(P均>0.05),见表1。纳入标准:①经体外组织病理学检查,所有患者均确诊为晚期胃癌;②TNM分期在Ⅲ~Ⅳ期;③自愿参与。排除标准:①器官严重衰竭者;②免疫系统障碍者;③对药物禁忌者;④患有其他恶性肿瘤;⑤化疗不耐受者。

表1 一般资料比较
1.2治疗方法:对照组采用常规化疗具体如下:多西他赛(上海创诺制药有限公司,国药准字H20184140,1mL:20mg注射剂),静滴1h,标准:60mg/m2;奥沙利铂(南京制药厂有限公司,国药准字H20000686,50mg注射剂),静脉滴注2~4h,130mg/m2;替吉奥胶囊(Taiho Pharmaceutical Co.,Ltd.Tokushima Plant,注册证号 H20130811,20mg×14粒×2板),每日2次,3周1疗程,每一疗程结束休息7d,继续下个疗程,持续3个疗程(3个月)。观察组在其基础上加用信迪利单抗,200mg/次,1次/1疗程,治疗3个疗程。
1.3观察指标:①临床效果:完成1疗程后,依据实体瘤疗效评估准则,对患者临床症状缓解情况进行评估:肿瘤完全消除,患者临床症状完全消失,表示完全缓解(CR);肿瘤最大直径、横径相乘,其积减小超过50%,且无新病灶再出血,部分缓解(PR);肿瘤最大直径和横径相乘,增大体积低于25%,未出现新病灶,表示稳定(SD);肿瘤最大直径和横径相乘,增大体积超过25%,表示进展(PD)。②毒副反应:记录两组患者化疗过程中腹泻、肝肾功能异常、白细胞减少、骨髓抑制等发生情况。③血清肿瘤标志物:利用电化学发光法在患者治疗前后收集静脉血液,评估其血清癌胚抗原(CEA)、糖链抗原(CA)、MG抗原(MG-Ag)水平。④免疫功能:于治疗前、治疗3个月后使用酶联免疫吸附法检测两组血清sTim-3、sLAG-3水平。⑤T淋巴细胞:于治疗前、治疗3个月后使用流式细胞仪检测两组患者血清CD3+、CD4+、CD8+水平。⑥治疗后随访1年,记录两组生存率。

2 结 果
2.1临床效果比较:治疗1个月后,观察组92.86%,对照组为73.81%,观察组总有效率更高(P<0.05),见表2。
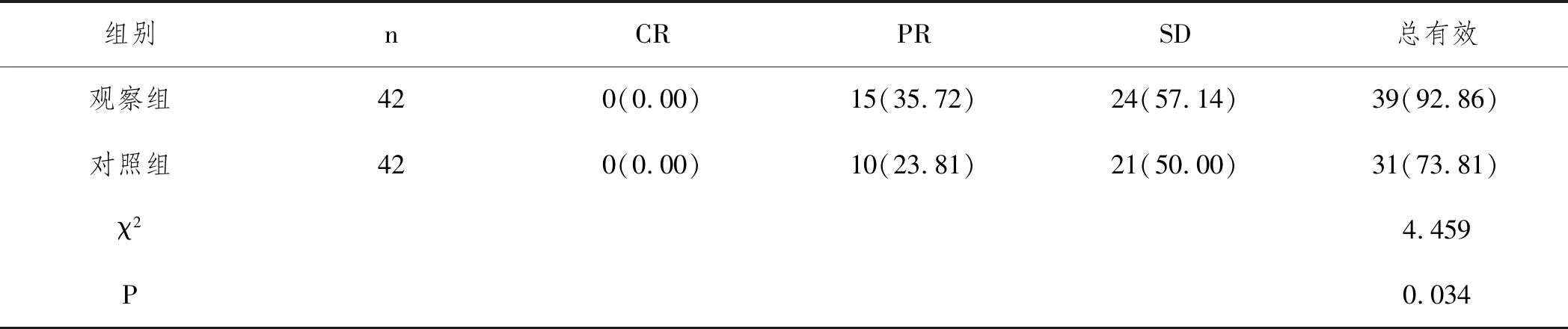
表2 临床效果比较n(%)
2.2毒副反应比较:治疗期间,两组肠胃道反应、肝肾功能异常、白细胞减少等毒副反应发生状况无统计学差异(P>0.05),见表3。
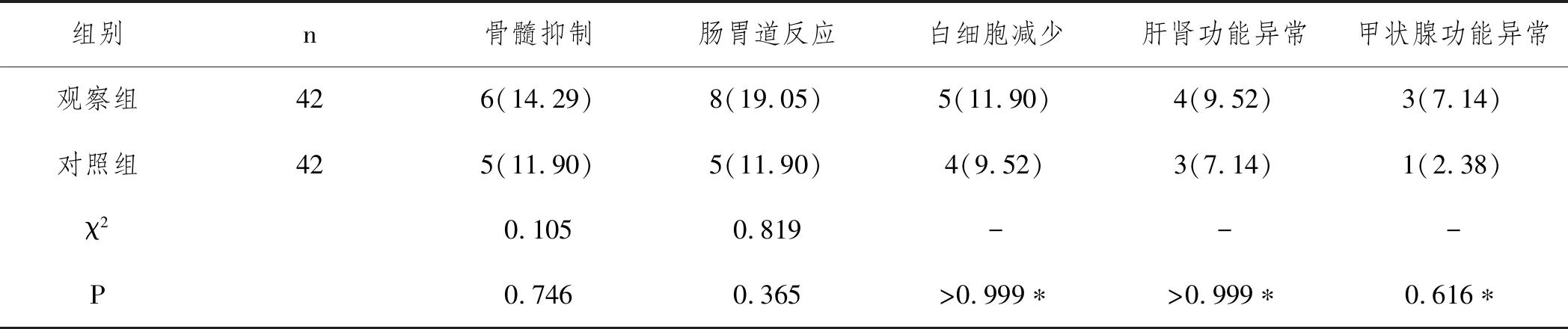
表3 毒副反应比较n(%)
2.3血清肿瘤标志物:治疗前,两组血清CA、CEA、MG-Ag水平比较,差异无统计学意义(P>0.05)。治疗3个月后,观察组上述指标下降更显著(P<0.05),见表4。

表4 血清肿瘤标志物比较
2.4免疫功能:治疗前两组血清sTim-3、sLAG-3水平比较差异无统计学意义(P>0.05)。治疗3个月后,两组患者上述指标均降低,且观察组降低更为显著(P<0.05),见表5。

表5 免疫功能
2.5T淋巴细胞水平比较:治疗前两组T淋巴细胞水平比较差异无统计学意义(P>0.05)。治疗3个月后,观察组CD3+、CD4+降低更明显,CD8+升高更明显(P均<0.05),见表6。
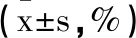
表6 T淋巴细胞水平
2.6两组患者生存情况:观察组失访2例,对照组失访1例。两组比较差异有统计学意义(log-rank χ2=3.883,P=0.048),见图1。
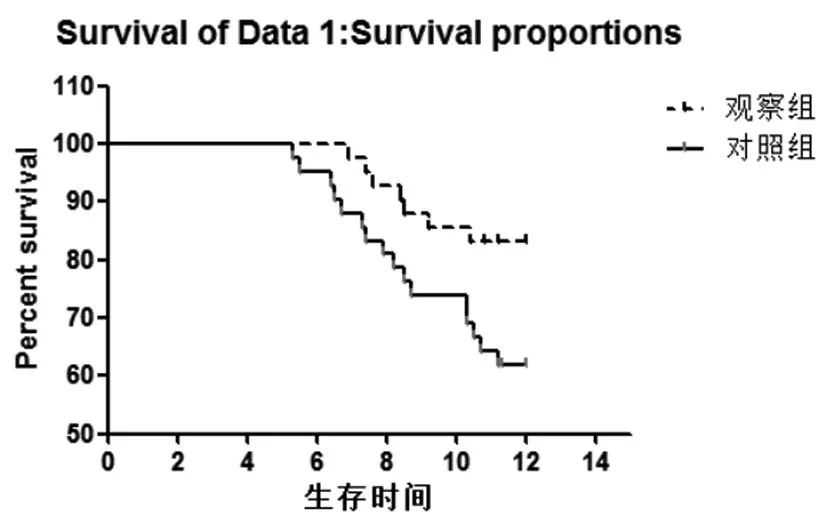
图1 两组生存曲线图
3 讨 论
胃癌患者发病较为隐匿,临床确诊时多数已步入晚期,失去手术治疗机会,因此化疗成为其首选治疗方案[4]。临床上多使用铂类、紫杉醇等进行联合化疗,然而仅仅通过化疗其作用效果难以达到理想状态,且化疗后常常导致器官损伤、骨髓抑制等情况产生,影响患者后续恢复[5]。免疫抑制剂用于肿瘤患者已取得丰硕的成果,如程序性坏死因子-1的抗体已成为非小肺癌的一线治疗,且在胃癌、肝癌等其它癌症患者中获得适应证[6]。
本研究中观察组治疗后,治疗有效率更高,血清肿瘤标志物水平降低更加明显,毒副反应发生率无显著差异,说明信迪利单抗联合化疗安全性好,可有效缓解晚期胃癌患者肿瘤负荷。分析原因:奥沙利铂属于铂类化疗药物,进入机体后可与肿瘤细胞DNA进行结合,形成链状复合体,从而造成细胞崩解死亡,具有有效的细胞毒杀作用,此外奥沙利铂对肾脏功能损伤较小,可减轻化疗毒副作用[7]。多西他赛能通过阻碍微管结构的解聚,从而抑制细胞有丝分裂,发挥阻碍肿瘤细胞复制增殖的功效。替吉奥胶囊是复合制剂,相比传统氟尿嘧啶能提高患者血药浓度,从而增强抑制肿瘤作用。有研究表明肿瘤细胞本身可造成患者免疫功能紊乱,再加上化疗对免疫系统的伤害,导致患者免疫功能不断降低[8]。信迪利单抗能阻断PD-1分子与其受体结合,解除免疫抑制,激活免疫细胞杀伤肿瘤细胞功能[9]。因此,信迪利单抗与化疗联合和可有效抑制患者肿瘤进展。
sTim-3在免疫细胞中高度表达,能通过整合素来促进其释放到胞外,从而促进肿瘤细胞免疫逃逸过程,有研究显示敲除sTim-3基因的小鼠中肿瘤细胞的迁移能力明显增强[10]。sLAG-3具有免疫调节功能,可用于胃癌患者疗效评价指标。本研究结果还发现治疗后观察组CD3+、CD4+高于对照组。PD1属于抑制型系统因子,当肿瘤细胞被免疫细胞毒杀时,其可通过免疫细胞表面PD1受体产生抑制型信号,避免肿瘤细胞被识别和毒杀,信迪利单抗则能阻断PD1/PDL1通路,抑制其下游信号的激活,从而解除这种免疫抑制[11]。另外,信迪利单抗作为人源免疫蛋白具有抑制免疫系统负向调节机制,促进淋巴细胞产生,从而上调免疫细胞的应答,减轻肿瘤细胞对免疫微环境的破坏,提高癌症患者细胞免疫。因此信迪利单抗与化疗方案联合后可显著改善提高患者T淋巴细胞水平,改善免疫系统。
综上所述,信迪利单抗联合化疗可显著降低肿瘤标志物水平,对于提高晚期胃癌患者生存率延缓肿瘤进展有利。

