基于16S rDNA测序探析早发性卵巢功能不全肾虚肝郁证患者肠道菌群的特征
黄旭春,陆岩,曹晓静,宋雷,成芳平,王小云
1. 广州中医药大学第二附属医院,广东 广州 510180;2. 广州中医药大学,广东 广州 510405
早发性卵巢功能不全(POI)是女性在40 岁之前出现卵巢功能衰退的临床综合征,以停经或月经稀发、伴有高促性腺激素和低雌激素为特征。POI 有发病率逐年升高并向低龄化发展的态势,多伴生育能力低下甚至不孕,并可增加骨质疏松和心血管疾病的患病风险,可导致患者产生负面心理等,严重影响其身心健康[1]。现代医学多采用激素替代疗法治疗POI。有研究表明,肠道菌群失衡与衰老关系密切。肠道菌群与线粒体之间存在对话,而线粒体可引起颗粒细胞凋亡、自嗜,使卵泡闭锁,导致卵巢功能提前衰退[2]。目前对肠道菌群与POI 相关性的研究尚处于初探阶段,小样本量研究显示,POI 的发生可能与肠道菌群紊乱有关[3]。中药可通过抑制氧化损伤改善卵泡和颗粒细胞的功能状态[4]。本研究通过16S rDNA高通量测序探析肾虚肝郁型POI 患者的肠道菌群特征,为中医药辨证治疗POI 提供循证依据。
1 资料与方法
1.1 研究对象选取2020 年1 月—2021 年12 月就诊于广州中医药大学第二附属医院的60 例POI 患者,设为POI 组,同时招募健康志愿者30 例,设为健康对照组。本研究方案经广州中医药大学第二附属医院医学伦理委员会批准(审批号BF2019-118-01)。
1.2 诊断标准参考《早发性卵巢功能不全中西医结合诊疗指南》[1]制定。年龄<40 岁;出现月经周期延长、周期不规律,经量减少、月经稀发,闭经至少4 个月;至少2 次血清促卵泡生成素(FSH)>25 U/L(在月经周期的第2~4 天,或闭经时检测,2 次检测间隔4 周);血清抗苗勒激素(AMH)≤7.85 pmol/L(即1.1 ng/mL);亚临床期POI:FSH 水平在15~25 U/L。
1.3 辨证标准参考《妇科常见病中医诊疗指南》[5]辨为肾虚肝郁证。主症:月经周期延后,腰膝酸软,烦躁易怒;次症:月经量少、色暗、夹血块或闭经,烘热汗出,精神抑郁,胸闷叹息;舌脉象:舌质偏暗、苔薄黄或薄白,脉弦细、尺脉无力。主症必备,含次症2 项以上,参照舌脉象即可确诊。
1.4 纳入标准①POI 组纳入标准:符合诊断及辨证标准;年龄20~40 岁;闭经时间<6 个月;FSH<40 U/L;18<体质量指数(BMI)<24;签署知情同意书。②健康对照组纳入标准:年龄20~40 岁;月经规律者;基础性激素在正常范围;18<BMI<24;身体健康,无内、外科重大疾病;签署知情同意书。
1.5 排除标准合并其他内分泌失调疾病,如高泌乳素血症、甲状腺功能亢进症等;妊娠期或哺乳期妇女;参与研究前3 个月内使用过激素、选择性雌激素受体调节剂、芳香化酶抑制剂、大豆提取物或中药等治疗;有习惯性使用抗生素史或参与研究前1 个月内有使用抗生素、益生菌、益生元、微生态活菌制剂;参与研究前1 个月内使用泻药或其他影响胃肠功能的药物;严重肝、肾、心、脑疾病患者;恶性肿瘤患者;重度精神障碍性疾病患者。
2 研究方法
2.1 标本采集时间与方法①性激素[FSH、促黄体生成素(LH)、雌激素(E2)]。抽血时间:月经来潮第2~4 天(卵泡早期);若无月经来潮,妇科B 超检查显示子宫内膜(EN)厚度<6 mm,则提示卵泡早期;若EN 厚度≥6 mm,则建议等待月经来潮或黄体酮撤退性出血后第2~4 天抽血。②肠道菌群。收集粪便时间同性激素检查抽血时间。留取患者自然排出的当日初次新鲜粪便标本,取3 g 左右样本分装于收集管中,在留取标本20 min 内将其放置于-80 ℃冰箱进行超低温冻存。委托深圳华大基因股份有限公司进行后续DNA 提取,采用16S rDNA 高通量测序分析工作。
2.2 样本DNA 提取和16S rDNA 测序使用MagPure 粪便DNA KF 试剂盒B(Magen,中国)提取微生物群落DNA。使用Qubit dsDNA BR 检测试剂盒(Invitrogen,美国),用量子比特荧光计对DNA 进行定量,并在1%琼脂糖凝胶上定量检测其质量。采用简易实时荧光定量(PCR)引物515F515F(5'-GTGC CAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHV GGGTWTCTAAT-3')扩增细菌16S rRNA 基因的文库配置可变区V4。正向和反向引物均用Illumina 适配器、pad 和连接子序列进行标记。PCR 体系构建:取30 ng DNA 样品及引物(V3V4 区引物 338F:ACTCCTACGGGAGGCAGCAG;806R:GGACTACHV GGGTWTCTAAT)配置PCR 反应体系。设置PCR 反应参数进行PCR 扩增。PCR 反应体系(30 μL):98 ℃(1 min),98 ℃(10 s),50 ℃(30 s)—30 cycles;72 ℃(60 s),72 ℃(10 min)。PCR 产物用Agcurt AMPure XP 纯化,洗脱缓冲液洗脱。文库经过了安捷伦科技2100 生物分析仪的鉴定。验证后的文库在伊利HiSeq 2500 平台(BGI,深圳)上按照标准管道进行测序,生成2×250 bp 的对端reads。
2.3 统计学方法采用SPSS26.0 统计学软件进行数据分析。计量资料服从正态分布以均数±标准差()表示,偏态分布数据采用中位数(四分位数)[M(P25,P75)]描述;计数资料以百分比(%)表示。计量资料若服从正态性,组间比较用独立样本t检验,组内比较用配对样本t检验;若非正态性,组间比较用Mann-WhitneyU检验,组内比较用Wilcoxon 符号秩和检验。计数资料比较用χ2检验或Fisher 确切概率法。检验水平α=0.05。利用Mothur 软件(version:1.31.2)进行Alpha 多样性分析(Chao1 物种丰富度统计,Shannon,Simpson 等物种多样性统计)和使用QIIME中的beta_diversity.py 工具计算Beta 多样性指数,采用R(v3.1.1)的VennDiagram 包进行韦恩图分析,采用R(v3.4.1)进行物种组成分析。
3 研究结果
3.1 一般资料见表1。POI 组与健康对照组在年龄、身高、体质量、BMI、婚姻、E2水平方面差异无统计学意义(P>0.05),在初潮年龄、孕次、产次及FSH、LH、AMH 水平方面差异均有统计学意义(P<0.05)。
表1 POI 组与健康对照组一般资料比较[M(P25,P75)或()或例(%)]

表1 POI 组与健康对照组一般资料比较[M(P25,P75)或()或例(%)]
?
3.2 肠道菌群
3.2.1 样本数量见图1。共纳入合格粪便样本90 份,其中健康对照组30 份,POI 组60 份。随着样本量的增加,物种丰度曲线曲度无显著变化,曲线趋于平缓,表明本试验样本数量已满足检出大部分物种的条件,抽样充分,可进行数据分析。

图1 物种累积曲线图
3.2.2 组成分析见图2。分别绘制门和属分类水平的群落柱形图,以获得组间不同样本肠道菌群的组成结构。在门水平上主要有古菌门、变形菌门、拟杆菌门、厚壁菌门、放线菌门等,其中拟杆菌门、厚壁菌门是主要优势菌。此外,2 组样本在门水平组成上也有差异,相对于健康对照组,POI 组拟杆菌门等相对丰度升高,厚壁菌门、放线菌门等相对丰度降低。在属水平上主要有梭状芽胞杆菌属XIVa、副萨特氏属、罗氏菌属、粪杆菌属、巨型单胞菌属、拟杆菌属、普雷沃菌属、芽孢杆菌属、毛螺旋菌属等,其中粪杆菌属、拟杆菌属、普雷沃菌属、梭状芽胞杆菌属XIVa、巨型单胞菌属是主要优势菌。相对于健康对照组,POI 组普雷沃菌属、拟杆菌属和梭状芽胞杆菌属XIVa 等相对丰度升高,粪杆菌属等相对丰度降低。

图2 物种组成柱形图
3.2.3 物种韦恩图分析见图3。POI 组OTU 数为945,健康对照组OTU 数为778,两者取交集共有的OTU 数为717(在POI 组中占比75.87%,在健康对照组中占比92.16%)。说明2 组大部分肠道菌群种类相似。结合图2,可以确定种类相似者构成比例的上调与下调也有一定差别,或可将此作为POI 组区别于健康对照组的特征性菌群,为进一步寻找和发现菌群标志物提供依据。
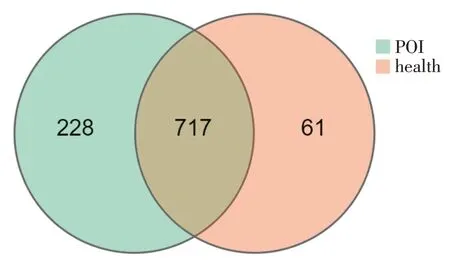
图3 OTU 韦恩图
3.2.4 Alpha 多样性分析见图4。POI 组OTU 数目的中位值、ACE 指数和Chao 指数的中位值、Shannon 指数的中位值均低于健康对照组,即在群落丰富度上POI 组差于健康对照组,但差异无统计学意义(P>0.05)。POI 组Coverage 指数和Sinmpson 指数均高于健康对照组,即其物种覆盖度和多样性多于健康对照组,其中物种覆盖度的差异有统计学意义(P<0.05),在物种多样性上差异无统计学意义(P>0.05)。

图4 Alpha 多样性箱线图
3.2.5 Beta 多样性分析见图5。如图5(a)所示,每一个独立的点代表一个样本,蓝色圆点代表POI患者,橘色三角形代表健康人,两个点的距离越远表示两者的群落构成差异越大。通过比对POI 组与健康对照组的主坐标分析(PCoA)可以发现,2 组样本之间部分空间距离相对集中,说明组内部分个体间差异偏小,且组间样本有部分重叠,但仍可以看出2 组之间存在一定的离散趋势。图5(b)提示,POI组与健康对照组肠道菌群构成有一定的差异,与前文的Alpha 多样性和物种韦恩图分析结果一致。
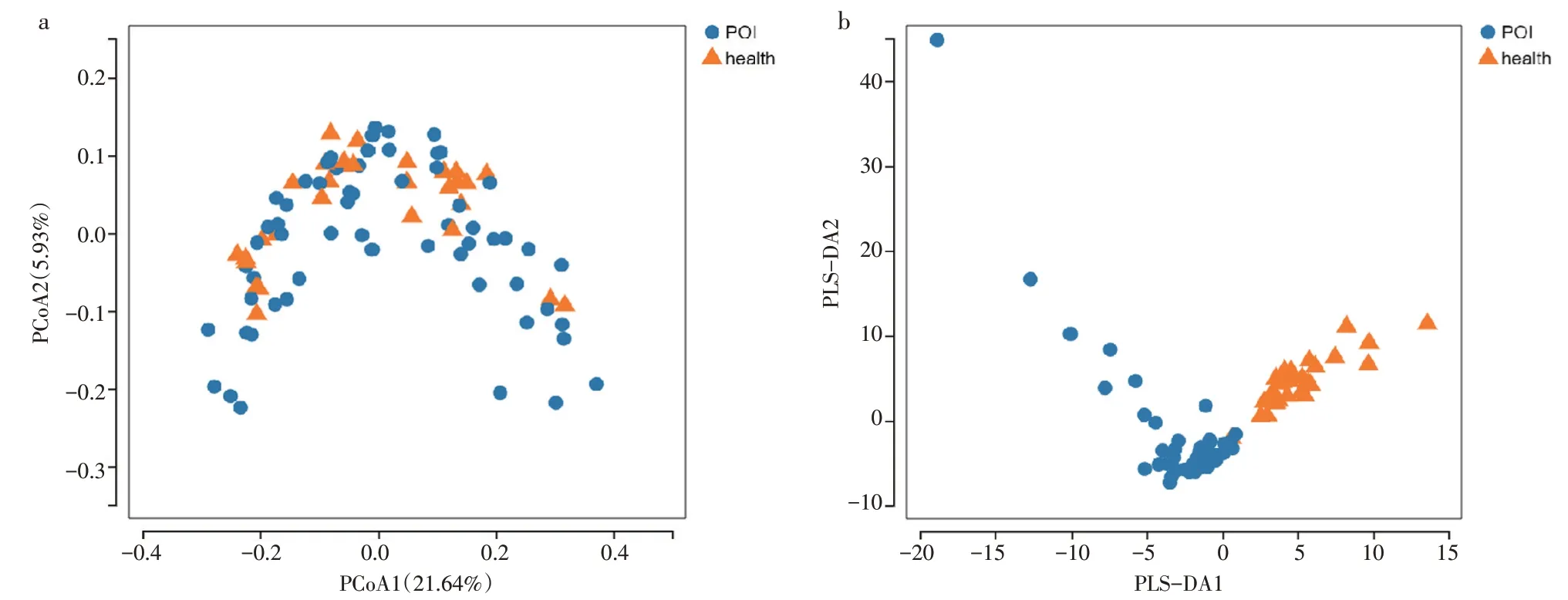
图5 PCoA 及偏最小二乘回归分析法(PLS-DA)图
3.2.6 物种差异分析见图6。图6(a)不同颜色节点表示对应组别中显著富集,且与另一组间差异存在显著影响的微生物类群。图6(b)的LEfSe 柱状图统计了2 组有显著作用的微生物类群通过线性判别分析(LDA)后获得的LDA 分值,LDA 分值越大,代表物种丰度对差异效果影响越大,绿色代表POI 组富集的物种,红色代表健康对照组富集的物种。从2 组的LEfSe 柱形图可以看出,分类单元在健康对照组丰度较高的显著性差异物种从门到属水平分别是:厚壁菌门、放线菌门、放线菌纲、大肠杆菌目、大肠杆菌科、毛螺菌科、放线菌属、梭状芽孢杆菌属、毛螺菌属、梭菌属、布劳特氏菌属、普雷沃氏菌属、拟普雷沃氏菌属、脱硫弧菌属、柯林斯氏菌属、丁酸球菌属、多尔氏菌属。分类单元在POI组丰度较高的肠道菌群显著性差异物种从门到属水平分别是:古菌门、甲烷杆菌目、莫拉菌科、甲烷杆菌科、类芽孢杆菌科、不动杆菌属、古菌属、短杆菌属、甲烷杆菌属。

图6 POI 组与健康对照组物种差异分析
4 讨论
肠道菌群是人体胃肠道内的一群规模宏大、种类纷繁复杂的微生物群落。肠道菌群寄生在胃肠道表面,大多数不具有致病性,可以与肠上皮细胞共生。基因组测序技术和生物信息学的发展阐释了其对健康的影响,以及微生物与宿主的相互作用关系。正常的肠道微生物群在宿主营养代谢、外源物质和药物代谢、维持肠道黏膜屏障结构完整性、免疫调节和抵抗病原体方面具有特定的功能。人类肠道菌群主要包括厚壁菌门、拟杆菌门、变形菌门和放线菌门4 个门类,其中拟杆菌门和厚壁菌门是最主要的门。拟杆菌门和厚壁菌门的丰度与脂肪沉积密切相关,厚壁菌门具有促进碳水化合物和蛋白质消化、吸收以保障人体营养供应的功能,拟杆菌门具有促进多糖分解以提高机体免疫的功能。在能量的转化和存储过程中,拟杆菌门和厚壁菌门可以协同作用,共同促进卵巢和子宫发育[6]。
一项关于POI 与肠道菌群的研究结果提示,相比于健康人群,POI 患者拟杆菌门丰度升高,厚壁菌门丰度降低[7]。本研究结果显示,与健康对照组比较,在门水平上POI 组拟杆菌门等相对丰度升高,厚壁菌门、放线菌门等相对丰度降低。说明肠道菌群的比例失调可能引起机体内环境紊乱,诱导疾病发生。本研究结果显示,在属水平上POI 组普雷沃氏菌属、拟杆菌属和梭状芽胞杆菌属XIVa 等相对丰度升高,粪杆菌属等相对丰度降低。隶属于拟杆菌门的普雷沃氏菌属具有促进蛋白质与碳水化合物分解的作用,通常与慢性炎症的发生、发展相关。有研究发现,普雷沃氏菌属丰度的升高与辅助性T 细胞17(Th17)介导的黏膜炎症有正相关性[8]。另有研究表明,P13K/Akt 信号通路通过改变经心内膜人间充质干细胞(hMSC)移植后卵巢早衰(POF)小鼠Th17/Tc17 和Th17/Treg 细胞的比例,参与了卵巢功能的修复[9]。隶属于拟杆菌门的拟杆菌属具有促进多糖和蛋白质水解的作用。拟杆菌属包含多种可能促进炎症及代谢性疾病相关的条件致病菌[10]。厚壁菌门的梭状芽胞杆菌属多为腐物寄生菌,少数为致病菌,能分泌外毒素和侵袭性酶类,诱发疾病。有研究表明,梭状芽孢杆菌属与结直肠癌的发病、肿瘤侵袭及转移有相关性[11]。粪杆菌属可在人体肠道中产生乙酸、丁酸、琥珀酸等短链脂肪酸(SCFAs)等[3,12]。SCFAs不仅具有抗炎和免疫调节特性,还可以影响心理功能和认知过程[11]。本研究结果提示,相较于健康人群,POI 患者体内促进炎症反应的相关菌群丰度上调,具有抗炎作用的有益菌菌群丰度下调,提示肠道菌群失调引起的炎症反应和免疫功能失衡可能是POI 的发病机制之一。
有研究发现,特定中医证型状态下的POI 患者肠道菌群相较于健康对照组可发生显著改变,紊乱的肠道菌群伴随着患者代谢状态改变[13]。提示肠道菌群紊乱可以反映特定中医证型的整体代谢改变。本研究仅对POI 肾虚肝郁证患者进行肠道菌群特征的探讨,后续将开展多种证型POI 之间的临床研究,结合宏基因组学和代谢组学等技术进一步探究POI菌群变化的机制,为中医药治疗POI 可能的作用机制提供高级别循证依据。

