常见植物蛋白的分类组成和性质研究概述
董 阳,李晓敏,史玉东,季国志
(内蒙古蒙牛乳业(集团)股份有限公司,内蒙古 呼和浩特 011500)
0 引言
由于低碳减排和食物多样化需求的增加,植物蛋白的研究和利用在国内外已经掀起了风潮。植物蛋白的分类和命名来源于研究者的主观意愿,体现了研究者认识和区分蛋白质的过程。随着研究技术的不断进步,人们研究植物蛋白采用的工具和研究的角度也在不断变化,逐渐出现了不同的分类方法。由于对蛋白组分分离手段的不同,植物蛋白的分类有了不同的标准。先后出现过依据蛋白质溶解性质分类的Osbern 方法、依据分子量分类的沉降系数分类方法,以及依据蛋白质分子组成结构分类的免疫学分类方法。但不同分类和命名下的植物蛋白互有交集,层次混乱,同种蛋白有着不同的叫法。这导致了不同来源、称谓的蛋白之间存在交集,不便进行研究结果的引申和平行对比。对植物蛋白分类和命名的过程,也体现了蛋白质的不同性质,这些性质对植物蛋白的应用效果有着非常重要的影响。
1 植物蛋白的应用前景
2021 年,我国正式宣布将力争于2030 年前实现碳达峰、2060 年前实现碳中和[1]。这一目标的提出从侧面说明了资源的日渐紧张和碳排放的亟待治理,然而全球人口对优质蛋白质的需求量仍在不断攀升。在生产过程中,相同质量的植物蛋白相较于动物蛋白可以节省大量水资源、土地资源和能源,同时碳排放也更少。
出于对节能减排和动物福利的需求,越来越多的人开始选用植物基食品和植物蛋白作为动物蛋白的替代和增补。植物中大部分的蛋白质存在于种子中,植物蛋白的种类众多且资源丰厚。植物种子含有丰富的营养物质和活性成分,是不可或缺的食物来源,其中含有丰富且优质的宏量营养素,是提取蛋白质、油脂和淀粉的一大原料。以大豆为例,大豆中的蛋白质不单含量充足,且氨基酸组成也很理想,有着较高的经消化率修正的氨基酸评分(PDCAAS)和可消化的必需氨基酸评分(DIAAS),可满足成人对必需氨基酸的需求[2-3]。此外,植物种子中还有丰富的碳水化合物、膳食纤维及优质的脂肪,维生素和矿物质的种类也很完善。因而,植物是一种很好的营养来源,植物蛋白食品的开发利用有着广阔的前景。
常见植物蛋白原料的宏量营养素含量[4]见表1。
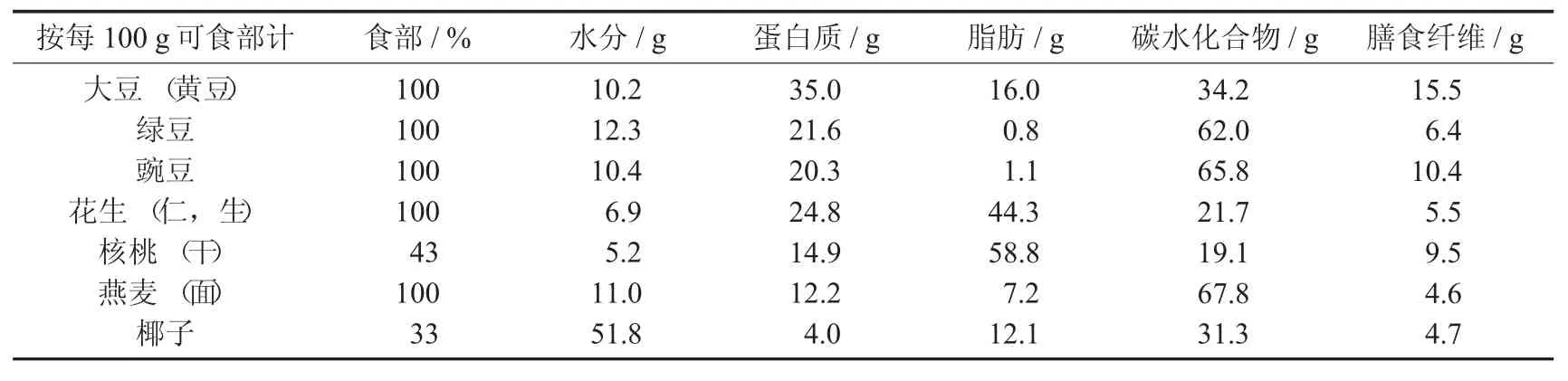
表1 常见植物蛋白原料的宏量营养素含量
2 植物蛋白的分类方法
对植物蛋白质组分进行划分是一个人为过程,显现出不同分离提取技术的特点和分类者的主观想法。将植物蛋白的种类进行细分时,出现过很多不同的蛋白质命名方式和分类标准。
2.1 Osbern 分类法
Osbern 最早提出的蛋白质分类方法一直沿用至今。20 世纪20 年代,依据蛋白质的溶解度,研究了几种植物的蛋白质组分提取方法,把蛋白质分为清蛋白、球蛋白、醇溶蛋白和谷蛋白[5]。这4 种蛋白质的溶解性质和强弱不同,分别可溶于水、盐溶液、乙醇和稀酸稀碱。其中,溶解性最强的是清蛋白,在以上4 类溶剂中均可轻易溶解,其他3 种蛋白质的溶解性依次下降,谷蛋白仅能在酸或碱溶液中溶解。Osbern 分类方法出现早、研究范围广,现在仍旧广泛应用于各类植物蛋白的分级分离。
在工业生产中,Osbern 分离蛋白质的原理也用来对蛋白原料进行分级分离。在提取过程中,运用蛋白质各组分在不同溶剂中溶解性的差别,让总蛋白质依次在水、盐溶液、乙醇溶液及酸或碱溶液4 类溶剂中充分溶解、分离和回收,最终将4 种蛋白按照顺序单独分离出来。
Osbern 分级分离植物蛋白流程见图1。
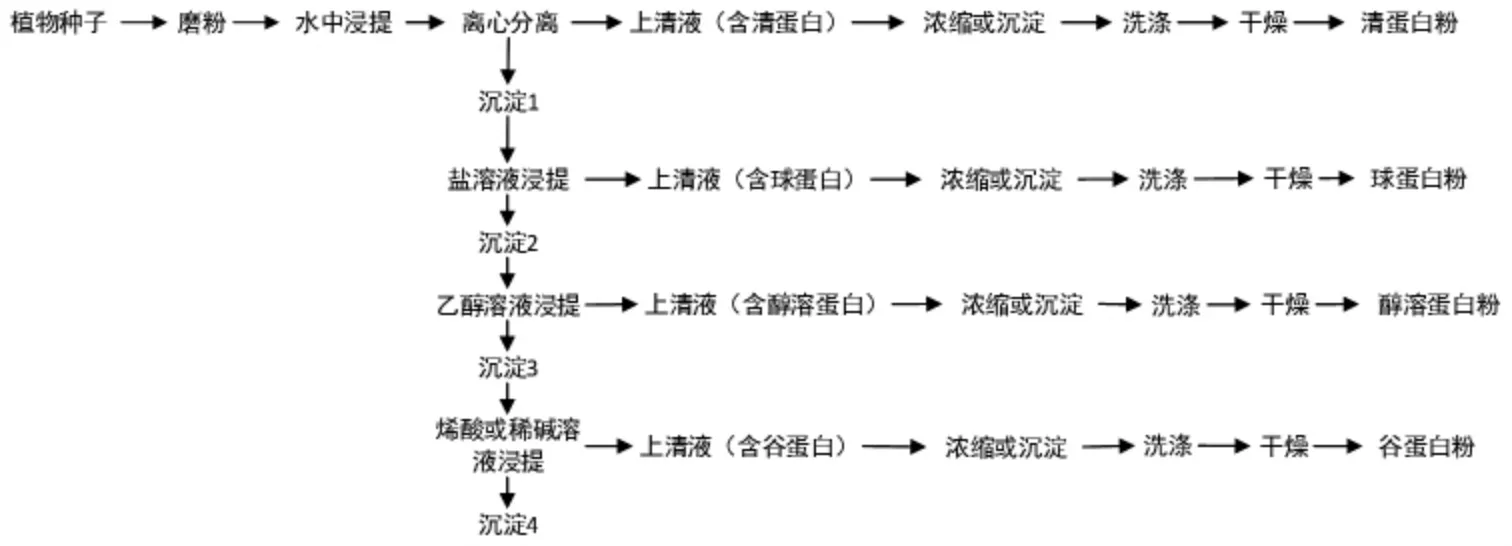
图1 Osbern 分级分离植物蛋白流程
孙媛[6]在利用Osbern 方法分离麦麸蛋白的过程中,在原有提取步骤前增加了碱溶步骤,来减少由麦麸中纤维过多造成的固液分离难的问题,从而提高了蛋白质的提取率。
2.2 按沉降系数分类
随着超速离心技术的研究,20 世纪50 年代出现了新的分别植物蛋白的办法。一批研究者开始通过离心分离,把大豆蛋白分离为2S,7S,11S,15S 组分[7]。S 代表大豆蛋白的沉降系数,即每单位离心力场的沉降速度,单位为Svedberg unit,1S=10~13 s。
沉降系数分类方法利用超速离心机提供的强离心力,根据不同大分子沉降速度的不同将蛋白质分离开。蛋白质的沉降速度受到分子量、密度和形状的影响,在一定的离心条件下,不同的蛋白组分会以不同的速度沉降,从而形成不同的区带[8]。这种分类方法体现了大豆蛋白分子的大小。在现今的研究中,直接采用该办法对植物蛋白进行分离的比较少,多数与其他分离分析方法(如等电点沉淀法、凝胶电泳法、反胶束法等技术[9-10]),共同使用。尤其在大豆蛋白成分的研究中,主要作为一种通俗叫法沿用至今,如大豆11S 组分中的球蛋白组成单一,就将这种球蛋白命名为11S 球蛋白(又称大豆球蛋白);而7S 组分中含有几种球蛋白,则统称为7S 球蛋白,但又可细分为β -伴大豆球蛋白、γ -伴大豆球蛋白和碱性7S 球蛋白[11]。在离子强度变化到一定水平时,大豆蛋白不同的组分之间存在解离或聚合的作用,如11S 组分可以解离成2S,在一定条件下也可能聚集成15S[12]。
植物蛋白产品中的蛋白质组分也受限于生产提取的方法。大豆分离蛋白的组分中占比最高的是7S和11S 组分。这是因为大豆分离蛋白在生产中,常利用等电点沉降的原理,造成2S 组分在提取过程中溶于水中难以回收,而15S 组分残留于豆渣中难以溶出[13]。β -伴大豆球蛋白是7S 组分的主要成分,11S 组分中又以大豆球蛋白为主[14],所以很多对大豆蛋白性质的研究中,首先以大豆分离蛋白为原料,对7S 和11S 这2 个组分进行粗分离及研究,同时依旧按照7S 和11S 蛋白对这2 种组分进行称呼。
2.3 按蛋白质结构层面分类
电泳、色谱等技术的出现和免疫学的发展给植物蛋白各组分的研究提供了新工具。许多研究者利用电泳方法或从免疫学角度对植物蛋白组分进行了重新分析,进一步对植物蛋白的分子量和亚基结构有了认识和了解。姜振峰等人[11]和M.Teraishi 等人[14]分别通过电泳和扫描图谱,研究了7S 球蛋白组分的组成。曲家妮等人[15]通过SDS -聚丙烯酰胺凝胶电泳,对盐溶盐析法粗分离出的混合大豆球蛋白组分进一步进行分离研究,从蛋白亚基的层面进行了亚基组成和蛋白性质之间的对比。齐宝坤等人[16]利用SDS-聚丙烯酰胺凝胶电泳,结合圆二色谱法,对大豆分离蛋白的亚基组成和二级结构进行了分析,并研究了蛋白分子中的基团组成的差异对表面疏水性的影响。
这类研究方法分离能力强大、检测灵敏,为研究和改善蛋白质分子结构提供了可能性。张悦[17]采用SDS-PAGE 聚丙烯酰胺凝胶电泳结合考马斯亮蓝染色法,可快速准确地区分出乳蛋白和大豆蛋白。王梦莉[18]利用SDS-PAGE、酶联免疫和免疫印迹3 种方法,对加工过程中大豆蛋白中致敏原的抗原性变化进行了研究。巨倩[19]用凝胶色谱纯化了分离出的大豆分离蛋白,并研究了不同7S/11S 组分的结构和性质。免疫学方法在植物蛋白研究中的应用,还为蛋白来源鉴定、过敏原的检测和消除、蛋白质结构的改性研究奠定了基础,更拓宽了植物蛋白的发展和应用前景。
分子研究手段(如凝胶电泳、色谱光谱、免疫印迹法和酶联免疫吸附剂测定(ELISA)等方法),促进了植物蛋白质从结构层面的研究和分类,使蛋白质性质机理的研究更加精准和微观,也体现了技术发展对蛋白质分类的影响和帮助。
3 几种常见植物的蛋白质组成和性质
了解蛋白质的组成有助于进行蛋白质性质的深入研究。蛋白不同的结构和基本性质会导致其加工性质的差异,同时受到浓度、温度、离子强度、酶等环境因素影响[20]。植物蛋白的加工性质一般有溶解性、持水性、持油性、起泡性及起泡稳定性、乳化性和乳化稳定性等。蛋白质的这些性质与其组成结构有关,影响着植物蛋白加工产品的性状。
3.1 大豆蛋白
大豆蛋白的组成见表2。
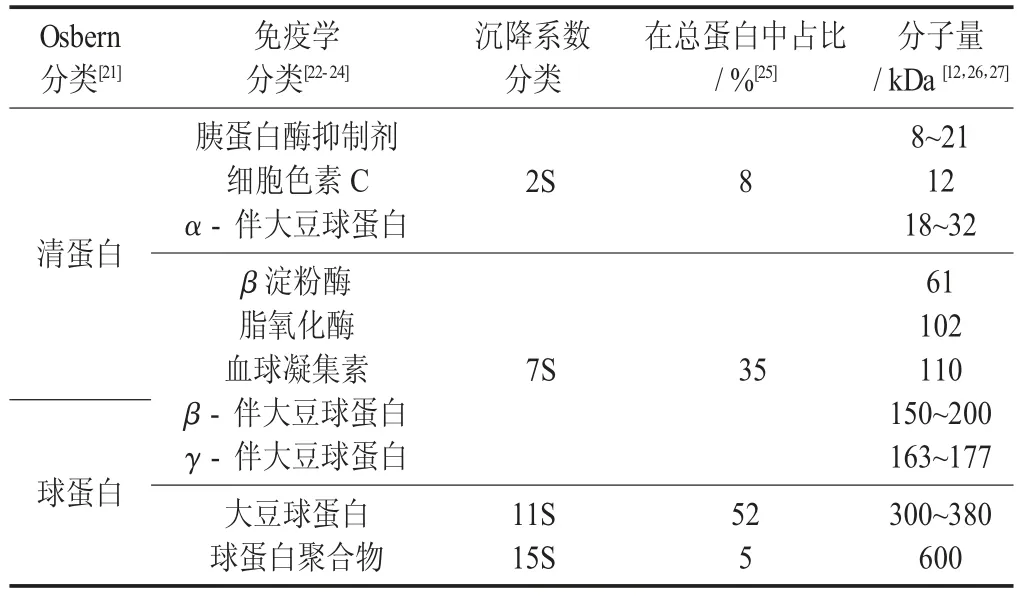
表2 大豆蛋白的组成
按照Osbern 分类,大豆蛋白各组分中占比最高的是球蛋白,约30%;其次是清蛋白,约8%;占比较少的是醇溶蛋白和谷蛋白,分别占到约2%和6%[21]。由于大豆分离蛋白采用碱溶酸沉浸出蛋白的提取方法。因此,7S 和11S 组分在大豆分离蛋白中占绝大部分。
2S 组分的清蛋白由α -螺旋和无规卷曲构成,结构松散、平均疏水度低,造成了其易溶于水的特点;组成11S 组分的主要部分是大豆球蛋白,也称11S 球蛋白,存在形式是含疏水缔合的二硫化物对的六聚体非糖蛋白,包含酸性(35~37 kDa)和碱性(20 kDa)亚基[22];组成7S 组分的蛋白质主要是β -伴大豆球蛋白,由疏水相互作用将α(57 kDa),α'(58 kDa)和β(42 kDa)3 种亚基以三聚体共轭型糖蛋白的形式结合,包括7S β -伴球蛋白和7S 碱性球蛋白两种蛋白[23-24]。大豆球蛋白和β -伴大豆球蛋白各占大豆蛋白总量的40%和28%左右[25-29]。
蛋白质的结构影响其加工性质。比如,蛋白质凝胶的组成可看作是依靠蛋白质相互作用建立的三维分子结构网络[30]。大豆蛋白凝胶的形成和稳定,与静电作用力、疏水相互作用及静电斥力有关[30]。蛋白质各基团造成的表面疏水性,可通过分子间作用力来影响蛋白质的凝胶性、乳化性、溶解性等功能特性[31];而凝胶性又影响着大豆蛋白产品的质构,与食品的口感和风味有关[32]。11S/7S 组分比值对大豆蛋白质的性质有很大影响。王丽侠等人[33]测量了大量大豆种子样本中11S 和7S 的相对含量及其比值,得到的比值约为1.9,产自不同生态区的大豆之间存在显著性差异。尽管2 种组分的蛋白质凝胶形成机制相同,但在大豆分离蛋白中,7S 和11S 组分的亚基组成不同,因此在形成凝胶时的作用力和聚集方式是不同的。Shigeru Utsumi 等人[34-35]研究发现,静电作用力和二硫键是11S 球蛋白形成凝胶的主要作用力,而7S 组分凝胶则依靠疏水作用和氢键形成。这就造成了7S 和11S 这2 种凝胶的性质不同,导致不同7S/11S 比例的大豆蛋白,凝胶性质也有所差异。在中性条件下,11S 组分形成的凝胶比7S 组分形成的更有弹性和刚性,是更强的凝胶,而富7S 组分的凝胶则具有更高的持水力[31]。
部分植物蛋白存在致敏性。大豆中存在五大类致敏原蛋白,分别为β -伴大豆球蛋白(Gly m5)、大豆球蛋白(Gly m6)、胰蛋白酶抑制剂(Gly m TI)、Gly m Bd 30K 和Gly m Bd 28K。其中,大豆球蛋白和β -伴大豆球蛋白是大豆种子贮藏蛋白的主要组成成分,在大豆蛋白中含量最为丰富且免疫原性最强,是引起幼龄动物出现过敏反应的主要因素[33]。目前,通过育种方法可得到致敏原基因缺失的大豆品种,或通过某些加工步骤破坏部分过敏原,减少过敏反应[34]。
3.2 豌豆蛋白
豌豆蛋白的组成[35-37]见表3。
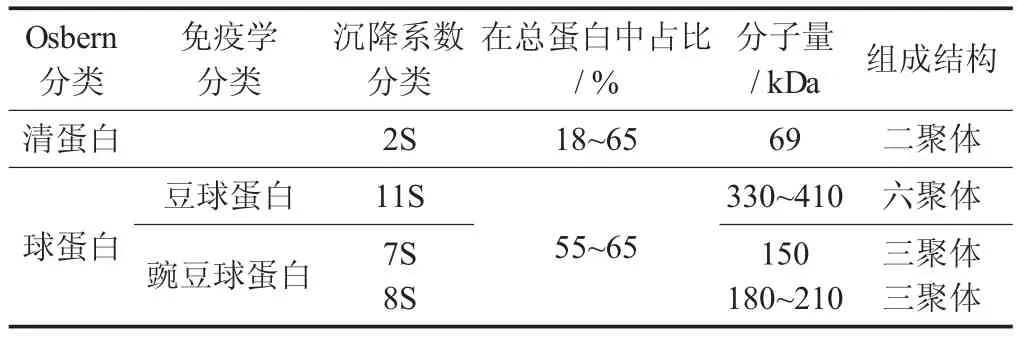
表3 豌豆蛋白的组成
豌豆中平均含有20%~25%的蛋白质,其中贮藏蛋白占60%~66%,等电点为pH 值4.0~5.0[38]。豌豆蛋白中占比最高的是球蛋白和清蛋白,二者占到90%以上,醇溶蛋白仅占比4%~5%,谷蛋白仅占3%~4%[35]。豌豆分离蛋白中最主要的组分是7S 和11S 这2 种组分,因此其组成、分子结构、电荷分布决定了豌豆分离蛋白的理化性质[39]。豌豆分离蛋白在中性条件下溶解度可达到70%,其中豌豆球蛋白的溶解性要高于豌豆分离蛋白,同时豌豆蛋白的乳化活性与溶解度呈正相关,由此也可以解释豆球蛋白和豌豆球蛋白的乳化能力比豌豆分离蛋白好[40]。豌豆蛋白的功能性质与大豆分离蛋白相比较,总体上更弱[41]。其中,豌豆分离蛋白的持水性和吸油性更好,但大豆分离蛋白的起泡性、乳化性及黏性要更好[42]。豌豆蛋白具有两亲性,有一定乳化性能,但弱于大豆蛋白,形成的凝胶强度和弹性也不如大豆蛋白[43]。可通过超声波加热等方法改变豌豆蛋白的部分结构,从而提高其溶解性等加工性质[44]。豌豆蛋白粉的氨基酸组成比较均衡,含有较高的赖氨酸,但蛋氨酸等含硫氨基酸较低,需要与其他谷物搭配弥补不足[45]。
相比于其他豆类,豌豆中功能蛋白含量较高,包括酶、酶抑制剂、激素、结构蛋白、输送蛋白和识别蛋白等[46]。豌豆贮藏蛋白主要由清蛋白和球蛋白组成,球蛋白主要由Legumin(11S)和Vicilin(7S)组成,7S 和11S 比例一般在1∶2 左右。豌豆蛋白中Vicilin(7S)由较多的肽段组成,首先是分子量50 kDa左右的肽段,这些肽段之后可聚集成150 kDa 的三聚体。在Vicilin(7S)的基因转录翻译时,此肽段有2 个可切割的位点,由此形成更小的肽段,如分子量为33.0,30.0,19.0,13.5,12.5~16。0 kDa 的亚基。Legumin(11S)则由分子量60 kDa 左右的肽段,通过二硫键构成分子量38~40 kDa 的酸性亚基和19~22 kDa 的碱性亚基,最终形成六聚体的形式。豌豆11S 中半胱氨酸的含量比7S 高很多,因此11S中含有二硫键而7S 中没有[47-48]。
提取豌豆蛋白常用碱溶酸沉和超滤膜技术,在最佳工艺条件下,碱溶酸沉可使分离率达到80%~94%。使用超滤技术分离豌豆蛋白,提取过程比用等电沉淀法更温和,因此制备的蛋白质得率更高,且蛋白质活性更好[49]。
豌豆蛋白曾被认为是很少引起过敏反应的蛋白质,但目前已经在豌豆蛋白中检出一些常见的过敏原,因此豌豆蛋白的免疫反应也需要得到重视[50]。
3.3 绿豆蛋白
绿豆蛋白的组成[51-54]见表4。
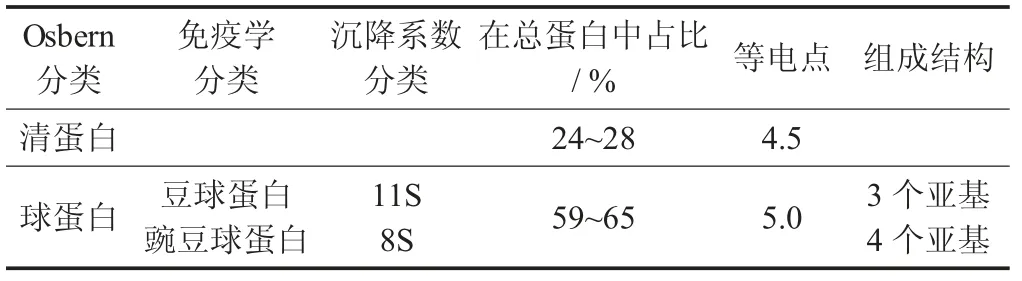
表4 绿豆蛋白的组成
绿豆种子蛋白质以球蛋白为主,其次是清蛋白,这2 种蛋白质是绿豆的主要贮藏蛋白,约占总蛋白的90%,谷蛋白占10%,醇溶蛋白占比最小,少于10%[52]。对16 种绿豆进行氨基酸组成分析,发现绿豆中含有丰富的赖氨酸,而限制氨基酸有蛋氨酸、半胱氨酸和苏氨酸,作为第一限制氨基酸的蛋氨酸加半胱氨酸,其化学评分为72%,其余的必需氨基酸评分都超过推荐值[53],这可通过其他膳食进行互补,以提高氨基酸利用率。绿豆的溶解性、氮溶指数(NSI 值)平均为79%,保水性平均为2.3 g/g,乳化性大多在50%~55%,乳化稳定性的差异较大,分布在40%~95%。大多品种绿豆的起泡性和泡沫稳定性都很好,起泡性分布在114%~269%,泡沫稳定性分布在92%~207%。吸油性平均为2.6 mL/g,但绿豆蛋白的凝胶性较弱,凝胶性质一般,形成条件比较受限[53]。
绿豆中按溶解度分类的4 种蛋白组分功能性质差异较大。其中清蛋白溶解性和起泡性最好。且受pH 值影响最小,其余3 种蛋白的等电点在pH 值5左右;谷蛋白的持水与持油能力最好,并且泡沫稳定性最好,但起泡性弱;醇溶蛋白的持水性和持油性弱[51]。清蛋白由于含有高磷酸基团和其他极性基团,可以增强蛋白质的水合作用,因此有较好的溶解性。绿豆分离蛋白和清蛋白的持水力在溶液质量分数为7%或更高时,可达到2.6 mg/L[54];而蒸煮等热处理方式,可提高绿豆蛋白的加工性质[55]。
绿豆分离蛋白的提取方法主要有碱溶酸沉法和热浸提法,按照一般的碱提酸沉法的工艺,提取绿豆分离蛋白,蛋白提取率最高可达22%。对提取条件进行优化后,提取效率可提高至73.25%[56]。用热水浸提法提取绿豆蛋白,蛋白质含量可达800 μg/mL,说明在工艺上是可行的。热水浸提法可减轻酸碱度对蛋白生物活性的影响,但存在耗时长、蛋白提取率低的问题,而且加热条件也会导致蛋白变性[57]。
3.4 燕麦蛋白
燕麦蛋白的组成[58-62]见表5。
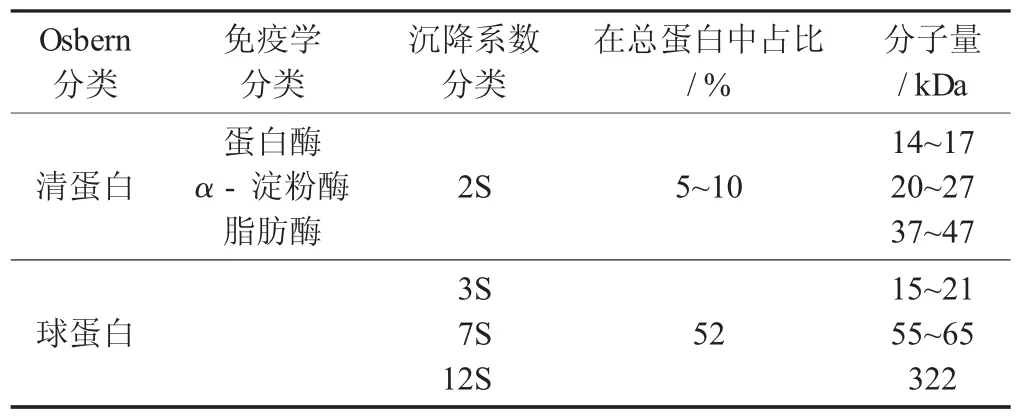
表5 燕麦蛋白的组成
燕麦球蛋白中含量最高的成分是12S 球蛋白,其结构与大豆11S 球蛋白类似,是6 个酸性多肽和6 个碱性多肽组成的,酸性多肽和碱性多肽之间通过二硫键连接,形成一个亚基,亚基之间再通过非共价键连接进而形成六聚体[62]。燕麦蛋白中的醇溶蛋白和谷蛋白含量较少,占比分别为14%和8%[63]。
燕麦蛋白的等电点在pH 值4.0~6.0,在中性条件下,通过不同工艺提取的燕麦蛋白,溶解度介于1.5~3.5 mg/mL;其氨基酸组成中,除赖氨酸以外,其他必需氨基酸的氨基酸评分(AAS)均接近或大于1[64]。燕麦蛋白的溶解度一般,可通过酶解和化学修饰的方法对其改性,来优化其加工特性[65]。
燕麦蛋白的起泡性和泡沫稳定性受pH 值影响较大,等电点处最低,中性条件下起泡性达到80%,泡沫稳定性为50%。乳化性在等电点处最低,乳化稳定性最高,中性条件下乳化性达到0.4~0.5,乳化稳定性为50%~60%[66]。燕麦蛋白在其变性温度以下就可以形成热诱导凝胶,但90 ℃诱导的凝胶的强度与酸奶相近,同时可用酶修饰来改变加热后凝胶的聚合行为,通过增加凝胶中的蛋白质聚集,来提高凝胶的亮度[67]。使用超声处理可暴露燕麦蛋白的疏水性氨基酸,从而促进凝胶的黏弹性和网络结构的形成[68]。
通常燕麦蛋白采用碱提酸沉和酶法进行提取。选取碱提酸沉法提取燕麦蛋白时,最高提取率可达64%,纯度86%,等电点4.2,分离率94.65%;酶法提取时,提取率可达84%,纯度达89%,等电点4.4,分离率93%,与碱提酸沉法相比,酶法提取的燕麦蛋白提取率和纯度都较高[67]。
3.5 核桃蛋白
核桃蛋白的组成[69-70]见表6。

表6 核桃蛋白的组成
核桃中含量最多的蛋白质是谷蛋白和球蛋白,占到蛋白总量的85%以上[71]。按照WHO/FAO 推荐的标准,核桃蛋白的必需氨基酸组成可以满足成人需求,但对于2~5 岁的儿童,赖氨酸是限制性氨基酸[70]。
核桃蛋白中疏水性氨基酸占比高,导致其溶解性较弱,在中性条件下约为10%。在核桃蛋白中,谷蛋白中的疏水性氨基酸占31.59%,高于清蛋白的24.11%和球蛋白的24.40%,而且核桃蛋白的表面疏水性要比燕麦分离蛋白和小麦谷蛋白更高[72]。溶解度较低的谷蛋白在核桃蛋白中含量最多,因此核桃蛋白因为溶解度低而应用受限[70]。可通过对核桃蛋白进行改性,如通过胰蛋白酶和转谷酰胺酶的处理酶解交联后,大幅提高其溶解性[73]。
核桃蛋白常见的提取方法有传统的碱溶酸沉法,也有正处于研究阶段的反胶束法、膜分离法等。采用传统碱提酸沉法、核桃分离蛋白的提取率可达82%[74]。核桃浓缩蛋白由分子质量不等的4 个部分组成,而碱沉酸提过程破坏了氢键和二硫键,导致核桃分离蛋白仅由约106 kDa 的部分组成[75]。反胶束法由于提取条件温和,因此无论是提取效率还是提取出蛋白的结构及加工性质,均好于碱溶酸沉法[76]。针对核桃蛋白的提取工艺,目前研究和应用最成熟的还是碱提酸沉法,可配合辅助超声波或微波技术,辅助工艺可破坏细胞壁,让蛋白质更好地溶出,从而提高蛋白质的提取率[77]。同时,高强度的超声预处理还可改善核桃蛋白的功能性质,有希望用于核桃蛋白质改性[78]。
核桃也是植物坚果类中的主要过敏原之一,核桃蛋白中含有一些结构上类似于2S 清蛋白、7S 豌豆球蛋白及11S 豆球蛋白的成分,这些是核桃的主要致敏成分[79]。
3.6 花生蛋白
花生蛋白的组成[80-82]见表7。
花生是重要的油料作物,并且富含蛋白质,但花生蛋白的加工特性一般,因此应用不太广泛[82]。按照联合国粮农组织(FAO)的标准,花生蛋白中大部分的必需氨基酸都可满足人体需求,除了蛋氨酸含量较少[83]。花生蛋白中含量最高的组分是花生球蛋白和伴花生球蛋白,其中球蛋白的含量最高,类似于大豆11S 球蛋白,但二硫键较少,因此热稳定性和凝胶性较弱[84]。花生蛋白中2S 组分二硫键多,又高度亲水,因此有着更好的耐热性、吸湿性和溶解性[85]。花生分离蛋白在中性条件形成自持凝胶的质量分数条件是达到16%时,盐离子在不同环境下对凝胶的影响不同,酸性条件下,盐离子有助于形成强凝胶,而中性条件下盐离子则不利于凝胶的形成。花生分离蛋白的乳化能力也一般,需要依靠改性处理进行改善[86-87]。由于花生的起泡性、乳化性等特性一般,因此人们采用多种方法对花生蛋白改性处理或开发新工艺来提高其加工性能。采用高强度超声法代替高压均质这一传统生产蛋白乳液的工艺,可更好地改变蛋白暴露的基团,得到乳化性更加稳定的花生蛋白溶液[88]。经过超高压处理的大豆分离蛋白,可明显改变其二级结构,显著提高其凝胶特性[89]。
花生是八大致敏原之一,现已发现的致敏蛋白有16 种,存在于花生清蛋白和球蛋白中[90]。在加工过程中,花生中的致敏蛋白结构会发生不同程度的变化,但还不足以使这些活性蛋白完全脱敏,需要在后续的研究中开发低致敏性花生食品[91]。
3.7 椰子蛋白
近年来,椰子蛋白也成为了产品开发中关注的原料之一。常用的分离方法是基于Osbern 分类方法,免疫学和沉降系数2 种分类方法与Osbern 分类之间的对应较少。椰子蛋白中占比最高的是球蛋白,为62%;其次是清蛋白,为30%,最少的是谷蛋白和醇溶蛋白,占比分别为5%和1%[92-93]。
椰子蛋白氨基酸组成一般,其中的赖氨酸、蛋氨酸和苏氨酸不足,椰子蛋白的等电点约为pH 值4.0,在较强的酸性和碱性条件下溶解度较好,高于大豆蛋白[92]。与大豆分离蛋白相比,椰子分离蛋白的持水性小、吸油性好;中性条件下起泡性约20%,略高于大豆分离蛋白;泡沫稳定性75%,低于大豆分离蛋白[94]。椰子分离蛋白的性质也受加工方式的影响,崔岩岩等人[95]发现,不同的脱脂方式对椰子分离蛋白的结构有着不同影响,进而影响其乳化稳定性等加工性质。
生产中主要采用热凝固法和超滤法来生产椰子蛋白。提取椰子分离蛋白常用碱溶酸沉法。彭吟雪[96]和曾仕林等人[97]在磷酸盐缓冲溶液中利用碱提酸沉原理提取椰子分离蛋白,提取率可达83%,两者的研究结果接近。
4 结语
植物蛋白分类和命名现状的不统一存在很多历史原因,其中体现了研究者逐渐认识和区分蛋白质各类性质的过程。随着研究技术、检测手段的不断进步及应用需求的不断变化,人们对植物蛋白进行研究时采用的工具和研究角度也在不断变化,造成了植物蛋白存在不同的分类体系和方法。但植物蛋白在多种分类和命名下,层次不够清晰,又相互有交集,同一种蛋白在不同的分类体系中有着不同的叫法。同时,由于人们对不同植物的蛋白质应用历史不同,对各种植物蛋白的组成和性质的研究深度也参差不齐,部分植物蛋白的结构和性质仅有初步研究,因此还需要随着后续出现的研究新结果来进行补充。
随着现代生物技术及蛋白质结构鉴定、检测方法的进步,有必要将不同分类和命名的植物蛋白中的具体组分进行定性、定量研究并相互对照,将不同分类标准下的蛋白质名称和性质进行系统梳理,便于更加清晰地了解不同提取、纯化、分离方法,以及对植物蛋白结构、性质、功能的影响,从而更好地指导生产应用。

