uRT-TPS和Monaco-TPS对同一直线加速器在多癌种放射剂量计算方面差异的比较
杨彦举,方应涛,高大地,王佳舟,赵 俊,胡伟刚
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
过去20 年,调强适形放疗(intensit ymodulated radiation therapy,IMRT)已在国内得到广泛应用,相较于传统三维适形放疗(three dimensional conformal radiotherapy,3D-CRT),其在向计划靶区(planning target volume,PTV)输送更高剂量的同时又具有高度的适形性,可保护正常组织免受过高剂量照射[1-3]。获得优秀的放疗计划不仅与物理师的经验有关,直线加速器的性能和治疗计划系统(treatment planning system,TPS)也起着至关重要的作用,因此各厂商除了硬件设备的更新迭代外,也致力于开发出剂量计算准确、优化函数精简和优化时间短的TPS。上海联影医疗科技股份有限公司推出的放疗平台uRT直线加速器及uRT-TPS已开始在国内多家放疗中心运行,其临床表现已得到初步认可。目前复旦大学附属肿瘤医院有多台Infinity直线加速器(瑞典Elekta公司)和uRT直线加速器(上海联影医疗科技股份有限公司),对应分别为Monaco-TPS和uRT-TPS。Monaco-TPS使用基于蒙特卡罗X射线体素(X-ray voxel Monte Carlo,XVMC)算法模拟数百万个粒子在介质中的传送过程,计算并存储每个粒子在体素中吸收剂量的沉积情况,具有极高的计算精度,被证明是较精确的剂量建模方法[4-7]。但当前版本的Monaco-TPS存在运算耗时问题,且不支持图形处理器(graphics processing unit,GPU)加速。uRT-TPS具有剂量计算准确、优化速度快、跳数(monitor units,MU)优化和人工智能(artificial intelligence,AI)赋能等诸多优点。若实现uRTTPS对其他品牌的直线加速器进行剂量计算,将在一定程度上减轻医师和物理师的临床工作强度。因此本研究尝试使用uRT-TPS对Infinity直线加速器进行建模,评估使用uRT-TPS对Infinity直线加速器进行剂量优化计算的可行性。
1 资料和方法
1.1 直线加速器及TPS
复旦大学附属肿瘤医院有多台Infinity直线加速器,其Agility机头具有80对5 mm宽的高精度运动多叶准直光栅,等中心层面射野最大为40 cm×40 cm,可满足当前大多数放疗技术的硬件需求。其光子束有6 MV和6 MV非均整(flattening filter free,FFF)两个能量挡位,最大剂量率分别为600和1 400 MU/min,本研究主要对6 MV光子束进行剂量学分析。
文中Monaco-TPS为5.11版本,剂量算法是X-Ray Monte Carlo;uRT-TPS为本地1.0版本,剂量算法为锥形束卷积算法(collapsed cone convolution,CCC),优化为控制点优化算法。文中两套IMRT计划的实现方式:动态IMRT(dynamic IMRT,d-IMRT),计算网格大小为3 mm×3 mm×3 mm;最小子野宽度为0.5 cm,最大控制点个数为50个,剂量率为600 MU/ min。点绝对剂量计划验证使用德国P T W 公司的UNIDOS型号剂量仪及30013型号0.6 cm3的指型电离室,三维面剂量验证使用瑞典ScandiDos公司的Delta4模体。
1.2 病例选取及IMRT计划的制定
从2022年9月在复旦大学附属肿瘤医院uRT直线加速器(上海联影医疗科技股份有限公司)上接受放疗的80例患者中随机选取20例,包含直肠癌、肺癌、乳腺癌和鼻咽癌各5例。患者每天治疗1次,每周5次,其处方剂量如下:
⑴ 直肠癌:单次2 Gy,共25次。
⑵ 肺癌:单次1.8 Gy,共28 ~ 34次。
⑶ 乳腺癌:4例单次2.67/3.20 Gy(同步推量),共15次;1例单次2 Gy,共25次。
⑷ 鼻咽癌:单次1.8 ~ 2.2 Gy,共30 ~ 35次。患者有2 ~ 4个靶区,且处方剂量各不相同。
我们将患者计算机体层成像(computed tomography,CT)影像先导入uRT-TPS进行PTV及危及器官(organ at risk,OAR)勾画并制订放疗计划,然后经医学数字成像和通信(digital imaging and communications in medicine,DICOM)影像传输协议导入Monaco-TPS中制定放疗计划。同一病例计划的射野中心、射野数、多叶光栅与治疗床角度及处方剂量均相同。为保证计划质量不受物理师经验影响,在临床优化目标一致的条件(处方剂量95%的剂量线覆盖靶区,各OAR的剂量限值目标一致)下,由具有3年计划制订经验的同一物理师完成所有计划优化。计划首先由物理师在uRT-TPS中根据经验设计,初步计划获得后再根据各PTV和OAR的剂量限值进一步优化,直至剂量满足临床剂量要求。将uRT-TPS中的优化结果作为Monaco-TPS的优化条件,在满足PTV临床要求下放松或收紧OAR的剂量限值。最后请1名具有8年以上工作经验的物理师完成计划审核。计划完成后,对所有IMRT计划进行点绝对剂量及三维面剂量验证。
1.3 统计学处理
各病例两套IMRT计划完成后,均在MIM软件(美国MIM公司)中统计PTV和OAR的剂量分布。PTV统计指标有Dmax、Dmean、D5%、D95%、VPTV95%、V95%、均匀性指数(homogeneity index,HI)和适形性指数(conformity index,CI)。其中Dmax和Dmean分别为最大剂量和平均剂量,D95%和D5%分别为覆盖PTV体积95%和5%的剂量,VPTV95%和V95%分别为95%处方剂量线覆盖PTV的体积和95%处方剂量的体积。HI = 1- (D5%-D95%)/Dmean,CI =VPTV95%/V95%,HI和CI介于0 ~ l之间,HI越接近于0表示靶区的均匀性越好,CI越接近1表示靶区的适形性越好[8-9]。各病种OAR的统计指标见表1。
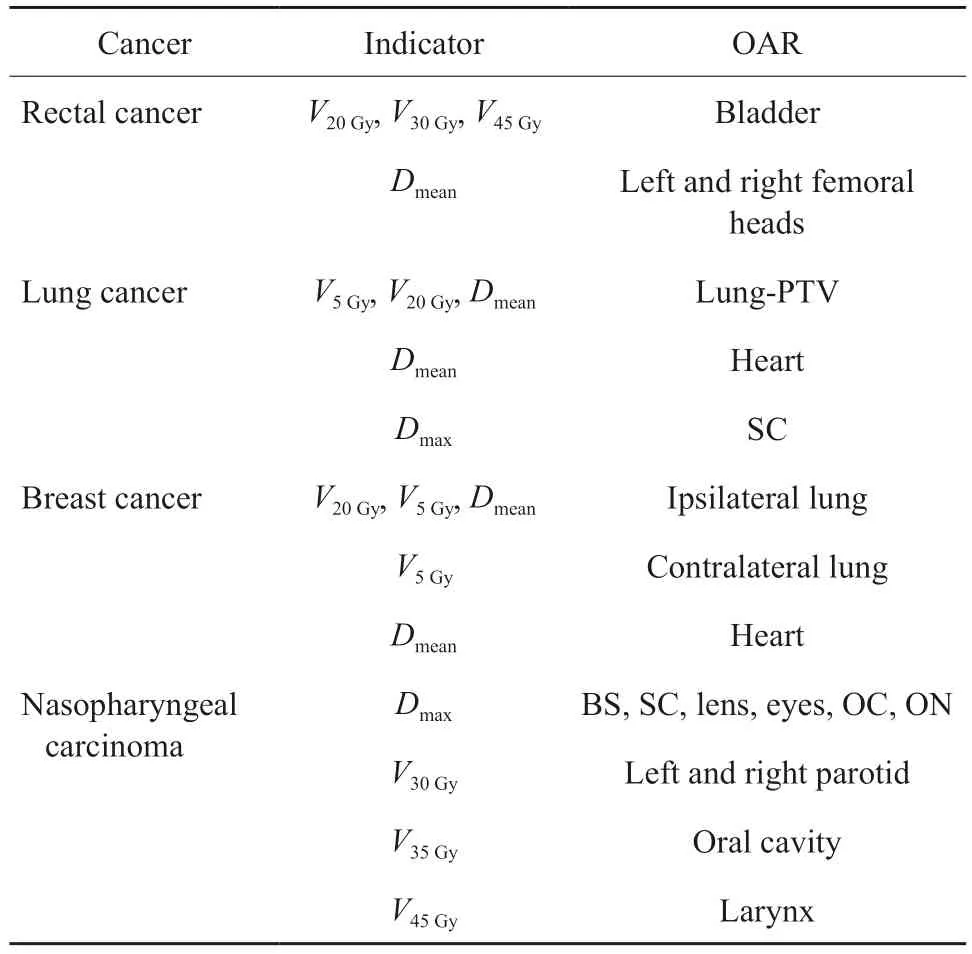
表1 各病种OAR的统计指标Tab.1 Statistical indicators of OAR for various diseases
评价以上各参数时,对同一计划在uRT-TPS和Monaco-TPS中进行相同剂量归一,即95%的处方剂量覆盖整个PTV。为评价uRT-TPS和Monaco-TPS优化的计划哪个在执行时更省时,统计每个计划的MU。除剂量评估以外,我们统计源皮距(source skin distance,SSD)和各OAR的体积来评价CT影像在uRT-TPS和Monaco-TPS中的重建差异。
采用SPSS 22.0软件对上述数据进行统计学分析,结果以±s表示。本研究主要分析uRT-TPS和Monaco-TPS对同一病例计划及验证结果的差异,各病种结果呈非正态分布,采用Wilcoxon配对符号秩和检验,P<0.05为差异有统计学意 义。
2 结 果
2.1 PTV剂量学及MU的差异
所有IMRT计划在满足临床剂量要求后,PTV各剂量指标及MU见表2。从总体来看,uRTTPS和Monaco-TPS之间只在Dmax指标上具有显著差异,uRT-TPS的剂量热点控制较好,最大剂量平均减少约1.1 Gy。uRT-TPS和Monaco-TPS的Dmean和高剂量区D5无显著差异,说明uRT-TPS和Monaco-TPS的质量基本一致,靶区的HI和CI也没有表现出差异,进一步印证了这一结果。uRTTPS和Monaco-TPS在各病种靶区剂量的差异见图1,指标差异的计算方法为Difference = (uRTMonaco)/Monaco×100%。uRT-TPS在直肠癌计划中具有较高Dmean的同时又降低了Dmax(P<0.05),在靶区剂量均匀性和热点控制上表现优异;对于肺癌和乳腺癌,靶区Dmax较小,其他没有明显差异;鼻咽癌的计划较复杂,有多个不同处方剂量的靶区,但uRT-TPS和Monaco-TPS最终均可实现水平较高的临床计划,PTV虽有剂量差异但差异无统计学意义(P>0.05)。在靶区剂量均匀性和适形性方面,由于鼻咽癌有多个不同处方剂量的PTV,这里只统计计划中处方剂量最大的靶区剂量均匀性和适形性。uRTTPS在直肠癌和肺癌中的表现优于Monaco-TPS,在乳腺癌和鼻咽癌中无显著差异,说明URT-TPS在单处方剂量单一靶区的剂量分布上表现较好。在计划MU方面,相对于Monaco-TPS,uRT-TPS在直肠癌和乳腺癌中具有较低MU且差异有统计学意义(P<0.05),差异值分别为-33.1±53.5和-162.7±247.7,而在鼻咽癌中虽具有较高MU,差异值为62.8±58.3,但差异无统计学意义(P>0.05)。
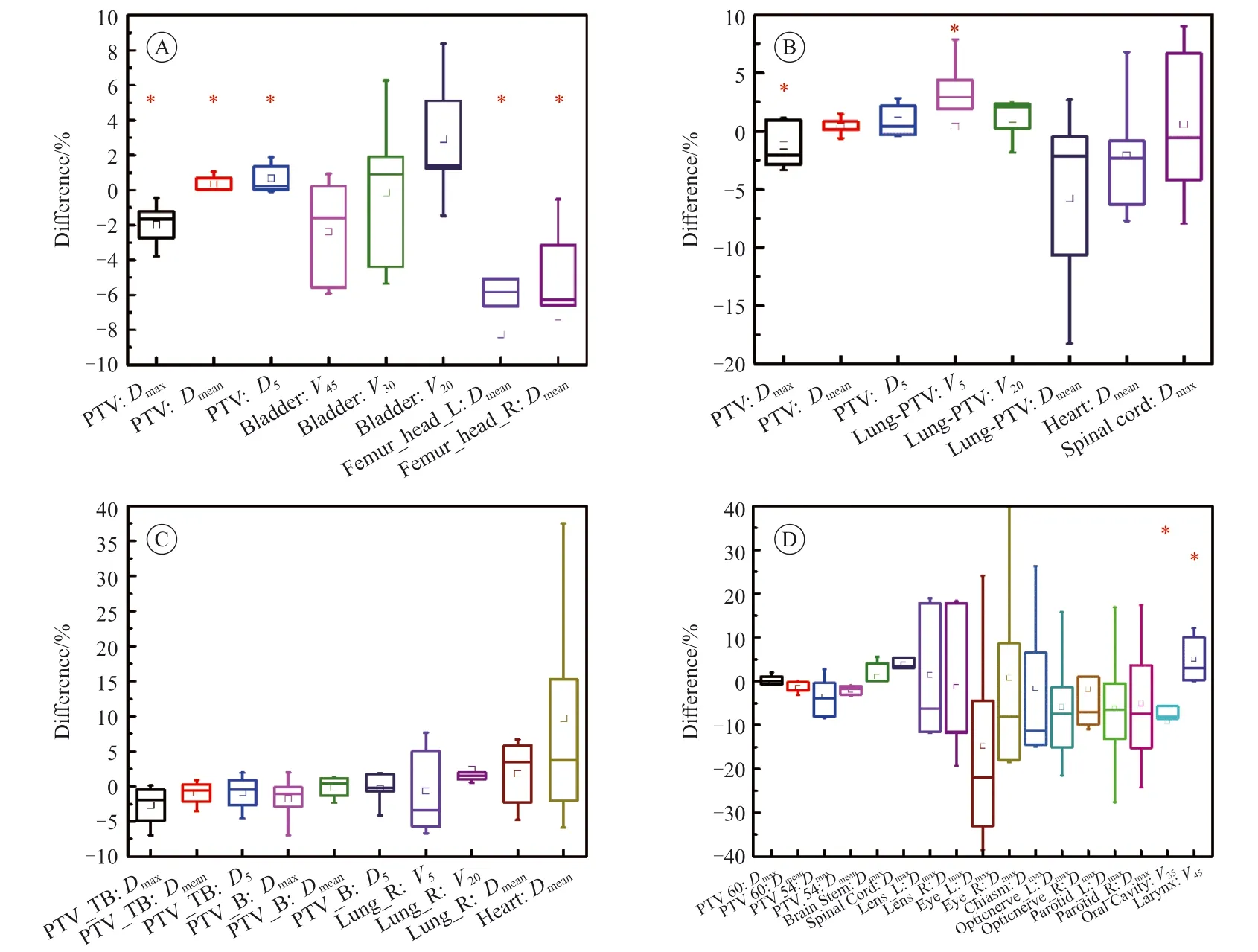
图1 uRT‑TPS和Monaco‑TPS IMRT计划在PTV和OAR上的剂量学差异Fig.1 Dosimetric differences in PTV and OAR between uRT-TPS and Monaco-TPS IMRT plans
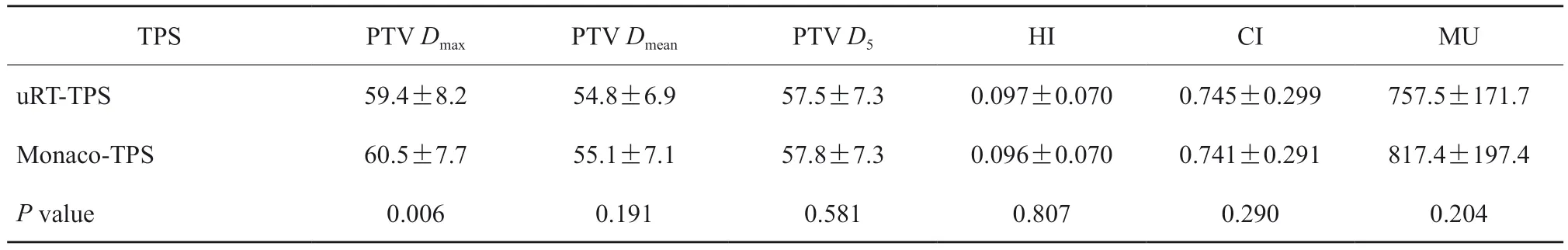
表2 20例患者在uRT‑TPS和Monaco‑TPS中IMRT计划的PTV剂量学参数比较Tab.2 Comparison of PTV dosimetry parameters of IMRT plan in 20 patients in uRT-TPS and Monaco-TPS
2.2 OAR剂量参数比较
uRT-TPS和Monaco-TPS在各病种中OAR的剂量差异见图1。对于直肠癌,两套IMRT计划在左右股骨头中的平均剂量差异有统计学意义(P<0.05),使用uRT-TPS制订的计划左右股骨头分别比Monaco-TPS降低约8.26%和7.23%;uRT-TPS和Monaco-TPS在膀胱中的剂量分布差异波动较大,Monaco-TPS的高剂量区域偏多,低剂量区域偏少,但总体差异无统计学意义(P>0.05)。对于肺癌计划的优化,Monaco-TPS在正常肺部组织低剂量区域分布较少,V5和V20均较低,但uRT-TPS在正常肺部组织中的平均剂量降低约1.51%,说明Monaco-TPS注重降低正常肺部组织低剂量区域的受量,而uRT-TPS更侧重降低正常肺部组织的高剂量区域,进而降低整体平均剂量;在心脏和脊髓中无显著差异。uRT-TPS和Monaco-TPS在乳腺癌计划中的剂量分布无显著差异,只有在患侧肺的V20指标上Monaco-TPS表现稍好,但差异无统计学意义(P>0.05),临床上不构成较大优势;由于病例选取的右侧乳腺癌,心脏受量均较低(均值分别为172.4±81.7和161.8±89.5),但uRT-TPS在个别病例上波动较大。对于鼻咽癌,总体上uRT-TPS和Monaco-TPS在OAR上的剂量差异波动较大,特别是小器官,如晶状体、视交叉和视神经等,但大多差异无统计学意义(P>0.05),主要是因为OAR体积小、多空腔且距离靶区较近,在最终剂量计算时易出现剂量极值。
2.3 uRT‑TPS和Monaco‑TPS的计划验证
各病例在uRT-TPS和Monaco-TPS中完成计划设计后,由经验丰富的物理师完成计划验证,并在临床性能良好的Infinity直线加速器上分别对各计划进行点绝对剂量和三维面剂量验证,结果见图2。对于点绝对剂量验证计划的制订,均移植原计划至水模体(美国Standard Imaging公司)上计算,将电离室移至剂量分布平缓区域(uRTTPS中电离室剂量标准差小于3,Monaco-TPS中电离室剂量均匀指数小于1.04)测量且该区域剂量大于处方剂量80%。对于三维面剂量验证计划的制订,将计划移植至Delta4Phantom+模体上计算,验证水平和竖直两个正交平面剂量,最大测量射野面积为20 cm×38 cm,总测量点数共1 069个,伽马通过率评价的剂量阈值下限为10%。总体上看,所有计划的点绝对剂量偏差均小于3%;三维面剂量的3 mm范围内相对剂量偏差小于3%的Gamma通过率均在95%以上,且绝大多数在97%以上,验证结果均满足临床要求。uRTTPS和Monaco-TPS计算的同一病例计划验证结果之间无显著差异,各病种之间的计划验证通过率也无显著差异。
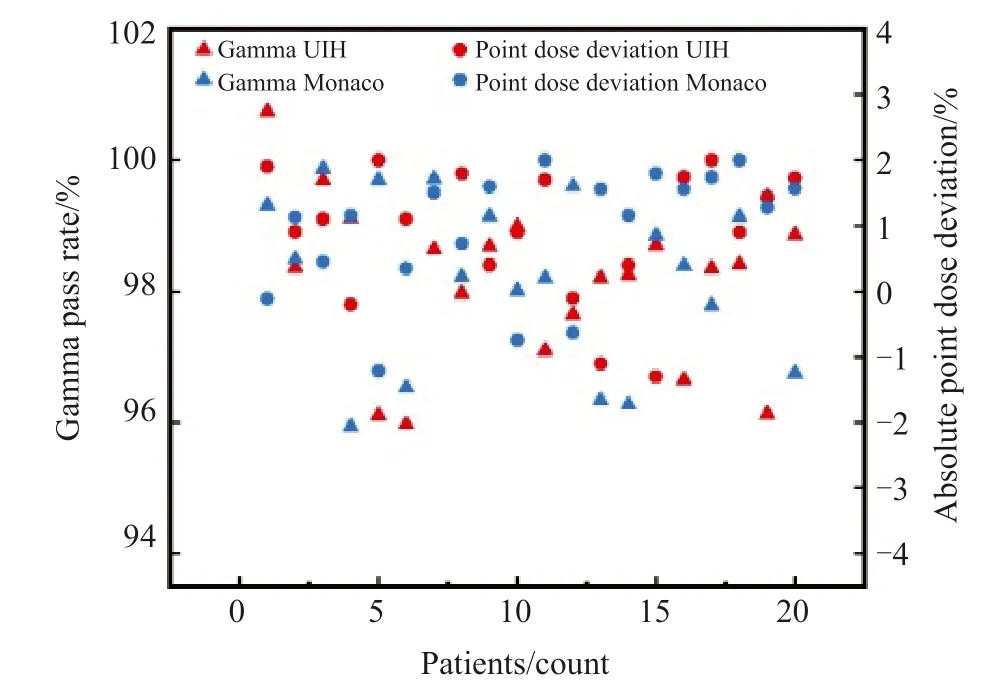
图2 各IMRT计划的点绝对剂量和三维面剂量验证结果Fig.2 Verification results of point absolute dose and 3D surface dose for each IMRT plan
2.4 SSD和OAR体积计算的差异
除剂量学的差异比较外,本研究还对uRTTPS和Monaco-TPS在CT影像的重建及感兴趣区体积计算上的差异进行对比,主要是为了比较uRT-TPS和Monaco-TPS对空间体积计算的精确度。CT影像在TPS中会被划分为多个体积元,体积元的数目和大小由TPS预设的图像分辨率决定[10-11]。由于各体积元的介质组成和密度不同,当射线经过各体积元时所吸收的辐射剂量也不同,最终体现在各感兴趣区的剂量分布上,因此OAR体积计算的精确性对后期计划评估至关重要。对体积计算的差异主要体现在感兴趣区边界处,在不满一个体积元时,各TPS对其体积计算有着不同的策略,表3给出各病种肿瘤患者在uRT-TPS和Monaco-TPS中OAR体积计算的统计值。从表中可以看出所有统计学指标uRTTPS均比Monaco-TPS小,且差异有统计学意义(P<0.05)。晶状体和视神经等小体积OAR差异较大,晶状体和视神经最大差异分别达到47.55%和45.33%。PTV、股骨头、肺和心脏等体积较大的OAR体积计算差异较小,均小于3%。此外,对于SSD,本文选用0度摆位野的SSD并在肺窗(窗位/窗宽,-300/1 600)条件下在各TPS中完成数据统计,uRT-TPS也均小于Monaco-TPS,差异有统计学意义(P<0.05)。
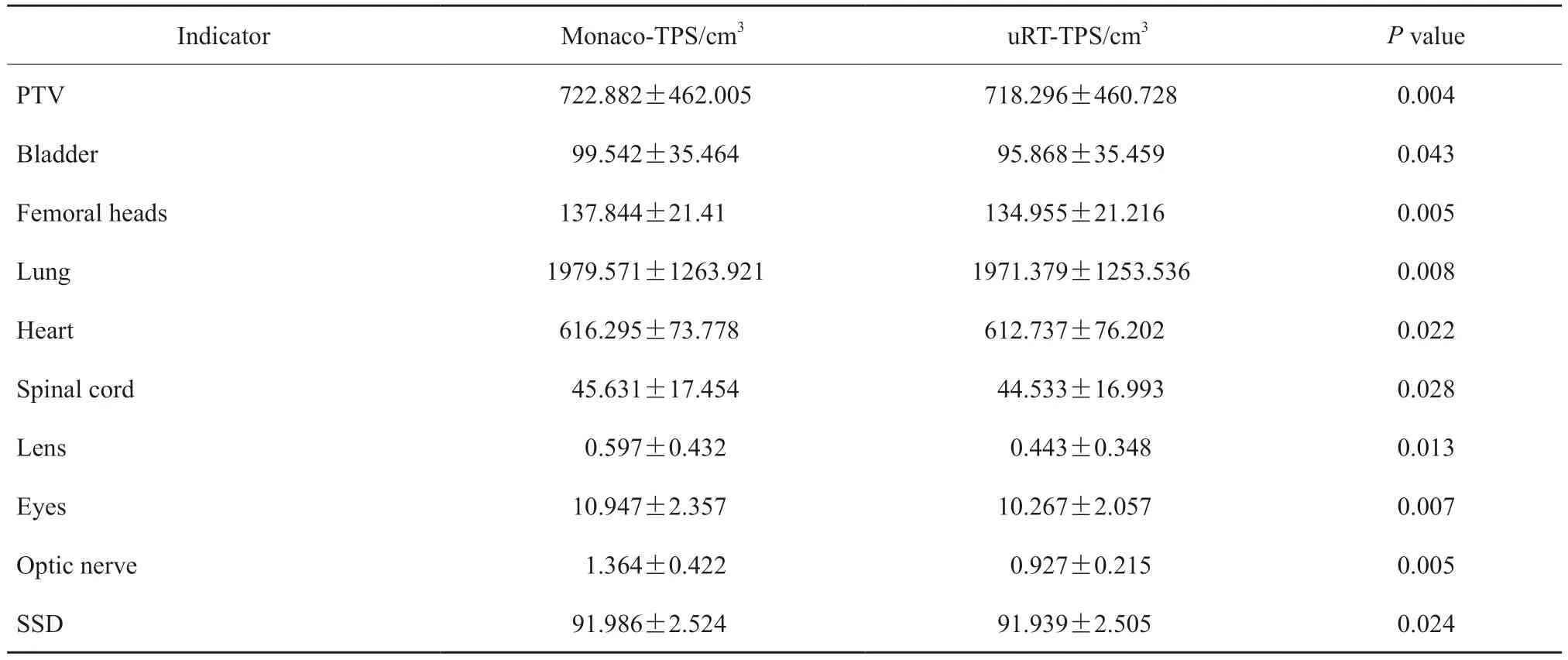
表3 20例临床病例在uRT‑TPS和Monaco‑TPS中OAR体积的平均值Tab.3 The average value of OAR volume in uRT-TPS and Monaco-TPS for 20 clinical cases
3 讨 论
最近20年,IMRT计划已在国内广泛应用。得益于IMRT计划具有的较高适形性的特点,患者靶区在接受高剂量放疗的同时正常组织也可得到较好的保护,能够提高肿瘤局部控制率并降低远处复发风险,从而极大地降低患者因放疗导致的放射性损伤及并发症的严重程度。目前,主流的3款进口TPS(Pinnacle-TPS、Monaco-TPS和Eclipse-TPS)占据了主导地位,且用于放疗的直线加速器也基本被国外公司垄断。由于国外具有先发优势,国产直线加速器及TPS软件很难与其竞争。因此,研发性能良好的国产设备及软件显得尤为重要,也符合国家健康发展战略。
根据本研究的剂量数据统计结果,uRT-TPS和Monaco-TPS均可对直肠癌、肺癌、乳腺癌和鼻咽癌制订较好的放疗计划,在保证靶区剂量一定适形性和均匀性的同时有效地保护正常组织,满足临床剂量学要求。对于PTV的结果,虽然总体差异无统计学意义,但uRT-TPS对计划热点控制较好,主要是在计划优化最终阶段引入对靶区热点去除的强权重优化。此外,在直肠癌和肺癌的靶区剂量上也有更好的适形性和剂量均匀性。由于uRT-TPS在剂量计算的最后阶段对MU采取优化算法滤除面积较小的子野,能够提升MU的利用率。对于OAR,Monaco-TPS在正常肺和心脏的保护方面表现稍好,主要是由于其优化策略上侧重于整体优化。Monaco-TPS的parallel和serial优化函数均有一个体积效应参数k,k的大小决定了辐射剂量响应曲线的陡峭度:k值越小函数作用体积越大,趋向限制平均剂量;k值越大函数作用体积越小,趋向限制点剂量。此外,Monaco-TPS优化时各感兴趣区的上下层排序影响到其优先级,一般PTV为最上层优先级最高,在满足靶区剂量要求的基础上逐步降低临近OAR的受量,这也解释了本研究中Monaco-TPS在肺V5和V20相对较低的情况下却有较高平均剂量的情况。类似的结果在其他研究中也有出现,例如,杨金磊等[12]在比较Monaco-TPS与Pinnacle-TPS对肺癌的容积调强的剂量差异时,得出Monaco-TPS在患侧肺高剂量区域及平均剂量比Pinnacle-TPS高,但低剂量区域无显著差异的结果。对于鼻咽癌,相对于其他3个病种其具有靶区多、形状复杂、OAR多及结构精细等特点,uRT-TPS和Monaco-TPS在晶状体、视神经和视交叉等微小器官均出现较大波动。由于统计学指标为Dmax,且鼻咽结构腔窦较多,当射线通过空腔与实质组织界面时,会产生大量散射而导致电子失衡等问题,降低剂量计算的精度,每次优化会出现较大的不确定性[13]。此外,uRT-TPS在获得同等质量水平的计划优化时间比Moncao-TPS短的多,主要是因为uRT-TPS在计算时引入并行GPU运算,大大加快剂量计算优化时间,剂量计算及优化时间平均在1 min左右。在算法上,Monaco-TPS 5.11的蒙特卡罗算法以概率统计理论为基础,通过模拟上亿个粒子与组织的相互作用,精确地统计出粒子束与物质相互作用的宏观特征,因此运算量巨大。当前版本的Monaco-TPS不支持GPU加速,剂量计算的中间值频繁在磁盘中存储与调用,所以总体计划优化时间要大于30 min,鼻咽癌计划因结构复杂优化时间更长。uRT-TPS采用和Pinnacle-TPS类似的锥形束卷积算法,其原理是利用点核与原射线穿过人体组织时在单位质量物质中所释放的总能量进行卷积叠加计算,具有优化较快的特点。此算法对不均匀介质中的剂量计算进行了修正,考虑了准直器散射、原射线及电子线污染的影响,因此可获得较准确的剂量分布[14-15]。得益于各类算法的发展,后期发展的uRT-TPS在通量图优化、叶片序列优化、控制点形状及权重优化等各环节采用执行效率更高的算法,结合靶区与OAR软硬权重配合得到较好的临床计划,计划优化算法的调整策略包括靶区各指标优先、控制靶区外剂量适形及压低正常组织受量等。体积计算的差异主要发生在感兴趣区边界处的统计,Monaco-TPS将边界处体积元的部分再27等分,然后统计该体积元内感兴趣区的占比,而uRT-TPS使用有向距离场的方式进行统计,对边界统计更加细腻,最终使得OAR边界计算更加精细,因而得到的数值较Monaco-TPS小。为进一步探究各TPS间的体积计算的差异,我们在MIM软件中分别勾画体积较小和较大的圆柱、长方体(直径或边长分别为1、3和6 cm)等规则结构并导出至各TPS,统计其在MIM、Monaco-TPS、uRT-TPS和Eclipse-TPS等软件中的体积。结果显示,MIM与Monaco-TPS中各规则结构体积基本一致,uRT-TPS与Eclipse-TPS中各体积基本一致,且后两款软件中各结构的体积比前两款小,也有体积小的结构差异大、体积大的结构差异小的特点,详见表4,该结果与先前研究[10-11]结果一致。对于同一计划在各TPS中的剂量评价,Monaco-TPS与MIM各靶区和OAR剂量基本一致,uRT-TPS中剂量稍偏低,特别是头颈中小体积OAR,如晶状体、视交叉等。
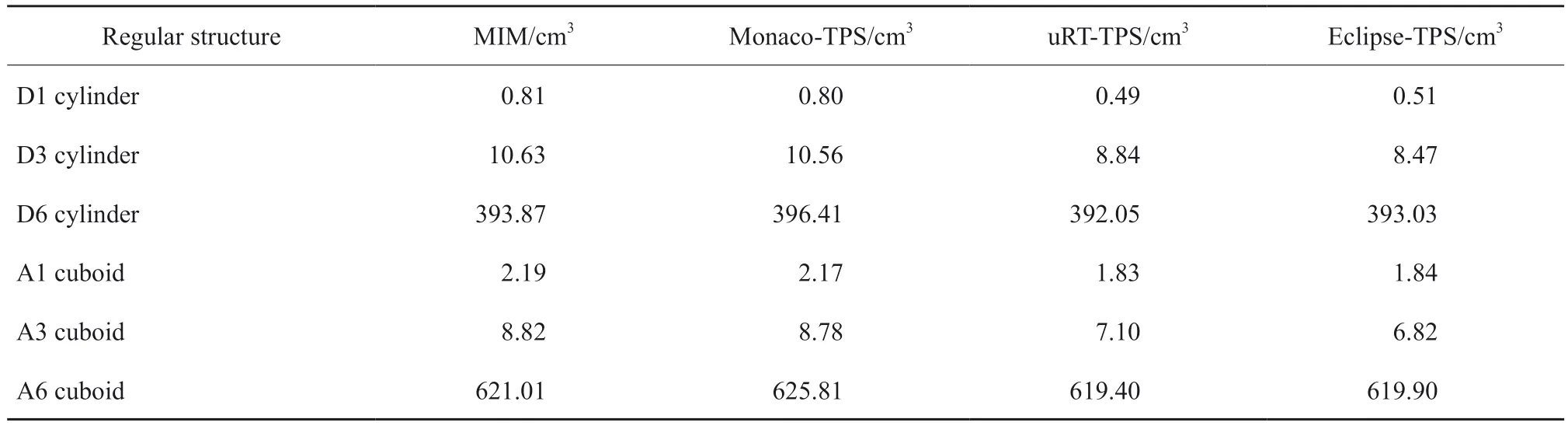
表4 不同体积的规则结构在各软件中的体积统计Tab.4 The volume statistics for different volumes of regular structures in each software
不同TPS对同一病例的计划差异来自于多方面,虽然本研究中的计划使用同一套CT和靶区,射野数、角度、最大控制点个数、多叶光栅和治疗床角度一致,但仍存在不同TPS间的系统差异和人为差异,即优化函数的策略不同,对CT体素的分割也有差异等;对于计划验证结果也受验证时摆位精度和机器状态的影响。此外,各TPS在剂量计算和结果统计时都有其计算和统计不确定度,即便约束条件一致,同一TPS的两次计算结果间也有差异。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
杨彦举:制定临床计划,收集整理数据,撰写论文;
方应涛,高大地:计划验证;
王佳舟,赵俊:论文修改及指导;
胡伟刚:研究方向指导。

