21例原发性胸壁尤因肉瘤的临床分析
江丽丽,马 妍,张田田,黄 山
苏州大学附属第一医院病理科,江苏 苏州 215000
尤因肉瘤(Ewing sarcoma,ES)是一种罕见的高度侵袭性肿瘤,其在遗传学上有特征性染色体易位,85%可发生FET基因家族与ETS转录因子融合产生ESWR1-FLI1基因。ES好发于骨组织,骨外ES(extraskeletal ES,EES)偶有报道,原发性胸壁ES(primary ES of the thoracic wall,PEST)病例报道罕见[1-15],临床易忽视,影像学检查易误诊,常需与胸腔其他恶性肿瘤进行鉴别。目前针对EES的治疗共识是多科学综合治疗,采用局部手术切除病灶伴或不伴放疗,再辅以化疗。一线化疗方案是VDC/IE,化疗可在局部治疗前开始,术后如无进展迹象可继续进行。本研究收集2018-2023年苏州大学附属第一医院及国内外PEST病例报道文献,探讨总结其临床特征、病理学形态、免疫表型、遗传学特征、鉴别诊断及预后,以提高对该肿瘤的认识。
1 资料和方法
1.1 临床资料
收集苏州大学附属第一医院收治的PEST病例资料并复习既往文献,筛选2018—2023年共21例病例,分析其临床表现、影像学特征、治疗方法、随访及预后[1-15](表1)。本院收治的2例病例为病例20和21。
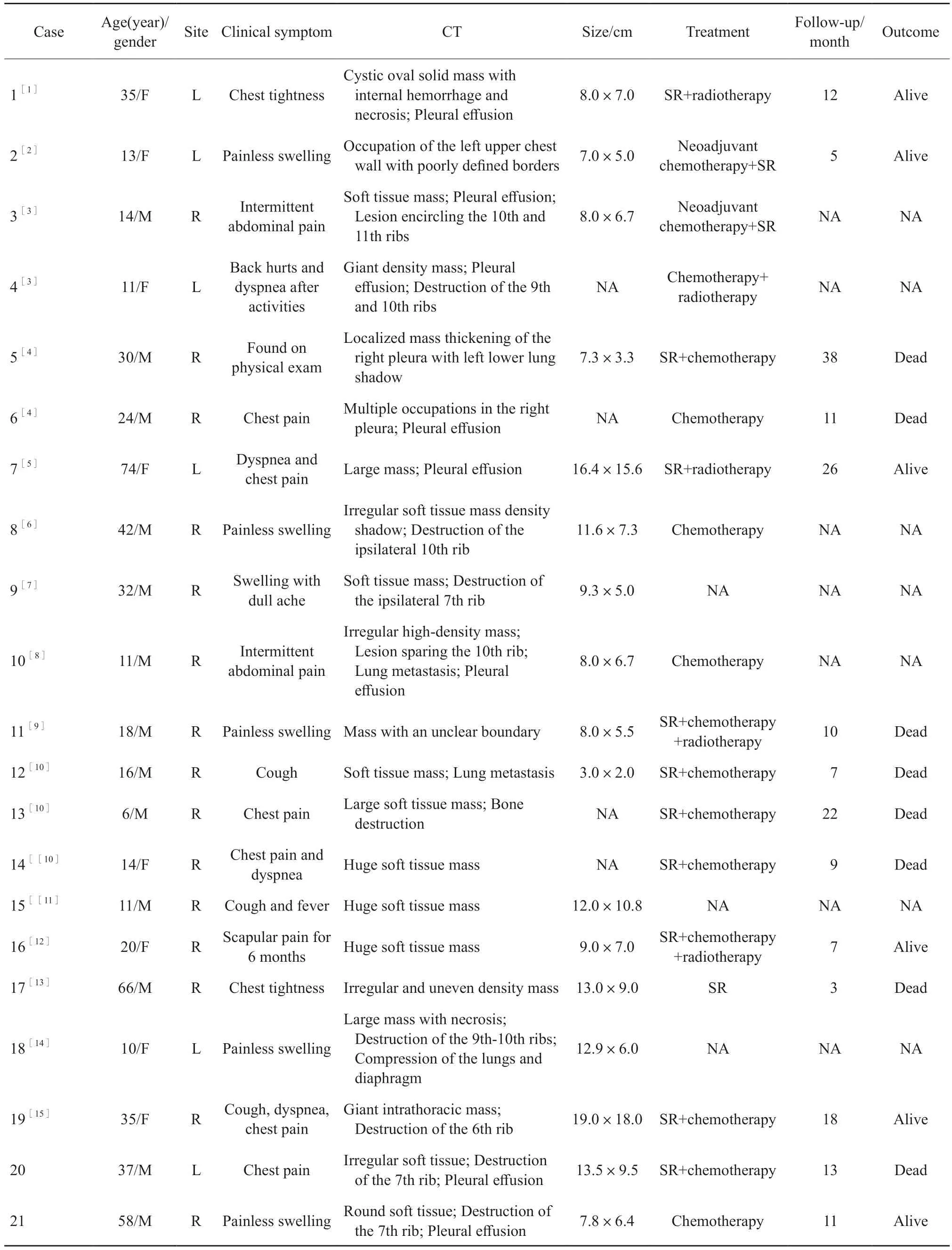
表1 21例PEST患者临床病理学特征及随访结果Tab.1 Clinicopatholigical characteristics and follow-up of 21 patients with PEST
1.2 方法
标本均经4%中性甲醛溶液固定,石蜡包埋,常规制片,行H-E染色。免疫组织化学染色采用EnVision法,所用一抗细胞角蛋白(cytokeratin,CK)、波形蛋白(vimentin)、CD56、S-100蛋白、结蛋白(Desmin)、Ki-67、NKX2.2、CD99、CD56、突触素、CgA、MyoD1,以及主要抗体CD99、NKX2.2均购自丹麦DAKO公司,FLI1购自北京中杉金桥生物技术有限公司。石蜡切片组织采用荧光原位杂交(fluorescenceinsituhybridization,FISH)EWSR1断裂分离探针,试剂盒购自广州安必平医药科技股份有限公司,二代测序(nextgeneration sequencing,NGS)试剂盒购自深圳华大基因股份有限公司,操作方法按说明书进行。
2 结 果
2.1 病理学检查
2.1.1 大体检查
病例2 0,左上肺胸壁切除肿物一枚,13.5 cm×9.5 cm×8.0 cm,切面灰红、鱼肉状,局灶出血坏死,肿物含部分肋骨,肉眼可见骨质破坏(图1A)。病例21,肿块临床未切除,送检活检穿刺标本,灰白灰红易碎组织数块,合计最大径0.5 cm(图1B)。
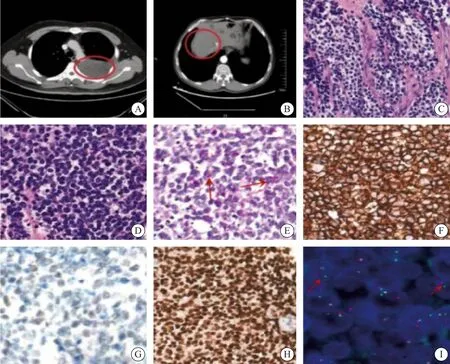
图1 PEST患者的组织病理学特征及FISH检测Fig.1 Histopathological features and FISH test of PEST patients
2.1.2 镜下观察
低倍镜下见紧密成片或小叶状分布的蓝色小圆细胞,小叶间为宽窄不等的纤维结缔组织间隔(图1C),瘤细胞核的形态较规则,圆形或卵圆形,核膜清晰,部分瘤细胞的细胞质透亮(图1D),核染色质细致均匀似粉尘样,过碘酸雪夫(periodic acid-Schiff,PAS)染色阳性(图1E)。
2.2 免疫表型
苏州大学附属第一医院收治的2例PEST患者的肿瘤细胞均为CD99膜强阳性(图1F),FLI1核弱阳性(图1G),Ki-67增殖指数为3% ~ 95%,其中病例20 CD56弱阳性,病例21 NKX2.2阳性(图1H)。21例患者的病理学免疫表型见表2。除3例未获得数据外,全组(18/18)病例CD99均弥漫强阳性,80%波形蛋白(vimentin)阳性(8/10),Ki-67增殖指数平均为50%,神经源性标志物不同程度表达。
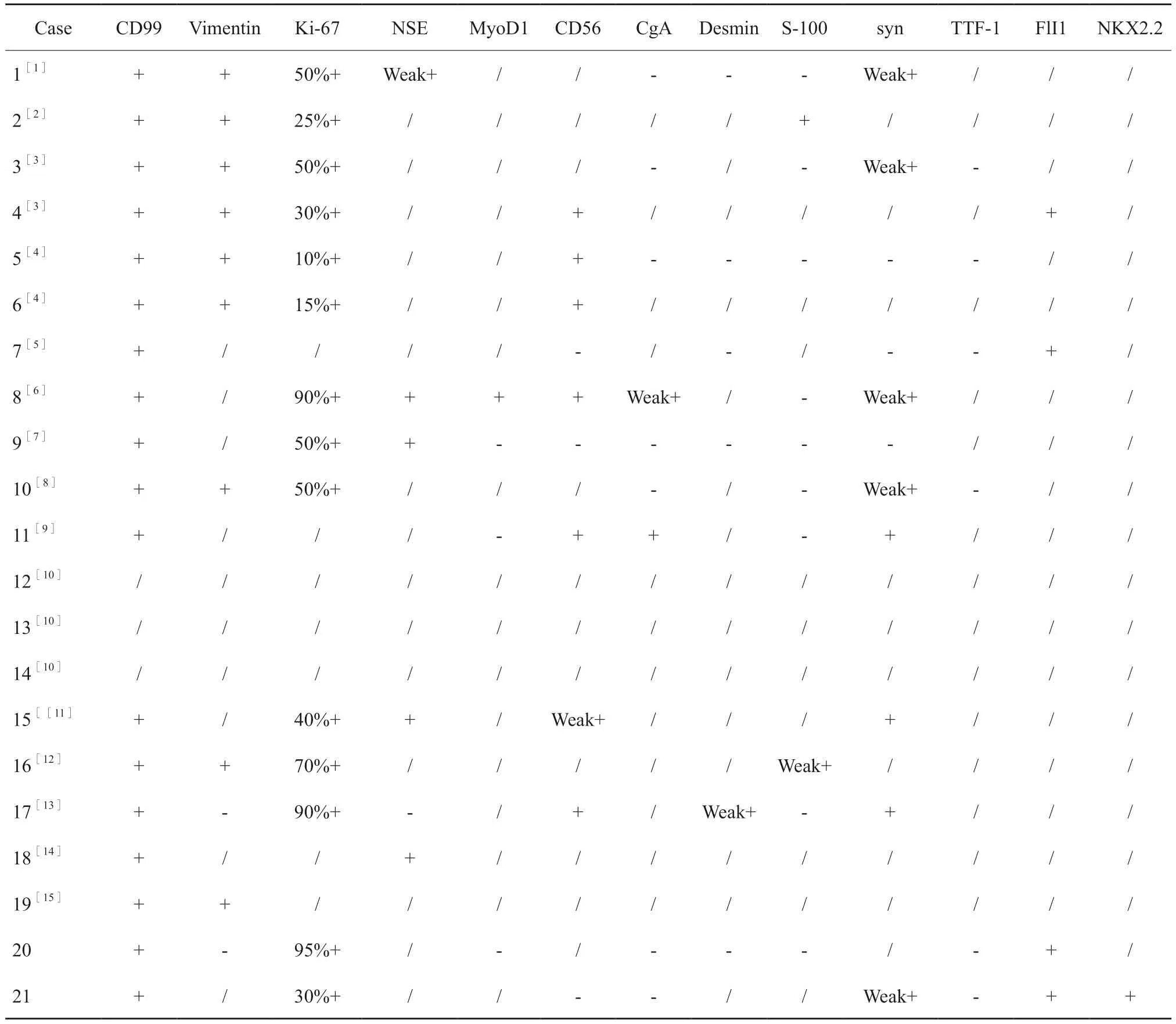
表2 21例PEST患者的免疫表型Tab.2 Immunohistochemistry of 21 patients with PEST
2.3 EWSR1基因检测
苏州大学附属第一医院收治的2例PEST患者FISH检测均见红绿分离信号,提示EWSR1基因断裂(图1I)。NGS检测可见EWSR1-FLI1基因融 合。
2.4 治疗及随访
病例20行“胸腔镜下胸壁病损切除术”,术后半年化疗6次,方案为长春地辛2 mg+环磷酰胺1 g+阿霉素90 mg(持续输注96 h)+达卡巴嗪1 500 mg(持续输注96 h),后行帕博利珠单抗治疗2次,复查腹壁多处转移,确诊1年内死亡。病例21在苏州大学附属第一医院确诊后至上海某医院就诊,未行手术,化疗5个疗程,方案为多柔比星脂质体40 mg+异环磷酰胺1 g+依托泊苷100 mg,3个疗程后瘤体消失,患者无瘤存活至末次随访,生存期为11个月。本研究截止时间为2023年10月。
2.5 生存结果分析
PEST患者累积生存率与患病年龄相关,发病年龄越小,患者累积生存率越低(图2)。平均生存时间为19.98个月,中位生存时间为13.00个 月。
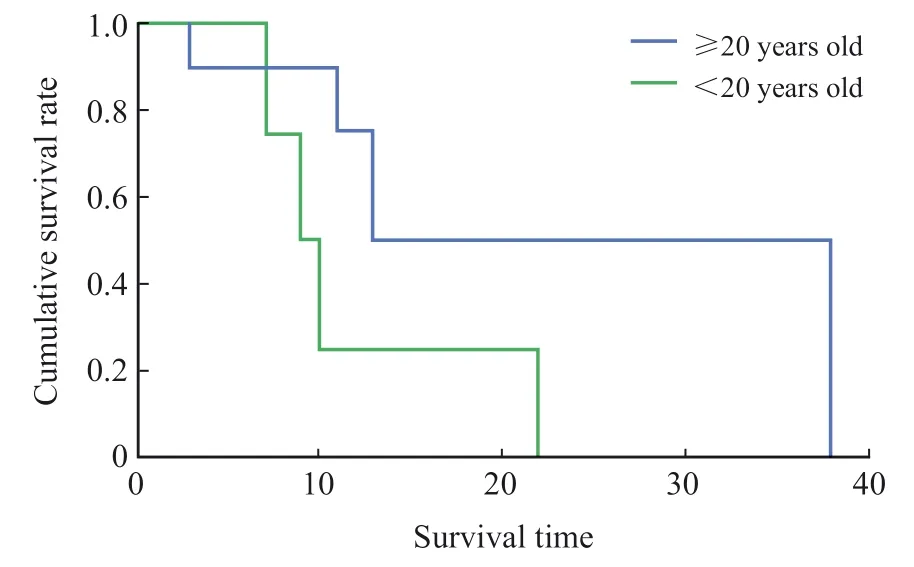
图2 21例PEST患者累计生存率的Kaplan‑Meier曲线Fig.2 Kaplan-Meier curve of cumulative survival rate in 21 patients with PEST
3 讨 论
PEST病例罕见,近5年来文献报道较少。PEST病因不明,可能与EWSR1基因异位有关。PEST的确诊依赖于病理组织学检查、免疫表型及分子病理学EWSR1基因检测。
复习既往文献并结合苏州大学附属第一医院的病历资料,统计2018—2023年近5年的PEST病例21例[1-15]。其中男性13例,女性8例,苏州大学附属第一医院收治的2例均为男性,男性较女性好发,此数据与ES患病性别比一致。发病部位左胸壁6例,右胸壁15例,提示右胸壁好发,此发现目前未有其他论文提出,待更多资料进一步证实。患病中位年龄为20岁,平均年龄为28岁,与ES常见于儿童青少年不同,PEST更多见于中青年,患病平均年龄相对较大。17例患者肿物中位肿瘤直径为8.0 cm,平均肿瘤直径为18.1 cm,4例无统计数据。13例(65.2%)患者因同侧胸腹痛就诊,6例因无痛性肿物就诊,偶有咳嗽等临床表现,影像学表现:21例均为软组织影,10例病例侵犯同侧肋骨伴胸腔积液。2例术前接受新辅助化疗,10例患者术后接受放化疗,5例仅接受放化疗,1例仅接受手术治疗,3例无手术资料。全组21例患者,随访时间为3 ~ 38个月,7例失访。PEST占所有原发性胸壁肿瘤的10% ~ 15%,影像学上与其他肿瘤难以鉴别,常有误诊,本研究病例21的CT提示间皮瘤,因此需要提高对PEST的认识。
ES肿瘤大体上通常为灰白灰红质软,可见出血和坏死。组织学检查中一般可见弥漫分布的核浆比增大的蓝色小圆肿瘤细胞,瘤细胞形态各异,有圆形或卵圆形的细胞核,染色质均匀,有细小的斑点,通常核仁不明显。苏州大学附属第一医院收治的2例PEST病理学特征符合ES描述,肿瘤大体切面呈灰红鱼肉状,伴出血坏死,镜下可见深染小圆细胞,PAS染色阳性。
约95%的ES肿瘤细胞CD99均弥漫强阳性。本研究中的病例CD99免疫表型均为阳性。CD99是ES的相关诊断标志物,灵敏度高但是特异度差。与CD99相比,FLI1的免疫组织化学检测对ES的特异度更高。既往对该抗体认识不足,应用有限,随着对ES的认识,近2年来,FLI1搭配CD99的共同应用大大提高了ES首诊率。其他免疫标志物,如NKX2.2和PAX7作为融合基因的下游产物具有更高的特异度,在ES中的阳性率可达90% ~ 93%。因此CD99、NKX2.2和PAX7的联合阳性对ES的特异度高。本研究中的病例CD99弥漫强阳性,FLI1核弱阳性,NKX2.2核强阳性提示ES。其他免疫标志物,如caveolin-1、B细胞淋巴瘤/白血病11B和高尔基体蛋白1对CD99表达阴性的ES也有高度特异性诊断价值。
遗传学上ES的肿瘤突变负荷低,每百万碱基有0.15个突变,在所有恶性肿瘤中突变率较低。ES的遗传学改变是由EWSR1和转录因子E-26(ETS)家族成员编码基因交叉融合发生染色体易位。EWSR1与FUS/TLS和TAF15共同组成FET(或TET)基因家族,EWSR1编码广泛表达的EWS蛋白。绝大多数ES都有含EWS的融合蛋白,仅有约1%的肿瘤存在FUS相关染色体易位。ETS家族27个成员中的至少5个可以与EWS蛋白融合导致ES,即FLI1、ERG、FEV、ETV和E1AF。首先,EWS-FLI1可见于85% ~ 90%的病例中,即22号染色体上的EWSR1与11号染色体上的FLI1融合重排形成t(11; 22)(q24; q12);其次,ESW-ERG发生率为10%,其他如ESW-ETV1、ESW-E1AF、ESW-FEV和TLS/FUS-ERG发生率均小于1%。
PEST组织学及免疫分型无特征性,对疑似ES的诊断应包括询问病史,简单家族史也有必要,诊断上可借助FISH检测与低分化滑膜肉瘤及横纹肌肉瘤进行鉴别。前者伴有SS18基因分离,后者可有FOXO1基因异位。病理学上,主要与其他“尤因氏样肉瘤”相鉴别,这是一类小圆细胞肉瘤统称,在形态上与ES相似,但融合基因不同,如CIC重组肉瘤、BCOR基因改变肉瘤及EWSR1-non-ETS肉瘤。虽然目前已有血液中的标志性蛋白质和代谢产物支持肿瘤诊断并早期检测复发,但在ES中尚未确定。此外,还需与容易误诊的胸膜间皮瘤及其他恶性转移性肿瘤相鉴别。
PEST一旦确诊,可采用ES治疗方案进行综合治疗,即局部控制[手术和(或)放疗]加化疗。临床上需要注意的是,除非肿块可以明确切除,否则在局部治疗前,应先用化疗对PEST进行分期。前期行新辅助化疗以消除可疑微转移灶并缩小原发灶,后期局部治疗时手术仍是首选。EES手术建议切除肿瘤及受累的骨组织,手术边缘阴性。行肿块边缘扩大切除手术的PEST患者5年生存率更高,但是这种差异性在四肢EES患者中还没有得到证实[16]。关于PEST患者胸壁切除的范围,2021年Zöllner等[17]的回顾性研究发现,受累肋骨完全切除和部分切除的两组患者5年生存率相似。目前,对于无法切除的原发病灶、手术切缘不足或对化疗反应不佳的患者,可考虑局部放疗。但最近Houdek等[18]研究发现,ST(手术+化疗)组与ST+RT组(手术+化疗+放疗)患者的10年生存率、局部复发率及转移生存率差异无统计学意义(P>0.05)。其他靶向治疗,如EWSR1-FLI1诱导产生的受体酪氨酸激酶胰岛素样生长因子Ⅰ受体,疗效有限。目前,经过综合治疗,ES整体5年生存率已提高到70%,但是转移性患者仅为30%。复发的患者预后更差,5年生存率不到10%。本研究中,患者平均生存时间为19.98个月,中位生存时间为13.00个月,患者累积生存率与患病年龄相关,发病年龄越小,患者累积生存率越低,此点与ES发病特征一致。PEST中肿瘤局限于胸部的患者可以获得长期生存,总体5年生存率为15% ~ 48%。Laskar等[19]研究表明,初诊年龄大于18岁、化疗反应差及伴有胸腔积液是生存率较低的指标。苏州大学附属第一医院收治的2例PEST患者,确诊时年龄均超过18岁并伴有肋骨破坏,但病例21就诊时无胸腔积液,化疗反应佳,5个疗程后瘤体消失,至本次随访时仍存活。
综上所述,PEST临床少见,治愈率低,及时确诊治疗是延长生存时间的重要手段。临床上PEST的肿块常见于年轻男性的右侧胸壁,常因胸闷、胸痛就诊,影像学检查显示为较大软组织影,病理学检查可发现小圆细胞特征,应尽早行EWSR1基因检测。ES相对其他肉瘤更易复发、转移,确诊后综合手术和化疗是有效的治疗手段。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
江丽丽:参与实验设计,实施研究和分析数据,文章撰写,统计分析,参与文章后期修改;
马妍:采集数据,收集病例,参与文章后期修改;
张田田:完成分子检测实验内容,参与文章后期修改;
黄山:指导论文攥写并审核,获取研究经费,参与文章后期修改。

