结直肠癌早筛、早诊、早治上海方案(2023年版)
上海市抗癌协会大肠癌专业委员会
结直肠癌是我国常见的恶性肿瘤,随着居民生活水平的不断提高和饮食习惯的改变,中国结直肠癌的发病率逐年升高[1]。降低中国结直肠癌的发病率和死亡率已成为刻不容缓的重大临床问题。
结直肠癌筛查和早诊、早治可以有效地降低结直肠癌患者的死亡率。随着人群结直肠癌筛查项目的广泛开展,让基层医院也能规范结直肠癌筛查和诊治方案对保障结直肠癌防治效果至关重要。上海在国内较早开展结直肠癌筛查项目,也取得了一定的经验和成果,同时也一直强调结直肠癌的规范化诊断和治疗,因此,针对基层医师对于结直肠癌背景、风险预防、常用筛查手段、规范性诊断和治疗等方面认知不足的现状,上海市抗癌协会大肠癌专业委员会组织上海各大医院结直肠癌诊治专家,共同编写《结直肠癌早筛、早诊、早治上海方案(2023年版)》。本方案从结直肠癌的流行病学、危险因素及保护因素、癌前病变及早期结直肠癌、筛查、早期结直肠癌的诊断和早期结直肠癌的治疗等6个方面分别进行了详细介绍,并提供了相关建议供临床参考。本方案旨在规范中国基层医院在结直肠癌筛查与早诊、早治上的实践,提升中国结直肠癌的防治效果。
1 结直肠癌的流行病学
1.1 中国结直肠癌的发病率形势
癌症是中国一个重大的公共卫生问题,已成为中国居民常见的死亡原因之一。目前,中国癌症的发病率、死亡率仍呈持续上升趋势,每年癌症所致的医疗花费超过2 200亿元。癌症防治是实现《“健康中国2030”规划纲要》,维护广大人民生命健康的一项重要举措。
2022年2月,国家癌症中心发布了最新的全国癌症统计数据[1]。全国肿瘤登记中心负责全国肿瘤登记数据收集、质量控制、汇总、分析及发布工作,由于全国肿瘤登记中心的数据一般滞后,本次报告发布数据为全国肿瘤登记中心收集汇总的全国肿瘤登记处2016年的登记资料。国家癌症中心发布的数据[1]显示,2016年中国结直肠癌发病率仍呈不断上升趋势(图1A)。2016年中国结直肠癌新发病例数约40.8万例,已经跃居癌症发病谱的第2位(图1B)。中国结直肠癌发病率为29.51/10万,世标发病率为18.05/10万,占全部恶性肿瘤新发病例的9.68%。2021年GLOBOCAN 2020[2]的数据显示,2020年全球结直肠癌总体发病率已升至第3位,全球新发病例数约为193万例,预计中国2020年新发结直肠癌约55.55万例,占所有恶性肿瘤的12.2%,高居中国癌症发病谱第2位。
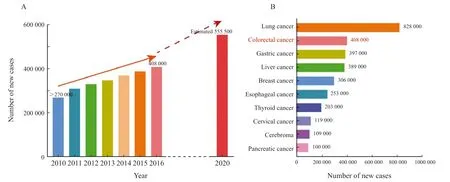
图1 中国结直肠癌发病率趋势Fig.1 Colorectal cancer incidence trends in China
中国结直肠癌患者发病年龄在2005—2014年保持相对稳定,平均年龄为59.3岁,低于全球平均确诊年龄(68.8岁)[3]。确诊结直肠癌时,患者年龄在45岁以下的比例,从2005年的17.9%下降至2014年的10.7%;相比之下,45 ~ 59岁时确诊的比例,从2005年的44.5%上升至2014年的52.8%。
中国结直肠癌发病率存在明显的性别差异,男性结直肠癌发病风险高于女性(图2A)。中国男性结直肠癌总世标发病率为女性的1.48倍。中国男性和女性结直肠癌发病率在40岁后呈明显上升趋势,75 ~ 79岁达到顶峰,男性各年龄段发病率均明显高于女性,且随年龄升高差距逐渐增大。2000—2016年,中国男性所有癌症的年龄标准化发病率保持稳定,但女性每年显著增加2.3%。然而,男性结直肠癌发病率的平均年百分比上升趋势是女性的2倍(2.4%vs1.2%)。
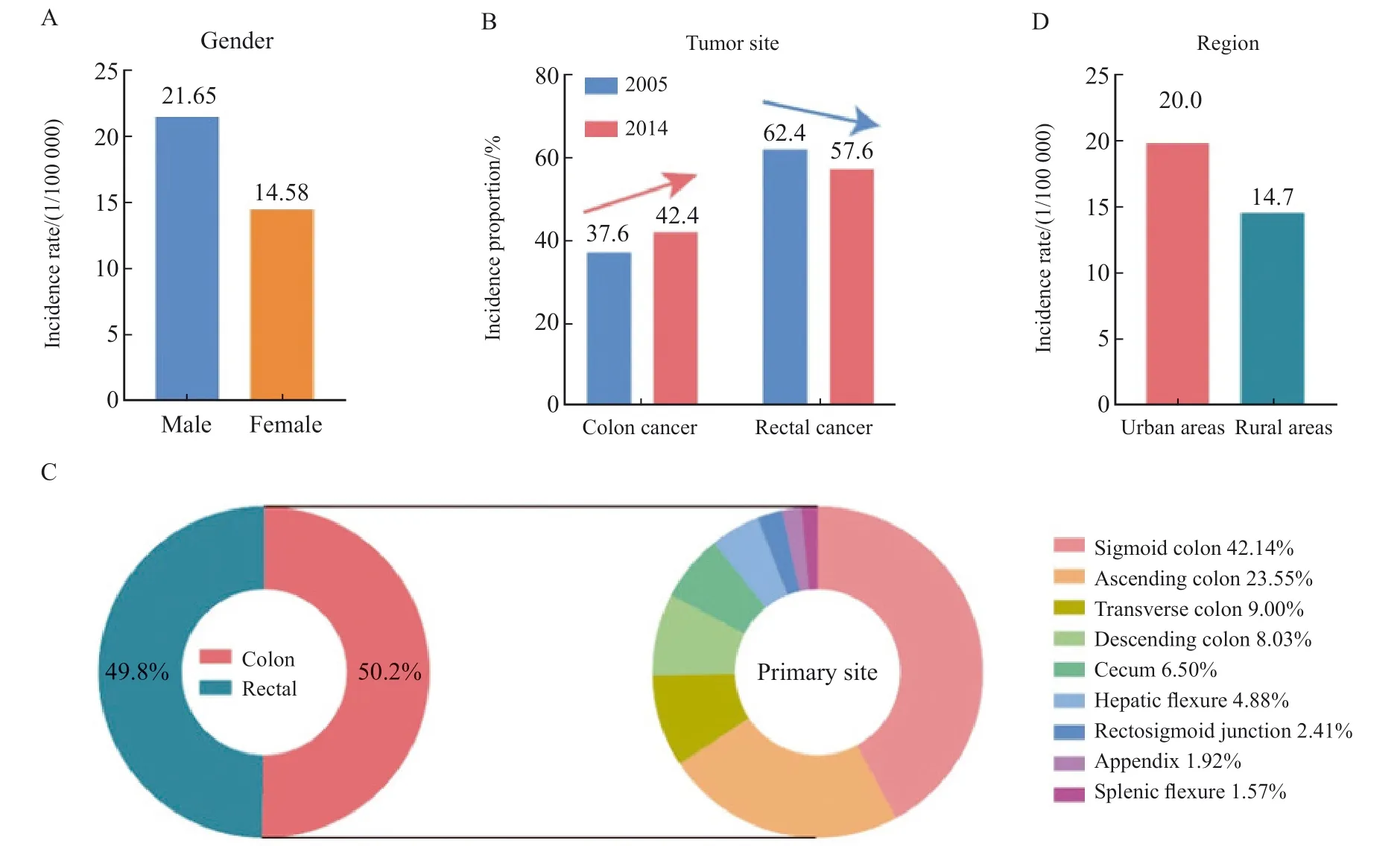
图2 中国结直肠癌发病率特征Fig.2 Characteristics of colorectal cancer incidence in China
分析确诊时肿瘤疾病分期发现,中国结直肠癌早期患者比例下降,而晚期确诊的患者比例上升显著。确诊为Ⅱ期结直肠癌患者的比例由2005年的36.5%下降至2014年的29.0%;而确诊Ⅳ期结直肠癌的比例由2005年的13.5%上升至2014年的20.5%。确诊为Ⅰ和Ⅲ期结直肠癌患者的比例未发生显著变化[3]。晚期结直肠癌患者诊断比例的增加,对中国结直肠癌的防控带来了重大挑战。
根据肿瘤发病部位划分,中国结直肠癌发病部位以直肠癌为主。然而,近年来,中国结肠癌患者比例不断增加,直肠癌患者比例逐渐下降(图2B)。结肠癌患者的比例由2005年的37.6%增加至2014年的42.4%,而直肠癌患者的比例从2005年的62.4%下降至2014年的57.6%[3]。最新国家癌症统计数据[4-5]表明,在中国结直肠癌病例中结肠癌发病率约占50.2%,直肠癌发病率略低于结肠癌,占49.8%。进一步根据结肠解剖学部位细分发现,在全部的结肠癌病例中,乙状结肠癌发病率最高,约占42.14%,升结肠癌占23.55%,横结肠癌占9.00%,降结肠癌占8.03%,盲肠癌占6.50%,结肠肝曲癌占4.88%,交搭跨越部位占2.41%,阑尾癌占1.92%,脾曲癌占1.57%(图2C)。
从发病地域分布上看,中国结直肠癌发病在地域分布上存在明显差异,具体表现为城乡分布差异与东西部分布差异[1]。城乡分析结果显示,城市地区的结直肠癌发病率略高于农村地区(图2D),但差异正在逐渐缩小。2015年中国城市地区结直肠癌世标发病率为农村地区的1.42倍[6],2016年中国城市地区结直肠癌世标发病率较农村地区缩小为1.36倍[1]。这一现象可能是由于结直肠癌相关危险因素的城乡差异正在逐渐缩小,如慢性感染、吸烟、饮食等日常习惯及空气污染等,导致发病率日趋接近。东西部分析结果显示,东部地区的结直肠癌发病率高于中部地区和西部地区,中部与西部地区结直肠癌发病率相近。进一步分析表明,华南地区发病率最高,其后依次为东北、华东、华北、西南、华中和西北地区[4]。
1.2 中国结直肠癌患者的死亡率形势
近年来,中国结直肠癌患者死亡率呈逐年上升趋势。2022年国家癌症中心发布的最新数据[1]显示,2016年中国结直肠癌全因死亡人数约19.6万人,居癌症全因死亡谱第4位(图3A)。同时,GLOBOCAN 2020[2]的数据显示,至2020年,全球结直肠癌死亡率已经跃居全球癌症全因死亡第2位,因结直肠癌死亡人数预计达93万例。2020年中国结直肠癌全因死亡预计将增至28.61万例,约占所有恶性肿瘤全因死亡人数的9.5%,居癌症全因死亡谱第5位。2016年中国结直肠癌死亡率为14.14/10万,世标死亡率为8.13/10万。中国男性结直肠癌死亡率约为女性结直肠癌死亡率的1.35倍,其中男性死亡率为16.17/10万,世标死亡率为10.04/10万;女性死亡率为12.01/10万,世标死亡率为6.36/10万(图3B)。
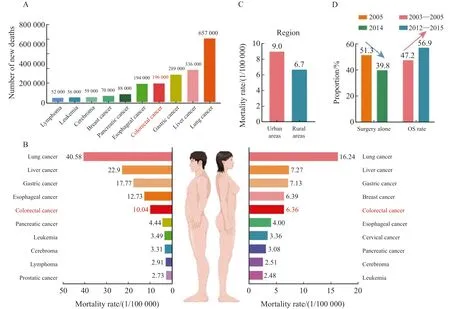
图3 中国结直肠癌死亡率趋势Fig.3 Colorectal cancer mortality trends in China
中国结直肠癌患者死亡率存在明显的性别差异。中国男性和女性的结直肠癌死亡率均在45岁后明显上升,60 ~ 79岁的死亡率最高。同时,中国男性结直肠癌死亡率各年龄段均明显高于女性,且两者间差距随年龄段升高而逐渐增大[1,4]。通过分析2000—2016年男性和女性结直肠癌死亡率变化发现,两者死亡率随时间变化趋势不完全一致。2000—2016年,中国男性结直肠癌死亡率平均每年上升1.3%,而女性结直肠癌死亡率相对趋于平稳[1]。
中国结直肠癌患者死亡率亦存在明显的地域差异(图3C)。2016年,中国城市地区结直肠癌死亡率为农村地区的1.34倍[1];与发病率类似,中国东部地区结直肠癌的死亡率高于中部地区和西部地区,中部和西部地区结直肠癌死亡率相近。进一步细分发现,华南地区结直肠癌死亡率最高,其后依次为东北、华东、华北、西南、华中和西北地区[4]。
经过不断地研究和探索,中国结直肠癌治疗方案变得更加复杂、多样及完善。2005—2014年,更多的结直肠癌患者接受了联合治疗(手术治疗联合化疗或放疗)而并非单一的手术治疗。接受单纯手术治疗的结直肠癌患者比例由2005年的51.3%下降至2014年的39.8%。有效的联合治疗不仅提高了结直肠癌手术的成功率,而且提高了患者的5年生存率。经统计,中国结直肠癌患者总体生存率从2003—2005年的47.2%上升至2012—2015年的56.9%[3](图3D)。
1.3 上海结直肠癌的发病率和死亡率形势
上海作为中国城市地区和东部地区的典型代表,上海结直肠癌发病增速最为显著(图4A),恶性肿瘤发病率已从20世纪70年代初的第7位上升至第2位[7-9]。根据上海癌症登记处数据[10],上海结直肠癌发病率在过去20年中翻了一番,已接近发达国家的发病率水平。在过去30年中,上海结直肠癌发病率以每年4.2%的速度持续上升,但每年平均早期诊断率仅为12%。
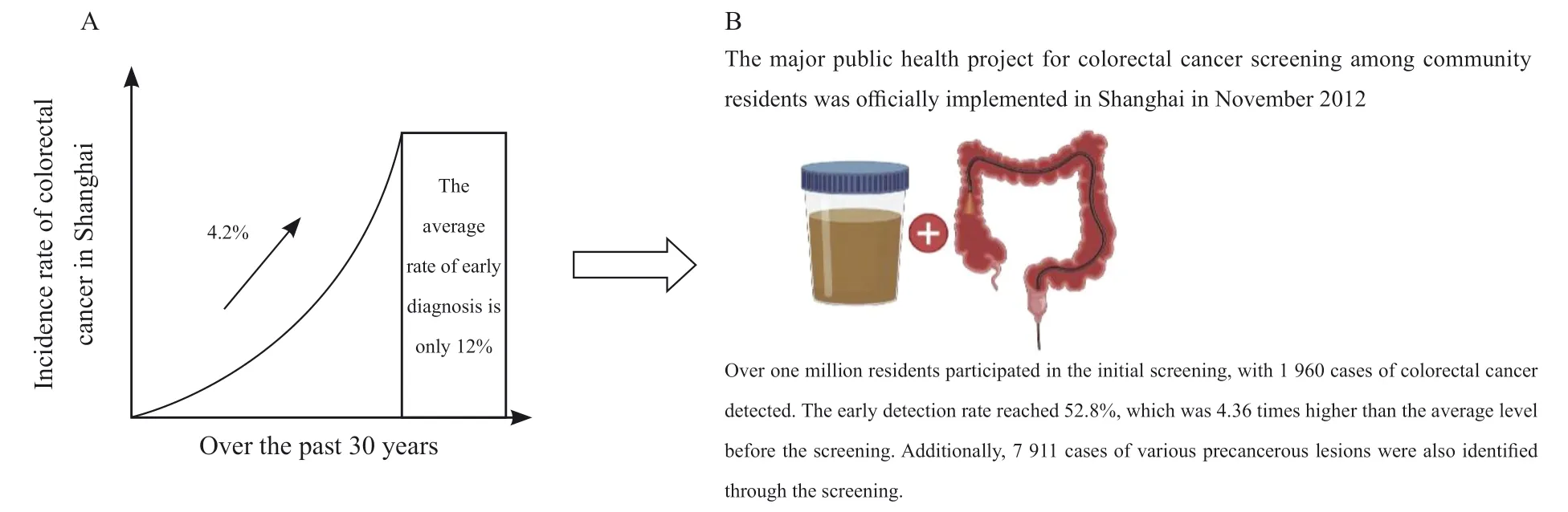
图4 上海结直肠癌发病率形势Fig.4 Colorectal cancer incidence situation in Shanghai
2016年,上海市新发结直肠癌病例数为9 337例,占所有恶性肿瘤的12.55%,居恶性肿瘤发病谱第2位,其中男性为5 441例(58.27%),女性为3 896例(41.73%)。上海市结直肠癌粗发病率为64.48/10万,男性为75.74/10万,女性为53.40/10万。标化发病率为24.64/10万,男性为30.03/10万,女性为19.52/10万。上海市结肠直肠癌死亡例数为4 599例,占所有恶性肿瘤的12.43%,居恶性肿瘤死亡谱第2位,其中男性为2 684人(58.36%),女性为1 915人(41.64%)。上海市结直肠癌粗死亡率为31.76/10万,男性为37.36/10万,女性为26.25/10万。标化死亡率为10.13/10万,男性为12.94/10万,女性为7.64/10万[9](图5)。
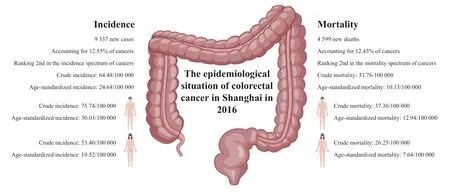
图5 2016年上海结直肠癌发病与死亡形势Fig.5 Colorectal cancer incidence and mortality in Shanghai in 2016
以人群为基础的筛查是结直肠癌防治的重要方法。2012年11月上海市重大公共卫生项目—社区居民大肠癌筛查项目正式启动实施,在全市开展大肠癌防治健康教育与免费筛查服务(图4B)。项目第一轮实施期间,超过100万居民参加了初筛检查,检出大肠癌病例1 960例,早期比例达52.8%,是筛查前本市平均水平的4.36倍,同时亦筛查出各类癌前病变7 911例,实现了筛查项目的预期目标。自2013年起,上海市结直肠癌新发病例数不断增加,可能与同期开展大肠癌筛查项目有关[8-11],但还未影响到标化发病率的整体变化趋势。其降低标化死亡率的效应也未充分体现,还需筛查项目持续和广泛开展[9]。
针对上海市结直肠癌各年龄组发病率和死亡率的变化趋势分析发现,2002—2012年,55岁及以上各组大部分年龄段结直肠癌发病率均呈上升趋势(70 ~ 74岁组除外),而2012—2016年,已转变为40 ~ 69岁组上升(60 ~ 64岁组除外),75岁及以上年龄组发病率已趋于稳定。考虑到上海的大肠癌筛查项目开展不久,而且仅覆盖50 ~ 74岁人群,项目参与者多以60岁以上的老年人为主,在确诊结直肠癌的同时,也发现大量的癌前病变,后者经过治疗又相应地减少了癌症的发生,从而影响发病率的变化[8-9]。同时,2012—2016年上海市结直肠癌各年龄组死亡率呈现总体改善趋势,除85岁及以上组上升外,其余各组均已转为下降或处于稳定状态[9]。
上海市结直肠癌发病率及死亡率存在明显的性别差异。2002—2016年,上海市男性结肠癌发病率及死亡率均呈明显的上升趋势,男性直肠癌发病率呈上升趋势,死亡率趋于平稳;而上海市女性结肠癌发病率及死亡率均趋于平稳,女性直肠癌发病率及死亡率均呈下降趋势。同时,55岁之后年龄组男性结直肠癌发病率及死亡率均显著高于女性;男性直肠癌40岁之后年龄组发病率及50岁之后年龄组死亡率均显著高于女性[9]。以上变化趋势均提示中老年男性应是上海市结直肠癌防治研究和实施的重点关注人群。
综上所述,中国结直肠癌的疾病负担仍然很重,年龄、性别及城乡差异较大,地区分布不均衡,癌症防控形势严峻。为此,针对结直肠癌的早期筛查、预防及治疗更应当引起格外重视。对于特定人群采取针对性的筛查方法,从疾病初期阻断结直肠癌的发生、发展进程,有望改善结直肠癌患者的整体生存预后。
2 结直肠癌的危险因素及保护因素
结直肠癌是全球第三大常见的癌症,也是癌症死亡的第二大原因。结直肠癌的病因和发病机理目前还不清楚,可能是由遗传和环境等多种因素[如炎症性肠病(inflammatory bowel disease,IBD)、吸烟、过度饮酒、食用大量红肉和加工肉等]共同作用引起的。
2.1 遗传因素和家族史
结直肠癌有明显的家族聚集性,研究[12]表明,约35%的结直肠癌患者有相应的家族史。其中,5% ~ 10%的病例存在明确的胚系基因变异,而大多数有结直肠癌病史的家族并不携带与癌症相关的基因突变,称为家族聚集性结直肠癌。多项研究和meta分析[13-14]指出,有一级/二级亲属患结直肠癌的个体,其发生结直肠癌的风险是普通人群的1.5 ~ 4.0倍。
遗传性结直肠癌主要包括林奇综合征(Lynch syndrome,LS)、家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)、黑斑息肉综合征(Peutz-Jeghers syndrome,PJS)、幼年性息肉病综合征(juvenile polyposis s y n d r o m e,J P S)和锯齿状息肉病综合征(serrated polyposis syndrome,SPS)等(表1)。LS是最常见的遗传性结直肠癌,约占所有新诊断结直肠癌病例的3%。在一般人群中,每280人中就有1人可能携带了LS相关的突变基因[15]。LS是一种常染色体显性遗传疾病,由错配修复(mismatch repair,MMR)基因(MLH1、MSH2、MSH6和PMS2)及EPCAM基因的致病性突变引起。除结直肠癌外,LS也与子宫内膜癌、卵巢癌、胃癌、胰腺癌及肾盂癌等多种恶性肿瘤相关[16]。FAP是另一种常染色体显性遗传疾病,通常是由腺瘤性肠息肉病(adenomatous polyposis coli,APC)基因的致病性突变引起。典型FAP患者在青年时期即会出现大量的结肠腺瘤性息肉,如不治疗,发生结直肠癌的风险接近100%。接受早期、高频次的内镜检查以及适时的结肠切除术可以极大地改善FAP患者的预后[17]。MUTYH相关性息肉病(MUTYH-associated polyposis,MAP)是常染色体隐性遗传综合征,由MUTYH基因突变所致,发病年龄为45 ~ 55岁,至65岁发病风险约为80%。临床表现包括多发性结直肠腺瘤性息肉和结直肠癌。与此同时,MAP患者的肠外肿瘤(包括十二指肠恶性肿瘤)的发生风险也会升高。家族性结直肠癌X型(familial colorectal cancer type X,FCCX)是指符合Amsterdam Ⅰ标准,但是肿瘤筛查结果未检测出MMR缺陷(MMR deficiency,dMMR)和高度微卫星不稳定性(microsatellite instability-high,MSI-H)的患者[18]。约50%的符合Amsterdam Ⅰ标准的结直肠癌患者为FCCX。FCCX是一大类异质性极大的疾病,病因尚不清楚。有些可能是其他基因引起的单基因病,有些可能是多基因病,也有些可能是由于相似的环境因素和生活方式引起的,不是遗传性疾病。FCCX的平均诊断年龄比LS相关结直肠癌更大,左半结直肠癌多见,发生结直肠癌的风险低,且较少出现肠外肿瘤[19-21]。

表1 遗传性结直肠癌的列表及结直肠癌风险Tab.1 List of hereditary colorectal cancers and colorectal cancer risks
值得注意的是,由于客观因素的限制,许多时候难以获得确切的家族史信息,因此对于声称无相关家族史的人群并不能完全排除遗传性结直肠癌的可能。同时,基于家族史的筛查已经成为结直肠癌早诊、早治的一项重要策略[22]。
2.2 生活方式和饮食模式
尽管存在遗传因素导致的个体差异,结直肠癌的发生风险与人们的生活方式同样密切相关,并且改变生活方式可以在较短时间内较大幅度地改变结直肠癌的发病率[23]。通常认为肥胖、低体力活动、不良饮食(如红肉和精加工肉类、低纤维、低钙饮食)、饮酒及心理压力等因素是结直肠癌发生的主要危险因素。
2.2.1 生活方式
缺乏体力活动是结直肠癌的危险因素之一[24]。体力活动可能通过促进肠道蠕动、增强免疫和改善代谢等来降低结直肠癌发生的风险[25]。近年来,久坐被认为是结直肠癌发生的另一个危险因素。有研究[26]显示,每天看电视的时间每增加2 h,结直肠癌的发生风险就会增加7%(95% CI:1.05 ~ 1.10)。久坐会损害骨骼肌功能,导致胰岛素抵抗,进而促使结直肠癌的发生[27]。
心理压力是个体对环境事件反应的总和。一项长达21年纳入61 563例患者的前瞻性研究[28]提示,长时间较高的心理压力水平与直肠癌发病率显著相关,但与结肠癌发病率无显著相关性。此外,妊娠期间的高压力水平和睡眠障碍也可能会影响后代的表观遗传构成,影响免疫系统和肠道功能,进而增加后代早发型结直肠癌的发生风险[29]。在压力情况下,受损的免疫系统可能助长肿瘤免疫逃逸,进而促使结直肠癌的发生[30]。在已经确诊的结直肠癌患者中,应激因素及相应介质也是影响疾病进展的重要生物学因素[31]。
2.2.2 饮食模式
长久以来,饮食是公认的导致结直肠癌发生的关键因素,高脂、高热量、低纤维饮食和含硫微生物饮食是结直肠癌发生的危险因素之一。
为了反映食物的累加效应,目前营养研究的重点已从单个营养素或特定食物转换到整体饮食模式[32]。在全球不同人群中进行的研究,主要分为两类饮食模式:健康饮食模式,特征是大量摄入水果、蔬菜、谷物、坚果、豆类、鱼或其他海鲜,以及低脂牛奶等乳制品,如谨慎饮食模式;不健康饮食模式,以大量摄入红肉和加工肉类、含糖饮料、精制谷物、甜点为特征,如西方饮食模式[33]。不健康饮食模式导致结直肠癌发生的生物学机制可能是多方面的,是各种饮食成分相互作用的结果。例如,在不健康饮食模式中,红肉和加工肉类可能直接导致结直肠癌的发生,每天红肉和加工肉类摄入量每增加100 g,罹患结直肠癌的风险将增加12%(95% CI:1.04 ~ 1.21)[34]。此外,有研究[35]指出,含硫微生物饮食可增加结直肠癌的发生风险。含硫微生物饮食的特征是蔬菜豆制品的摄入量低,而加工肉制品的摄入量高。肠道微生物可与食品中的硫代谢产生致癌物质硫化氢,高含量的硫代谢微生物饮食与早发性结直肠腺瘤的发生风险呈正相关[35]。
2.2.3 饮酒和吸烟
任何类型的乙醇饮料中,乙醇都是明确的结直肠癌危险因素。已有研究[36]表明,即使是少量饮酒(每天≤1杯乙醇饮料),也会显著增加结直肠癌的发生风险[相对危险度(risk ratio,RR) = 1.04,95% CI:1.01 ~ 1.06]。乙醇的致癌作用可能与肠道微生物代谢产物乙醛有关[37]。
香烟烟雾含有多种化合物,可通过循环系统或直接摄入到达结直肠黏膜,并诱发遗传和表观遗传学改变[38]。一项观察性研究的meta分析[39]发现,结直肠癌的发生风险随着每年吸烟数量的上升而增长,并且开始吸烟的年龄越小,发生结直肠癌的风险越大。
2.2.4 代谢综合征
结直肠癌的发生与代谢综合征密切相关,其中肥胖是结直肠癌的重要危险因素,在结肠癌患者中尤其明显[40]。评价肥胖的指标中,最常用的是体重指数(body mass index,BMI)和腰围(waist circumference,WC),前者主要反映全身肥胖情况,后者主要反映腹部肥胖。有研究[41]表明,WC相比于BMI是结直肠癌发生的更强的危险因素。研究[42-43]发现,肥胖个体(BMI≥25 kg/m2)患结直肠癌的风险较体重正常个体明显升高[比值比(odds ratio,OR) = 1.42,95% CI:1.19 ~ 1.68],且随着BMI的增加,结直肠癌的发生风险也逐渐增加。对于相同的BMI,亚洲人群的内脏脂肪含量相比白种人更多,男性的内脏脂肪含量比女性更多,可能与遗传因素及激素水平有关[44]。内脏脂肪含量的差异造成男性和亚洲人群结直肠癌的发病率明显较 高[45]。
除了肥胖,包括糖尿病在内的代谢综合征同样是结直肠癌发生的危险因素。有研究[46]指出,年龄<50岁且患有Ⅱ型糖尿病的患者发生结直肠癌和高危腺瘤的风险增加。上述研究明确了代谢因素在结直肠癌病因和预防中的重要性,为后续的防治提供了有力参考。
因此,肥胖及代谢综合征是结直肠癌发生的危险因素[47]。
2.3 肠道微环境
结直肠中存在大量的肠道菌群,肠道菌群与宿主有着复杂的共生关系,维护着肠道内环境稳定,保护肠道免受炎症和癌症侵袭。随着研究的逐步深入,越来越多的证据[38,48-50]表明,肠道微环境与结直肠癌的发生存在相关性。
目前,几种细菌已被证实可以通过特定的生物学机制在促进结直肠癌中发挥关键作用。例如,具核梭杆菌表达黏附素,包括FadA和Fap2,可与肿瘤细胞结合,激活致癌性Wnt/β-连环蛋白(β-catenin)信号转导通路,其促癌作用依赖于菌株的持续定植及产生的毒素TcdB,其诱导结直肠癌的发生与结肠上皮细胞转录反应和致癌性黏膜免疫的改变有关[48]。
此外,肠道菌群失调也可能与结直肠癌发生有关。有研究[49]发现,结直肠癌患者的肠道菌群多样性较健康人群明显降低。另有研究[38]发现,早发型结直肠癌具有独特的细菌代谢特征,使细胞具有更强的增殖和侵袭能力。
除了直接促进结直肠癌外,肠道菌群还可能通过与饮食的相互作用产生影响。抗生素、压力和某些饮食成分可导致肠道微生态失调,进而导致有害细菌产物(如脂多糖)的积累,这些有害微生物的代谢物可能引起炎症反应[50]。因此,避免不利的暴露因素可能对维持肠道微生态平衡乃至结直肠癌的防治至关重要。
2.4 抗生素使用
不恰当的抗生素使用可能与结直肠癌发生有关。一项meta分析[51]论证了抗生素使用与结直肠癌之间的关系,发现在曾经使用过抗生素的个体中,合并结直肠癌的风险增加,特别是广谱抗生素。结直肠腺瘤与大多数结直肠癌的发生关系密切,被视为一种癌前病变。有研究[52]发现,成人抗生素的使用与结直肠腺瘤的发生风险增加有关,特别是直肠乙状结肠恶性肿瘤。上述证据均支持抗生素使用对结直肠癌的发生具有不利影响,其机制可能涉及肠道微生态失调导致的致瘤细菌过度增长和侵袭、肠生物膜诱导的上皮生物学改变等[53]。综上所述,抗生素的使用可能增加结直肠癌的发生风险,目前关于抗生素与结直肠癌关系的研究较少,但抗生素使用与结直肠癌的相关研究为后续进一步探索提供了初步证据。
2.5 IBD和寄生虫
1863年,Virchow提出“炎症和肿瘤”学说,炎症与肿瘤发生的关系被逐渐证实。但迄今为止,这两种病理学状态之间转化的分子变化仍然未明确。
自1925年Crohn等报道IBD相关结直肠癌以来,IBD是结直肠癌风险因素之一的理论已得到广泛认同。溃疡性结肠炎(ulcerative colitis,UC)患者中结直肠癌的总患病率为3.7%,10、20和30年的结直肠癌累积患病率分别为2.0%、8.0%和18.0%。克罗恩病(Crohn’s disease,CD)患者中,10、20和30年的结直肠癌累积患病率分别为2.9%、5.6%和8.3%。尽管近期大规模人群研究[54]结果显示,IBD相关的结直肠癌的发生风险有所下降,结直肠癌仍约占IBD死因的15%。
在全球范围内,约有220万例新发癌症病例归因于致癌感染,占新发癌症总病例的15.4%。日本血吸虫感染已被国际癌症研究机构归类为人类致癌可能。越来越多的流行病学和病理学证据涉及结直肠癌中的日本血吸虫感染,导致肿瘤具有独特的生物学行为。尽管目前缺乏实验证据,但可用的流行病学和病理学数据的共识也强烈暗示了日本血吸虫感染与结直肠癌之间的关联。血吸虫相关的结直肠癌的一些特点已有文献[55]报道,包括诊断发病年龄晚,多为60 ~ 70岁,男性居多,罹患肿瘤的部位以远端大肠为主,以及预后不良等。
2.6 目前已明确的结直肠癌保护因素
2.6.1 合理饮食
现有证据[56]表明,膳食纤维、全谷物及乳制品的摄入可降低结直肠癌的发生风险,膳食纤维,特别是不溶性纤维,可通过减少粪便运输时间和增加粪便的体积进而减少结直肠上皮细胞对肠道内致癌物质的暴露。另一个提出的机制涉及与肠道菌群的相互作用,到达结肠但未消化的可溶性纤维很容易被厌氧肠道菌群发酵成短链脂肪酸(乙酸盐、丙酸盐和丁酸盐等)。人肠道细胞系的体外研究[57-58]表明,丁酸盐可促进正常结肠细胞的存活和结肠肿瘤细胞的凋亡。
有研究[59]表明,增加摄入水果和蔬菜等含有可溶性植物纤维素的食品,可以降低结直肠腺瘤及结直肠癌的发生风险。然而,一篇纳入了14项研究的meta分析[60]发现,相比每日摄入少于200 g水果和蔬菜,每日摄入超过800 g可降低远端结肠癌的发生风险(RR = 0.74),但不会降低近端结肠癌的发生风险。而随后一篇包含19项队列研究的meta分析[61]得出结论,与水果和蔬菜摄入最低量相比,摄入最高量仅有微弱的保护作用(RR = 0.92,95% CI:0.86 ~ 0.99),且只可预防远端结肠癌。综上,摄入量超过100 g/d是降低结直肠癌风险的主要原因,而在此基础上再增加摄入量的获益相对较小。此外,增加膳食钙摄入或使用钙补充剂可能也是结直肠癌的一项保护因素。已有研究[62]评估了钙与结直肠癌发生、发展之间的关系,1篇包含了1 485例受试者的meta分析得出结论,补钙可显著降低结直肠腺瘤的复发风险(RR = 0.80,95% CI:0.68 ~ 0.93),对于钙剂的一级预防效果,目前尚缺乏大规模前瞻性研究,并且其预防作用可能取决于个体的维生素D受体基因型和(或)维生素D水平是否正常。
2.6.2 改善生活方式
适当锻炼,避免久坐。有规律的适当体力活动、适当控制热量摄入,避免肥胖、戒烟、戒酒等都有利于预防结直肠癌。有研究[63]发现,规律的职业性和休闲性体力活动均可预防结直肠癌。相比体力活动少者,体力活动较多者的近端结肠癌的发生风险显著降低27%(RR = 0.73,95% CI:0.66 ~ 0.81),而远端结肠癌的发生风险降低26%(RR = 0.74,95% CI:0.68 ~ 0.80)[64]。
2.6.3 药物使用
适当剂量的阿司匹林或NASID、他汀类药物、女性激素、抗氧化剂及血管紧张素转化酶抑制剂的使用有助于降低结直肠癌及结直肠腺瘤的发生率。已有研究[65]表明,阿司匹林及其他非甾体抗炎药(nonsteroidal anti-inflammatory drug,NSAID)可以预防结肠腺瘤和结直肠癌的发病。在一般风险人群中,常规应用阿司匹林和其他NSAID可使结肠腺瘤和结直肠癌的发生风险降低20% ~ 40%。一项meta分析[66]发现阿司匹林治疗5年或更长时间,剂量为每天75~300 mg,结直肠癌的长期风险可降低24%(HR = 0.75,95% CI:0.56 ~ 0.97),小剂量和大剂量阿司匹林均有预防作用,该作用在近端结肠腺癌中及阿司匹林疗程更长时更显著。对于绝经后女性,绝经后激素替代治疗与结直肠癌的发生风险降低相关[67]。有研究[68]评估了两种他汀类药物对冠状动脉疾病的益处,发现这些药物可轻微降低结肠癌的发病率(次要终点)。体外和体内研究[69]表明,血管紧张素Ⅱ是癌症发生的促成因素,抑制血管紧张素Ⅱ可以减缓结肠癌细胞生长,提示血管紧张素转化酶抑制剂可能对结直肠癌具有保护作用。通常认为,维生素D对结直肠肿瘤具有保护作用,维生素D缺乏症与结直肠肿瘤的发生有关。在全球范围内,在对结直肠肿瘤进展过程中CYP27B1和CYP24A1水平改变的研究[70]结果支持维生素D在预防和(或)早期治疗结直肠肿瘤中的作用。
3 癌前病变及早期结直肠癌
3.1 癌前病变的定义
结直肠癌的癌前病变是指被证实与结直肠癌发生密切相关的病理学变化。结直肠癌的癌前病变包括结直肠腺瘤、腺瘤病(息肉病伴异型增生)、无蒂锯齿状病变、传统锯齿状腺瘤及IBD相关异型增生等[71]。癌前病变的定义主要参考来源包括世界卫生组织(World Health Organization,WHO)消化肿瘤分类(2019版)[72]、《中国结直肠癌癌前病变和癌前状态处理策略专家共识》[73]等多部国内外指南和共识。
3.2 腺瘤的分类及特点
腺瘤是指存在异型增生的上皮。组织学特点为细胞核大且深染,不同程度的细胞梭形、复层并缺乏极向。根据腺体结构的复杂程度、细胞分层程度及核异型程度可分为低级别和高级别。
3.2.1 按大小分类
通常根据腺瘤直径大小,将≤5 m m、5 ~ 10 mm、10 ~ 20 mm和>20 mm的息肉分别称为微小腺瘤、小腺瘤、大腺瘤和巨大腺瘤。
3.2.2 肉眼形态学分类
根据息肉形态及与黏膜平面关系进行分类,即巴黎分型。
3.2.2.1 隆起型
病变明显隆起于肠腔,基底部直径明显小于病变头部最大直径(有蒂或亚蒂);或病变呈半球形,基底部直径明显大于病变头部最大直径。分为3个亚型:
⑴ Ⅰp型:即有蒂型,病变基底部有明显的蒂与肠壁相连。
⑵ Ⅰsp型:即亚蒂型,病变基底部有亚蒂与肠壁相连。
⑶ Ⅰs型:病变明显隆起于黏膜面,但基底无明显蒂结构,基底部直径明显小于或大于病变头端最大直径。
3.2.2.2 平坦型
病变高度低平或平坦隆起型统称平坦型。分为5个亚型:
⑴ Ⅱa型:病变直径<10 mm,平坦型病变或与周围黏膜相比略高。
⑵ Ⅱb型:病变与周围黏膜几乎无高低差者。
⑶ Ⅰa+dep型:即在Ⅱa型病变上有浅凹陷者。
⑷ LST-NG:非颗粒型侧向发育型腺瘤,可分为平坦型(Ⅱa型)及假凹陷型(Ⅱa+Ⅱc型、Ⅱc+Ⅱa型)。
⑸ LST-G:颗粒型侧向发育型腺瘤,可分为颗粒均一型(Ⅱa型)及结节混合型(Ⅱa型、Ⅰs+Ⅱa型、Ⅱa+Is型)。
3.2.2.3 浅表凹陷型
病变与周围黏膜相比明显凹陷,分为4个亚型:
⑴ Ⅱc型:病变略凹陷于周围正常黏膜。
⑵ Ⅱc+Ⅱa型:凹陷病变中有隆起区域。
⑶ Ⅱa+Ⅱc型:隆起型病变中有凹陷区域,但隆起相对平坦。
⑷ Ⅰs+Ⅱc型:隆起型病变中有凹陷区域,但隆起相对较高,该型病变都是黏膜下层高度浸润者,目前不属于内镜治疗的适应证。
3.2.3 基于表面腺管开口及血管形态学的分型
3.2.3.1 窄带成像(narrow-band imaging,NBI)非放大内镜(magnifying endoscopy,ME)下的分类
NBI模式下,可观察血管及腺体开口形态。
2006年提出的Sano分型,即根据毛细血管网形态分型:Ⅰ型无毛细血管改变;Ⅱ型可见腺体周围毛细血管网;Ⅲ型可见网状毛细血管网末端及分支杂乱不规则,其中ⅢA型具有更密集的血管网,而ⅢB型的血管网形态几乎不可见。
2010年提出的NBI国际结直肠息肉内镜分型—NICE分型,即根据颜色、血管、表面腺管口形态分型:NICE1型表面颜色较正常组织浅或相同,表面无血管或仅有单一的花边状血管,腺管口呈黑色或白色点状,或均匀缺失,对应病理学类型可能为增生性息肉或无蒂锯齿状腺瘤/息肉;NICE2型息肉表面及血管呈棕色,腺管口为白色椭圆、管状或分支状结构,对应病理学类型为腺瘤;NICE3型病变呈棕黑色,血管分布混乱或缺失,腺管开口极不规则或缺失,可能的病理学类型为深层黏膜下浸润癌。多项研究[74-75]显示,NICE分型对息肉组织学诊断的准确率为59.5% ~ 84.2%。
3.2.3.2 ME-NBI下的分类
根据息肉在ME-NBI下的表现结合表面腺管开口和微血管表现,日本研究者在2014年提出JNET分型:1型病变表面血管不可见,腺管口为棕色或白色点状,与周围正常组织相似,对应增生性息肉或无蒂锯齿状腺瘤;2A型病变表面毛细血管网规则,呈螺旋状或网状分布,腺管口呈管状、分支或乳头状,对应低级别上皮内瘤变(low grade dysplasia,LGD);2B型息肉表面血管不规则,分布无秩序,腺管口显示不规则或模糊,对应高级别上皮内瘤变(high grade dysplasia,HGD)或浅层黏膜下浸润癌;3型病变表面毛细血管稀疏中断,腺管开口无特定形态,对应深层黏膜下浸润癌。有研究[76]显示,根据JNET分型,息肉判断准确率达90%。
3.3 结直肠癌的常用分期方法
根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版TNM分期系统,结直肠癌可分为0、Ⅰ、Ⅱ、Ⅲ和Ⅳ期[77]。结直肠癌解剖学分期推荐应用AJCC第8版TNM分期系统(表2)。
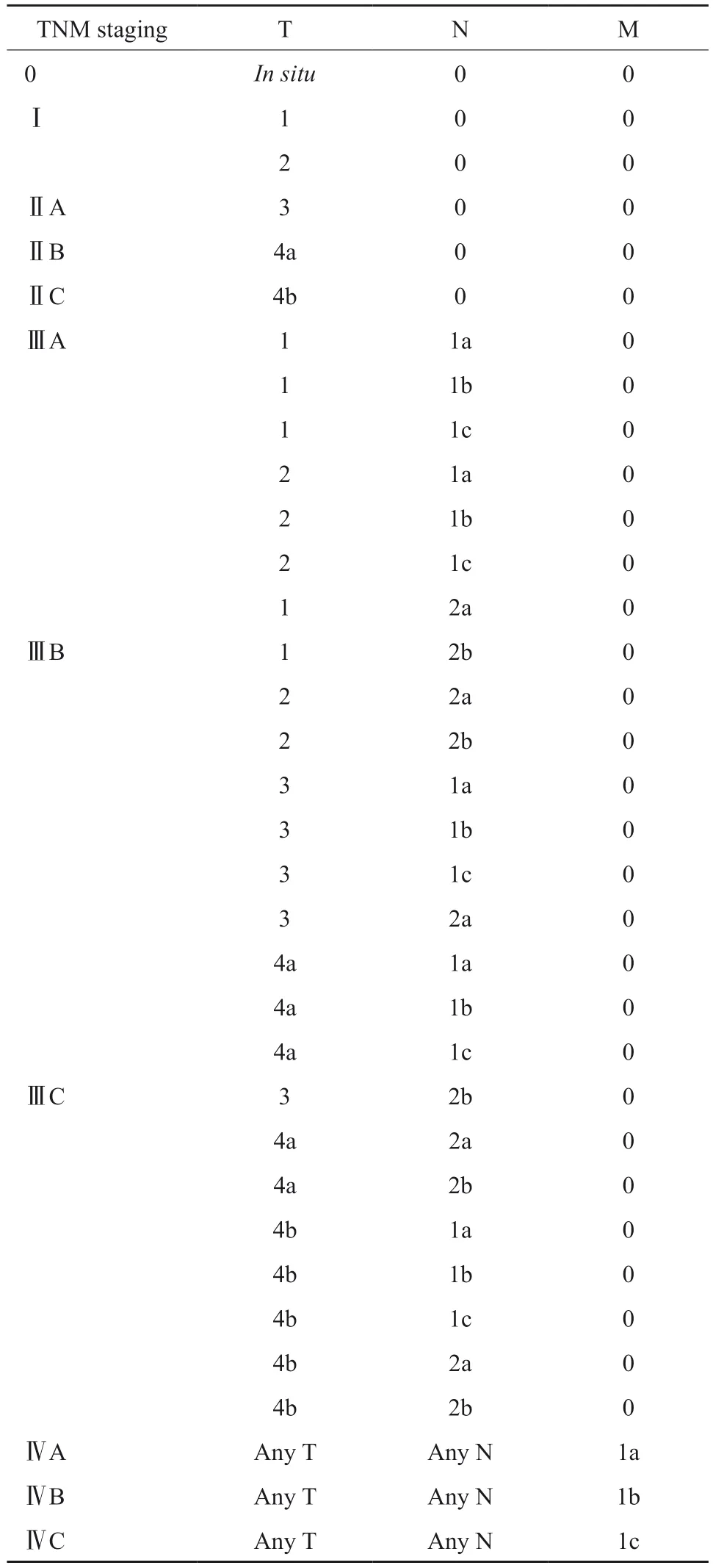
表2 AJCC第8版TNM分期系统Tab.2 The AJCC 8th edition TNM staging system
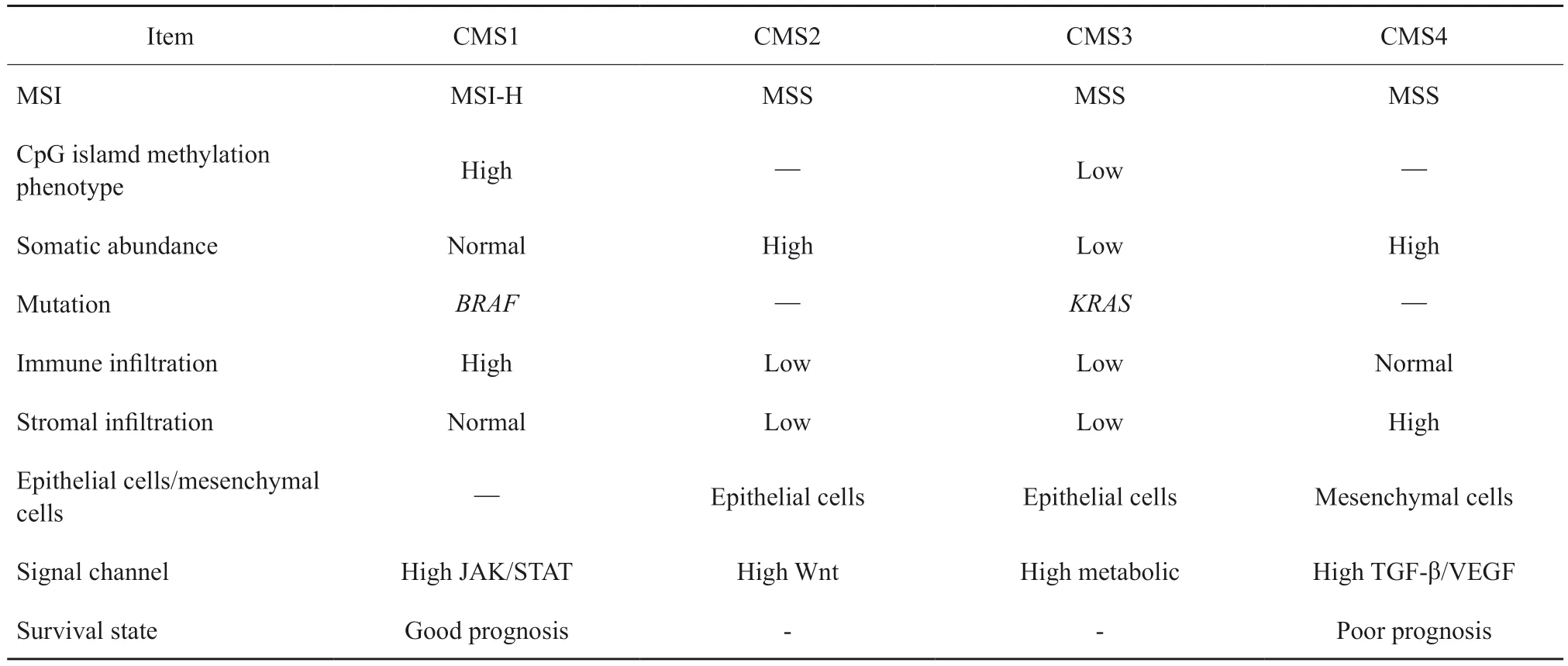
表3 结直肠癌CMS分型特点Tab.3 Characteristics of consensus molecular subtypes of colorectal cancer
3.3.1 原发性肿瘤(T)
Tx:原发肿瘤不能评估;T0:无原发肿瘤证据;Tis:原位癌,局限于上皮内或侵犯黏膜固有层;T1:肿瘤侵犯黏膜下层;T2:肿瘤侵犯固有肌层;T3:肿瘤穿透固有肌层到达浆膜下层或侵犯无腹膜覆盖的结直肠旁组织;T4:肿瘤侵犯腹膜脏层或侵犯/粘连于临近器官或结构[T4a:肿瘤侵犯腹膜脏层(包括大体肠管通过肿瘤穿孔和肿瘤通过炎性区域连续浸润腹膜脏层表面);T4b:肿瘤侵犯/粘连于临近器官或结构]。
3.3.2 区域淋巴结(N)
Nx:区域淋巴结无法评估;N0:无区域淋巴结转移;N1:1 ~ 3枚区域淋巴结转移(淋巴结内肿瘤最大直径≥0.2 mm)或存在任何数量的肿瘤结节并且所有可辨识的淋巴结无转移;N1a:1枚区域淋巴结转移;N1b:2 ~ 3枚区域淋巴结转移;N1c:浆膜下、肠系膜、无腹膜覆盖的结直肠组织周围内有肿瘤堆积,且无区域淋巴结转移;N2:≥4枚区域淋巴结转移;N2a:4 ~ 6枚区域淋巴结转移;N2b:≥7枚区域淋巴结移。
3.3.3 远处转移(M)
M0:无远处转移的临床或放射影像学证据;M1:临床和放射影像学检查证实具有远处转移;M1a:远处转移仅局限于单个器官(如肝、肺、卵巢等),但没有腹膜转移;M1b:远处转移分布于一个以上的器官,但没有腹膜转移;M1c:存在腹膜转移,伴或不伴有其他器官转移。
随着分子通路机制研究的不断深入,2015年Guinney等[78]分析了来自不同基因表达平台和不同肿瘤类型的大型数据集共4 151例Ⅱ ~ Ⅲ期结直肠癌患者,提出结直肠癌共识分子亚型分型法(consensus molecular subtypes classification,CMS)。此方法根据基因组学、表观遗传学、转录组学和蛋白质组学方面将结直肠癌分为CMS1、CMS2、CMS3和CMS4共4种亚型(表 3)。⑴ CMS1型:又称免疫活化型,占所有结直肠癌患者总数的14%。CMS1型代表了高度的变异特征,MSI-H,常伴随BRAF突变,CpG岛甲基化表型(CpG island methylator phenotype,CIMP),免疫浸润高,预后相对较好。
⑵ CMS2型:又称经典型,占所有结直肠癌患者总数的37%。CMS2型具有高体细胞拷贝数变异。Wnt和MYC信号转导通路是结直肠癌经典腺瘤-腺癌发生的关键信号转导通路。CMS2型常伴有Wnt和MYC信号通路的激活,表现为Wnt信号转导通路的下游靶点APC基因发生突变及抑癌基因TP53基因高度突变。
⑶ CMS3型:又称代谢型,占所有结直肠癌患者总数的13%,多位于右半结肠,病理学特征上多表现为中、高分化的乳头状肿瘤,具有显著的代谢失调特征,是结直肠癌分子亚型中唯一存在KRAS基因高频突变的亚型,并以KRAS基因突变为主要特征。
⑷ CMS4型:又称间质型,占所有结直肠癌患者总数的23%,以直肠癌为主,就诊时多为晚期,常有上皮-间质转化(epithelial-mesenchymal transition,EMT)相关基因的上调、血管生成、各种转化生长因子-β(transforming growth factor-β,TGF-β)信号转导通路及间质重建通路的激活,并表现出高复发性和更低的存活率。CMS4型的主要特征为肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)浸润邻近肿瘤组织及肿瘤干细胞化。CMS4型结直肠癌中,可见CAF浸润肿瘤间质。
3.4 早期结直肠癌的定义及治疗
目前中国普遍将局限于结直肠黏膜层及黏膜下层的癌定义为早期结直肠癌,其中局限于黏膜层的为黏膜内癌,浸润至黏膜下层但未侵犯固有肌层者为黏膜下癌[71]。
早期结直肠癌术后无需行放化疗,实施根治性手术患者可获得长期生存,5年局部复发率约4.5%,5年无病生存(disease-free survival,DFS)率约90.0%。
3.5 由癌前病变发展成早期结直肠癌的机制及分子病理学基础
3.5.1 Wnt信号转导通路
Wnt信号转导通路是人体维持细胞、干细胞特性的重要信号转导通路,涉及细胞生长、增殖和分化等生命活动,在机体的生长发育过程中发挥关键作用。目前已经明确,Wnt信号转导通路的异常激活会导致肠道病变,是导致结直肠癌发生、发展的主要原因,约90%的结直肠癌患者存在Wnt信号转导通路的异常[79]。基因的损伤可使Wnt信号转导通路激活,使非典型细胞增殖导致腺瘤形成,而突变慢慢积累,最终导致腺瘤进展为结直肠癌,并引起肿瘤的侵袭、转移。Wnt/β-catenin信号转导通路的特点是Wnt与其核心受体复合物(脂蛋白相关受体5/6)和Frizzled蛋白家族的10个成员结合[80]。在没有Wnt配体的稳定状态下,β-catenin被由糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、酪蛋白激酶Ⅰ(casein kinase Ⅰ,CKⅠ)、轴素(axin)和APC组成的复合物磷酸化。Axin是一种支持与GSK-3β和APC形成复合物的物质。一旦进入复合物,GSK-3β能够促进细胞质中β-catenin的磷酸化,APC介导磷酸化β-catenin与细胞质中泛素介导的蛋白水解途径的结合。在存在Wnt蛋白配体的情况下,Wnt与其核心受体复合物结合,通过募集胞质蛋白Dishevelled并阻断或破坏Axin/GSK3/APC复合物的形成来激活Wnt信号转导通路,从而抑制β-catenin的降解导致β-catenin在细胞质中积累。然后,积累的β-catenin转移到细胞核中,并与转录因子T细胞因子/淋巴增强因子1结合,启动Wnt靶基因的表达。
Wnt信号转导通路可通过诸多生化过程促进结直肠癌的发生、发展。环状RNA在包括结直肠癌在内的各种癌症的进展中发挥至关重要的作用。SP1是结直肠癌中公认的癌基因,被认为可以触发Wnt/β-catenin信号转导通路。研究[81]发现,hsa_circ_0026628(circ_0026628)是一种源自SP1前体mRNA的圆形RNA,在结直肠癌细胞中表达上调,促进结直肠癌细胞增殖、迁移、EMT和干燥。有研究[82]表明,circ_0082182在结直肠癌中表达上调,在功能上,circ_0082182通过靶向miR-411和miR-1205激活Wnt/β-catenin信号通路,促进结直肠癌细胞增殖、细胞周期进展和转移,同时抑制细胞凋亡和EMT过程,在体内,circ_0082182通过下调miR-411或miR-1205的表达激活Wnt/β-catenin信号转导通路,从而加速结直肠癌肿瘤的发生。
APC基因是首个被发现与结直肠癌发生相关的基因,也是结直肠癌患者体细胞突变率最高的基因[83]。其失活突变及启动子区甲基化可降低由其组成的B-细胞连接蛋白降解复合体对B-细胞连接蛋白的降解作用,导致B-细胞连接蛋白在细胞质内的大量蓄积及Wnt信号转导通路的异常激活,是大多数结直肠癌的起始分子事件,可导致正常大肠黏膜转变为息肉。荷兰阿姆斯特丹大学医学中心的研究者通过构建APC基因失活介导的小鼠和人类肠癌模型,发现APC介导的β-catenin是一种有助于维持肠道干细胞状态的基因表达调节剂,会积极抑制邻近细胞的生长甚至诱导野生型肠道干细胞凋亡[84]。不仅如此,携带APC突变的癌症干细胞相比正常干细胞有更强的竞争优势,这种优势是由于APC突变细胞能分泌Wnt拮抗因子,不仅抑制了正常干细胞的活性,还会促进其分化。而最新研究[85]发现,氯化锂能消除Wnt拮抗因子的抑制作用,为预防肠癌提供了新策略。
3.5.2 磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号转导通路
PI3K信号转导通路广泛存在于细胞中,是参与细胞生长、增殖、分化及细胞周期调节的重要信号通路。该信号通路在恶性肿瘤的发生、发展、治疗及转归中均发挥重要作用,在一系列上游或旁路信号分子的影响下,作用于下游的信号分子对细胞调亡起着非常重要的调节作用。
PI3K是一种胞内磷脂酰肌醇激酶,能够将磷脂酰肌醇或磷酸肌醇的第三位羟基磷酸化,其本身既有丝氨酸/苏氨酸激酶的活性,也有磷脂酰肌醇激酶的活性,由一个催化亚基p110和调节亚基p85构成。根据p110结构特点和底物分子的不同,PI3K可分为Ⅰ型、Ⅱ型和Ⅲ型,Ⅰ型又可分为ⅠA和ⅠB两个亚型,其中ⅠA亚型与癌症发生的关系最为密切,并可被受体型酪氨酸激酶、G蛋白偶联受体和小G蛋白RAS激活。上述受体蛋白接受相应信号激活后可以募集并激活PI3K。激活的PI3K可以将包膜上的磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)转化为磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-trisphosphate,PIP3),后者可为磷酸肌醇依赖性蛋白激酶1提供锚定位点,使其转位至细胞膜。AKT是一种丝氨酸/苏氨酸激酶,分为AKT1型、AKT2型和AKT3型。AKT在锚定至细胞膜后可在自身和3-磷酸肌醇依赖的蛋白激酶1(3-phosphoinositidedependent protein kinase 1,PDK1)的作用下发生多个丝氨酸/苏氨酸位点的磷酸化,得以激活并脱离PIP3,进入细胞质或细胞核内,进一步磷酸化下游的信号分子,调控细胞的蛋白合成及细胞增殖和代谢。AKT下游的信号分子中,哺孔动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一类重要靶分子,包括mTOR1型和mTOR2型,具有调控mRNA翻译过程的重要作用,进而影响细胞增殖和血管生成。10号染色体上缺失的磷酸酶与张力蛋白同源物(phosphatase and tensin homologue deleted on chromosome ten,PTEN)基因是PI3K信号通路的负向调控因子,有脂质磷酸酯酶活性,可将PIP转化为PIP2,抑制PI3K信号转导通路的激活。
有研究[86]发现,在LS中存在PI3KCA和KRAS基因明显突变,PI3KCA和AKT过表达,以及PTEN抑癌基因缺失,PI3K/AKT/mTOR信号转导通路的激活是结直肠癌发生、发展的重要环节,包括促进蛋白质合成和影响细胞增殖。PI3K抑制剂可抑制mTOR活性,阻滞G1期细胞周期,阻断细胞生长。Engelman研究[87]发现,PI3KCA基因突变引起的PI3K/AKT信号转导通路激活可显著促进结直肠癌细胞增殖,AKT可磷酸化mTOR及其下游分子传递生存信号,抑制细胞凋亡,促进结直肠癌细胞存活。综上,PI3K信号转导通路通过促进细胞增殖、延长细胞存活、抑制细胞凋亡等途径参与结直肠癌的进展。
3.5.3 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号转导通路
MAPK信号转导通路是真核生物信号传递网络中的重要途径之一。MAPK/ERK信号通路由一系列细胞质蛋白组成。该途径涉及三种主要激酶,包括MAPK/ERK、MAPK14和c-Jun氨基末端激酶。MAPK/ERK信号通路在调节细胞增殖中的作用取决于信号从刺激因子(如应激、细胞因子、生长因子和炎症)传递到细胞核的过程。以一种独立于蛋白激酶C(protein kinase C,PKC)机制的方式,受体酪氨酸残基的磷酸化和活化导致对接蛋白(如Grb2)与受体的磷酸酪氨酸残基结合,随后与Ras鸟嘌呤核苷酸交换蛋白质(如Sos)。在激活Sos后,Ras家族鸟苷三磷酸(guanosine triphosphate,GTP)酶(KRAS、N-Ras)从非活动的鸟苷二磷酸(guanosine diphosphate,GDP)结合形式转换为活动的GTP结合形式。活化的GTP-Ras导致磷酸盐的形成并激活丝氨酸/苏氨酸激酶蛋白(如Raf-1)。相比之下,PKC传递的信号导致GTP与Ras成员的结合增加,然后以PKC依赖的方式激活Raf1。PKC激活Raf-1后,MEK1/2的第217和221位的两个丝氨酸残基也被Raf-1磷酸化和激活。最终,ERK家族酶被MEK1/2磷酸化和激活,将几个细胞质蛋白靶点磷酸化或转移到细胞核中,参与各种细胞生命过程。PKC依赖性和PKC非依赖性机制都参与由EGF等刺激因子激活的MAPK/ERK信号通 路。
已有多项研究[88-91]表明,MAPK/ERK信号转导通路的激活,通过影响细胞增殖、凋亡和细胞生长来刺激结直肠细胞癌变。已知的机制包括MAPK/ERK成分的突变、参与肿瘤发生的靶基因的过表达和相关信号转导通路受体的上调[如表皮生长因子受体(epidermal growth factor receptor,EGFR)]等[92-93]。这些改变不仅存在于原发性肿瘤中,而且也发生在转移性肿瘤中[94]。
研究[88]表明,RAS突变存在于40% ~ 50%的结直肠癌病例中。其中85% ~ 90%发生在第12或13位密码子上,其余发生在第61位及146位密码子上。点突变使KRAS基因激活,影响其编码蛋白的G蛋白结合域,导致内在GTP酶持续激化,RAS-RAF-MAPK信号转导通路不再依赖EGFR上游信号而呈持续异常激活。多项临床研究[95-96]表明,转移性结直肠癌患者KRAS基因突变状态与抗EGFR单抗疗效关系密切。
BRAF突变存在于10% ~ 20%的结直肠癌中,并且发生在结直肠癌变的早期阶段,通常与预后不良有关。因此,BRAF突变会刺激MAPK/ERK信号转导,影响细胞生长、局部侵袭和转移。BRAFV600E突变是BRAF突变中最常见的遗传改变,由谷氨酸残基取代缬氨酸600引起。BRAF突变体与MLH1启动子甲基化和高水平CIMP导致的散发性MSI-H肿瘤相关。有研究[97]显示,BRAF突变的预后作用与MSI状态之间没有显著关联,而BRAF/MSI组合可能是评估结直肠癌预后风险的分子生物标志物。一项meta分析[98]发现,BRAFV600E突变与结直肠癌的致病特征显著相关,包括TNM分期、分化差、MSI、CIMP和MLH1甲基化等。
3.5.4 TGF-β信号转导通路
TGF-β信号转导通路作用范围广泛,包括各种病理生理学过程,如细胞增殖分化、创伤愈合、胚胎发育、细胞外基质形成、神经系统发育及肿瘤的发生、发展。TGF-β信号转导通路主要成员包括TGF-β超家族蛋白、TGF-β受体及胞质蛋白Smads。TGF-β超家族包括TGF-β、激活蛋白、抑制素及骨形态发生蛋白(bone morphogenetic protein,BMP)等。TGF-β可进一步分为TGF-β1型、TGF-β2型和TGF-β3型,是一种同源二聚体分泌蛋白,在正常状态下与休眠相关多肽(latent-associate peptide,LAP)及休眠TGF-β结合蛋白(latent TGF-β binding protein,LTBP)结合形成无活性的休眠复合物,储存在血小板α颗粒中。在微环境发生某些改变(如血小板反应素改变LTBP的结构)时,促使TGF-β从复合物中释放,与靶细胞膜表面的TGF-β受体结合启动TGF-β信号转导通路。TGF-β受体分为Ⅰ型、Ⅱ型和Ⅲ型,其中Ⅲ型受体不直接参与信号传递。Ⅰ型受体和Ⅱ型受休均属于丝氨酸/苏氨酸激酶受体,两者通过形成异源二聚体发挥作用,其中Ⅱ型受休的胞外段负责与TGF-β超家族信号结合,并激活自身胞内段的丝氨酸/苏氨酸活性,进而募集Ⅰ型受体形成异源二聚体,并通过磷酸化作用将其活化,后者将信号传递给胞质蛋白Smads。Smads蛋白中有MH1和MH2两个关键结构域,分別位于氨基端和羧基端。MH1结构域可特异性识别DNA序列CAGAC;而MH2结构域可与转录激活蛋白或辅阻遏物相互作用,是Smad的功能区。依其结构和功能的不同,Smad蛋白可大致分为3类:① 受体调控型Smad(receptor-regulated Smad,R-Smad),包括1、2、3、5和8亚型;② 辅助型Smad(commonmediator Smad,Co-Smad),包括4亚型,与R-Smad相互作用参与信号传递;③ 抑制型Smad(inhibitory Smad,I-Smad),包括6、7亚型,可抑制R-Smad和Co-Smad的激活。总体而言,2、3、4、7亚型介导TGF-β的信号转导,而其他亚型参与BMP和激活蛋白的信号转导。活化的Ⅰ型受体可磷酸化R-Smad,后者与Co-Smad即Smad4结合,形成异源寡聚体复合物,然后转位进入细胞核内,直接与DNA结合或与其他DNA结合蛋白一起发挥转录因子作用。另一方面,I-Smad可拮抗R-Smad的信号传递,形成可控制TGF-β信号通路的负反馈环路。
对于恶性肿瘤而言,TGF-β信号转导通路可以表现出两种截然相反的作用:在肿瘤发生初期调控细胞周期停止,抑制增殖;在肿瘤晚期则促进肿瘤细胞运动、EMT,促进肿瘤发展和转移。肿瘤微环境是肿瘤发生、发展的稳态环境,其中多种细胞表达TGF-β。TGF-β信号转导通路能够作用于肿瘤微环境,使肿瘤发生纤维化、血管生成,诱导免疫抑制。
3.6 本章小结
目前有关结直肠癌的发生途径,多数学者认同结肠腺瘤-腺癌途径。根据结肠腺瘤大小、形态学及NBI内镜分型等,众多学者提出了不同的分类方式。结直肠癌的传统TNM分期目前在临床上的应用仍旧十分广泛,但随着分子通路机制的研究不断深入,结直肠癌CMS随之诞生。
结直肠癌的进展过程是由多因素作用、多基因调控的极其复杂的生物学现象,其信号转导通路错综复杂。本章对研究较为成熟的几条信号转导通路进行了简要介绍,包括Wnt信号转导通路、PI3K/AKT信号转导通路、MAPK/ERK信号转导通路及TGF-β信号转导通路。
4 结直肠癌的筛查
结直肠癌是全球范围内常见的恶性肿瘤之一,其发病率位居恶性肿瘤第3位,死亡率位居恶性肿瘤第2位,是威胁人类生命健康的主要疾病之一[99]。近年来,随着生活水平的不断提高,生活方式及饮食结构的变化,结直肠癌在中国的发病率仍呈不断上升的趋势,已成为中国消化系统发病率第2位的恶性肿瘤[100-101]。因此,降低结直肠癌的发病率和死亡率,能够减轻国民经济负担,提高国民整体寿命及健康水平。
结直肠癌筛查可以有效地降低结直肠癌死亡率和发病率。通过结直肠癌筛查,可以在疾病早期发现病变,提升结直肠癌的早诊率,有效改善结直肠癌的治疗效果,降低死亡率,提高患者生存率。大多数结直肠癌的发生、发展遵循腺瘤-癌序列,从癌前病变进展到癌需要5 ~ 10年,这给了结直肠癌筛查充足的时间进行早期发现。早期结直肠癌的5年生存率要显著高于晚期,Ⅰ期的5年生存率接近90%。美国从20世纪80年代开始推广结直肠癌筛查,30年来美国的结直肠癌死亡率下降了30%[102]。中国结直肠癌的癌症负担严重,总体生存率较低,最主要原因是大多数结直肠癌患者首诊时已是中晚期,早诊率仅10%左右[103-104]。因此,提高结直肠癌早诊率,是改善目前中国结直肠癌高发病率、高死亡率,降低结直肠癌负担的关键步骤。
提高早诊率,关键在于优化结直肠癌筛查策略并提高结直肠癌筛查的普及率。中国结直肠癌的筛查工作起步于20世纪70年代,由浙江大学在浙江省海宁市、嘉善县等结直肠癌高发地区率先建立肿瘤登记系统,并创立了结直肠癌序贯筛查模式。2005年,在中央财政补助地方公共卫生专项资金支持下以海宁市、嘉善县两地作为示范基地,进一步开展结直肠癌筛查工作,并证实粪便隐血试验(fecal occult blood test,FOBT)相比于序贯结直肠癌筛查模式和问卷形式,可显著提高结直肠癌和腺瘤检出率。2007年,国家卫生和计划生育委员会在全国农村地区推广农村癌症早诊、早治项目,其中包括结直肠癌筛查。2012年,“城市癌症早诊、早治项目”正式开展,并逐渐覆盖至全国,至2017年,参与基线调查的40 ~ 74岁居民近268万,覆盖全国18个省、直辖市和自治区的38个城市,并且通过风险评估筛查出了40余万结直肠癌高危人群。上海市由复旦大学附属肿瘤医院联合上海市疾病预防控制中心等单位于2008年率先在上海市闵行区七宝镇开展了大肠肿瘤的社区筛查工作,建立起合适的筛查流程并在此基础上发展出适合上海地区人群特点的筛查策略。基于该项目的成功经验,上海市政府将大肠癌筛查列为上海市公共卫生服务项目,并于2013年启动了百万人群的大肠癌社区筛查。
2019年,由国家消化系统疾病临床医学研究中心(上海)牵头制订了《中国早期结直肠癌筛查流程专家共识意见(2019,上海)》[105]。该共识推荐在50 ~ 75岁人群中选用结直肠癌筛查高危因素量化问卷、伺机筛查风险问卷和亚太结直肠癌筛查(Asia-Pacific colorectal screening,APCS)评分3种问卷,结合粪便免疫化学检测(fecal immunochemical test,FIT)、粪便DNA检测进行初筛,任一结果为阳性者建议接受结肠镜检查。2020年,国家癌症中心中国结直肠癌筛查与早诊早治指南专家组制订了《中国结直肠癌筛查与早诊早治指南(2020,北京)》[106],中华医学会肿瘤学分会早诊早治学组制订了《中国结直肠癌早诊早治专家共识》[107],提出了适合中国国情的结直肠癌筛查策略。
现阶段,众多的筛查专家共识在筛查策略上仍然存在一定差异,并且缺乏实践应用反馈。因此,我们将在总结前期结直肠癌筛查经验与共识的基础上,进一步归纳并总结适合中国当下国情的结直肠癌筛查策略。
4.1 筛查方式
4.1.1 问卷调查
现阶段,国内在无症状人群筛查方面应用较多的问卷或评分系统主要包括结直肠癌筛查高危因素量化问卷、伺机筛查风险问卷、APCS评分及其修订版以及中国结直肠肿瘤预测评分。
结直肠癌筛查高危因素量化问卷凝聚了中国结直肠癌高发现场筛查工作的宝贵经验,尤其适合筛选出有症状、有家族史和高危病史的人群,在中国使用范围广,顺应性良好,是国内社区层面筛查中最常用的群人群危险分层问卷。伺机筛查风险问卷则是针对到医院就诊的个体进行肠癌筛查,一般由医务人员使用。APCS评分及其修订版作为筛选结直肠癌和进展期腺瘤高风险人群的工具更为简洁易用,已得到较为广泛的验证,基于无症状人群年龄、性别、吸烟、结直肠癌家族史、BMI和自诉糖尿病的评分系统可预测结直肠腺瘤、进展期腺瘤和结直肠癌的总体风险,有助于后续筛查方案的选择(表4)。
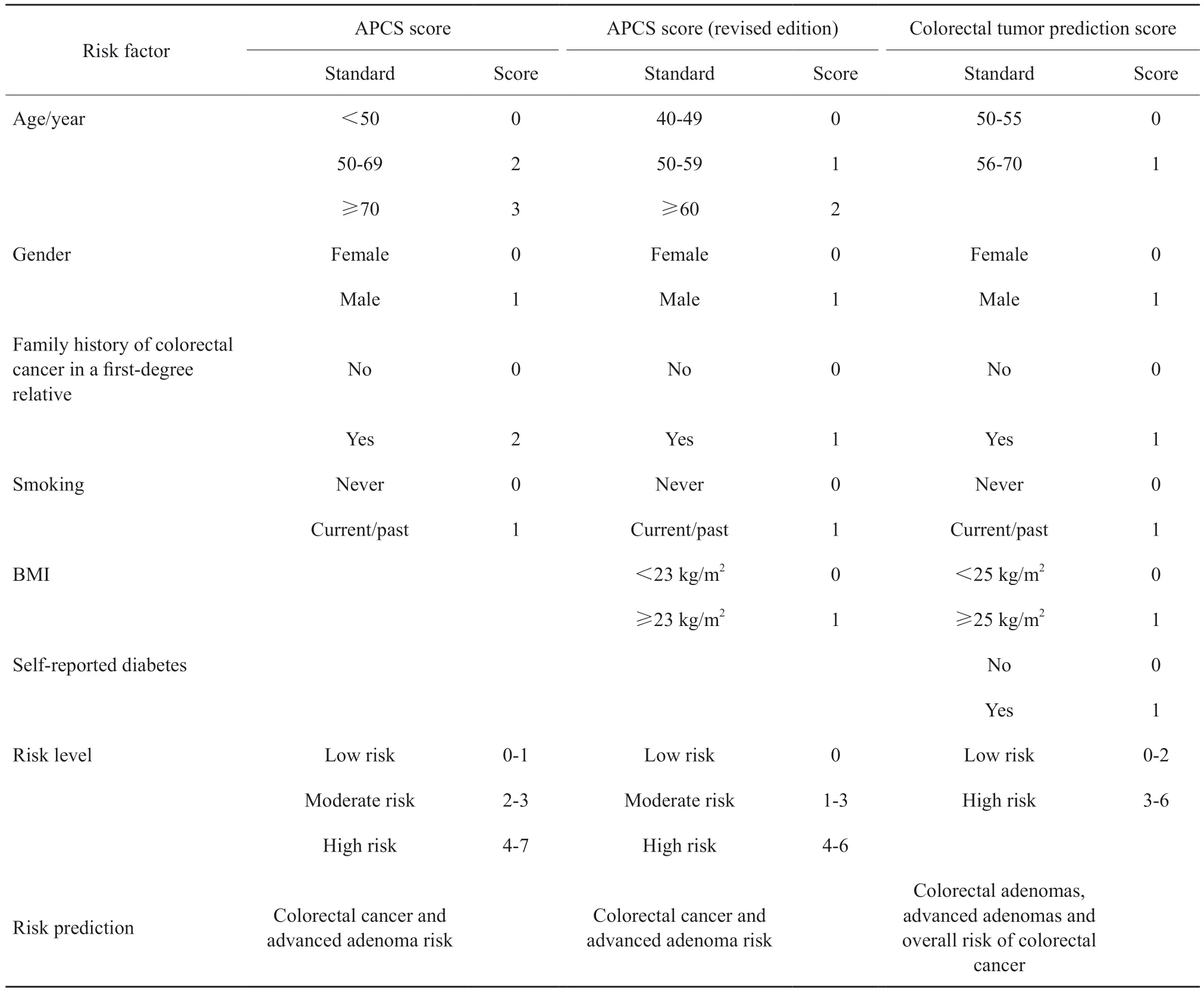
表4 结直肠癌筛查人群危险分层评分系统Tab.4 The colorectal cancer screening population risk stratification scoring system
4.1.2 基于粪便的筛查手段
4.1.2.1 化学法FOBT
化学法FOBT是早期肠癌常用的筛查手段,其中以愈创木脂FOBT(guaiac-based FOBT,gFOBT)最为常用。研究[108]表明,化学法FOBT可以降低肠癌患者的死亡率,但由于其对结直肠癌及癌前病变较低的灵敏度,因此无法降低结直肠癌的发病率,并且其检测结果非常容易受到饮食的干扰导致更高的假阳性率。因此,化学法FOBT已经逐渐被FIT所替代。
4.1.2.2 FIT
FIT利用人血红蛋白抗原抗体反应的原理进行检测,可克服化学法检测的不足,避免了食物等因素的影响,显著提升筛查结果的特异度、灵敏度及阳性预测值,更适合用于人群筛查,并且被证明可以降低52%的结直肠癌死亡率[106]。因此,FIT已被全球多项指南推荐用于结直肠癌筛查。FIT有多种检测方法,主要包括胶体金法、乳胶凝集比浊法及酶联免疫吸附法等,其中定性的胶体金试纸在中国结直肠癌筛查中的应用最为广泛,且以连续两个粪便样本的FIT成本效益更佳。文献报道,FIT诊断结直肠癌的灵敏度和特异度分别为74%和96%,但其检测进展期腺瘤的灵敏度偏低,一般仅24%[109]。
4.1.2.3 多靶点粪便DNA检测
粪便DNA检测主要针对结直肠脱落细胞的基因突变和(或)甲基化等靶点,也可与FIT联合检测。现阶段,多靶点粪便FIT-DNA检测(ColoGuard:包括FIT与KRAS突变、NDRG4甲基化和BMP3甲基化)已被国外批准用于结直肠癌筛查,其检测结直肠癌的灵敏度高于FIT(92.3%vs73.8%)[109]。对于癌前病变(进展期腺瘤),多靶点粪便FIT-DNA检测的灵敏度也显著提高(42.4%vs23.8%)。因此,美国多个权威组织推荐将其应用于无症状人群结直肠肿瘤的早期筛查,推荐周期为3年1次或1年1次。国内ColoClear by Circle试剂盒与ColoGuard的设计类似,检测的具体位点有所差别,检测结直肠癌的灵敏度为95.5%。Mo等[110]报道了在ColoGuard的基础上联合Septin9甲基化、BRAF和PI3KCA突变以及肠道菌群的多靶点粪便DNA检测方法,结果显示,多靶点粪便FIT-DNA检测对比FIT单一手段显著提高了结直肠癌和腺瘤的检测灵敏度(结直肠癌:81.5%vs69.4%;结直肠腺瘤:27.8%vs11.1%)。国内另一项研究[111]将检测试剂盒联合检测粪便标本中SFRP2和SDC2基因甲基化(荧光PCR法)用于诊断结肠癌和进展期腺瘤的灵敏度分别达到了97.7%和57.9%,显著高于FIT法(69.7%和21.1%,P<0.05)。然而,现阶段粪便DNA检测用于人群早期结直肠癌筛查的主要缺点在于价格相对较高,应用于大规模人群筛查仍然存在卫生经济学的障碍。上述3种基于粪便的检查手段的优缺点比较见表5。
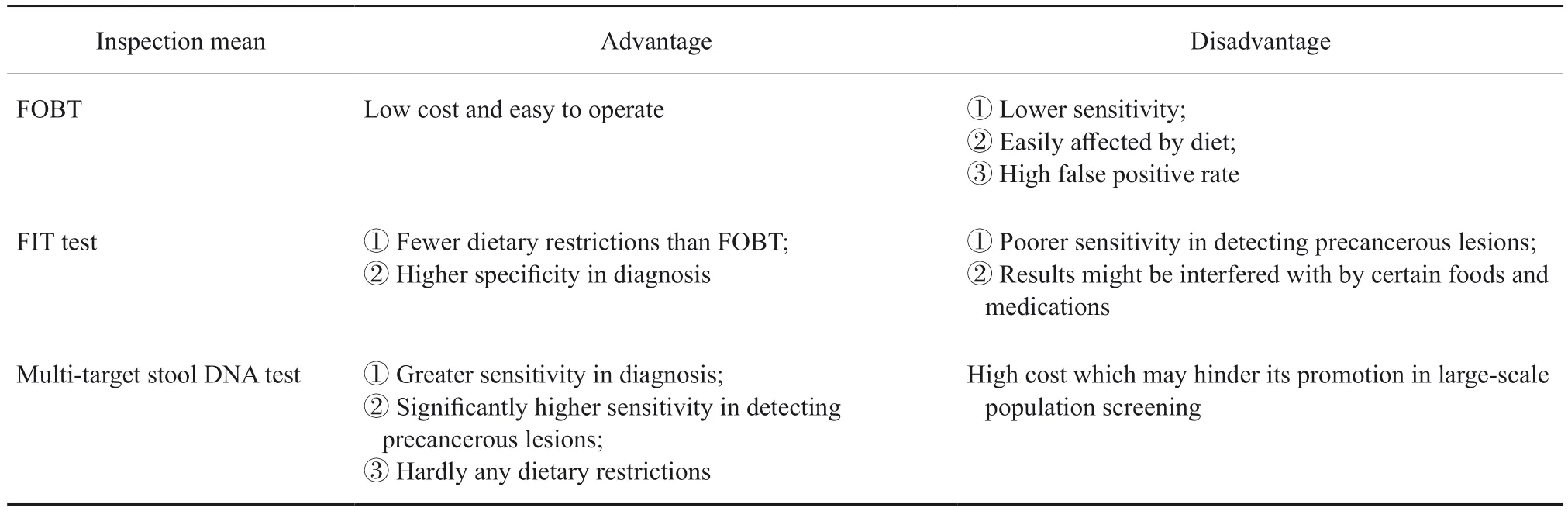
表5 基于粪便的检查手段的优缺点比较Tab.5 Comparing the advantages and disadvantages of stool-based examination methods
4.1.3 基于血液的筛查手段
液体活检克服了组织活检的许多局限性,于2010年被引入并用于分析肿瘤患者中的循环肿瘤细胞(circulating tumor cell,CTC)。随着检测技术的不断发展,现在已逐渐扩展到检测循环肿瘤衍生因子,其中以检测循环肿瘤DNA(circulating tumor DNA,ctDNA)的研究最为广泛。
4.1.3.1 血液CTC检测
CTC检测相比传统组织学活检,具有创伤小、可重复检测、灵敏度及特异度高等优势,可提供关于结直肠癌患者疾病状态的实时信息,有助于结直肠癌的早期筛查、预后评估及治疗反应监测等。来自中国台湾省的一项纳入667名受试者的前瞻性临床研究[112]表明,通过CTC检出结直肠癌的灵敏度达95%,明显超过FOBT的筛查效果(62% ~ 79%)。然而,现阶段CTC在检测平台、判读指征等方面尚缺乏全球性的统一标准,并且检测费用依然昂贵。因此,在合理选择CTC检测平台、控制检测成本、制定并完善相应检测指征及判读标准的前提下,使用CTC检测作为结直肠癌早期筛查的方法将会更加合理可行。
4.1.3.2 血浆ctDNA检测
作为循环肿瘤的衍生因子,ctDNA同样在早期筛查、预后评估、肿瘤复发动态监测及治疗反应监测等方面具有重要应用。
血浆ctDNA检测的靶点之一是基因突变,然而由于结直肠癌相关单一基因突变率通常小于60%,难于通过检测单一基因突变达到筛查诊断的目的,二代测序(next generation sequencing,NGS)可以同时检测多个基因突变,但由于费用高昂,目前也不太适合应用于结直肠癌的筛查诊断领域。
血浆ctDNA检测的另外一个理想靶点是基因甲基化。甲基化SEPT9(methylateSEPT9,mSEPT9)基因是结直肠癌早期发生、发展过程中的特异性分子标志物。基于实时甲基化特异性PCR方法检测血浆ctDNA样本中的mSEPT9已在国外获得批准用于结直肠癌的筛查。来自国内的一项大规模临床试验的结果表明,mSEPT9对结直肠癌检出的灵敏度和特异度分别达到74.8%和87.4%,均显著高于FIT的检测水平,但mSEPT9对于癌前病变(进展期腺瘤)的诊断灵敏度仍然不足(27.4%)[113]。
除了mSEPT9,国内研究团队一直在不断探索新的符合中国人群的ctDNA甲基化的基因集以期用于人群筛查。复旦大学附属肿瘤医院、复旦大学附属中山医院联合国内多家医疗中心的研究[114],报道了兼具结直肠癌早筛和复发预测功能的血液多基因甲基化标志物检测方法(ColonAiQ:SEPT9、SEPT9region2、BCAT1、IKZF1、BCAN、VAV3),检测结直肠癌的灵敏度为86%,特异度为92%,与Septin9单基因甲基化检测相比,ColonAiQ的6个位点的组合可以涵盖更全面的肿瘤表观遗传异质性,具有更高的检测效率。在后续的研究[115]中,复旦大学附属肿瘤医院联合上海交通大学医学院附属仁济医院团队报道了该标志物组合还具有动态监测结直肠癌术后复发的应用前景。此外,复旦大学附属肿瘤医院联合南方医科大学研究团队的研究[116]报道了191个甲基化单倍型位点组成的血浆ctDNA甲基化NGS模型,诊断肠癌的总体灵敏度为87%,Ⅰ期肠癌灵敏度也高达85%,特异度为88%,对于进展期腺瘤的检测灵敏度也高达79%。
除以上甲基化靶点外,复旦大学附属肿瘤医院团队的研究[117]报道了基于循环游离DNA(circulating free DNA,cfDNA)多组学片段特征的肠癌早筛模型,检测结直肠癌的灵敏度高达94.8%。
现阶段ctDNA的检测由于存在费用较高等问题,建议应用于结直肠癌高危人群或经济条件较好的普通危险人群的筛查,以及作为FIT初筛阳性人群的次级筛查方法,以提高筛查的准确率和人群依从性。相比于粪便标本的检查,血浆ctDNA除了作为筛查诊断的手段,还可以应用于结直肠癌术后复发的动态监测,具有全程管理的优势。
4.1.4 可视化筛查手段
4.1.4.1 结肠镜
结肠镜检查在结直肠癌筛查中具有独特且不可替代的地位,是整个结直肠癌筛查流程的核心环节(图6)。少数发达国家采用结肠镜检查进行一步法筛查,但是由于其较差的顺应性(20% ~ 40%)及较高的成本,大多数国家包括中国将其作为所有初筛阳性者的后续确证检查。结肠镜下活检或切除标本的病理学检查是结直肠癌确诊的金标准,内镜下进行癌前病变切除可以有效地降低结直肠癌的发病率和死亡率。
图6 纤维结肠镜Fig.6 Fiber colonoscopy
4.1.4.2 乙状结肠镜
乙状结肠镜被广泛用于欧美国家,但在国内使用较少,国内多项共识并未对其进行推荐(图7)。来自英国的一项纳入170 432名受检者的大样本量随机对照研究[118]结果显示,乙状结肠镜筛查可显著降低人群结直肠癌的发病率和死亡率,其中发病率下降了35%,死亡率下降了41%。然而,由于其天然缺陷,乙状结肠镜无法观测到乙状结肠近侧的结肠,可能导致近侧结直肠癌出现漏诊[119]。
图7 乙状结肠镜Fig.7 Sigmoidoscopy
4.1.4.3 计算机体层成像(computed tomography,CT)虚拟肠镜
CT虚拟肠镜是指在肠道清洁后,通过腹部高精度CT检查模拟成像,获得结直肠的三维图像从而诊断肠道肿瘤的方法(图8)。该方法需肠道准备、操作相对复杂、检查费用昂贵,同时存在假阳性、放射线危害及人群接受度低等诸多问题,目前暂不建议应用于大规模人群筛查。主要适用于部分无法完成全结肠镜检查的病例。
图8 CT虚拟肠镜Fig.8 CT virtual cdonoscopy
4.1.4.4 胶囊内镜
胶囊内镜检查具有使患者痛苦少、方便快捷等优点(图9)。目前有少数研究尝试将结肠胶囊内镜(colon capsule endoscopy,CCE)用于结直肠癌筛查。一项早期研究[120]表明,CCE对大于1 cm结肠息肉的诊断灵敏度为60%,对结直肠癌的诊断灵敏度为74%,约2%的CCE操作失败,8%的受检者出现不良反应。虽然近期的研究[121]提示其新一代产品诊断效能有所改善,但由于发现病变后无法取活检的局限性,仍需结肠镜检查明确,综合成本效益考虑,目前国内暂不推荐其常规用于结直肠癌人群筛查。
图9 胶囊内镜Fig.9 Capsule endoscopy
4.2 筛查策略
4.2.1 人群筛查策略
4.2.1.1 人群危险分层
现阶段,人群筛查需要首先进行人群的风险评估,浓缩出高危人群,采取对应的筛查措施。国内外关于低危和高危人群的界定有一定差异,根据国内现行的指南及共识[105-107],我们推荐人群筛查可以采用高危因素量化问卷或APCS评分联合FIT/FIT-粪便DNA检测明确人群危险分层:
⑴ 低危人群:① 无高危因素量化问卷中的任何一项或APCS评分0 ~ 1分;② FIT/FIT-粪便DNA检测阴性。
⑵ 高危人群:有高危因素量化问卷中的任何一项或APCS评分>1分或FIT/FIT-粪便DNA检测阳性。
4.2.1.2 筛查策略
建议低危人群45 ~ 75岁接受结直肠癌筛查;76 ~ 85岁的身体健康、预期寿命在10年以上者,可以根据自身情况决定是否继续维持筛查;85岁以上者不推荐继续筛查。高危人群具有结直肠癌家族史的筛查年龄应提前至40岁或更早。
对于低风险人群的筛查方案可以选择:① 每5 ~ 10年高质量全结肠镜检查;② 每年FIT或每1 ~ 3年粪便/血液DNA筛查,筛查阳性者行结肠镜检查。
对于高危人群的筛查方案包括以下几种情况:① 立即接受全结肠镜检查,检查结果为阴性者每年复查FIT或每1 ~ 3年复查粪便/血液DNA;② LS家系中携带致病突变者,自20~30岁开始,每2年1次结肠镜检查,40岁以后每年接受1次结肠镜检查;③ 腺瘤性息肉综合征患者或致病突变携带者,建议应每年进行1次结肠镜检查;④ 1位一级亲属患有结直肠癌或进展期腺瘤(发病年龄<60岁)、2位及以上一级亲属患有结直肠癌或进展期腺瘤(任意发病年龄)者,40岁开始(或比家族最小发病者发病年龄提前5 ~ 10年)筛查,每年1次FIT,每5年1次结肠镜检查。1位或多位二级和三级亲属患有结直肠癌,45岁开始,每10年1次结肠镜检查。
4.2.2 遗传性结直肠癌筛查策略
4.2.2.1 LS结直肠癌的筛查策略
筛查对象为符合LS诊断标准的患者和家属。参照家族中致病性突变基因情况进行筛查。
LS的患者应当行MMR蛋白免疫组织化学染色和MSI检测:① 若以上2项均阴性,根据个体情况和家族风险评估筛查;② 若至少一项阳性,即免疫组织化学染色相关蛋白表达缺失和(或)MSI-H,则行MLH1、MSH2、MSH6和PMS2胚系基因突变分析。如胚系基因检测阳性,对致病性突变基因携带者根据不同的基因突变状态制定相应的筛查策略,MLH1、MSH2突变携带者从20 ~ 25岁开始接受结肠镜随访(每1 ~ 2年1次)或比家族中最年轻患者发病年龄提前2 ~ 5年;对MSH6、PMS2突变携带者从25 ~ 30岁开始接受结肠镜随访(每1 ~ 2年1次)或比家族中最年轻患者发病年龄提前2 ~ 5年[122-123]。同时患有FCCX和LS的高危人群接受结肠镜筛查的起始年龄需要比家族中最年轻患者的发病年龄提前5 ~ 10年[18]。对非突变基因携带者,可以参照结直肠癌一般人群进行筛查。
4.2.2.2 结肠腺瘤性息肉病基因相关性综合征(包括典型FAP、轻型FAP、MUTYH基因相关息肉病)的筛查策略
⑴ 确诊先证者:① 如果患者符合FAP诊断标准或怀疑为APC基因相关性息肉病,应行APC基因测序分析确定APC致病性基因突变;② 如未发现APC基因突变,可行MUTYH基因突变检测。
⑵ 家族成员:应尽早确认是否携带家族性突变基因,如果未发现可遗传的致病性APC基因突变,可以参照结直肠癌一般人群进行筛查。
⑶APC基因相关性息肉病患者、无症状致病性APC突变基因携带者、未行分子遗传学检测的家族成员监测方法:① 从10 ~ 11岁开始,每1 ~ 2年行1次全结肠镜检查,一旦发现息肉,则每年行1次全结肠镜检查,直至行结肠切除术;② 25岁以后或结肠切除术前行上消化道内镜检查,每1 ~ 3年检查1次;③ 发现十二指肠腺瘤或行结肠切除术前,每1 ~ 3年行1次小肠检查(内镜或影像学检查);④ 轻型FAP患者开始接受肠镜检查的时间可以从18 ~ 20岁开始。
⑷ MAP:推荐接受结肠镜筛查的起始年龄为40岁或比一级亲属患结直肠癌的诊断年龄提前10岁,每1 ~ 2年行1次结肠镜检查[122-123]。
4.2.2.3 PJS的筛查
⑴ 确诊先证者:建议所有PJS合并息肉或典型口腔黏膜色素沉着者都行分子遗传学检测。
⑵ 家族成员:建议行分子遗传学检测。从18岁开始接受全结肠镜检查,每2 ~ 3年1次。此外,胃和小肠的检测需要开始得更早,建议从8岁开始,每2 ~ 3年行1次胃及小肠的内镜检查。
4.2.2.4 JPS的筛查
建议从15岁开始接受肠镜和胃镜检查,如发现息肉,每年行1次内镜检查;如未发现息肉,则每2 ~ 3年行1次内镜检查。
4.2.3 UC和原发性硬化性胆管炎患者
UC患者最迟应在症状出现8年后接受初次结肠镜筛查,初次筛查后,每1 ~ 3年接受结肠镜检查。原发性硬化性胆管炎患者建议在确诊后即开始每年行1次结肠镜检查。
4.2.4 国内外一般人群筛查策略对比(表6)
表6 国内外一般人群筛查策略对比Tab.6 Comparison of screening strategies for the general population at home and abroad
2021年美国预防服务工作组筛查指南[124]将无结直肠癌、腺瘤性息肉、IBD病史,无家族史的45 ~ 75岁无症状人群定义为平均风险人群,并建议应当参加结直肠癌筛查;不建议86岁及以上的人群参与筛查;对于76 ~ 85岁人群,应当根据其健康状况、此前是否参加过筛查及个人意愿综合考虑。该指南未明确提出首选的筛查方式,而是列出来多种可选的筛查方式以达到增加筛查顺应性的目的,其中包括:① 每年行1次高敏gFOBT;② 每年行1次FIT;③ 每1 ~ 3年行1次多靶点粪便FIT-DNA检测;④ 每10年行1次全结肠镜;⑤ 每5年行1次CT结肠成像;⑥ 每5年行1次软式乙状结肠镜检查;⑦ 每10年行1次软式乙状结肠镜检查+1年1次FIT。在2023年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)结直肠癌筛查指南[125]中,除了以上筛查方法,还推荐血液DNASEPT9甲基化检测或CTC检测作为筛查的方法之一。
2021年日本消化内镜学会结直肠镜筛查与监测指南[126]肯定了APCS评分在人群风险分层中的重要意义,对于所有40岁以上的平均风险人群,不设年龄上限,均推荐接受结直肠癌筛查,建议每年1次FIT检查,一旦出现阳性需要立即接受肠镜检查。
2017年澳大利亚国立健康与医学研究理事会筛查指南[127]建议50 ~ 74岁无症状平均风险人群每2年进行1次FIT,如有FIT出现阳性结果则建议受检者立即接受全结肠镜检查。该指南还提出了一些其他提高筛查效果的策略,如在50 ~ 74岁每年进行FIT;在50岁进行1次结肠镜检查,随后每2年进行1次FIT检查;在55、65、75岁分别进行1次结肠镜检查;在50 ~ 74岁每2年进行1次FIT并对结果为阴性者在50岁或54、64、74岁进行软式乙状结肠镜检查等。此外,该指南特别指出需要对家族史这项因素进行风险分层,需要综合考虑家族史中患病成员的亲属等级、数量和发病年龄。
2016年加拿大卫生预防保健工作组筛查指南[128]将无结直肠癌或息肉、IBD,无结直肠癌的体征或症状,无家族史、结直肠癌相关遗传综合征的无症状人群定义为平均风险人群。该指南对于50 ~ 59岁人群仅弱推荐接受结直肠癌筛查,而强推荐60 ~ 74岁人群进行结直肠癌筛查。具体筛查方式建议为每2年进行1次高敏gFOBT或FIT,或每10年进行1次软式乙状结肠镜检查。考虑到结肠镜检查消耗的额外医疗资源与带来的并发症风险,不推荐直接将其作为筛查方式。
历经近50年的发展,结直肠癌筛查在中国逐渐形成更加规范、符合中国国情的一套筛查策略。2020年,国家癌症中心中国结直肠癌筛查与早诊早治指南制定专家组制定了《中国结直肠癌筛查与早诊早治指南(2020,北京)》[106],这是中国首部基于循证医学证据而非专家共识意见的结直肠癌筛查指南,其证据检索纳入了本地的研究结果,更适合中国国情,更利于在中国的临床实践中对结直肠癌筛查方案与早诊、早治技术进行规范。该指南将不具有下列危险因素者定义为一般风险人群:① 一级亲属有结直肠癌病史;② 患有结直肠癌/肠道腺瘤/8 ~ 10年长期不愈的IBD病史;③ FOBT阳性。考虑到中国人群结直肠癌发病率自40岁开始上升,指南建议一般风险人群40岁起接受结直肠癌风险评估。评估为中低风险者在50 ~ 75岁接受结直肠癌筛查,评估为高风险者接受结直肠癌的筛查年龄应提前至40岁。但由于高级别循证医学证据的缺乏,该指南仅列举了散发性结直肠癌的危险因素,但未对高风险人群的评估标准给出明确的推荐,并且在具体筛查手段的筛查间隔方面未予明确推荐。
现阶段,结直肠癌的筛查更多的仍是以地区为中心的结合当地发展水平等方面的筛查策略的实施。以上海为例,上海市抗癌协会发布的《居民常见恶性肿瘤筛查和预防推荐(2023版)》[129]推荐一般人群结直肠癌筛查的起止年龄定为45 ~ 75岁,采用调查问卷联合FOBT作为主要的筛查手段,对于一般人群,推荐每年进行1次FOBT检查或每10年进行1次肠镜检查,有条件者可以联合粪便或血液的基因检测进行筛查。
4.3 本章小结
基于问卷风险分层联合FIT仍是目前适用范围最广的筛查策略,在大规模人群筛查中具有较高的可行性和经济学效益。
粪便多靶点DNA以及基于血液的筛查手段包括CTC和ctDNA在结直肠癌尤其是癌前病变的筛查中具有更大的优势,但由于较高的费用限制了其在大规模人群筛查中的广泛应用,推荐应用于结直肠癌高危人群或经济条件较好的普通危险人群的筛查,以及作为FIT初筛阳性人群的次级筛查方法。
低危人群筛查策略:选择每5 ~ 10年行高质量全结肠镜检查或每年行FIT或每1 ~ 3年行粪便/血液DNA筛查,筛查阳性者立即行结肠镜检查。
高危人群筛查策略:① 一般人群中的高危者需立即接受全结肠镜检查,检查结果为阴性者每年复查FIT或每1 ~ 3年复查粪便/血液DNA;② LS家系中携带致病突变者,自20岁开始,每2年行1次结肠镜检查,40岁以后每年行1次结肠镜检查;③ 腺瘤性息肉综合征患者或致病突变携带者,建议应每年行1次结肠镜检查;④ 1位一级亲属患有结直肠癌或进展期腺瘤(发病年龄小于60岁)、2位及以上一级亲属患有结直肠癌或进展期腺瘤(任意发病年龄)者,40岁开始(或比家族最小发病者发病年龄提前5 ~ 10年)筛查,每年行1次FIT,每5年行1次结肠镜检查。1位或多位二级和三级亲属患有结直肠癌,45岁开始,每10年行1次结肠镜检查。
5 早期结直肠癌的诊断
5.1 内镜及超声诊断
5.1.1 内镜诊断技术
结肠镜检查是结直肠癌早期诊断的关键性检查技术,用于检测、治疗癌前病变及早期结直肠癌[130]。良好的肠道准备及检查技术的发展在提高结直肠癌诊断率和降低社会疾病负担方面均发挥重要作用。因此,多种辅助检查技术的研发,如高清电子内镜、超声内镜(endoscopic ultrasonography,EUS)、ME、图像增强内镜(image-enhanced endoscopy,IEE)、共聚焦激光显微内镜(confocal laser endomicroscopy,CLE)、磁控胶囊内镜及计算机辅助诊断内镜(computer aided diagnosis,CAD)等,能够帮助改进早期结直肠癌的检测。
5.1.1.1 白光内镜(white light endoscopy,WLE)
WLE是临床上最基础的内镜检查技术,常与活检标本组织学分析相配合对结直肠癌等疾病进行早期诊断(图10)。按照分辨率大小分为标准WLE(standard definition-WLE,SD-WLE)和高清WLE(high-definition-WLE,HD-WLE),分辨率分别能够达到10 ~ 40万像素和100万像素[131]。一项随机对照试验[132]比较了HD-WLE和SD-WLE,结果提示无蒂锯齿状息肉的检出率(8.2%vs3.8%)、腺癌的检出率(2.6%vs0.5%)均提高。另一项研究[133]使用HD-WLE将腺瘤的漏诊率从30.2%降低到16.6%,腺瘤检出率从36.5%增加到43.8%。由此可见,HD-WLE能够提高肠息肉的检出率,有助于结直肠癌的早期诊断。有研究[134]报道,在传统WLE下,早癌常表现为有蒂息肉蒂部膨大、表面可见边界清晰的凹陷及基底白斑,其中有蒂息肉蒂部膨大的阳性率为71.9%。而近年来有研究[135]显示,相比于其他改良的内镜技术,如NBI和联动成像模式等,传统WLE对于息肉和腺瘤的漏诊率明显较高,且单个患者的息肉检出数量也有明显差别。因此,将WLE与其他改良内镜技术联合应用,不仅能够提高结直肠癌的早诊率,同时也可以避免结直肠多发息肉的患者接受重复的内镜检查,提高患者接受度,减少其痛苦。
5.1.1.2 ME
ME是在电子内镜的基础上,于内镜头端放置光学变焦镜头,使其拥有较高的分辨能力,对黏膜组织的放大倍数达到肉眼观察的150倍,可帮助内镜医师在内镜下发现临床早期的肿瘤并进行良恶性鉴别。在消化道疾病的诊治中,ME常与其他内镜图像增强技术(如NBI技术、蓝激光成像技术及染色内镜技术)配合使用,从而提高早期肿瘤的检出率。其中ME-NBI可通过pit分型和观察微血管形态联合诊断结直肠肿瘤(图11)[136]。
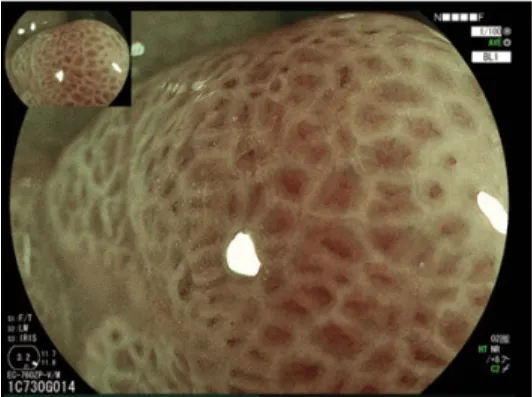
图11 ME下结肠腺瘤微腺管及微血管的形态Fig.11 Morphology of microducts and microvessels in colon adenomas in ME mode
5.1.1.3 IEE
IEE 包括化学染色内镜和电子染色内镜[137]。
⑴ 化学染色内镜:化学染色内镜是指在消化内镜下用导管向消化道黏膜表面喷洒化学染料或向其黏膜内直接注射,使正常黏膜组织与异常组织呈现出不同的特征,辅助临床医师对消化道疾病诊断。常用的化学染料包括鲁氏碘液、靛胭脂和亚甲蓝等。联合使用染色内镜能够突出显示消化道黏膜的表面结构,观察病变的形态扁平或凹陷,提高结直肠息肉及结直肠癌的检出率。Yang等[138]对高清色素内镜和HD-WLE监测UC患者是否会发生瘤变开展了多中心前瞻性随机对照试验,结果提示高清色素内镜对于监测结直肠肿瘤具有明显的优势,可显著地减少活检次数。Kawaguti等[139]利用放大染色内镜和pit分型对结直肠肿瘤是否浸润至黏膜下层进行判断,放大染色内镜在判断病变浸润深度方面具有较高灵敏度(73.3%)且有助于临床选择合适的治疗方式。内镜下应用醋酸溶液和亚甲蓝进行双重染色检查,也能够显著地提高结直肠癌的检出率[140]。但近年来随着电子染色内镜技术的不断发展,化学染色法使用逐渐减少。
⑵ 电子染色内镜:与化学染色内镜技术不同,电子染色内镜技术不需要将染料喷洒或注射至黏膜上,而是应用不同的光谱模式照射病灶,使正常黏膜组织和病变组织在镜下呈现差异性表现,同时能够节省操作时间。NBI是目前最常用的电子染色内镜技术,通过窄带滤光片,将原始光分为605 nm的红光、540 nm的绿光和415 nm的蓝光,这3种光对组织的穿透率不同,红光可深达黏膜下层,用于显示黏膜下血管网,绿光则能较好地显示中间层的血管(图12)[141]。多中心前瞻性研究[142]指出,在使用NBI技术时,NICE分型结合形态特征在判断结直肠病变是否具有深部浸润方面特异度可达96%,在无专业人士参与和放大设备的条件下同样具有较高的灵敏度。
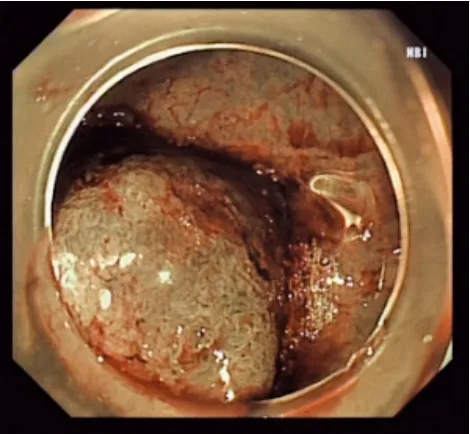
图12 NBI模式下结肠腺瘤的形态Fig.12 Morphology of colon adenomas in NBI mode
自体荧光内镜(auto-fluorescence imaging,AFI)通过显示病变区域与毗邻完整组织的荧光强度或颜色不同,来帮助临床发现病变,检测组织的良恶性并提高早癌、异形增生的诊断率。使用荧光图像早期癌症诊断仪器行荧光内镜检查对消化道恶性肿瘤的诊断有很高的灵敏度,能够提高早期癌的检出率[143]。但AFI存在分辨率低、图像质量低于传统WLE的缺点。AFI虽可较为准确和全面地诊断早期结直肠癌,但同样存在灵敏度高,易受到患者体内自身正常组织杂散光干扰,严重时导致检查结果发生较大偏差,从而产生假阴性、假阳性的情况[144]。因此,AFI在早期结直肠癌的诊断中具有较高的灵敏度,同样具有一定的局限性,能否广泛应用于临床仍需进一步研究。
蓝激光成像内镜(blue laser imaging,BLI)是日本富士公司开发的一种以两种半导体激光器为光源的新型内镜,能够捕捉到黏膜表面及血管细节形态的图像(图13)。BLI在判断结直肠肿瘤浸润深度方面能达到与ME-NBI相似的效果[145]。近年来,BLI技术被广泛应用于结直肠癌及癌前病变的诊断,是判断结直肠病灶浸润深度的有效工具[146]。
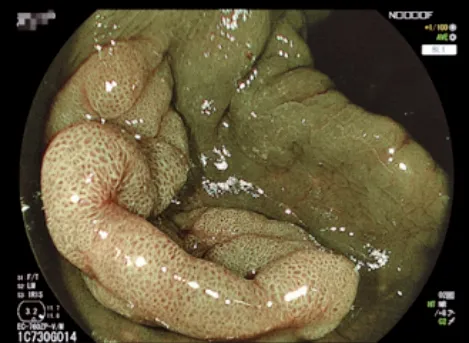
图13 BLI模式下结肠腺瘤的形态Fig.13 Morphology of colon adenomas in BLI mode
5.1.1.4 共聚焦激光显微内镜(confocal laser endomicroscopy,CLE)
CLE能够通过共聚焦的方式,使胃肠道黏膜放大50 ~ 150倍并且获得极高分辨率的图像,可直接在内镜下对黏膜和病变组织的细胞学形态进行观察(图14)。CLE可作为常规内镜检查及ME检查后的补充操作,帮助临床诊断结直肠癌。目前,CLE可用于包括结直肠息肉的分类、息肉切除术后切除边缘和IBD的评估[147]。
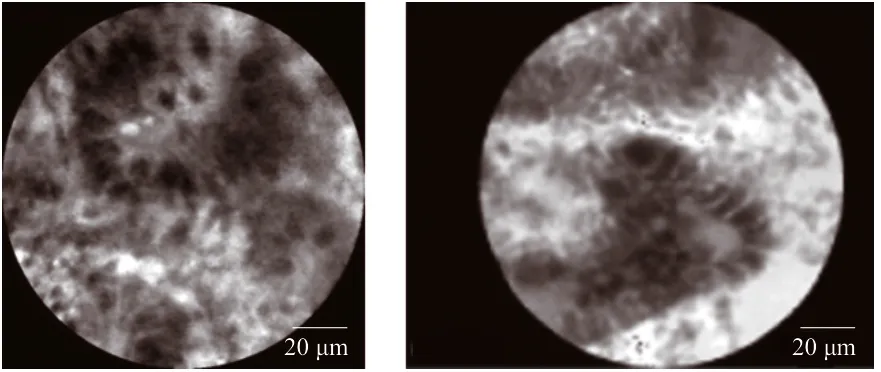
图14 CLE下结直肠腺癌Fig.14 Colorectal adenocarcinoma under CLE
5.1.1.5 CCE
由于结肠镜检查在急性肠扭转或伴随其他结直肠疾病情况下,仍具有出血和穿孔的风险,CCE作为一种新的非侵入性无创全结直肠检查技术正在逐渐被大众所接受。在发明初期,胶囊内镜主要用于对胃镜和结肠镜都难以达到的小肠进行检查[148]。2006年,Eliakim等[149]将第一代CCE(CCE-1)带入到临床医师的视野中。CCE-1能够检测出直径≥6 mm的结直肠息肉,对于结直肠病变具有一定的灵敏度。相比于CCE-1,CCE-2能够显著提高结直肠病变检测的灵敏度[150]。有研究[151]指出,在日本于结肠镜检查前出现粪便潜血阳性的患者,可推荐其进行CCE检查,避免结肠镜检查可能带来的风险。同时,由于CCE的无创性,IBD的患者也可考虑行CCE检查。
综上所述,推荐使用HD-WLE、放大和增强内镜和其他特殊内镜成像进行早期诊断,但要考虑患者受益和成本。推荐使用HD-WLE结合增强内镜来预测肠息肉黏膜下的浸润深度。
5.1.2 EUS在早期结直肠癌中的诊断
EUS能够为结直肠癌的具体生长情况提供一个直观评价,可用于观察肿瘤大小、辅助判断病灶浸润深度及与毗邻脏器的关系,同时可用于观察周围淋巴结情况、鉴别肠道良性疾病、预测病情发展趋势及随访术后复发等。EUS包含普通EUS和直肠腔内超声(endorectal ultrasonograph,ERUS)。相比于普通EUS,对于中低位直肠肿瘤患者,ERUS可更准确地评估其病灶浸润深度,主要诊断价值在于明确早期直肠癌T分期及评估淋巴结是否存在转移方面。正常结直肠壁在EUS下由内到外显示为5层结构:① 第1层表现为高回声(黏膜层);② 第2层表现为低回声(黏膜肌层);③ 第3层表现为高回声(黏膜下层);④ 第4层表现为低回声(固有肌层);⑤第5层表现为高回声(浆膜下层及浆膜层;直肠为外膜层)[152]。早期结直肠癌在EUS下通常表现为:肠壁的低回声肿块,肠壁层次结构模糊、消失、扭曲、中断或增厚,肿瘤不规则低回声肿块影可向肠腔内外突入、位于肠壁内或形成半球型,周围器官和淋巴结可能受到侵犯(图15)[153]。同时,EUS能够通过对黏膜层次及黏膜下层次的变化,辅助判断早期结直肠癌的浸润深度:① 黏膜内癌(m层),病变局限在第1、2层内,表现为第1层不平或隆起突出,第2层低回声带中可见点状回声或中位回声肿块,第3层以下无异常改变;② 黏膜下层癌(sm层),癌组织浸润达黏膜下层时,可看到第3层强回声带出现不整、薄层化及断裂破坏图像[154]。EUS虽然在结直肠癌中能够辅助判断周围淋巴结是否累及,但准确率欠佳。多项meta分析[155-157]结果显示,对于新发直肠癌的T分期和N分期,EUS与CT、磁共振成像(magnetic resonance imaging,MRI)的辅助诊断准确能力无显著差异。EUS和MRI判断直肠癌病灶处于T1或T2期的准确率欠佳,对于T2期以上分期存在难以判断的可能[155-157]。指南[158]指出肠镜下表现出黏膜下浸润特征的直肠病灶,EUS在进行T分期中发挥重要辅助作用。早期结直肠癌可通过内镜下黏膜切除术(endoscopic mucosa resection,EMR)和内镜黏膜下剥离术(endoscopic submucosa dissection,ESD)等内镜微创技术进行切除。但内镜下切除可产生直肠旁的炎症淋巴结,从而影响EUS判断淋巴结受累情况,进而对病灶的TNM分期产生干扰。因此,应在行内镜下微创切除前,应用EUS和MRI对直肠病灶进行肿瘤分期。
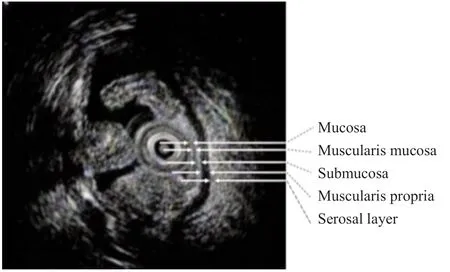
图15 EUS下结肠壁各层结构Fig.15 Structure of colon wall layers under EUS
综合以上,不推荐EUS作为所有需进行内镜下切除的结直肠病灶的术前常规检查。对于存在结直肠黏膜下浸润特殊表现的病灶,应在内镜下切除术前进行更全面的TNM分期,对其是否处于T2/T3期,以及是否存在淋巴结受累进行更仔细地判断。
5.1.3 经内镜的活检取材方式
早期结直肠癌的术前诊断中,对可疑病变组织开展内镜下活检取材和病理学诊断是结直肠癌诊断的金标准。但术前内镜活检钳取材病变的组织,经病理学诊断为高级别内瘤变时,在经内镜切除或传统外科手术切除后,95%会被重新诊断为结直肠癌,仅5%仍被诊断为高级别内瘤变[159]。对于直肠癌患者,应用内镜下活检钳进行组织取材,病理组织学分级准确率为67.3%,且病理组织学分级偏低的病例占25.0%,分级偏高的病例占7.7%[160]。因此,在对可疑结直肠恶性病变进行内镜下活检钳取材时,需要经验丰富的内镜医师进行多点取材,至少送检6块活检钳咬除组织,以辅助术前对病理学类型诊断及精细的组织学分级判断。且由于早期结直肠癌表面组织学类型常为炎症黏膜或低级别/高级别内瘤变,在活检病灶取材时应在多点取材的同时,对病灶较深处进行取材,提高早期结直肠癌的早诊率。在经多点深度内镜下活检钳取材,仍未取到病变组织,且在内镜下具有恶性病变特征时,可考虑使用内镜下圈套器进行病变组织的多点取材,降低错诊率且辅助术前病理组织学分级[160]。
综上所述,对于肠镜下发现具有恶性病变特征的结直肠病灶,应增加活检钳取材组织量。对于肠镜下具有恶性病变特征,但常规内镜活检钳取材组织未见恶性病变的患者,可考虑使用内镜下圈套器进行组织取材。
5.2 病理学诊断
近10年来,结直肠癌的分子病理学诊断进展迅速,随着结直肠癌分子机制和相关细胞学、病理学机制理解地不断深入,目前已根据分子病理学特征对结直肠癌进行分类,实施个体化治疗,并改善患者预后[161]。本部分详细介绍结直肠癌病理学诊断相关内容。
5.2.1 结直肠癌的活检及病理学描述
结直肠癌的病理学诊断需要结肠镜下活检,病理学活检报告是结直肠癌治疗的依据。活检诊断为浸润性癌患者行规范性结直肠癌治疗[162]。在当前的研究和临床实践中,结肠镜是结直肠癌筛查普遍应用的金标准。内镜医师在可视镜头下完整地检视整个结直肠的情况,对可疑病变取组织活检进一步明确病理学诊断。但由于目前中国40岁以上一般风险人群中筛查性结肠镜检查的腺瘤检出率研究报道较少,且中国结直肠肿瘤的发病率和患病率均低于美国,对于是否需要指南共识调低推荐界值仍需要进一步的研究证据[163]。
活检组织的取材和病理学描述,通过以下几个方面[164]标本固定标准:
① 固定液:推荐使用4%中性缓冲甲醛溶液固定液,避免使用含有重金属的固定液;② 固定液量:必须大于等于所固定标本体积的5 ~ 10倍;③ 固定温度:正常室温;④ 固定时间:标本应尽快剖开固定,离体到开始固定的时间不宜>30 min。推荐内镜下切除标本或活检标本的固定液浸泡时长为6 ~ 48 h。
取材要求:① 核对临床送检标本数量,送检活检标本必须全部取材;② 将标本包于纱布或柔软的透水纸中以免丢失;③ 每个蜡块内包埋≤5粒活检标本,并依据组织大小适当调整。
5.2.2 内镜治疗后的病理学诊断描述
活检标本离体后,应由内镜医师及时将活检黏膜组织基底面黏附于滤纸上,立即浸入固定液中固定[165]。内镜下黏膜切除标本离体后,内镜医师展开标本,黏膜面向上,使用大头针固定于软木板或泡沫板,标示口侧缘和肛侧缘,翻转令黏膜面朝下放入固定液中。息肉切除标本,有蒂息肉可直接放入固定液中,无蒂息肉用墨汁标记好切缘后放入固定液中(图16、17)。建议记录标本和肿瘤病变的大小、形态及各方位距切缘的距离。息肉切除标本的取材:首先明确息肉的切缘、有无蒂及蒂部的直径,建议用墨汁涂蒂切缘(有蒂)及烧灼切缘(无蒂)。取材时要考虑到切缘和有蒂息肉蒂部的浸润情况能够客观正确地评价。建议按如下方式取材:无蒂息肉以切缘基底部为中心向左、右两侧全部取材。有蒂息肉当蒂切缘直径>2 mm时,略偏离蒂切缘中心处垂直于蒂切缘平面切开标本,再平行此切面,间隔2 ~ 3 mm将标本全部取材;蒂切缘直径≤2 mm时,垂直于蒂切缘平面间隔2 ~ 3 mm将全部标本取材,使蒂部作为一个单独的蜡块。推荐按同一包埋方向全部取材。记录组织块对应的方位。EMR和ESD标本的取材:由于肿物距切缘距离一般较近,切缘的评估尤其重要。建议涂不同的颜料标记基底及侧切缘,以便在观察时能够对切缘做出定位,并评价肿瘤切缘情况。每间隔2 ~ 3 mm平行切开标本,如临床特别标记可适当调整,分成大小适宜的组织块,应全部取材并按同一方向包埋。
图17 有蒂病变标本的固定方式Fig.17 Fixation method of pedunculated lesion specimens
5.2.3 规范化的病理学报告
⑴ 肉眼分型:参照内镜医师提供的内镜下病变表现和分型的信息,依据早期癌内镜分型标准,在EMR和ESD标本拍照时进行观察,并作出判断。
⑵ 组织学分型:按早期胃肠黏膜上皮肿瘤性病变的组织学类型,对EMR和ESD标本的病理学诊断可分为无上皮内瘤变、不确定的上皮内瘤变、LGD、HGD(包括原位癌、可疑浸润癌、黏膜内浸润癌)及黏膜下浸润癌。
⑶ 标本切缘状态:组织标本的电灼性改变是EMR和ESD标本切缘的标志。切缘干净是指在切除组织的各个水平或垂直电灼缘均未见肿瘤细胞。切缘阴性,但癌灶距切缘较近,应记录癌灶与切缘最近的距离;水平切缘阳性,应记录阳性切缘的块数;垂直切缘阳性,应记录肿瘤细胞所在的部位(固有层或黏膜下层)。电灼缘的变化对组织结构、细胞及其细胞核形态的观察会有影响,必要时可行免疫组织化学染色帮助判断切缘是否有癌灶残留。
⑷ 肿瘤侵犯深度:肿瘤侵犯深度的判断是以垂直切缘阴性为前提的,黏膜下层的浸润深度是判断病变是否切除干净的重要指标之一,侵犯黏膜下层越深则淋巴结转移的概率越高。结直肠病变中以1 000 μm为界,不超过者为SM1,超过者为SM2。黏膜下层浸润深度的测量方法,因肿瘤组织内黏膜肌层的破坏程度而异。若肿瘤组织内尚可见残存的黏膜肌层,则以残存的黏膜肌层下缘为基准,至肿瘤浸润前锋的距离。若肿瘤组织内无任何黏膜肌层,则以肿瘤最表面为基准,测量至肿瘤浸润前锋的距离。
⑸ 脉管有无侵犯:EMR和ESD标本有无淋巴管、血管(静脉)侵犯是评判是否需要外科治疗的重要因素之一。肿瘤侵犯越深,越应注意有无脉管侵犯的状况。黏膜下浸润的肿瘤组织进行特殊染色或免疫组织化学染色,常能显示在H-E染色中易被忽略的脉管侵犯。
⑹ 有无溃疡和其他黏膜病变:溃疡或溃疡瘢痕可影响EMR、ESD及对预后的判断,是病理学报告中的一项重要内容。而周围黏膜非肿瘤性病变,包括炎症、萎缩、化生等改变及其严重程度也应有所记录。
5.2.4 早期结直肠癌的评估和分级
癌细胞穿透结直肠黏膜肌层浸润至黏膜下层,但未累及固有肌层,称为早期结直肠癌(pT1)[166]。上皮重度异型增生及没有穿透黏膜肌层的癌称为HGD,包括局限于黏膜层但有固有膜浸润的黏膜内癌。若为内镜下或经肛门的局部切除标本,建议对早期结直肠癌的黏膜下层浸润深度进行测量并分级[167],扁平病变当黏膜下层浸润深度≤1 000 μm时,为黏膜下层浅层浸润,是内镜治疗的适应证,当黏膜下层浸润深度>1 000 μm时,为黏膜下层深层浸润,需结合其他因素和临床情况考虑是否行外科手术扩大切除范围。黏膜肌层可以明确时,浸润深度的测量是从黏膜肌层的下缘至浸润最深的距离,当黏膜肌层完全消失时,黏膜下层浸润深度从表面开始测量。有蒂病变分为两种情况,当黏膜肌层呈分支状生长时,以两侧肿瘤和非肿瘤交界点之间的连线为基线,基线以上的浸润视为头浸润,是内镜治疗的适应证;基线以下的浸润视为蒂浸润,相当于黏膜下层深层浸润,处理原则同上。当有蒂病变的黏膜肌层可以定位或不呈分支状生长时,按扁平病变测量浸润深度。
5.2.5 组织病理学描述
组织病理学应描述[168-169]:① 大体标本情况,包括肿瘤大小、大体类型、肉眼所见浸润深度、有无穿孔及肿瘤距两侧切缘的距离;② 肿瘤分化程度(肿瘤分型、分级);③ 肿瘤浸润深度(pT分期或ypT是根据有活力的肿瘤细胞来决定的,经过新辅助治疗的标本内无细胞的黏液湖不认为是肿瘤残留);④ 对于Ⅰ和Ⅱ期的结直肠癌,肿瘤出芽为预后不良因素,建议对无淋巴结转移的结直肠癌病例报告肿瘤出芽分级[170],肿瘤出芽是位于肿瘤浸润前缘,5个细胞以下的肿瘤细胞簇,报告20倍视野下肿瘤出芽最密集的区域(热点区)的出芽数目分级;⑤检出淋巴结数目、阳性淋巴结数目及淋巴结外肿瘤堆积(pN分期),后者指肠周脂肪组织内与原发肿瘤不相连的实性癌结节,镜下可见癌细胞沉积但未见残留淋巴结结构[171],无淋巴结转移、有癌结节时,报告为pN1c分期,并需报告癌结节数目,有淋巴结转移时,依照阳性淋巴结数目进行pN分期,无需考虑癌结节,但病理学报告中同样需报告癌结节数目;⑥ 近端切缘、远端切缘的状况,推荐报告系膜/环周切缘的状况(如果肿瘤距切缘很近,应当在显微镜下测量并报告肿瘤与切缘的距离,肿瘤距切缘1 mm以内报切缘阳性);⑦ 肿瘤退缩分级,用以评估肿瘤术前新辅助治疗效果[172];⑧ 脉管侵犯情况(以V代表血管,V1为镜下血管浸润,V2为肉眼血管浸润,L代表淋巴管),建议尽量区分血管与淋巴管浸润;⑨ 神经束侵犯情况;⑩ MMR蛋白(MLH1、PMS2、MSH2及MSH6)表达情况。建议依据免疫组织化学检测结果选择检测MMR基因的突变状态和甲基化状态。确定为复发或转移性结直肠癌时,推荐检测KRAS、NRAS及BRAF基因状态。如无手术切除标本可从活检标本中测定。
5.2.6 分子病理学检查
MSI发生在约15%的结直肠癌中,绝大部分属于超突变型结直肠癌[173]。最多见的散发性结直肠癌中出现dMMR的原因是MLH1基因的双等位基因甲基化影响其基因表达,在晚期(Ⅲ期)MSI结直肠癌中,对基于5-FU的辅助化疗或标准辅助化疗仍然存在争议,需要进一步研究。此外,美国食品药品管理局(Food and Drug Administration,FDA)批准了帕博利珠单抗(一种单克隆抗PD-1抗体)用于治疗包括结直肠癌在内的MSI或dMMR的实体肿瘤。这是美国FDA首次批准基于常见癌症生物标志物而不是特定器官肿瘤的靶向治疗。根据2023年发布的最新NCCN治疗指南[174-175],结直肠癌病理学报告需要提供一些分子病理学信息,如所有结直肠癌的MSI或MMR检测结果等,以便指导治疗。
5.3 影像学诊断
随着现代医学科技的发展,早期结直肠癌的筛查与诊断技术不断提高。其中,多种影像学技术的出现和优化,使得早期结直肠癌的诊断更加准确,得以及早发现病灶并明确肿瘤分期,有助于指导临床决策,改善临床高危人群和患者的预后[176]。
5.3.1 MRI检查
MRI作为早期结直肠癌首选的分期工具,在肿瘤定位、决定切除范围及判断肿瘤与腹膜反折的关系方面均具有较高的准确率[177-178]。MRI具有分辨率高、无电离辐射、安全性高及准确率高的特点,能够清楚地显示癌细胞的浸润情况,以及与周围组织结构的关系,是应用于结直肠癌诊断的重要影像学方法。目前,推荐MRI作为直肠癌常规检查项目。如无禁忌证,建议行直肠癌MRI扫描前肌注山莨菪碱抑制肠蠕动。当临床或超声/CT检查怀疑肝转移时,推荐行肝脏增强MRI检查。目前,随着MRI磁场强度、梯度场强的提高及各种线圈的应用,MRI在结直肠癌早期病变诊断中的优势更加明显,也解决了对结直肠癌原发肿瘤Ⅰ期与Ⅱ期判断准确率偏低的问题。在结直肠癌术前淋巴结转移分期的判断中,MRI能够根据淋巴结的大小判断淋巴结转移情况,但对于大小正常但存在转移的淋巴结更容易漏诊,而异常增大的未转移淋巴结也容易误诊。
5.3.2 CT检查
CT的密度分辨力高,配合对比剂的应用,能清晰地显示结直肠管壁的断面,正确判断管壁厚度和病变形态,同时也能清楚地显示管壁外的情况;因而,CT检查能提供病变侵犯肠壁的情况,向壁外蔓延的范围,局部淋巴结是否肿大,以及是否有远处转移等有价值的信息,并能发现其合并症,从而有助于作出结直肠癌术前分期的诊断,为选择合适的治疗方案提供依据[179]。在结直肠腔适度扩张的情况下,正常肠壁厚度<3 mm,3 ~ 6 mm为临界值,>6 mm时提示异常。早期结直肠癌在CT图像中表现为肠壁局限性或环周性增厚,表面可不光整,局部肠壁可因侵犯深度而有不同表现。增强扫描病变肠壁多表现为较明显的强化。CT图像能显示原发灶周围及其引流区域等处的淋巴结,但CT不能显示淋巴结的内部结构,仅以大小作为判断其转移的标准,有一定局限性。
5.3.3 结肠CT技术
结肠CT技术,又称作CT虚拟结肠镜,是指受检者在经过肠道准备后,用气体充盈扩张清洁的结肠,仰卧位及俯卧位下进行全结肠的薄层CT扫描,对二维图像进行三维重建,可观察整个结肠的情况[180-183]。与传统光学结肠镜相比,CT虚拟结肠镜技术具有安全性高、无创的优势,无麻醉风险、检查时间短,患者接受度较高。但该方法在人群筛查中仍存在一定局限性,包括需要严格的肠道准备、检查设备和专业技术人员有限、放射线辐射风险等。而磁共振虚拟结肠镜相对于CT虚拟结肠镜技术不存在辐射暴露等问题,与传统光学结肠镜相比,在诊断直径<5 mm的结直肠病变时,具有较高的灵敏度和特异度[184]。通常情况下,实施磁共振结肠镜同样需要进行严格的肠道准备。因此,暂不推荐用于大规模的人群筛查,仅推荐用于无法完成结肠镜检查的病例,或作为临床辅助诊断的手段[185]。
5.3.4 其他检查
正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)在判断有无局部或远处转移方面并不显著优于CT或MRI,且检查费用较高,不推荐常规用于早期结直肠癌的筛查[186-187]。但对于病情复杂、常规检查无法明确诊断的患者可作为有效的辅助检查手段。术前检查提示为Ⅲ期以上肿瘤,为了解有无远处转移,可推荐使用。
此外,气钡双重造影操作简便、安全可靠、并发症少,气钡双重造影的优势在于对病变部位的准确判断,气钡双重造影可发现充盈缺损、肠腔狭窄及黏膜皱襞破坏等征象,显示肿瘤部位和范围。气钡双重X线造影可作为诊断结直肠癌的检查方法,但不能用于结直肠癌的分期诊断。如疑有结肠梗阻的患者应当谨慎选择。
5.4 液体活检和早期诊断
5.4.1 液体活检的发展历史
液体活检最早在2010年由Lianidou等[188]提出,液体活检指利用患者体液,通过检测肿瘤细胞释放到体液中的标志物信息,从而获得患者体内肿瘤基因或蛋白表达的全面信息。液体活检的主要标志物包括肿瘤标志物分子、CTC、cfDNA和外泌体。液体活检的样本主要是血液,其他的还有尿液、唾液、乳汁、胸水和脑脊液等体液。
5.4.2 液体活检在早期诊断中的应用进展
许多针对cfDNA的商业化产品也在研发之中,STRIVE研究(NCT03085888)[189]利用亚硫酸氢盐测序评估数千个甲基化序列并结合机器学习方法来预测癌症甲基化模式,实现对包括肠癌在内的12种癌症的识别。一项概念验证研究[190]入组了包括肠癌在内的208例不同阶段的癌症患者和215名健康人,使用机器学习识别癌症患者血液中DNA片段化的异常模式,即全基因组上不同区域的长短片段的比值,该方法在95%特异度下对肠癌检测的灵敏度达81%。
粪便DNA检测近年来也越来越受到关注,传统肠癌早筛使用FIT,但其特异度低,容易受饮食等因素影响,相比之下,粪便DNA检测可能更具有优势。随着检测技术的优化和DNA靶标的更新,多靶点粪便DNA panel对结直肠癌检测展现出很好的结果。早在2014年,美国FDA就批准ColoGuard用于结直肠癌筛查,其利用粪便样本检测血红蛋白和多基因(NDRG4和BMP3)甲基化及KRAS在内的7个基因突变,作为世界上第1个获批的基于粪便DNA的结直肠癌筛查产品,大样本临床试验证实了ColoGuard相比传统FIT对肠癌的识别更准确[191]。除ColoGuard外,目前其他成熟的商品化基于粪便DNA的肠癌检测试剂盒也有许多,包括德国Epigenomics公司的Epiprocolon和杭州诺辉健康科技有限公司的常卫清等[192]。
除了甲基化外,羟甲基化也是表观遗传修饰的重要标记,研究[193]证实羟甲基化在正常基因组中表达量相对稳定,具有独特的表观修饰作用,5-羟甲基胞嘧啶在近年来越来越被认为可能是下一代癌症检测的标志物,目前认为该修饰与基因调控和肿瘤发病密切相关。在肝癌、胰腺癌等癌种中,均有高质量研究[194-195]证实了5-羟甲基胞嘧啶用于早期诊断的价值。笔者所在团队在5-羟甲基胞嘧啶用于肠癌早诊已经取得良好结果,已开展多中心临床研究建立5-羟甲基胞嘧啶肠癌早诊模型,相比于传统的癌胚抗原(carcinoembryonic antigen,CEA)可以更精准、更特异地发现早期肠癌[196]。
5.4.3 展望
除了上述相对成熟的液体活检技术外,各种新兴的生物标志物也在被研究,包括外泌体、miRNA等。外泌体作为细胞间通讯的一种手段,在几乎所有体液中都非常丰富,其可以包含蛋白质、RNA等。目前已有基于外泌体miRNA、lncRNA及蛋白质等对肠癌进行早期诊断的研究,由于缺乏标准化的标本制备、外泌体分离和分析程序,因此目前外泌体的临床应用仍然受限,如何实现外泌体标准化标本制备、外泌体分离和分析仍是其发展的瓶颈[197]。miRNA作为一种非编码RNA,主要参与基因转录后调节。与其他RNA相比,其化学稳定性较高,且在不同癌症中有相对特异的表达谱,被认为可能是一种合适的肿瘤诊断标志物[198]。许多研究报道了miRNA在肠癌早期诊断中的作用,如2021年发表于NatureCommunication的研究[199]利用7种miRNA实现对结直肠癌发病风险的预测,但其同样受检测方式的影响,如何建立成熟的、可复现的miRNA早诊模型仍值得探索。
在过去的几十年里,液体活检领域发展迅速,在肿瘤的诊断、监测、疗效预测和预后预测等方面有着鼓舞人心的结果。越来越多证据表明,液体活检在结直肠癌早诊上可以发挥重要作用,其中CTC、cfDNA等已经展现出巨大潜力,并在临床上得到验证和使用。但液体活检仍有局限性,结肠镜和活组织检查仍是肠癌诊断不可替代的金标准。
目前液体活检在技术上仍存在阻碍,还缺乏分离、富集或检测的标准化方法,应用不同的技术或检测方法来检测可能会导致不同的灵敏度和特异度,成熟稳定的检测平台仍是目前临床转化的瓶颈。此外,仍需要开展多中心大规模的前瞻性研究验证其使用价值,相信随着技术发展,液体活检在肠癌早诊上会发挥越来越大的作用。
5.5 本章小结
综上所述,结直肠癌的早期诊断和治疗仍是提高生存率和改善患者预后的重要诊治手段。结肠镜检查结合活检病理学检查作为结直肠癌早期诊断的重要手段,能为患者后续治疗策略的制定提供重要参考。近年来,肠镜下结直肠癌的诊断技术逐步发展,ME、电子染色内镜和CLE等多种改良内镜技术手段的出现,为内镜医师整体评估病变状态提供了依据。同时,术前全面的影像学检查和相对成熟的液体活检及分子检测技术在结直肠癌的早期诊断、监测、疗效预测和预后预测中均发挥重要作用,助力结直肠癌早期诊断和制定诊治策略。通过临床现有手段,以规范化的结肠镜检查、病理学诊断及影像学诊断结合迅速发展的液体活检技术,早期诊断结直肠癌并选择后续手术方式和个性化诊治策略以阻止疾病的进一步发展,是改善患者预后的重要手段。
5.6 相关推荐
各种内镜的适用场景:传统WLE适用于日常人群及高危患者的结直肠癌筛查及初步诊断,并结合内镜下活检钳对病变组织进行靶向多点活检病理学诊断,提高结直肠癌的诊断准确率。色素内镜结合ME适用于发现结直肠黏膜病变后,内镜医师在内镜下对于该病变的血管类型等其他分型的辅助判断。胶囊内镜可作为全消化道检查的辅助手段,既往常用于小肠肿瘤的诊断,同时适用于存在一定结肠镜检查禁忌证(如患有严重IBD或身体状况无法支持传统肠镜检查)的患者,以避免肠镜检查所带来的风险。超声肠镜可以在一定程度上显示肠壁结构,提示病变浸润深度,为后续选择手术方案提供重要参考。CLE作为近年来新兴的内镜诊断技术,通过激光共聚焦显微技术使肠道黏膜放大50 ~ 150倍并且获得极高分辨率的图像,以观察组织形态,可以作为ME及EUS的补充方式,辅助结直肠癌的诊断。早期结直肠癌病理学诊断的标准化格式应包含以下要点:基于早期癌内镜分型标准的肉眼分型、基于早期胃肠黏膜上皮肿瘤性病变的组织学类型、标本水平切缘及垂直切缘状态、肿瘤侵犯深度(黏膜下层存在浸润,深度则需详细描述)、脉管有无侵犯、是否存在溃疡及其他黏膜病变。
6 早期结直肠癌的治疗
6.1 早期结直肠癌和癌前病变的内镜治疗
6.1.1 早期结直肠癌及癌前病变行内镜治疗的适应证
与传统外科手术相比,内镜下切除具有创伤小、并发症少、恢复快及费用低等优点,且疗效相当,5年生存率均可达到95%以上[200]。原则上,无淋巴结转移或淋巴结转移风险极低、使用内镜技术可以完整切除、残留和复发风险低的病变均适合行内镜下切除[201-202]。推荐结直肠腺瘤、黏膜内癌为内镜治疗的绝对适应证,黏膜下浅层浸润的SM1癌为内镜治疗的相对适应证[203-204]。
腺瘤和黏膜内癌无淋巴结以及血管转移,是内镜治疗的绝对适应证。黏膜下浅层浸润的SM1癌淋巴结转移的比例仅为3.3%,因此,可作为内镜治疗的相对适应证。但是需要对切除的标本进行严格的病理学评估,判断是否有淋巴管和脉管的浸润,根据具体情况来判断是否需要追加外科手术。据报道[204],对于黏膜内癌及SM1癌行内镜治疗和外科手术治疗的疗效差异无统计学意义。
6.1.2 早期结直肠癌及癌前病变行内镜治疗的禁忌证[201,203-204]
⑴ 术前判断发生黏膜下深层浸润者。
⑵ 术前判断提示肿瘤已浸润至固有肌层者。
⑶ 术前判断发生淋巴结转移甚至远处转移者。
⑷ 合并严重心肺疾病,美国麻醉医师协会分级Ⅲ级及以上,无法耐受内镜手术。
⑸ 生命体征不平稳。
⑹ 有出血倾向或正在使用抗凝药。
⑺ 不能取得患者同意。
⑻ 患者不能配合。
⑼ 无法行肠道准备(如肠梗阻等)。
⑽ 有其他结肠镜检查禁忌证。
⑾ 肿瘤位置不利于内镜治疗,如内镜控制不充分,在进行内镜治疗时操作较困难,同时对出血、穿孔等并发症的对应处置也困难者,为内镜治疗的相对禁忌证[203-204]。
6.1.3 术前评估
在进行内镜治疗时,有关肿瘤大小、预测肿瘤浸润深度及组织类型的信息是不可或缺的[204]。因此,术前准确评估肿瘤浸润深度、范围及有无淋巴结侵犯是选择合理治疗方式的关键。对肿瘤浸润范围的判断主要借助染色内镜和NBI,浸润深度的判断则主要依据病变大体形态、放大染色观察病变腺管开口分型及NBI分型等[201]。
所有结直肠肿瘤疑有癌变时均应在白光和染色内镜下仔细观察,有条件时可行ME和电子染色内镜检查以判断可能的浸润深度,预测淋巴结转移的风险。对0 ~ Ⅱc病变、非颗粒型及结节混合型LST,建议常规使用染色放大或NBI评估深层黏膜下浸润癌的发生风险[201]。EUS也可提供有用的信息,但目前缺乏统一的标准,受操作者水平影响较大,准确的评估仍依据术后病理学诊断[201]。
推荐内镜治疗前应用EUS、CT及MRI等影像学检查进行临床分期,排除浸润达到或超过肌层、区域淋巴结转移或远处转移的患者。无淋巴结转移,并且根据肿瘤的大小及部位预计能够一次性切除的早期结直肠癌是内镜治疗的适应证。综合应用pit pattern分型、Sano分型和NICE分型、黏膜下注射是否有抬举征以及EUS检查来确定结直肠病变浸润深度来指导治疗方案的选择[107]。
6.1.4 内镜治疗方法的选择
近年来,随着内镜下诊治技术的不断进步,绝大多数早期结直肠癌和癌前病变都可以通过内镜下手术切除[205]。常用的内镜切除方法包括息肉凝除术、息肉钳除术、息肉圈除术、EMR和ESD等[201]。冷圈套、冷活检钳技术也可用于较小息肉的摘除[201]。
⑴ 息肉凝除术(图18):息肉凝除术一般用于5 mm以内的小息肉,可以采用热活检钳的头端凝除息肉,也可以行氩离子凝固术。
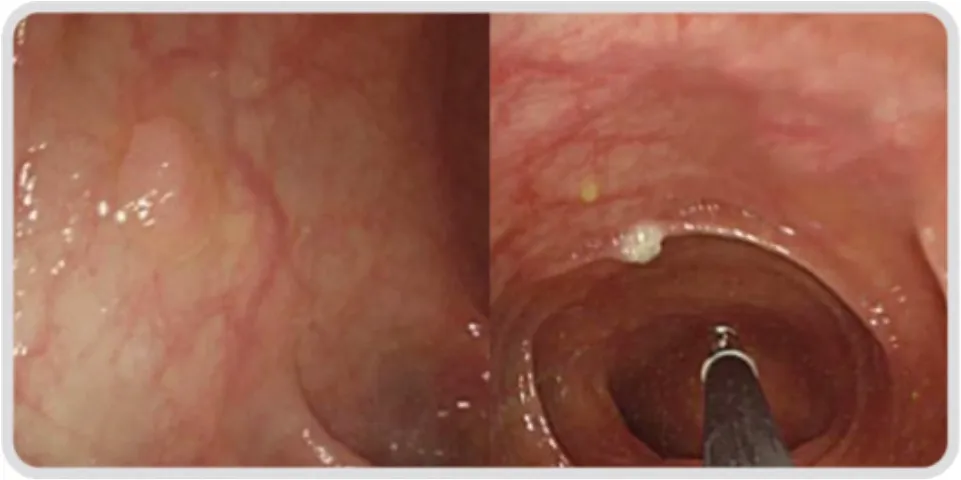
图18 结肠息肉凝除术Fig.18 Coagulation for colon polyp
通过结肠镜插入一个带电的热活检钳,通电后,利用电能产生的热量将息肉凝除。
⑵ 息肉钳除术(图19):息肉钳除术是指采用热活检钳,通电后将息肉完整钳除。一般适用于有蒂或亚蒂的小息肉,并且可以留取息肉标本送病理学检查。息肉钳除术存在病变残留率高、对标本的组织结构有破坏、容易发生迟发性出血和穿孔风险高等缺点[206]。
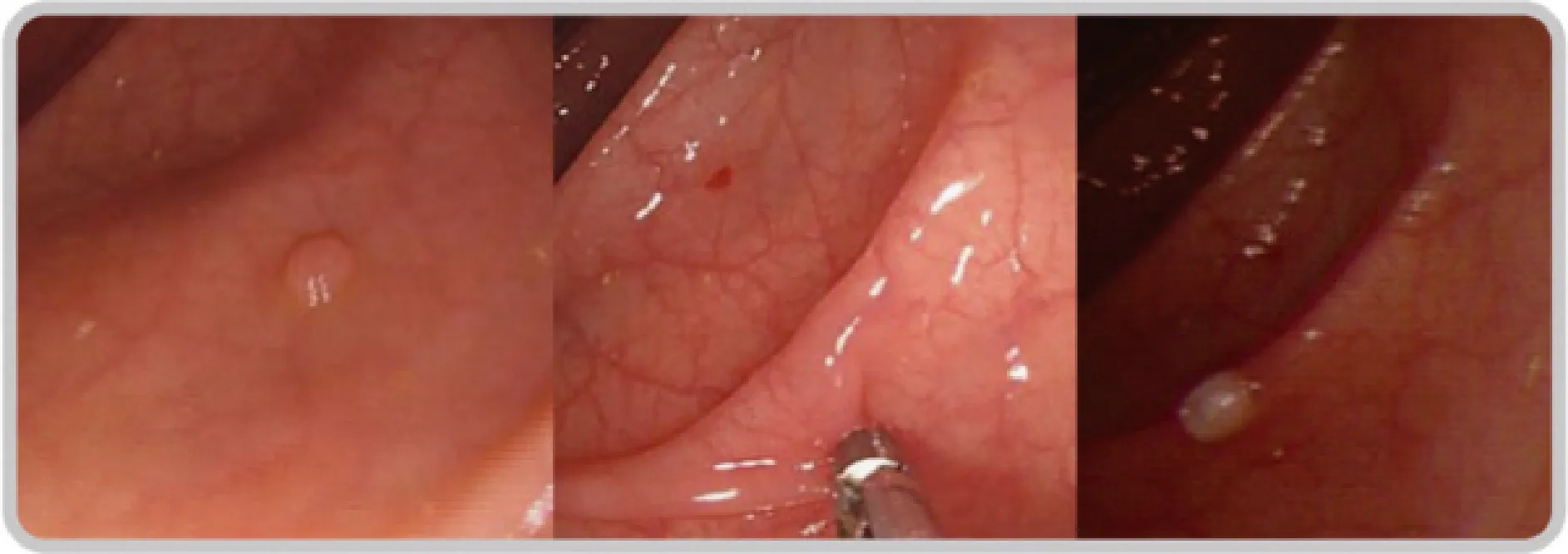
图19 结肠息肉钳除术Fig.19 Forcep polypectomy for colon polyp
通过结肠镜插入一个带电的热活检钳,将钳子的两个嘴张开后,夹住息肉,通电后,利用电能产生的热量将息肉切下来。切下来的标本取出后送病理学检查。
⑶ 息肉圈除术(图20):息肉圈除术是指用圈套器在息肉基底部,一次性将息肉完整圈除,一般用于治疗直径>5 mm的隆起型病变。与息肉钳除术相比,息肉圈除术的息肉残余率和肠穿孔发生率更低。对于直径>1 cm的广基病变,有一定的不完全切除率,如怀疑伴绒毛成分、无蒂锯齿状腺瘤/息肉癌变,应考虑行EMR[207]。
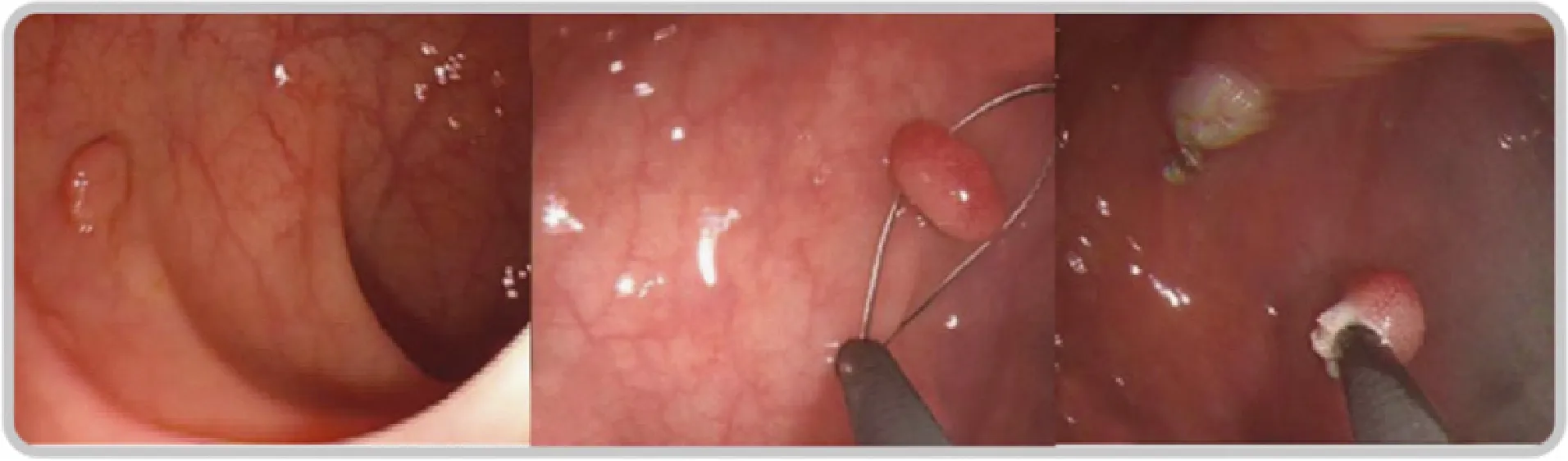
图20 结肠息肉圈除术Fig.20 Snare polypectomy for colon polyp
通过结肠镜插入一个带电的圈套器,将圈套套在息肉的基底部,收紧圈套,通电后,利用电能产生的热量将息肉切下来。切下来的标本取出后送病理学检查。
⑷ EMR:EMR是指内镜下往黏膜下注射液体(通常是甘油果糖+肾上腺素+亚甲蓝),将黏膜病灶抬起,然后用圈套器整块或分块切除。常用于用于大肠表浅肿瘤的诊断和治疗[201]。内镜分片黏膜切除术(endoscopic piecemeal mucosal resection,EPMR)用于传统EMR不能一次完整切除的较大病灶,该技术将病灶分多次切除,适用于直径>2 cm的巨大平坦型病变[201]。分片切除的组织标本体外拼接困难,影响精确的病理学检查评估,局部残留和复发风险高,术后应注意密切随访[208]。
⑸ ESD:ESD是在EMR基础上发展起来的新技术,对不同部位、大小、浸润深度的病变,在进行黏膜下注射后使用特殊电刀,如IT刀、Dual刀和Hook刀等,逐渐分离黏膜层与固有肌层之间的组织,将病变黏膜和黏膜下层完整剥离的方法。ESD的具体操作步骤如下:① 黏膜下注射,使病灶明显抬举;② 部分或环周切开黏膜;③ 黏膜下剥离,使黏膜与固有肌层完全分离,一次完整切除病灶;④ 创面处理,包括创面血管处理和边缘检查;⑤ 标本处理和送检。结直肠ESD相对于上消化道ESD有独特的特点,结肠肠壁菲薄、部分肠段相对游离及肠腔操作空间小等解剖因素决定了其操作难度较大[201]。ESD治疗早期结直肠癌的整块切除率和完全切除率更高,局部复发率更低[201]。ESD主要用于治疗最大径在2 ~ 5 cm之间的结直肠腺瘤和早期结直肠癌。国内结直肠ESD的发展极不均衡,只有少数大型医疗机构能常规开展该技术,整块切除率为85.5% ~ 98.3%,治愈性切除率为83.3% ~ 97.6%。结直肠ESD与腹腔镜辅助外科手术疗效相当,但并发症风险更小[209]。与常规内镜切除和EMR相比,ESD的完整切除率更高[201,210]。
不同内镜治疗方法的适应证:
⑴ 息肉钳除术的适应证:对于5 mm以下的结直肠病变可以使用热活检钳钳除术,但由于热活检钳钳除术会损坏组织,所以要慎用[107,204]。需要注意的是在通电时如果钳子向下压,会有穿孔的危险,所以要将组织上提再通电[204]。
⑵ 息肉圈除术的适应证:对于微小息肉(≤5 mm)可以使用冷圈套器切除[203]。对于小型息肉(6 ~ 9 mm),推荐使用冷圈套器或热圈套器切除术[203]。对于隆起型病变Ⅰp型、Ⅰsp型及Ⅰs型,推荐使用圈套器电切术或冷切术[107,204]。对于Ⅰp型病变,圈套器要套住蒂的中间部;对于Ⅰs型病变,圈套器要套在病变的基底部,之后再收紧圈套器,将病变上提接通高频电切除;残余部分较大时可再次电切,残余部分较小时,可予以热活检钳或APC烧灼处理;切除的标本要回收行病理学检查[204]。
⑶ EMR的适应证:对于可一次性完全切除的Ⅱa型、Ⅱc型及一部分Ⅰs型病变,推荐使用EMR治疗,安全有效,是临床一线治疗方法[107,204]。EMR在原则上以能进行一次性切除的最大直径不超过20 mm的病变为适应证[107,203],但是有些直径超过20 mm的病变可以通过分割切除治疗,即EPMR。对于面积较大的Ⅰs型、Ⅱa型病变、LST和结直肠HGD,用EPMR治疗是安全和有效的,并且与外科手术相比,具有并发症少、住院时间短及费用低等优势,可以作为临床一线治疗方案。如果残留部分较大时再行EMR追加切除,对于小的残余用热活检钳或氩离子凝固术烧灼处理。回收切除的标本,必须进行病理组织学检查[204]。
⑷ ESD的适应证:对于最大直径超过20 mm且必须在内镜下一次性切除的病变、抬举征阴性的腺瘤及部分早期癌、>10 mm的EMR残留或复发再次行EMR。治疗困难者及反复活检不能证实为癌的低位直肠病变,推荐使用ESD[107,204]。ESD在切除病灶的大小、整块切除率、完全切除率及病灶的复发率等方面均优于EMR[211]。但ESD的技术难度较大,需由有资质的高年资专科医师实施[107]。由于结直肠ESD的技术难度较大,相关并发症发生率较高。在日本结直肠ESD穿孔率为1.4% ~ 10.4%[204],国内有研究[204]显示,结直肠ESD的穿孔率为9.4%,要明显高于结直肠EMR治疗的穿孔率。所以,在选择ESD治疗早期结直肠癌及癌前病变时,一定要慎重。另外,利用ESD治疗LST时更容易穿孔,在治疗过程中一定动作轻柔,幅度要小,降低穿孔率[204]。
⑸ 其他方法的适应证:包括氩离子凝固术、光动力治疗、激光疗法及微波治疗等,只能去除肿瘤,不能明确病理学诊断,也无法确定肿瘤是否获得根治。因此,不建议作为结直肠腺瘤及早期结直肠癌的首选治疗方法[203],可以用于其他治疗后怀疑有小的残留时[204]。
6.1.5 术后饮食、用药和相关并发症的处理
6.1.5.1 术后饮食
内镜治疗后通常需要禁食1 ~ 3 d;密切观察血压、脉搏及呼吸等生命体征的变化,进行必要的实验室检查,如临床表现和相关检查无异常,然后再开始进食流质,然后在2周内逐渐过度到正常饮食[201]。
6.1.5.2 术后抗生素的使用
一般来说,息肉钳除、圈除和EMR者不需使用抗生素,仅预计大范围ESD时从手术当日开始静脉使用抗生素[204]。对于术前评估切除范围大、操作时间长、肠道准备差及穿孔风险高者,可考虑预防性使用抗菌药物。选用第二代或第三代头孢菌素,可加用甲硝唑。术后用药总时间一般不超过72 h。评估认为出血风险较大者,可酌情使用止血药物[201]。
6.1.5.3 手术相关并发症的处理
内镜治疗术后的常见并发症包括肠出血、肠穿孔、电凝综合征及腹部不适等[201,203-204]。
⑴ 肠出血:术后出血指术后2周内需急诊留观、住院或干预处理(再次行结肠镜干预或血管造影栓塞或外科手术)的出血,多发生在术后48 h内[201]。出血的主要原因是电凝止血不彻底,尤其是病变蒂比较粗大者,出血的风险更大。少量出血可以通过内镜治疗,如电凝止血、止血夹止血等予以止血处理。大量出血者如果内镜下止血效果不好,可能还需要输血,甚至外科手术[204]。
⑵ 肠穿孔:术中肠穿孔多能即刻发现,如操作结束后腹部平片发现膈下游离气体,CT发现腹腔游离气体,或查体见明显广泛腹膜刺激征等,应考虑为术后肠穿孔[201]。肠穿孔的主要原因是病变基底部肠壁被收入圈套器电切或电凝时间过长损伤到肠壁深层的组织。一般情况下穿孔可以经内镜下钛夹夹闭穿孔部位。如果出现弥漫性腹膜炎的体征,或内镜治疗后腹膜炎的症状体征进行性加重,则需要行外科手术治疗[204]。
⑶ 电凝综合征:又称息肉切除术后综合征或透壁综合征,表现为结肠病变高频电切除后出现的局限性腹痛、发热、白细胞升高、腹膜炎而无明显穿孔征象,发生率为0.003% ~ 0.100%。高血压、病变较大及形态平坦是电凝综合征的独立危险因素。对电凝综合征患者一般采取禁食和水、静脉输注广谱抗生素、补液及营养支持治疗,直至症状消失,通常预后良好[201]。
6.1.6 补救性手术的指征
内镜下切除术后,如果出现以下情况,需要补救性根治性切除术+淋巴结清扫术[107,201,204]:① 切除标本侧切缘和基底切缘阳性(距切除切缘不足500 μm);② 黏膜下浸润深度≥1 000 μm;③ 淋巴管血管侵犯阳性;④ 低分化腺癌、未分化癌、印戒细胞癌或黏液腺癌;⑤ 浸润最深部位有高级别肿瘤出芽(2级以上);⑥ 带蒂息肉的蒂部有肿瘤细胞浸润。
对于部分高龄、低位直肠癌患者保肛意愿强烈而不愿接受手术者,可考虑提交多学科团队(multi-disciplinary team,MDT)讨论后行补救性放化疗[107]。
6.1.7 癌前病变内镜下切除术后的随访复查
大肠癌前病变的患者在内镜治疗后要进行密切随访,密切随访可以显著提高患者的生存率[200-201,204]。
⑴ 直肠、乙状结肠增生性小息肉(直径<10 mm),每2 ~ 3年复查1次。
⑵ 对于1 ~ 2个小管状腺瘤(直径<10 mm)的患者,在息肉切除术后1 ~ 3年进行初次随访,具体间隔视患者意愿、医师选择而定。
⑶ 对于3 ~ 10个腺瘤,并且任何一个腺瘤的直径≥10 mm、有绒毛结构、HGD的患者,建议每1 ~ 2年复查1次。
⑷ 对于1次发现10个以上腺瘤的患者,建议每年复查1次,并注意排除FAP的可能。
⑸ 推荐对于接受分块切除无蒂型息肉的患者应该在随后的2 ~ 6个月进行随访,从而验证息肉是否被完全切除。
⑹ 推荐对于怀疑有LS和息肉病综合征的患者应加强随访[204]。
6.1.8 内镜治疗术后复发的处理
6.1.8.1 术后复发率
国外报道,常规EMR 局部复发率为0.8% ~ 7.2%,EMR或EPMR切除较大结直肠病变后局部复发率较高,困难病例的局部残留或复发率甚至高达20.4% ~ 27.0%。一项meta分析[212]发现,EMR切除结直肠无蒂病变的中位局部复发率达15%,分片切除复发率高达20%,而整块切除后复发率仅为3%,分片切除是复发的唯一独立危险因素,结直肠ESD的局部复发率仅为0.0% ~ 2.0%。国内文献[201]报道,EMR复发率为0.0% ~ 3.2%,ESD局部复发率为0.0% ~ 4.9%。
6.1.8.2 复发的预防和处理
切除病变后应仔细检查创面,有条件者建议使用染色或NBI观察,发现可见残留时尽量使用圈套器圈除。研究提示,使用氩离子凝固术电凝治疗复发风险高,可控性差。
6.1.8.3 随访
国内较为公认的是治愈性切除后6和12个月各复查1次结肠镜,此后每年复查1次,并行肿瘤标志物和相关影像学检查。一般认为分片切除的病例,应在3 ~ 6个月内行首次复查[201]。
6.2 早期结直肠癌的经肛门局部治疗
根据肿瘤的位置和严重程度,直肠癌有多种手术方法。这些方法包括局部切除术[如息肉切除术、经肛门局部切除术和经肛门内镜下微创手术(transanal endoscopic microsurgery,TEM)]和创伤更大的经腹手术(如直肠前切除术、低位前切除术和腹会阴联合切除术)[213]。本节拟对直肠癌经肛门局部切除的优缺点、适应证和注意事项作一简要介绍。
局部手术的优点为并发症发生率更低、围手术期死亡率低及术后恢复快[213-214]。局部切除的局限性为没有淋巴结受累的病理学分期[213]。此外,有证据[215]表明,淋巴结微转移在早期直肠病变中很常见,并且不太可能通过ERUS发现。接受局部切除的患者局部复发率高于接受根治性切除的患者[213]。一项对1985—2004年接受经肛门局部切除术或根治性切除术治疗的T1期直肠癌的282例患者进行的回顾性研究[216]显示,两组患者的局部复发率分别为13.2%和2.7%(P= 0.001)。一项纳入2 124例患者的回顾性研究[217]显示,接受局部切除术和标准根治性切除术患者的局部复发率分别为12.5%和6.9%(P= 0.003)。经肛门局部切除术和TEM均要求行直肠全层切除,切除深度要达到直肠周围脂肪组织。黏膜切缘和基底切缘距离肿瘤边缘要>3 mm,并且要完整切除,避免肿瘤破碎[213]。局部切除的标本应在固定前进行定向和固定,并由外科医师标注好,让病理科医师充分理解,以促进标本的定向组织病理学评估。如果病理学检查发现不良特征,如切缘阳性、淋巴管血管侵犯、低分化、侵犯黏膜下层下1/3[218],则建议行补救性的经腹根治性切除[213]。仔细选择合适的T1N0期直肠癌患者行局部切除术非常重要,仔细检查手术切除的标本也很重要,有部分后续行经腹根治性手术的患者被证明为T2期肿瘤或具有一些高危特征[213]。
6.2.1 经肛门局部切除术
经肛门局部切除术仅适用于某些早期直肠癌(T1N0期)[213]。只有同时符合下述条件的直肠癌,才可以通过经肛门局部切除术完整切除,达到切缘阴性。经肛门局部切除术的适应证包括:① 肿瘤直径<3 cm;② 高至中度分化的肿瘤;③ 位于距肛缘8 cm以内;④ 肿瘤累及小于30%的周径;⑤ 没有淋巴结转移的证据。
6.2.2 TEM
距肛缘<20 cm 的结直肠肿瘤可选择TEM[219]。当可以充分显露直肠病变时,TEM可以通过肛门切除小的直肠肿瘤。特别是对于位置更高的直肠病变,TEM的优势更明显[213]。
6.2.2.1 TEM的适应证[107]
⑴ 直肠腺瘤,尤其适用于广基或无蒂直肠腺瘤。
⑵ 良好组织病理学特征的早期直肠癌(病变占肠周<30%、直径<3 cm、肿瘤活动、中/高分化、cT1N0期、无脉管或神经浸润、无淋巴结转移证据)。
⑶ 经内镜切除局部恶变息肉(底部/周边切缘阳性或无法评估)的扩大切除。
6.2.2.2 TEM的相对适应证[107]
⑴ 不良组织病理学特征的cT1期直肠癌(直径>3 cm,3级以上分化或淋巴管血管侵犯)的姑息性切除。
⑵ 高龄、伴随较重基础疾病、手术风险高的cT2期及以上分期直肠癌患者的姑息性切除。
⑶ cT2期及以上分期直肠癌行根治手术无法保留肛门而坚决要求保肛患者的姑息治疗,在充分告知风险及可选择治疗方案的前提下慎重实施,术后根据病理情况经MDT讨论后制定下一步治疗策略。
6.2.2.3 TEM的禁忌证[107]
⑴ 无法耐受手术者。
⑵ 距肛缘>20 cm的结直肠肿瘤。
⑶ 肛门或直肠狭窄,无法置入TEM直肠镜者[107]。
6.2.2.4 TEM的肿瘤学结果
2015年,一项meta分析[220]结果显示,与经肛门局部切除术相比,TEM可能获得更好的肿瘤学结果。一项小型前瞻性、单盲、随机试验[221]比较了腹腔镜手术与腹腔镜联合TEM治疗60例直肠癌患者的疗效,发现TEM组手术时间和住院时间较短,中位随访28个月后,两组均未见局部或远处复发。个别研究[222-223]显示,与根治性切除术相比,TEM在Ⅰ期直肠癌患者中的肿瘤学结果可能优于根治性切除术,但并非所有研究都得出同样的结果[224]。
6.3 早期结直肠癌的根治性手术
6.3.1 早期结直肠癌的经腹根治性手术
对于术前评估提示超出局部切除术(含内镜下手术及经肛门手术)适应证范围的早期结直肠癌和癌前病变,以及局部切除术后评估需要追加外科手术的患者,应行经腹根治性手术。建议结合肿瘤生长位置、大小、患者手术耐受度及患者意愿等综合考虑决定具体的手术方式及切除范围[107]。结直肠癌的根治性手术方式推荐行全结肠系膜切除(complete mesocolic excision,CME)或全直肠系膜切除(total mesorectum excision,TME)。根治性手术需要遵循肿瘤外科原则,遵照相关指南和规范选择手术切除范围和淋巴结清扫范围[107]。
TME为整块切除直肠系膜,包括相关的血管和淋巴结构、脂肪组织和直肠系膜筋膜。直肠系膜筋膜将肿瘤和周围淋巴结完整包裹起来,通过在筋膜外侧的锐性分离,可以保护自主神经。TME旨在从根本上去除位于肛提肌上方直肠系膜内的淋巴引流区域。如果肛门功能完好且远端肠管足够长,则可以在TME之后进行结肠肛门吻合术[213]。如果肿瘤位置过低,则可能需要行经腹会阴联合根治性切除术(Miles术)。
6.3.2 经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)
与常规腹腔镜手术相比,结直肠癌的NOSES的区别在于取标本的途径和消化道重建方式。因为腹部没有辅助切口,所以外观上更加美观,创伤更小,恢复更快。
6.3.2.1 NOSES的适应证
由于NOSES是基于常规微创设备平台完成的,因此NOSES必须先满足常规微创手术适应证的基本要求,主要包括:① 手术团队一定要具备丰富的腹腔镜手术经验,并能熟练完成全腔镜下消化道重建;② 不能用于局部晚期肿瘤;③ 不适用于肿瘤引起的急性肠梗阻和肠穿孔;④ 需进行全腹腔探查;⑤ 需考虑术前病灶定位[224]。
NOSES需经自然腔道完成标本取出,这对NOSES适应证也提出了具体要求,主要包括:肿瘤浸润深度以T1~ T3为宜;经肛门取标本要求标本最大环周直径<5 cm为宜;经阴道取标本要求标本最大环周直径5 ~ 7 cm为宜。在临床工作中,可以根据肠系膜肥厚程度、自然腔道解剖结构等情况,灵活掌握手术适应证。良性肿瘤、Tis、T1期肿瘤病灶较大,无法经肛门切除或局部切除失败者,也是NOSES的合理适应证[225]。
6.3.2.2 NOSES的禁忌证
NOSES的相对禁忌证包括肿瘤局部晚期、肿瘤病灶较大、肠管系膜肥厚及患者过度肥胖(BMI>30 kg/m2)[107,225]。此外,合并肛周疾病或肛门狭窄者不建议开展经直肠NOSES,合并妇科急性感染、阴道畸形、未婚未育及已婚计划再育的女性,不建议开展经阴道NOSES[107,225]。
6.3.3 经肛门TME(transanal TME,taTME)
部分早期中低位直肠癌可以选择taTME,它是利用TEM或经肛微创外科手术(transanal minimally invasive surgery,TAMIS)平台,采用“由下而上”的操作路径,并遵循TME原则而实施的经肛腔镜直肠切除手术[107]。建议在有经验的中心谨慎开展taTME手术。
6.3.3.1 taTME的适应证
男性、前列腺肥大、肥胖、肿瘤直径>4 cm、直肠系膜肥厚、低位直肠前壁肿瘤、骨盆狭窄、新辅助放疗引起的组织平面不清晰等“困难骨盆”的中低位直肠癌,尤其是低位直肠癌患者[107]。
6.3.3.2 taTME的禁忌证
taTME手术不适用于肛门狭窄或有损伤史的患者,也不适用于高位直肠癌的患者[107]。taTME的禁忌证主要包括肛门狭窄或肿瘤过大无法置入经肛操作平台者,以及患有严重基础疾病而无法耐受腔镜手术者[226]。
6.3.3.3 taTME的规范化培训至关重要
taTME是一项近年来在结直肠外科领域迅速发展的新技术,具有较高的操作难度,且受到盆腔解剖结构的复杂性及手术视野狭小等因素的影响,初学者不易在较短时间内掌握,具有一定的挑战性[227]。首先,传统的腹腔镜或开腹手术操作均是从上往下,腹腔内视野较为开阔,解剖结构及解剖标志相对熟悉,而taTME手术采用自下而上的手术方式,视野相对狭小,而且大部分结直肠外科医师对于经肛腔镜视野下的解剖标志还不太熟悉[227];其次,taTME主要采用经肛的单孔操作,而使用的仍然是传统的腹腔镜手术器械,在操作过程中存在“筷子效应”,对于术者的技术要求更高,即使是腹腔镜技术娴熟的医师亦存在一定困难[227]。因此掌握taTME技术必然需要经过一定的学习曲线锻炼,而规范化的培训有助于缩短学习曲线,保障患者安全[227]。
6.3.4 经括约肌间切除术(intersphincteric resection,ISR)
对于不适合行局部切除术的cT1早期低位直肠癌患者,可选择行ISR。根据内括约肌切除范围的不同,ISR手术主要分为部分内括约肌切除术(Ⅰ型)、次全内括约肌切除术(Ⅱ型)及完全内括约肌切除术(Ⅲ型)。ISR的禁忌证包括肿瘤侵犯肛提肌或外括约肌及术前肛门控便能力不佳[228]。ISR术后患者的肛门排便和控便功能会受到一定影响,应该严格选择括约肌良好和沟通充分的患者施行该术式。行ISR时,要注意避免损伤女性阴道后壁和男性后尿道,避免损伤直肠外括约肌和直肠穿孔,保证远端切缘阴性,并常规行预防性末端回肠造口术[107]。
6.3.5 低位早期直肠癌的适形切除术
随着外科设备和器械的不断进步、腹腔镜直肠癌临床研究的开展,以及对极低位直肠周围组织相关解剖和直肠癌肿瘤生物学行为的不断认识,部分极低位直肠癌患者可以在保证肿瘤学疗效的基础上免遭切除肛门的痛苦。海军军医大学第一附属医院的张卫[228]在对局部解剖及生理功能的深入认识基础上,提出了一种极低位直肠癌功能性保肛新术式—适形保肛手术(conformal sphincter preservation operation,CSPO)。CSPO的手术方式主要是在分析了导致ISR后功能不佳的原因,同时在对盆底肛管超微结构深入研究的基础上而进行的一系列有针对性的改进设计。CSPO和ISR都是针对极低位直肠癌的保肛手术,但存在以下区别:① CSPO不进行广泛括约肌间沟的分离,最大限度地保护神经和肌肉交织结构,从而改善肛门功能;② CSPO与ISR的远端切除线不同,CSPO根据肿瘤的位置,选择斜行向上的弧形切除线,从而避免了ISR的水平切线,因而保留了更多的对侧内括约肌和齿状线;③ 由于CSPO保留了更多对侧的肠壁可以用作吻合,因此,CSPO术后患者的吻合口更高[228]。部分内括约肌切除患者术后的肛门括约功能要好于内括约肌次全切除或全切除的患者,说明保留更多的内括约肌会使患者术后的肛门功能有所改善。保留更多的齿状线会改善肛门的感受功能,而吻合口高度的提升也将直接影响术后的肛门功能。这些改进在临床实践中也取得了理想的效果,目前,CSPO术后Wexner评分为(5.9±4.3)分[229]。一项比较CSPO与ISR的多中心回顾性对照研究[230]显示,两组患者术后3年总生存(overall survival,OS)和DFS率差异均无统计学意义,而CSPO组患者术后的肛门功能满意度明显优于ISR组。此外,在对CSPO手术弧形切除线侧方切缘安全性的研究中证实,侧切缘距肿瘤1 cm也是安全的[231]。
6.4 早期结直肠癌的术前新辅助放化疗
6.4.1 早期低位直肠癌的根治性放化疗和“观察-等待”策略
对于早期低位直肠癌患者,如果行根治性手术,可能无法保留肛门。这种情况下,也可以考虑行术前根治性放化疗。如果放化疗后达到临床完全缓解(clinical complete response,cCR)的患者,可考虑行“观察-等待”策略,如未达到cCR仍建议行根治性切除术。在“观察-等待”期间如果局部复发,再补救行根治性切除术。目前,临床上用以下指标来评价cCR:症状消失,直肠指诊不可触及肿块,CEA等肿瘤指标降至正常水平,结肠镜下肿块不可见,MRI/CT/ERUS未见肿瘤征像。但是,cCR尚不能代表病理学CR(pathological CR,pCR)。因此,达到cCR患者进行“观察-等待”期间需密切随访。也可尝试全程新辅助治疗,可能进一步促进肿瘤退缩,提高pCR率,使得更多患者接受“观察-等待”策略或保肛手术[107,232-233]。
6.4.2 早期低位直肠癌的术前放化疗+免疫治疗
低位直肠癌放疗后的“观察-等待”策略是安全可行的,不会增加远处转移的发生率,也不会对患者生存产生负面影响。但目前术前放化疗后达到cCR的患者比例仍较低。如何改进新辅助治疗方案,提升患者的cCR率,达到器官保留的目的,是目前结直肠癌领域的研究重点。免疫治疗目前在肿瘤的治疗中得到了广泛应用[234]。EYNOTE-177研究[235]结果显示,在dMMR和MSI-H的转移性结直癌患者中,免疫治疗能够显著延长患者的DFS,同时不良反应发生率更低,但对于MMR正常(MMR proficient,pMMR)/微卫星稳定(microsatellite stability,MSS)的患者,免疫治疗并不能使其获益。近年来,已有研究发现放疗与免疫治疗可能存在协同促进作用,其机制主要包括:① 放疗诱发肿瘤细胞死亡后释放肿瘤抗原和免疫激活信号,促进特异性T淋巴细胞抗肿瘤应答;② 放疗改变了肿瘤免疫微环境,使肿瘤细胞的免疫逃逸受到抑制,促进免疫细胞对肿瘤细胞的杀伤作用;③ 放疗可诱导肿瘤组织中肿瘤浸润淋巴细胞的聚集和程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)的表达上调,从而增加免疫治疗敏感性[236-237]。因此,在MSS结直肠癌患者中,放疗有望增加其对免疫治疗的敏感性,进而提升新辅助治疗后cCR患者的比例,为更多的患者提供器官保留的机会(等待观察或局部切除)[234]。
6.5 特殊类型的早期结直肠癌的治疗
6.5.1 遗传性早期结直肠癌的治疗
6.5.1.1 LS伴发早期结直肠癌的治疗
LS是由于MMR基因(MLH1、MSH2、MSH6和PMS2)和EPCAM基因的致病性胚系突变引起的高度外显性遗传性癌症综合征。LS患者发生多种癌症的风险显著升高,包括结直肠癌、子宫内膜癌、胃癌、卵巢癌、胰腺癌、输尿管癌、肾盂癌、神经系统肿瘤(胶质母细胞瘤)、小肠癌、皮脂腺癌和角化棘皮瘤等。LS占所有结直肠癌的3%,是最常见的遗传性结直肠癌,但其临床表现多样,诊断困难。LS的筛查需要综合应用阿姆斯特丹(Amsterdam)标准、贝塞斯达(Bethesda)标准等各种筛查标准、预测模型、危险因素、免疫组织化学检测MMR蛋白的表达情况、MSI、MLH1甲基化、BRAF基因突变和胚系基因突变检测等各种方法。只有找到MMR基因的致病性胚系基因突变后,才能确诊为LS。患者的一级亲属均建议检测该家族的突变基因。通过对LS患者和MMR基因突变携带者进行规范化的随访监测和预防性手术,可以早期发现、甚至预防癌症的发生,还可以通过产前诊断和生殖医学的手段,彻底阻止这个疾病遗传给下一代[238]。
对于已患结直肠癌的LS患者,可选择常规的根治手术(术后每1 ~ 2年行结肠镜检查)或者选择全结肠切除+回直肠吻合术。两种方法各有优缺点,前一种方案术后发生异时性结直肠多原发癌的可能性更高,但是由于LS相关的肠癌预后良好,所以两种方案的OS差异并无统计学意义[238]。需综合分析患者的年龄、个人意愿、后期随访监测的依从性和当地医疗水平进行个体化选择。因为LS患者还有较高的发生子宫内膜癌和卵巢癌的风险,而且很难做到早期诊断,所以对于已完成生育任务的女性患者,推荐在肠道手术或其他腹部手术的同时行预防性全子宫和双侧附件切除术。对于尚未患癌的携带者,由于其一生患肠癌的风险为70%左右,应加强肠镜监控,建议每1 ~ 2年行结肠镜检查[107]。由于常规结肠镜检查是结直肠癌的有效预防措施,因此一般不建议对LS患者进行预防性结肠切除术(癌症发生前切除结肠)。
6.5.1.2 FAP伴发早期结直肠癌的治疗
FAP指结肠内有大量腺瘤性息肉。从广义上讲,所有的腺瘤性息肉病都可以称为FAP,因为他们几乎都是家族遗传性的腺瘤性息肉病。从狭义上讲,只有APC基因突变引起的腺瘤性息肉病才叫FAP,大多数情况下使用的是这个定义。MUTYH突变引起的腺瘤性息肉病为MAP;POLE和POLD1突变引起的腺瘤性息肉病为聚合酶校正相关息肉病(polymerase proofreading-associated polyposis,PPAP);NTHL1突变引起的腺瘤性息肉病为NTHL相关息肉病(NTHL1-associated polyposis,NAP)。还有10% ~ 20%的腺瘤性息肉病突变基因不明。FAP是一种罕见的遗传性癌症易感性综合征,其特征是成百上千个腺瘤性息肉。如果不及时治疗,受影响的个体不可避免地会在相对年轻的时候患上结直肠癌。FAP以常染色体显性遗传方式遗传,是由APC基因突变引起的。APC基因突变导致一组具有重叠特征的息肉病,包括典型FAP、轻型FAP、Gardner综合征和Turcot综合征[238]。
FAP患者的治疗要综合考虑患者的基因型、表型(息肉总数目、直肠息肉数目、年龄)、个人意愿及当地医疗机构的具体情况,进行个体化治疗。有些息肉比较少的FAP患者,可以考虑内镜治疗。一般来说,≤100枚腺瘤的患者,可以考虑每1 ~ 2年行结肠息肉内镜下切除术;息肉数目超过100枚的患者,通常需要行结肠切除术。但是在一些特殊情况(如患者拒绝手术,年轻、未结婚、未生育,硬纤维瘤高危患者)下,也可以考虑内镜治疗,通常需要3 ~ 6个月做1次内镜治疗[238]。
FAP患者的外科手术方式大致有3类[238]:
⑴ 全大肠切除术(total proctocolectomy,TPC)+末端回肠造口术(end ileostomy,EI):其缺点是并发症多,可能出现排尿、排便和性功能障碍,需要永久造瘘。
⑵ TPC+回肠储袋肛管吻合术(ileal pouchanal anastomosis,IPAA):其缺点是术后残余肠黏膜息肉常见,需每年检查储袋和肛管,可导致性功能和生育功能降低,控便功能因人而异。
⑶ 全结肠切除术+回肠直肠吻合术(ileorectal anastomosis,IRA):其并发症少,性功能和生育功能影响小,肛门功能好。其缺点是术后残余肠黏膜息肉常见,2% ~ 12%的患者会出现恶性肿瘤,需每年检查直肠。而且保留的肠管有可能后面息肉越来越多,结肠镜下无法控制,可能需要二次手术。适合于直肠息肉<20枚的患者。
对于携带有APC或MUTYH基因致病性胚系突变的、尚未患息肉的个体,应较早开始肠镜监控,目前不推荐对基因突变携带者行预防性全结肠切除等外科手术[107]。
6.5.1.3 其他遗传性息肉病综合征的治疗
PJS是STK11/LKB1基因的致病性胚系突变引起的遗传性结直肠癌。PJS是一种罕见的常染色体显性遗传性疾病,患病率为1/25 000 ~1/280 000。该病以胃肠道多发性息肉、皮肤黏膜色素沉着和癌症易感性为主要特征。PJS患者罹患多种上皮源性恶性肿瘤的风险明显高于正常人群,其肿瘤谱包括结直肠癌、胃癌、胰腺癌、乳腺癌和卵巢癌等[239]。
JPS是一种罕见的常染色体显性遗传的错构瘤性息肉病综合征,其特征是在整个胃肠道内存在多个幼年型错构瘤性息肉,其中以结肠和直肠最多见。幼年性是指息肉的类型,而不是息肉的发病年龄。大多数JPS个体到20岁时已有息肉;一些人可能在一生中只有4 ~ 5个息肉,而同一家族中的其他人可能有100个以上的息肉。如果息肉未经治疗,可能导致出血和贫血。大多数幼年性息肉是良性的,然而可能发生恶变。JPS家族患胃肠道肿瘤的风险为9% ~ 50%,多为结肠癌,但是也有胃、上消化道和胰腺肿瘤的报道。满足以下任何一条即可诊断为JPS:超过5个结直肠幼年性息肉;遍及胃肠道的多发幼年性息肉;任何数量的幼年性息肉和幼年性息肉家族史。在50% ~ 60%的被诊断为JPS的患者中,能找到SMAD4或BMPR1A基因的胚系突变。大多数SMAD4致病性变异个体还常伴发遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia,HHT)。绝大多数JPS的息肉都可以通过内镜下息肉切除术获得控制。当息肉数量较多时,可能需要切除全部或部分结肠或胃。有HHT表现时也需要及时治疗。对于外科手术切除后的JPS患者,还需要定期进行结肠镜检查,从而对剩余的结肠、直肠和贮袋进行评估[238]。
锯齿状息肉是指隐窝腺体具有锯齿状形态特征的结直肠息肉,常由于隐窝上皮细胞增生、向腺腔内折而形成,其中一些类型具有恶变潜能。SPS是常见的结直肠息肉病综合征之一,与传统的腺瘤癌变过程不同,SPS通过锯齿状息肉途径癌变。SPS是一种遗传性疾病,其遗传学特征包括BRAF基因突变、CpG岛甲基化、RAS基因突变、MSI及少量RNF43突变,而RNF43突变是目前唯一明确的遗传原因。SPS患者及其亲属发生结直肠癌的风险增加。随着内镜技术的发展和诊断标准的不断修订,锯齿状息肉的检出率有所提高,但目前对其认识仍较局限,仍需要进一步研究探讨[238]。
对于PJS、JPS和SPS这3种息肉病综合征,由于息肉的数目相对较少,绝大多数可以通过定期结肠镜下治疗控制好。只有当息肉发生癌变的时候,才需要行根治性的结肠肠段切除术[107]。
6.5.2 IBD合并上皮内瘤变、癌变的外科处理
IBD主要包括CD和UC[239]。IBD发生结直肠癌的风险高于正常人群,中国UC患者发生结直肠癌的10年累计风险为1.5%,20年为3.6%,30年为14.4%[240]。对IBD患者定期进行结肠镜检查,及早发现上皮内瘤变或早期癌变,并行内镜下切除,可有效地预防结直肠癌的发生。对内镜下不可切除的上皮内瘤变病灶、高度上皮内瘤变或多灶性上皮内瘤变,结肠切除术仍为首选的治疗方式[107]。
对UC癌变、内镜切除不满意和不适宜内镜切除的上皮内瘤变者推荐手术治疗[239]:UC合并结直肠癌或上皮内瘤变时,同时性或异时性多源发肿瘤的发生率较高。边界清楚的HGD首选内镜下切除[241],并根据切除病理学检查结果决定是否补做结肠切除术或定期随访。非腺瘤样异型增生相关病变或肿物(dysplasia-associated lesion or mass,DALM)的癌变率高,且36% ~ 41%的LGD-DALM术后病理学检查结果亦显示为HGD或结直肠癌,因此推荐手术。内镜下不可见(扁平)的HGD有40% ~ 60%已癌变,推荐手术。内镜下不可见(扁平)的LGD应采用手术还是内镜下监测尚无定论。
推荐IPAA作为UC的确定性手术方式[239]:IPAA不但切除UC靶器官,而且在末端回肠构建储袋并与肛管进行吻合,使术后患者生活习惯和生活质量接近正常,是目前推荐的UC根治性手术方式。
择期IPAA推荐分两期进行[239]:即在第1次手术完成全结直肠切除+IPAA,并在储袋近端行转流性回肠造口,术后8周左右进行第2次手术,将造口还纳。
对UC合并癌变或HGD者可以实施IPAA,但推荐按照肿瘤外科原则进行[239]:术前合并癌变或HGD、需要手术的UC患者,可以行IPAA,并按照肿瘤外科原则切除系膜并清扫淋巴结,部分直肠病变轻微的结肠HGD可考虑实施IRA;合并低位直肠HGD或早期癌变者,可以行TME+直肠黏膜剥除或ISR+IPAA。既往有结直肠肿瘤的患者在IPAA术后储袋肿瘤风险增加。
6.6 相关推荐
⑴ 早期结直肠癌的内镜治疗手段应用场景:结直肠腺瘤、黏膜内癌为内镜治疗的绝对适应证,向黏膜下浅层浸润的SM1癌为内镜治疗的相对适应证。常用的内镜切除方法包括息肉凝除术、息肉钳除术、息肉圈除术、EMR和ESD等。内镜下切除术后,如果发现切缘阳性或存在复发的高危因素,则需要行补救性根治性切除术。
⑵ 早期结直肠癌的手术治疗手段应用场景:对于术前评估提示超出局部切除术(含内镜下切除和经肛门局部切除术)适应证范围的早期结直肠癌和癌前病变,以及局部切除术后评估需要追加外科手术的患者,应行根治性手术。建议结合肿瘤生长位置、大小、患者手术耐受度及患者意愿等综合考虑决定具体的手术方式及切除范围。
⑶ 早期结直肠癌的新辅助治疗手段应用场景:对于早期低位直肠癌患者,如果行根治性手术可能无法保留肛门,这种情况下也可以考虑行术前新辅助放化疗。如果放化疗后达到cCR的患者,可考虑行“观察-等待”策略。目前还有多项研究正在探索术前放化疗+免疫治疗用于早期低位直肠癌的新辅助放化疗。
利益冲突声明:所有作者均声明不存在利益冲突。

