产前超声诊断先天性心脏病胎儿的基因特征
梁博诚,罗丹丹,罗彩群,谭 莹,欧阳淑媛,廖伊梅,袁 鹰,文华轩,李胜利*
(1.南方医科大学第一临床医学院,广东 广州 510515;2.深圳市妇幼保健院超声科,3.母胎医学中心,4.医学遗传中心,广东 深圳 518028)
新生儿先天性心脏病(congenital heart disease, CHD)是导致围产期新生儿死亡的主要原因之一,在活产儿中的发病率约1%;其中遗传性因素所致者约占35%,且多预后不佳[1-3]。遗传学检查和遗传咨询对于产前诊断CHD至关重要,且直接影响是否终止妊娠及制定产前监测、围产期护理等决策[4]。目前产前常用检测胎儿基因技术包括染色体核型分析、染色体微阵列分析(chromosomal microarray analysis, CMA)及全外显子测序(whole-exome sequencing, WES)[5]。本研究观察产前超声诊断CHD胎儿的基因特征。
1 资料与方法
1.1 研究对象 回顾性分析2014年12月—2022年12月于深圳市妇幼保健院经产前超声诊断CHD并接受基因检测的613胎单胎胎儿,孕妇年龄20~47岁、平均(30.7±4.5)岁,接受侵入性产前诊断时孕周12~38周、平均(23.9±3.5)周;其中572胎接受羊水穿刺、6胎接受绒毛膜活检,终止妊娠后对35胎行脐带基因检测。本研究经院伦理委员会批准[SFYLS(2022)068];检查前孕妇及家属均知情同意。
1.2 仪器与方法
1.2.1 产前超声 采用Samsung WS80A/Samsung HERAXW10A彩色多普勒超声仪、频率4.0~6.0 MHz凸阵探头。嘱孕妇仰卧,由2名具有15年及以上工作经验的超声医师扫查胎儿心脏,采集标准四腔心、左心室流出道、右心室流出道、三血管及三血管气管切面二维超声图像及CDFI,必要时扫查其他切面。参考文献[6]方法将胎儿心脏结构异常分为8类,即圆锥动脉干畸形(conotruncal defect, CTD)、心内膜垫缺损(endocardial cushion defect, ECD)、静脉系统畸形、左/右心室流入道畸形、心脏肿瘤、内脏反位、心肌异常及复合畸形(存在2种及以上上述异常);根据是否合并心外畸形分为非孤立性与孤立性CHD,将后者进一步分为合并胸腺发育不良、泌尿系统畸形、神经系统畸形、宫内发育迟缓、颜面部畸形、骨骼系统畸形、消化道畸形或呼吸系统畸形。见图1。
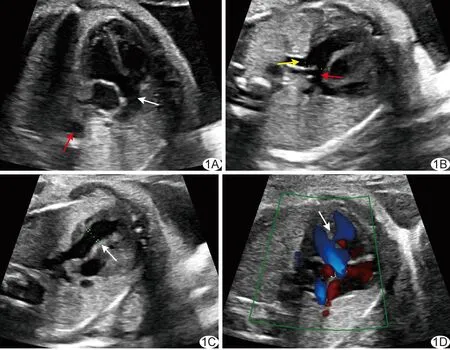
图1 法洛四联症胎儿,孕妇29岁,孕22周 A.左心室流出道切面图示主动脉骑跨(白箭示升主动脉、红箭示降主动脉); B.肺动脉分叉切面图示左肺动脉0.29 cm(黄箭),右肺动脉0.26 cm(红箭); C.右心室流出道切面图示主肺动脉宽0.58 cm(箭); D.左心室流出道切面CDFI示室间隔处过隔血流(箭)
1.2.2 基因检测 染色体核型分析和/或CMA:与深圳市妇幼保健院医学遗传中心内部数据库,以及Database of Genomic Variants(http://dgv.tcag.ca/dgv/app/home)、Database of Chromosomal Imbalance and Phenotype in Humans Using Ensembl Resource(https://www.deciphergenomics.org/)、Online Mendelian Inheritance in Man(https://www.omim.org/)、International Standards for Cytogenomic Arrays(https://clinicalgenome.org/)及International Standards for Cytogenomic Arrays(https://www.clinicalgenome.org/)数据进行对比,判断胎儿染色体结构变异,包括良性拷贝数变异(copy number variations, CNV)、临床意义不明确的CNV(variants of uncertain significance, VUS)、致病性/可能致病性CNV(pathogenic CNV/likely pathogenic CNV, P/LP)及非整倍体;提示良性CNV或VUS时,建议孕妇接受WES检查;WES:采用QIAGEN血液试剂盒提取羊水/胎儿血液/脐带血/其他组织来源基因组DNA,以Berry nano WES芯片捕获并富集约20 000个基因的外显子及侧翼内含子序列中的DNA序列,于Illumina Novaseq平台进行DNA测序,以Seqmax软件分析生物学信息。以实验室自创数据库搜索导致疾病的DNA变异,并根据ACMG指南[7]进行分类。见图2。

图2 经产前超声诊断CHD胎儿基因检测流程示意图
1.3 统计学分析 采用SPSS 28.0统计分析软件。以Fisher精确概率法比较计数资料。P<0.05为差异有统计学意义。
2 结果
2.1 染色体核型分析和/或CMA 479胎接受染色体核型分析及CMA,60胎(60/479,12.53%)基因检测显示异常;134胎仅接受CMA,4胎(4/134,2.99%)基因检测异常。613胎中,非整倍体及P/LP检出率分别为5.06%(31/613)及5.38%(33/613)。
613胎中,568胎为孤立性、45胎为非孤立性CHD,其中分别有40胎(40/568,7.04%)及15胎(15/45,33.33%)染色体核型分析和/或CMA异常,差异有统计学意义(P<0.01);26胎(26/568,4.58%)及5胎(5/45,11.11%)非整倍体异常,差异无统计学意义(P>0.05);23胎(23/568,4.05%)及10胎(10/45,22.22%)P/LP异常,差异有统计学意义(P<0.01)。
613胎中,41胎为复合型、572胎为非复合型CHD,前者染色体核型分析和/或CMA异常检出率(10/41,24.39%)高于后者(54/572,9.44%)。复合型CHD中,CTD合并静脉系统畸形染色体核型分析和/或CMA异常检出率最高(4/13,30.77%);非复合型CHD中,内脏反位染色体核型分析和/或CMA异常检出率最高(1/4,25.00%)。其中11胎为21-三体综
合征包括5胎合并ECD(5/11,45.45%);7胎为18-三体综合征,3胎合并CTD(3/7,42.86%)、6胎合并ECD(85.71%);33胎22q11.2微缺失均合并CTD(33/33,100%)。
568胎孤立性CHD中,21-三体综合征在非整倍体异常中检出率最高(11/26,42.31%),22q11.2微缺失(5/23,21.74%)在P/LP异常中检出率最高;45胎非孤立性CHD中,18-三体综合征(2/5,40.00%)及22q11.2微缺失(3/10,30.00%)分别在非整倍体异常及P/LP异常中检出率最高。
45胎非孤立性CHD中,合并发育迟缓与骨骼系统畸形、发育迟缓与泌尿系统畸形、胸腺发育不良与颜面部畸形、神经系统与泌尿系统畸形各1胎,且均存在染色体核型分析和/或CMA异常;其余41胎合并单一系统心外畸形,染色体核型分析和/或CMA在合并胸腺发育不良、神经系统畸形、泌尿系统畸形、发育迟缓、颜面部畸形、骨骼系统畸形、消化道畸形及呼吸系统畸形的非孤立性CHD胎儿中检出分别3胎(3/5,60.00%)、1胎(1/3,33.33%)、3胎(3/9,33.33%)、2胎(2/10,20.00%)、1胎(1/5,20.00%)异常,而在4胎合并骨骼系统畸形、4胎合并消化道畸形及1胎合并呼吸系统畸形中未见异常。见表1。
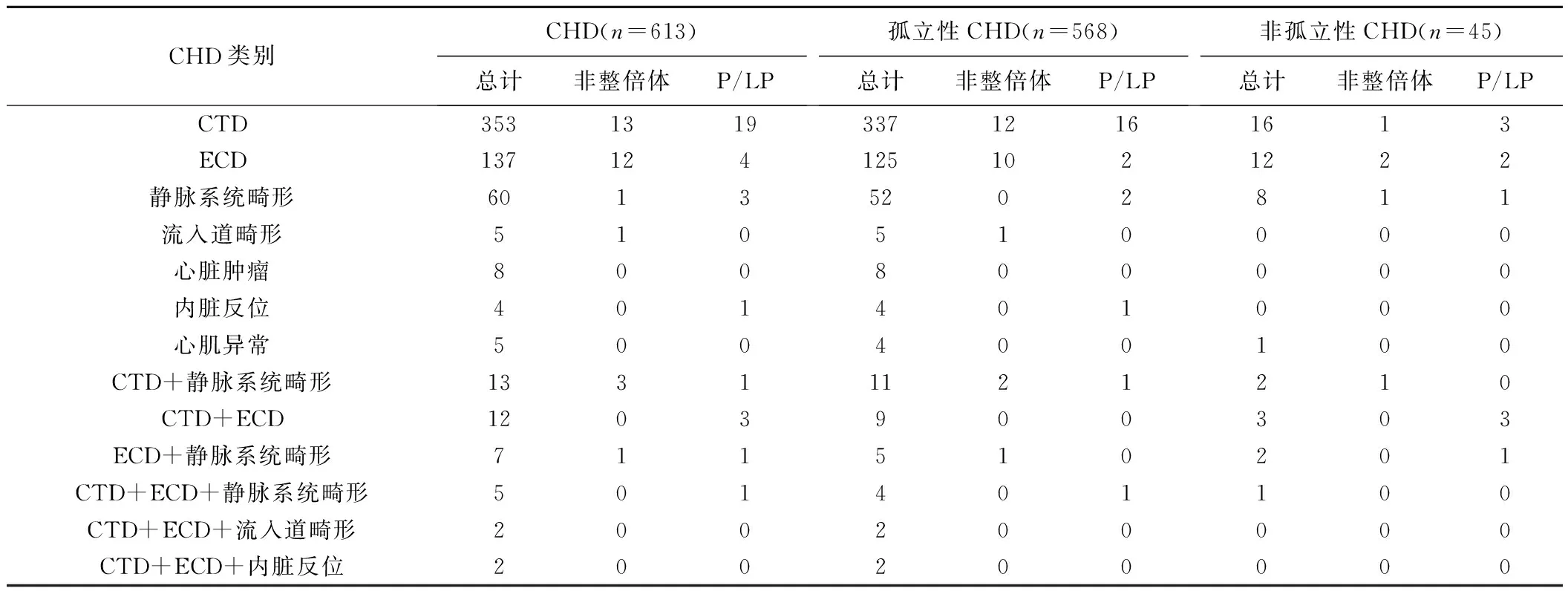
表1 产前诊断CHD胎儿的染色体核型分析和/或CMA异常(胎)
2.2 WES 40胎因染色体核型分析和/或CMA提示VUS及良性CNV而接受WES,其中3胎P/LP(表2)、3胎VUS,34胎为良性CNV。

表2 3胎P/LP胎儿WES结果
经染色体核型分析和/或CMA及WES检查共发现32胎VUS;进一步亲系验证结果显示15胎为家族性变异、17胎为新发变异。之后13名孕妇及家属选择终止妊娠;19名继续妊娠,新生儿均未见严重畸形。
3 讨论
产前超声发现胎儿组织结构异常时,通常需要进行染色体核型分析、CMA及WES等基因检测。CMA用时短、性价比高,对CNV变异较敏感,临床应用广泛。
本研究纳入613胎产前超声诊断CHD胎儿,对479胎行染色体核型分析及CMA、对134胎仅行CMA,结果显示前者基因异常检出率(60/479,12.53%)高于后者(4/134,2.99%),提示CMA联合染色体核型分析可检出更多异常。对40胎染色体核型分析和/或CMA提示良性CNV或VUS CHD胎儿行WES,将3胎分别诊断为DDS、ALGS及结节性硬化症,提示对于初步基因检测阴性样本行WES可获得更多信息,提高产前基因检测准确率。19胎WES结果为VUS的CHD胎儿继续妊娠,新生儿均无严重畸形,提示对基因检测结果为VUS的CHD胎儿应谨慎处理,避免过度解读。
ZHANG等[8]报道,产前诊断胎儿CHD的1 035胎中,CMA基因异常检出率为9.76%(101/1 035),
包括非整倍体检出率4.83%(50/1 035)及P/LP检出率5.31%(55/1 035)。本研究染色体核型分析和/或CMA异常检出率为10.44%(64/613),非整倍体及P/LP检出率分别为5.06%(31/613)及5.38%(33/613),与既往研究[8]结果相符。
本研究对比不同类型心脏结构异常胎儿基因检测结果,发现染色体核型分析和/或CMA异常检出率在复合型高于非复合型CHD胎儿(24.39%vs.9.44%);复合型CHD胎儿中,非整倍体与P/LP检出率在CTD合并静脉系统畸形胎儿中检出率高达23.08%(3/13)及7.69%(1/13),而在单纯CTD中仅分别为3.68%(13/353)及5.38%(19/353),以上结果提示,CTD合并其他类型心脏结构异常时,基因检测异常可能性更大。
21-三体综合征与18-三体综合征胎儿常合并CTD及ECD[9];22q11.2微缺失与迪格奥尔格综合征(DiGeorge syndrome)、腭心面综合征及椎干畸形面容异常综合征(conotruncal anomaly face syndrome, CAFS)等发生有关,且常伴CTD[10-11]。本组孤立性与非孤立性CHD胎儿中,染色体核型分析和/或CMA提示非整倍体异常检出率最高者分别为21-三体综合征(11/26,42.31%)及18-三体综合征(2/5,40.00%),且11胎21-三体综合征中5胎合并ECD(5/11,45.45%);P/LP异常检出率最高者均为22q11.2微缺失,且上述胎儿均合并圆锥动脉干畸形(33/33,100%)。
综上所述,胎儿CHD、尤其合并心外畸形者存在基因异常可能;CTD胎儿合并其他类型心脏结构异常时,基因异常可能性更大。相比CMA,染色体核型分析联合CMA更有助于发现基因异常,产前超声发现胎儿CHD时,应及时建议行染色体核型分析及CMA。
利益冲突:全体作者声明无利益冲突。
作者贡献:梁博诚研究设计和实施、查阅文献、数据分析、撰写文章;罗丹丹指导、修改文章;罗彩群指导、审阅文章;谭莹研究设计;欧阳淑媛研究实施;廖伊梅和袁鹰经费支持;文华轩图像处理;李胜利研究设计和实施、指导、修改和审阅文章、经费支持。

