临床-CT模型评估食管鳞状细胞癌侵犯脉管和/或神经
危涵羽,梁长华*,甄思雨,杨鑫淼,姚阳阳,魏正琦,李 强,程思佳
(1.新乡医学院第一附属医院放射科,2.磁共振科,河南 新乡 453100)
食管癌(esophageal cancer, EC)发病率和死亡率分别位于全球癌症第7位和第6位[1];食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)为其主要组织学亚型[2]。多数EC确诊时局部已处于晚期[3],食管切除术为主要治疗方法[4],但术后复发率与转移率均较高[5];辅以新辅助放化疗,5年生存率仍低于50%[6]。EC侵犯脉管(lymphovascular invasion, LVI)和/或神经(perineural invasion, PNI)与其预后密切相关[7]。病理学评估LVI、PNI有创、耗时,且可能无法准确反映肿瘤整体状态[8];增强CT(contrast-enhanced CT, CECT)有助于监测病程[9]。本研究观察临床-CT模型评估ESCC LVI和/或PNI的价值。
1 资料与方法
1.1 研究对象 回顾性分析2021年10月1日—2022年10月31日156例于新乡医学院第一附属医院接受食管根治性切除术的单发ESCC患者资料,男99例、女57例,年龄47~87岁、中位年龄68.0岁;根据病理结果将LVI和/或PNI阳性者归为阳性组(n=58)、LVI及PNI均阴性者归为阴性组(n=98)。阳性组男32例、女26例,年龄47~87岁、中位年龄68.0岁;阴性组男67例、女31例,年龄51~80岁、中位年龄68.0岁。纳入标准:①经病理证实ESCC;②术前未接受任何抗肿瘤治疗;③术前1周内接受CT平扫及双期增强扫描;④CT显示病灶清晰、无伪影;⑤临床资料完整。排除合并其他恶性肿瘤、存在多个EC病灶、非同次接受平扫与增强CT扫描及图像质量差者。本研究经院伦理委员会审核通过(EC-023-114),检查前所有患者均知情同意。
记录甲胎蛋白(alpha-fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原(carbohydrate antigen, CA)125、CA153及CA199检查结果。
1.2 仪器与方法 采用GE Revolution CT和Toshiba CT Aquilion ONE扫描仪。嘱患者仰卧、双手上举放于头部两侧,从颈根部扫描至肾脏中部;管电压120 kVp,管电流375 mAs,螺距1.375∶1,探测器64 mm,准直器0.625 mm×40 mm,矩阵512×512,FOV 40 cm×40 cm,层厚5 mm,层间距5 mm,重建层厚1 mm。采用双筒高压注射器经肘前静脉以3.5 ml/s流率注射非离子型对比剂碘佛醇(320 mg/ml)80~100 ml并跟注30 ml生理盐水,分别于30 s及70 s后采集动脉期及静脉期增强图像,参数同上。
1.3 图像处理与评估 由分别具有3、5年工作经验的放射科医师各1名测量轴位及矢状位CT所示肿瘤最大厚度及最大长度;于肿瘤最大层面测量平扫CT值(CT plain phase value, CTP)、动脉期CT值(CT arterial phase value, CTA)及静脉期CT值(CT venous phase value, CTV),计算CTA与CTP差值(ΔCTA-P)、CTV与CTP差值(ΔCTV-P)、CTV与CTA差值(ΔCTV-A)、ΔCTA-P与CTP比值(即动脉期增强率A%)及ΔCTV-P与CTP比值(即静脉期增强率V%)。将图像以DICOM格式导入3D Slicer软件(5.0.2),沿肿瘤边缘逐层勾画ROI,获取肿瘤体积。
1.4 病理学检查 由分别具有2年和10年工作经验的病理科诊断医师各1名评估LVI和/或PNI。LVI指肿瘤细胞侵犯血管/淋巴管管壁或于血管/淋巴管内发现瘤栓[10];PNI指肿瘤沿神经纤维生长并包绕≥33%神经周径,或肿瘤细胞侵犯神经纤维任一层(神经外膜、神经束膜和神经内膜)[11]。若所取切片无法准确反映LVI和/或PNI,则进一步行免疫组织化学检查。
1.5 建立模型 基于组间差异有统计学意义的参数绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),对AUC>0.6的特征行多重共线性诊断后纳入多因素logistic方程,采用Forward:LR法进行分析;最后以R语言建立模型并可视化为列线图,采用ROC曲线、校准曲线和决策曲线评估其诊断效能、校准效能和临床价值。
1.6 统计学分析 采用SPSS 25.0及MedCalc 22.016统计分析软件。以±s表示符合正态分布的连续变量,行独立样本t检验;以中位数(上下四分位数)表示不符合正态分布者,行Mann-WhitneyU检验。以χ2检验比较分类变量。采用方差膨胀因子(variance inflation factor, VIF)行多重共线性检验,VIF≥10代表变量间存在多重共线性。以DeLong检验比较AUC。利用组内相关系数(intra-class correlation coefficient, ICC)评估观察者间一致性,ICC>0.75表示一致性好。P<0.05为差异有统计学意义。
2 结果
2.1 一致性 观察者间所测肿瘤厚度、长度及体积的一致性均好(ICC=0.83、0.99、0.80),故取1名医师测值进行后续分析。
2.2 临床资料及CT所见 组间CEA、CA199、肿瘤厚度、肿瘤体积、CTV、ΔCTV-P及V%差异均有统计学意义(P均<0.05)。见表1。
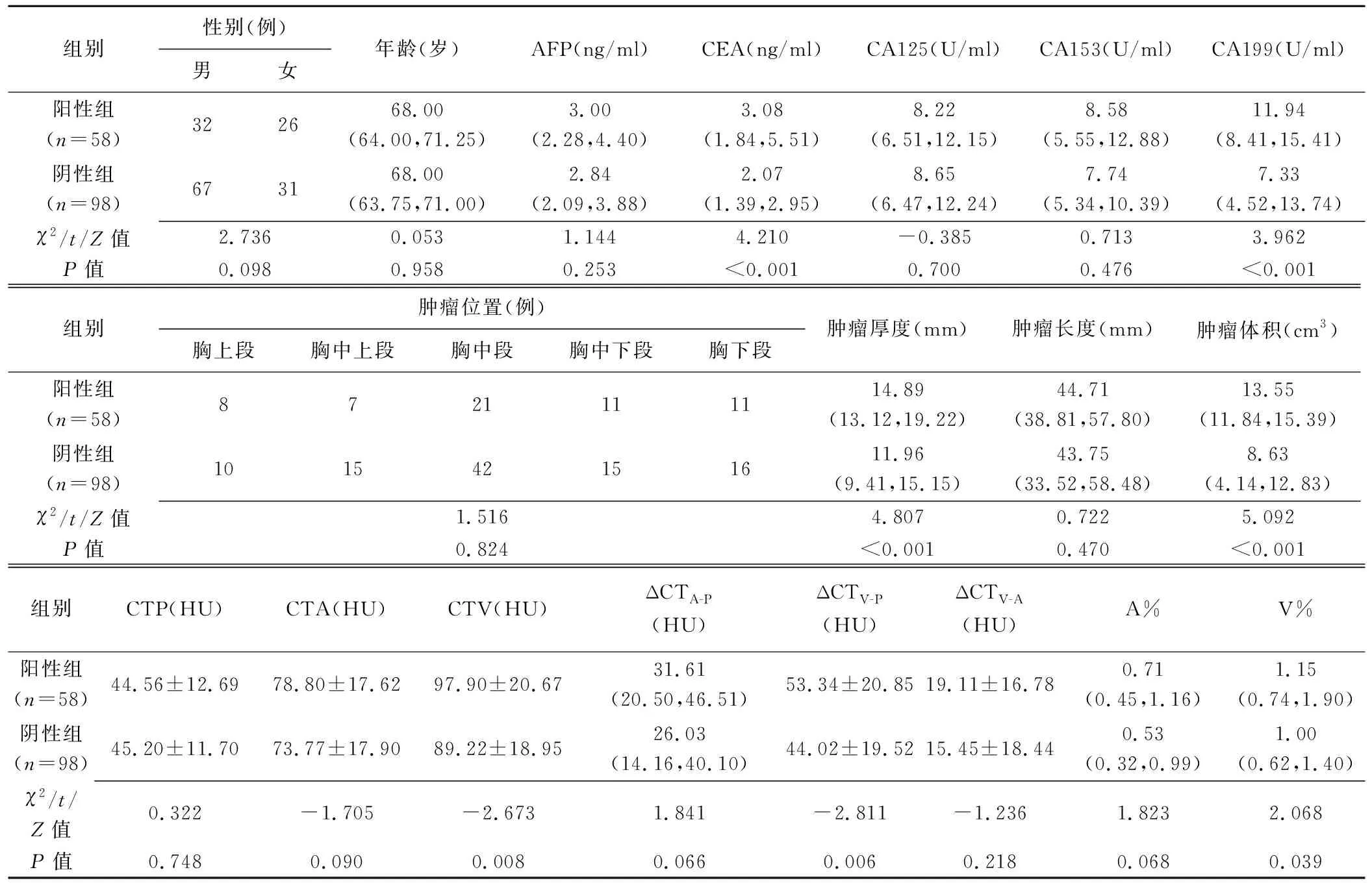
表1 LVI和/或PNI阳性与LVI和PNI均阴性单发ESCC患者临床及CT资料比较
2.3 筛选特征 以CEA、CA199、肿瘤厚度、肿瘤体积、CTV、ΔCTV-P及V%评估ESCC LVI和/或PNI的AUC分别为0.702、0.690、0.731、0.744、0.621、0.631及0.599(图1、表2);剔除AUC≤0.6者(即V%),剩余特征VIF为1.05~3.30。logistic回归分析显示,CEA、CA199、肿瘤厚度、肿瘤体积及CTV是ESCC LVI和/或PNI的独立预测因素;见图2、3。

图1 以临床及CT特征评估ESCC LVI和/或PNI的ROC曲线
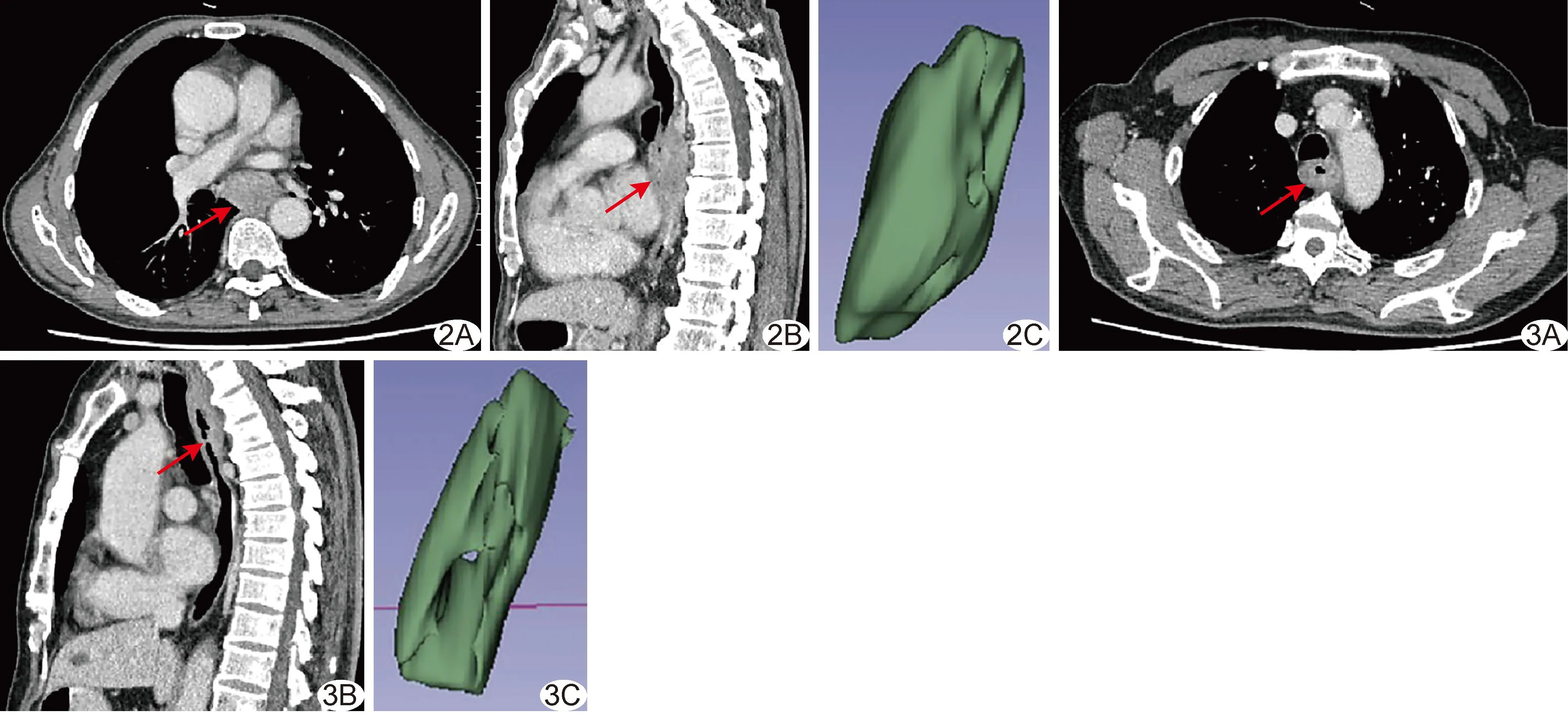
图2 患者男,74 岁,ESCC, PNI(+) A、B.术前轴位(A)和矢状位(B)胸部CT图示胸中下段食管壁局部偏心性增厚(箭),最厚处约22.86 mm,CTV=88.01 HU; C.3D Slicer示肿瘤体积约22.02 cm3 图3 患者男,70 岁,ESCC,LVI及PNI均(-) A、B.术前轴位(A)和矢状位(B)胸部CT示胸上段食管壁局部向心性增厚(箭),最厚处约10.27 mm,CTV=80.25 HU; C.3D Slicer图示肿瘤体积约15.38 cm3
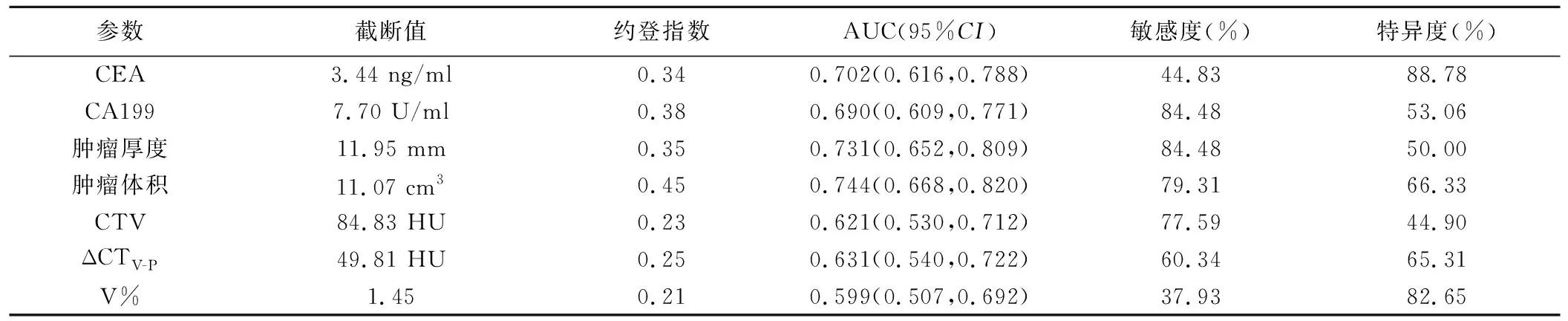
表2 临床及CT特征评估ESCC LVI和/或PNI的效能
2.4 评估模型效能 校准曲线(图4)、决策曲线(图5)及列线图(图6)显示,基于CEA、CA199、肿瘤厚度、肿瘤体积及CTV建立的联合模型评估ESCC LVI和/或PNI的效能较佳;其准确率、敏感度及特异度分别为82.05%、65.52%及91.84%,AUC为0.838[95%CI(0.768,0.908)],高于各单一参数(P均<0.05);见图7。
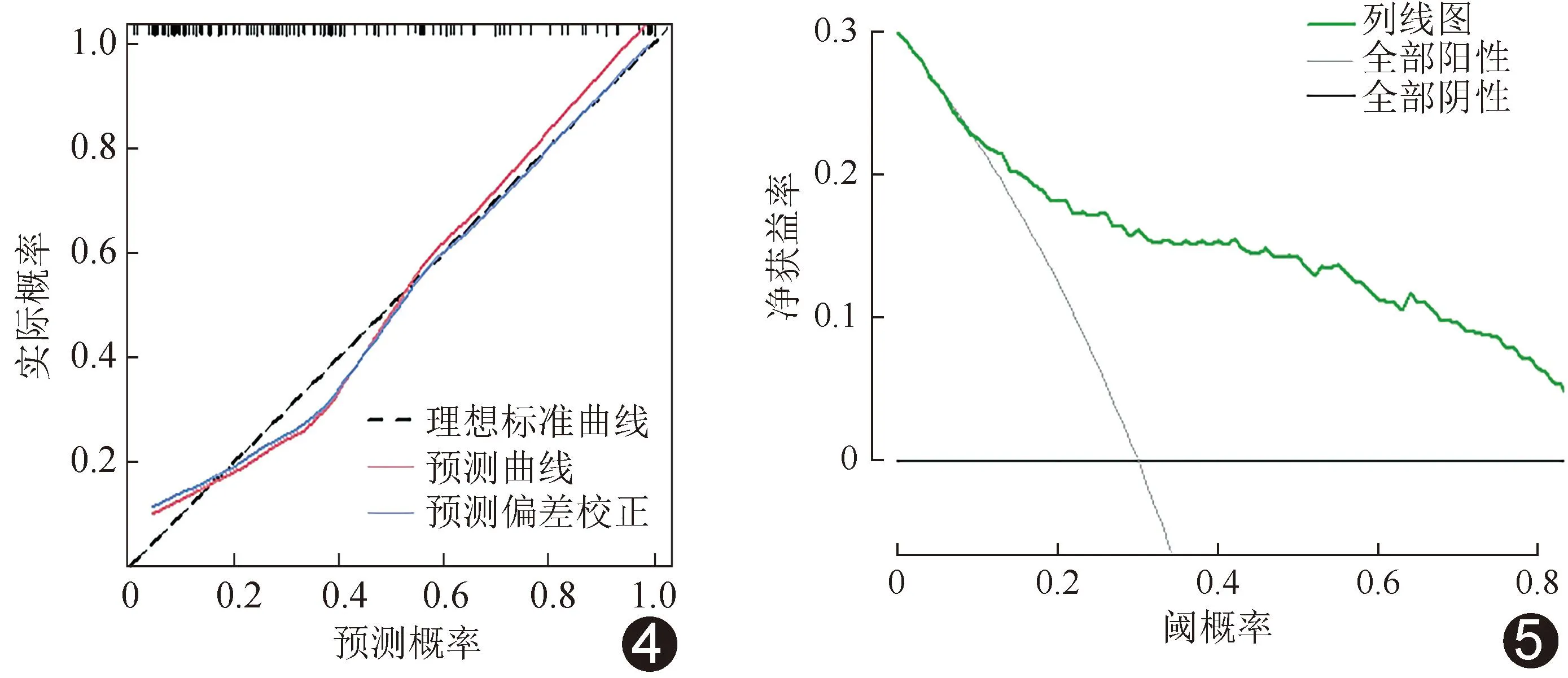
图4 评估ESCC LVI和/或PNI的临床-CT模型的校准曲线 图5 评估ESCC LVI和/或PNI的临床-CT模型的决策曲线
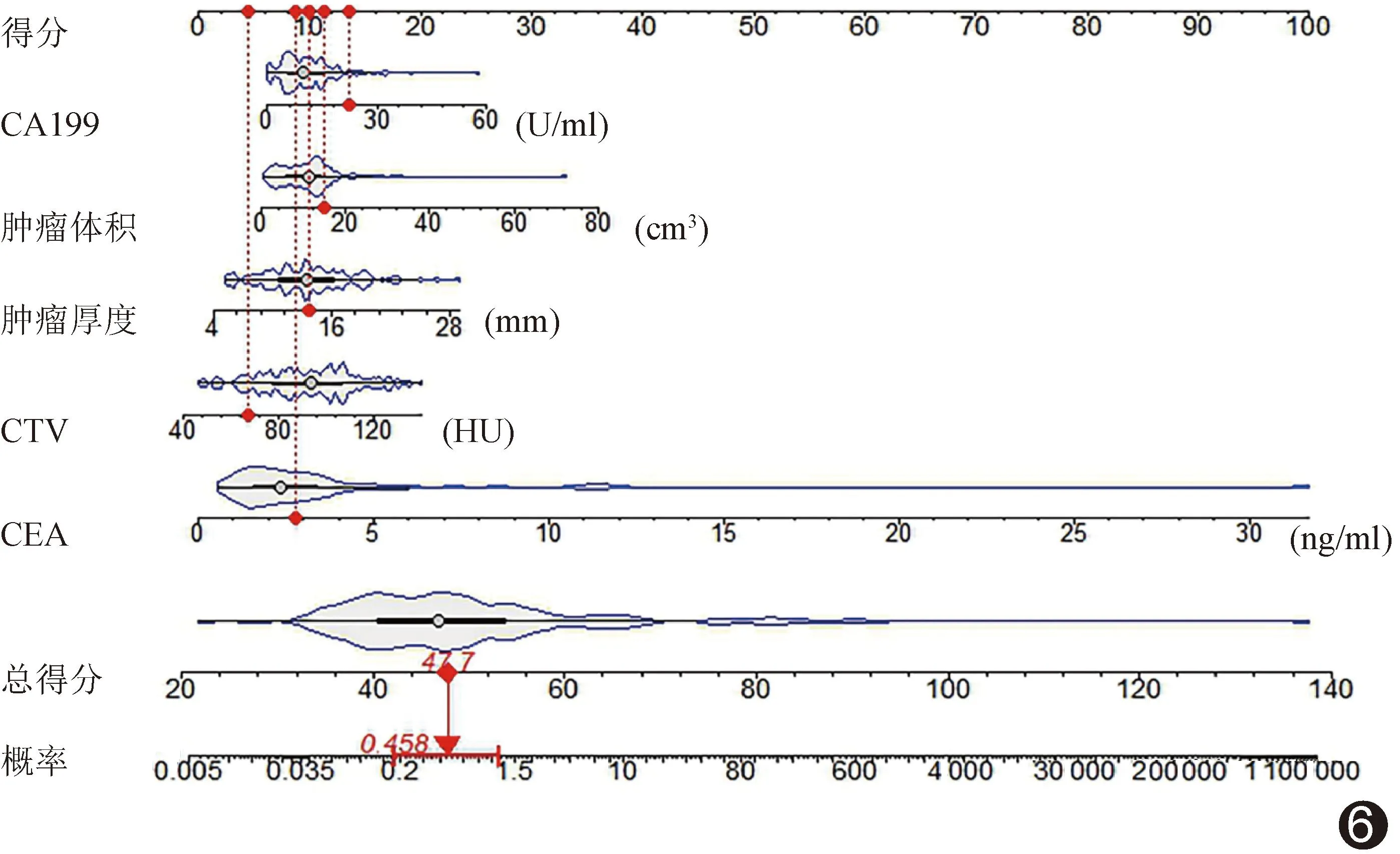
图6 以CEA、CA199、肿瘤厚度、肿瘤体积及CTV联合评估ESCC LVI和/或PNI的列线图
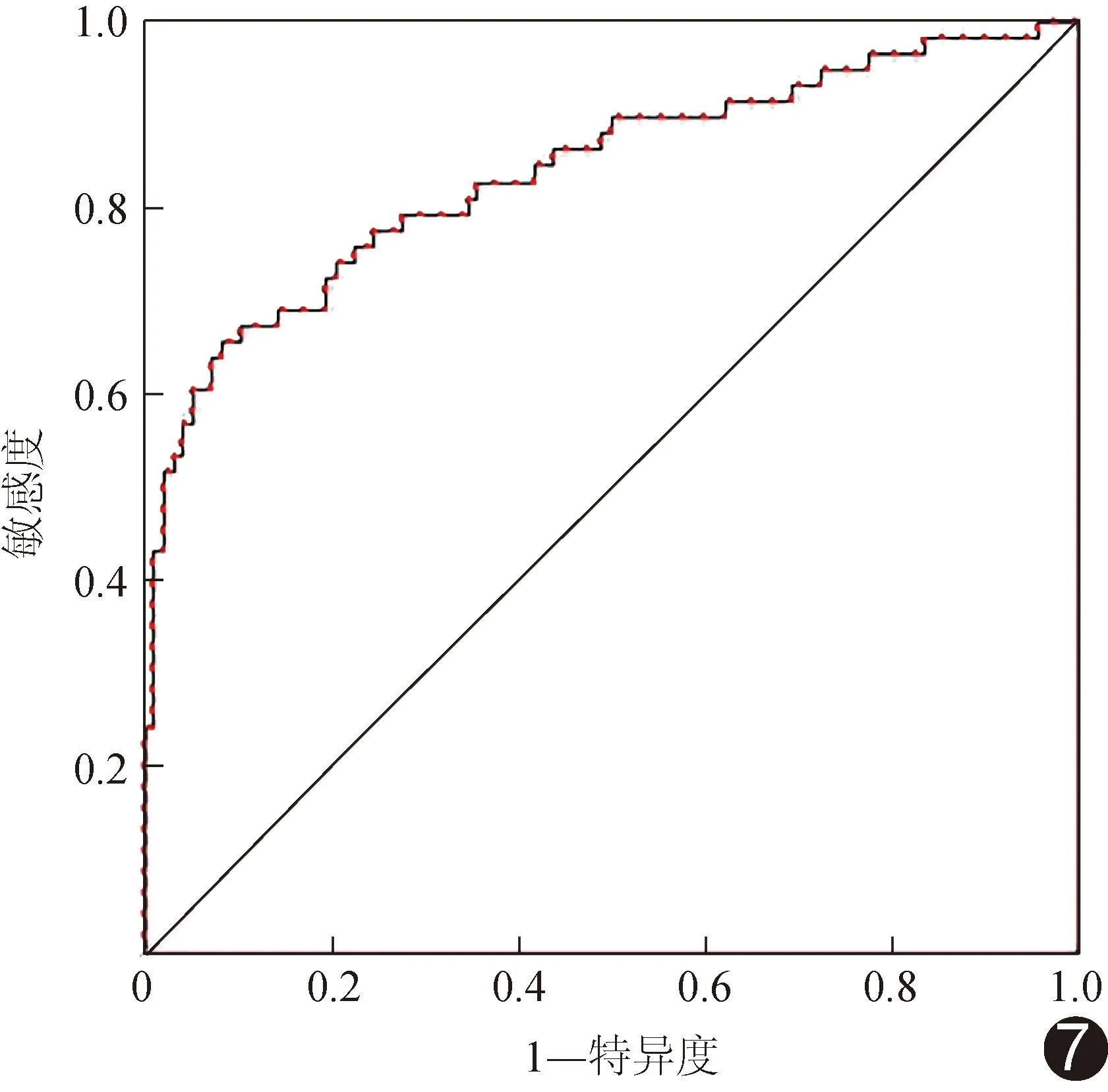
图7 以CEA、CA199、肿瘤厚度、肿瘤体积及CTV联合评估ESCC LVI和/或PNI的ROC曲线
3 讨论
近年CT预测食管癌研究多与淋巴结转移、分化程度、病理分期、放化疗或手术等疗效及并发症有关,少有LVI和/或PNI相关文献,尤其罕见PNI相关研究。BAI等[12]发现PNI与EC肿瘤分期、LVI、淋巴结转移、患者总生存期(overall survival, OS)及无病生存期(disease-free survival, DFS)相关,认为PNI可作为EC恶性程度高、预后差的指标。本研究基于临床及CT资料建立的联合模型评估ESCC LVI和/或PNI的AUC为0.838,提示其具有良好诊断效能。
肿瘤厚度和体积可反映其大小;肿瘤越大,越可能侵犯周围组织,LVI和/或PNI阳性率越高。有学者[13]提出肿瘤厚度是ESCC LVI(+)的独立预测因素;LI等[14]基于动脉期增强CT以肿瘤厚度评估ESCC LVI的AUC为0.739,并认为肿瘤体积并非ESCC LVI的独立预测因素。本研究阳性组ESCC厚度和体积均大于阴性组,以肿瘤厚度、肿瘤体积评估ESCC LVI和/或PNI的AUC分别为0.731、0.744,即效能较佳,但组间肿瘤长度差异无统计学意义。YAN等[15]报道,局部进展型ESCC肿瘤长度与患者生存期无关,且放化疗早期肿瘤厚度的变化幅度大于长度。本研究结果显示肿瘤体积是ESCC LVI和/或PNI的独立预测因素,与LI等[14]结果不同,可能与采用Forward:LR法进行logistic回归分析有关。
ESCC侵犯脉管后,血管内癌栓致局部血液循环障碍,且肿瘤内新生血管丰富、分布不规则,静脉期对比剂进入肿瘤血管内更多,使肿瘤CTV较高;一项针对胃癌淋巴血管和神经浸润的预测性研究[16]亦显示,静脉期CT参数的预测效能优于动脉期。丁聪等[17]发现70 keV静脉期CT显示EC病灶最为清晰,其敏感度及特异度分别为84.4%及90.6%;CHENG等[18]提出40 keV单能量静脉期CT有助于提高评估EC T分期的准确率,尤其静脉期电子密度可有效鉴别T1~T2期与T3~T4期。王大伟等[19]发现基于增强CT(尤其是静脉期)纹理分析对于预测EC术后早期复发转移具有一定价值。本研究阳性组CTV、ΔCTV-P及V%均高于阴性组,且 CTV为ESCC LVI和/或PNI的独立预测因素。
陈琪等[20]发现EC组血清红细胞分布宽度、中性粒细胞/淋巴细胞比率、CEA及CA199水平均高于健康对照组;ZHANG等[21]认为胃癌LVI和/或PNI(+)与高CEA、高CA199、肿瘤浸润较深、淋巴结转移较多及高TNM分期显著相关。本研究以CEA和CA199评估ESCC LVI和/或PNI的AUC为0.702和0.690,且以上各项均为独立预测因素,与既往研究[13]结果不完全相同,可能与样本量及地域差异有关,有待进一步探讨。
综上,基于CEA、CA199、肿瘤厚度、肿瘤体积及CTV的临床-CT模型可有效评估ESCC LVI和/或PNI。本研究的主要局限性:①为单中心、回顾性研究;②未划分验证集验证模型;③仅纳入CT定量特征;④将LVI和PNI任一项阳性均归为阳性组,无法分析模型单独评估LVI(+)或PNI(+)的效能。
利益冲突:全体作者声明无利益冲突。
作者贡献:危涵羽研究设计和实施、图像分析和处理、数据和统计分析、查阅文献、撰写和修改文章;梁长华指导、修改和审阅文章、经费支持;甄思雨研究设计和实施、统计和数据分析、修改文章;杨鑫淼、魏正琦和程思佳研究实施;姚阳阳研究实施、修改文章;李强指导、研究实施。

