T1 mapping技术用于评估心尖肥厚型心肌病患者心肌钆沉积
杨宏志,兰 天,杨如武
(1.西电集团医院医学影像科,陕西 西安 710077;2.国家心血管病中心 北京协和医学院 中国医学科学院阜外医院磁共振影像科,北京 100037)
含钆对比剂(gadolinium-based contrast agent, GBCA)是目前临床应用最多的MR对比剂,不良反应发生率低,安全性高,但存在引发肾源性系统性纤维化的风险[1]。反复注射GBCA可致颅脑、骨骼、皮肤、肾脏及心脏等处钆沉积,且针对颅脑钆沉积的研究[2-3]较多,而对心肌钆沉积关注较少。本研究观察T1 mapping技术用于评估心肌钆沉积的可行性。
1 资料与方法
1.1 研究对象 收集2018年5月—2023年5月于西电集团医院和中国医学科学院阜外医院就诊的60例心尖肥厚型心肌病(apical hypertrophic cardiomyopathy, AHCM)患者,男42例、女18例,年龄39~86岁、平均(53.5±15.0)岁;根据是否接受GBCA注射分为增强组和对照组,每组30例。纳入标准:①心脏MRI显示舒张末期左心室短轴位心尖室壁厚度≥15 mm,或心尖厚度与左心室后壁厚度比值>1.5,符合诊断AHCM标准[4];②增强组接受1次GBCA心脏增强MR检查及Native T1 mapping扫描,或接受多次心脏增强MR检查,且末次复查时Native T1 mapping显示心肌病灶延迟强化与首次相比无明显改变;③对照组于首次心脏MR检查时接受Native T1 mapping扫描,且既往未曾接受GBCA注射。排除标准:①图像伪影明显、无法测量;②高血压、高血脂、糖尿病病史3年及以上或3年以下但控制不佳。本研究经院伦理委员会批准(20220627-01、IRB2012-BG-006),检查前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0 T MR仪及体线圈行心脏扫描。嘱患者屏气,以稳态自由进动序列及回顾性心电门控技术采集左心室长轴位(四腔心、两腔心、三腔心)及短轴位电影序列,扫描参数:TR 39.2 ms,TE 1.4 ms,FOV 340 mm×286 mm,FA 51°;将左心室四腔心电影序列图中垂直于左心室长轴的左心室基底部、中间部和心尖部短轴平面定位为扫描层面,应用改良Look-locker反转恢复序列采集单层Native T1 mapping(图1),扫描参数:TR 280.6 ms,TE 1.1 ms,FOV 360 mm×306 mm,触发延迟时间544 ms,NEX 3,带宽1 085 Hz/像素。心脏钆对比剂延迟强化(late gadolinium enhancement, LGE)扫描中,经外周静脉以2.5 ml/s流率注射钆喷酸葡胺(0.5 mmol/ml,拜耳)0.2~0.3 mmol/kg体质量,于10~15 min后采集心脏图像。
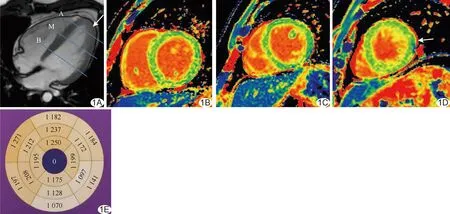
图1 增强组患者,男,39岁,AHCM A.左心室舒张末期四腔心电影序列图示心尖部心肌增厚(箭);蓝线B、M、A分别为左心室基底部、中间部及心尖部Native T1 mapping扫描定位层面; B、C.左心室短轴位基底部(B)及中间部(C)T1 mapping图未见心肌增厚,信号未见异常; D.左心室短轴位心尖部T1 mapping图示心肌增厚(箭)但未见异常信号; E.16节段心肌模型图示左心室心肌各节段T1值为1 070~1 271 ms
1.3 图像分析 将增强组末次、对照组首次心脏MRI导入Medis软件(荷兰Cardiovascular Imaging),由2名具有2年以上心脏MRI诊断经验的主治及以上职称医师阅片,测量心尖厚度及射血分数,并应用美国心脏学会16节段心肌模型(图1),避开心肌外血池或周围组织,于左心室基底部、中部和心尖部短轴 T1 mapping图中手动分割左心室心肌,分别以左心室1~6、7~12、13~16节段的平均T1值为基底部、中部和心尖部心肌T1值,并测量相应层面脾脏T1值;取2名医师测值的平均值进行分析。计算心肌T1相对值(T1 relative value, T1R):T1R基底部心肌=T1基底部心肌/T1基底部层面脾脏,T1R中部心肌=T1中部心肌/T1中部层面脾脏,T1R心尖部心肌=T1心尖部心肌/T1心尖部层面脾脏。
1.4 统计学分析 采用SPSS 25.0统计分析软件。采用Shapiro-Wilk检验评估计量资料的正态性,以±s表示符合正态分布者,采用独立样本t检验行2组间比较,以单因素方差分析行多组间比较;以中位数(上下四分位数)表示不符合正态分布者,行Mann-WhitneyU检验。以χ2检验比较计数资料。对增强组T1R分别基于性别、年龄、体质量指数(body mass index, BMI)、心功能,以及有无高血压、高脂血症、糖尿病,心尖厚度、射血分数、延迟强化、首次增强检查至末次复查间隔时间及GBCA总量进行进一步分析,其中年龄、BMI、射血分数、心尖厚度、间隔时间及GBCA总量均以均值作为界值。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 组间患者性别、年龄、BMI,心功能纽约心脏病学会(New York Heart Association, NYHA)分级及高血压、高血脂及糖尿病病史差异均无统计学意义(P均>0.05),见表1。
2.2 MRI参数 组间心尖厚度、射血分数及各心肌T1R差异均无统计学意义(P均>0.05)。增强组内左心室不同部位心肌T1R差异均无统计学意义(F=0.765,P=0.468)。见表2。

表2 60例AHCM患者心脏MRI参数比较
2.3 增强组内T1R分析 增强组30例中,26例接受1次、3例接受2次、1例接受3次GBCA注射;首次增强检查至末次复查时间间隔11~131个月、平均68.90个月,GBCA总剂量11~42 ml、平均16.47 ml;LGE显示21例存在延迟强化,包括20例累及心尖部(部分同时累及室间隔插入部、邻近下壁、侧壁、前壁及乳头肌)、1例仅累及室间隔,强化方式为局灶性肌壁间强化或心内膜下强化。增强组内不同性别、有无高血压患者间心肌T1R差异均有统计学意义(P均<0.05),其余各不同参数患者间心肌T1R差异均无统计学意义(P均>0.05)。见表3。

表3 增强组内心肌T1R分析
3 讨论
目前针对心肌钆沉积的研究尚少。SWAMINATHAN等[5]对10例曾接受20~100 ml GBCA注射者进行尸检,发现其心脏、大血管及皮肤均存在较多钆沉积。心肌穿刺活检为有创检查,难度大、风险高。T1 mapping为无创MR新技术,通过采集左心室心肌在多个心动周期相同时相(一般为舒张末期)的不同翻转时间点的数据并加以后处理,可有效定量评估T1值并借以反映心肌钆沉积[6-8];相比既往研究[9]采用常规T1信号强度比值,T1 mapping评估颅脑钆沉积更为准确。采用改良Look-locker反转恢复序列采集AHCM患者Native T1 mapping图以评估左心室各段心肌T1值具有扫描时间短、图像质量佳等优势[10]。
多项研究[11-12]结果显示,通过多参数多序列成像,心脏MRI可较好地显示心肌组织病理学变化,如充血、水肿、坏死和纤维化等,进而对心肌组织学特征进行定性,尤其LGE和T1 mapping所示心肌纤维化与病理学结果的一致性较好。心肌T1值主要由组织细胞和细胞外间质共同决定,心肌纤维化为细胞外间质发生改变所致[6]。心脏MR检查时,心肌纤维化区域增强后出现GBCA滞留并表现为高弛豫率使T1值较增强前缩短,而对比剂排出后纤维化区域T1值接近增强前水平[13]。根据颅脑钆沉积相关研究[9]结果,推测心肌出现钆沉积将使其T1值缩短。
钆喷酸葡胺为线型对比剂,更易导致钆沉积[9,14]。本研究对60例AHCM患者采集T1 mapping图并获得心肌T1值,因其心肌肥厚,易于测量T1值;根据临床经验,以同层面实质信号尚均匀的脾脏T1值作为基准计算T1R,以降低测量误差及个体误差;结果显示增强组与对照组左心室T1R基底部、T1R中间部、T1R心尖部差异均无统计学意义,且增强组内左心室各段心肌T1R差异亦无统计学意义,这意味着AHCM患者在接受GBCA增强后数年甚至十数年后其肥厚心肌及非肥厚心肌中均未见明显钆沉积。本研究结果与SWAMINATHAN等[5]的结果不同,可能原因如下:①本研究以T1R间接评估心肌钆沉积,而该研究通过心肌活检进行定量检测,敏感性更高;②本研究增强组仅5例(5/30,16.67%)、而该研究10例中的7例(7/10,70%)有糖尿病病史,推测糖尿病易致微循环障碍[15]进而引起钆沉积;③本研究增强组患者仅1例接受3次GBCA注射,而该研究中8例接受注射剂量≥40 ml或多次注射。
本研究增强组除不同性别及有无高血压患者之间外,其余不同对比参数患者间心肌T1R差异均无统计学意义。女性患者各部位心肌T1R均低于男性患者,可能与遗传、微环境稳定性、体内电解质浓度、转运蛋白等有关[9];无高血压患者不同部位心肌T1R均低于合并高血压者,除受上述因素影响外,还与心肌微循环相关,有待进一步研究。
综上所述,T1 mapping技术可用于评估AHCM患者心肌钆沉积。但钆在体内沉积的机制复杂,本研究仅为单中心回顾性分析,样本量有限,GBCA总剂量较少,有待进一步观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:杨宏志查阅文献、研究设计、研究实施、统计分析、撰写和修改文章;兰天研究设计、图像处理、修改文章;杨如武指导、研究设计、审阅文章。

