多模态超声与超声引导下细针穿刺抽吸活检鉴别C-TIRADS 4类甲状腺良、恶性结节
钟 迪,唐 棣,高小强,李海霞,王宏波,刘 莹
(哈尔滨医科大学附属肿瘤医院超声科,黑龙江 哈尔滨 150000)
甲状腺癌是最常见内分泌恶性肿瘤之一,部分可出现腺体外侵犯、中央或颈侧淋巴结转移。随着影像学技术和临床诊断水平的提高,甲状腺结节检出率逐渐增加,其中5%~10%[1-2]为恶性。甲状腺结节结构复杂,良、恶性征象存在部分重叠[3-4]。根据常规超声可进行中国甲状腺影像报告和数据系统(Chinese thyroid imaging reporting and data system, C-TIRADS)分类,以指导临床制定诊疗方案; C-TIRADS 4类结节恶性风险跨度较大,早期鉴别诊断较为困难。剪切波弹性成像(shear wave elastography, SWE)可准确评估组织硬度,已广泛用于浅表器官[4]。超声造影(contrast-enhanced ultrasound, CEUS)可提供常规超声无法反映的微血管信息,并能实时观察甲状腺结节增强模式[5]。近年来,联合应用常规超声、SWE及CEUS的多模态超声已广泛用于诊断甲状腺结节[6-7]。超声引导下细针穿刺抽吸活检(ultrasound-guided fine-needle aspiration biopsy, US-FNAB)是诊断甲状腺结节的常用方法,但受限于操作者技术及标本细胞学和形态学特异度,可能出现假阴性[8]。本研究对比多模态超声与US-FNAB鉴别诊断C-TIRADS 4类甲状腺良、恶性结节的价值。
1 资料与方法
1.1 研究对象 回顾性分析2020年1月—2023年6月201例于哈尔滨医科大学附属肿瘤医院接受术前常规超声、SWE、CEUS及US-FNAB的甲状腺结节患者,男43例、女158例,年龄19~78岁、平均(45.3±4.9)岁;共247个甲状腺结节,最大径2.3~16.0 mm、平均(4.1±2.9)mm,包括193个恶性、54个良性(表1)。纳入标准:①C-TIRADS 4类;②术前均接受甲状腺常规超声、SWE、CEUS及US-FNAB检查,且资料完整;③首次接受手术治疗,且术后病理结果明确。本研究经医院伦理委员会批准,检查前患者均知情同意。

表1 201例甲状腺结节患者共247个结节术后病理结果
1.2 仪器和方法 采用Mindray Resona 7超声诊断仪、频率3~11 MHz 的L11-3U高频线阵探头。嘱患者仰卧,以常规超声扫查颈部,观察甲状腺结节形态、回声、边缘及内部结构等;根据C-TIRADS分类标准[9],将结节具有实性、微钙化、极低回声、边缘模糊/边缘不规则/甲状腺外侵犯及垂直位中的每一项计为1分,可见“彗星尾”伪像计为-1分,将得分相加并据以进行分类:1类(无分数),无结节;2类(-1分),恶性风险0;3类(0分),0<恶性风险≤2%;4a类(1分),2%<恶性风险≤10%;4b类(2分),10%<恶性风险≤50%;4c类(3~4分),50%<恶性风险≤90%;5类(5分),恶性风险>90%。将4b、4c和5类视为恶性结节。
进入SWE模式,放置ROI,使其覆盖目标结节和周围少量非病变甲状腺组织,待图像稳定后冻结并存储图像;避开粗钙化及囊性部位,将取样框(Q-box,直径1 mm)置于目标结节最硬处,测量杨氏模量最大值(Emax)、最小值(Emin)、平均值(Emean)及剪切波速度;重复3次,取平均值。以Emax≥50.85 kPa为恶性结节[10-11]。
建立静脉通路,选取结节最大长轴切面,选择造影模式行CEUS,弹丸式注入声诺维造影剂(Bracco)1.5 ml后推注5 ml生理盐水,3 s后观察结节灌注情况及增强模式。以不均匀低增强为恶性结节[12-14]。
以2种及以上检查判断恶性为多模态超声诊断甲状腺恶性结节。见图1。
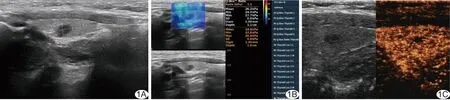
图1 患者女,41岁,甲状腺左叶乳头状癌 A二维超声示甲状腺左叶结节呈实性低回声、边缘模糊,C-TIRADS分类4b类; B.SWE图示结节Emin=24.3 kPa,Emax=27.7 kPa,Emean=26.2 kPa; C.CEUS图示结节呈不均匀低增强
1.3 US-FNAB 嘱患者仰卧,常规消毒、铺巾,以2%利多卡因局部浸润麻醉;于超声引导下采用5 ml注射器穿刺目标结节,并通过不同针道反复进行提插,若抽吸细胞数不足则多次穿刺。参照Bethesda报告系统[15]进行分类:Ⅰ类,无法诊断或标本不满意;Ⅱ类,良性;Ⅲ类,意义不明确的细胞非典型性病变或滤泡性病变;Ⅳ类,滤泡性肿瘤或可疑滤泡性肿瘤;Ⅴ类,可疑恶性;Ⅵ类,恶性。以Ⅴ、Ⅵ类为恶性结节。
1.4 金标准 以术后病理结果(图2)为金标准评估各方法的诊断效能。
1.5 统计学分析 采用SPSS 26.0统计分析软件。计算多模态超声和US-FNAB的诊断敏感度、特异度、准确率、误诊率和漏诊率。以χ2检验比较计数资料。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,以DeLong检验比较曲线下面积(area under the curve, AUC)。P<0.05为差异有统计学意义。
2 结果
术后病理确诊的193个甲状腺恶性结节中,常规超声、SWE、CEUS、多模态超声及US-FNAB分别诊断正确167、152、174、189及173个;54个良性结节中,常规超声、SWE、CEUS、多模态超声及US-FNAB分别诊断正确32、40、42、48及52个。
2.1 常规超声 247个甲状腺结节中,常规超声判断C-TIRADS 4a类58个、4b类88个、4c类101个,其诊断甲状腺恶性结节的效能见表2。

表2 各方法鉴别甲状腺良、恶性结节的效能[%(例)]
2.2 SWE 以Emax、Emin和Emean诊断甲状腺恶性结节的AUC分别为0.891、0.783和0.811。以Emax≥50.85 kPa诊断甲状腺恶性结节的效能见表2。
2.3 CEUS 193个甲状腺恶性结节中,174个呈不均匀低增强、19个呈均匀等增强或高增强;54个良性结节中,42个呈均匀等增强或高增强、12个呈不均匀低增强。以CEUS不均匀低增强诊断甲状腺恶性结节的效能见表2。
2.4 多模态超声 多模态超声鉴别甲状腺良、恶性结节的效能见表2。
2.5 US-FNAB 以US-FNAB鉴别甲状腺良、恶性结节的效能见表2。
2.6 效能比较 多模态超声鉴别甲状腺良、恶性结节的敏感度、特异度、准确率高于,而误诊率和漏诊率低于单一常规超声、SWE及CEUS(P均<0.05);多模态超声的敏感度、准确率和误诊率高于,而特异度和漏诊率低于US-FNAB(P均<0.05)。见表2。
3 讨论
中华医学会超声医学分会浅表器官和血管学组于2020年提出C-TIRADS,临床医师可据此制定诊疗甲状腺结节方案;但部分恶性结节无或极少具有其中的恶性征象[4],导致C-TIRADS 4类甲状腺结节恶性风险跨度较大,早期定性较为困难。
SWE可客观显示软组织弹性值,有助于临床定量分析甲状腺结节硬度[16];且与应变弹性成像相比,SWE检查过程中无需人为向组织施压,有助于减少主观因素的影响。然而甲状腺位置表浅,受患者呼吸运动、血管和气管干扰,以及结节内钙化或囊变等因素均可导致SWE无法准确反映甲状腺结节硬度[17]。CEUS可显示直径<10 μm的微血管,并通过观察甲状腺结节灌注模式而为鉴别其良、恶性提供依据[18]。本研究19个甲状腺恶性结节CEUS表现为均匀等增强或高增强,可能与肿瘤体积过小或肿瘤内新生血管浸润有关;12个良性结节呈不均匀低增强,可能与结节内钙化或反复出血有关[19]。本研究联合常规超声、SWE及CEUS行多模态超声,其鉴别甲状腺良、恶性结节的敏感度、特异度、准确率、误诊率及漏诊率分别为97.93%、88.89%、95.95%、11.11%及2.07%。
US-FNAB是术前诊断甲状腺结节的重要方法,但可能出现假阴性;且当FNAB结果为阴性时,是否需再次穿刺或行诊断性手术目前仍存在争议[20]。本研究以US-FNAB鉴别甲状腺良、恶性结节的敏感度、特异度、准确率、误诊率及漏诊率分别为89.64%、96.30%、91.09%、3.70%及10.36%,与程琳等[21]的结果基本一致;其敏感度、准确率和误诊率低于,而特异度和漏诊率高于多模态超声。既往研究[22]亦显示,多模态超声可于US-FNAB阴性甲状腺结节中检出恶性结节。
综上所述,多模态超声鉴别C-TIRADS 4类甲状腺良、恶性结节的敏感度、准确率较高但误诊率高,US-FNAB的特异度较高但漏诊率高。然而,本研究为单中心回顾性小样本研究,可能存在选择性偏倚,有待后续加以完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:钟迪查阅文献、研究设计和实施、撰写及修改文章;唐棣数据分析;高小强统计分析;李海霞审阅文章;王宏波图像处理;刘莹指导、经费支持。

